Explantes de pitahaya (Hylocereus guatemalensis) a partir de areolas: Protocolo para la regeneración in vitro y una exitosa aclimatación
DOI:
https://doi.org/10.17268/sci.agropecu.2025.033Palavras-chave:
Areola, cactácea, propagación clonal in vitro, desinfección, medios de cultivo, reguladores de crecimiento, enraizamientoResumo
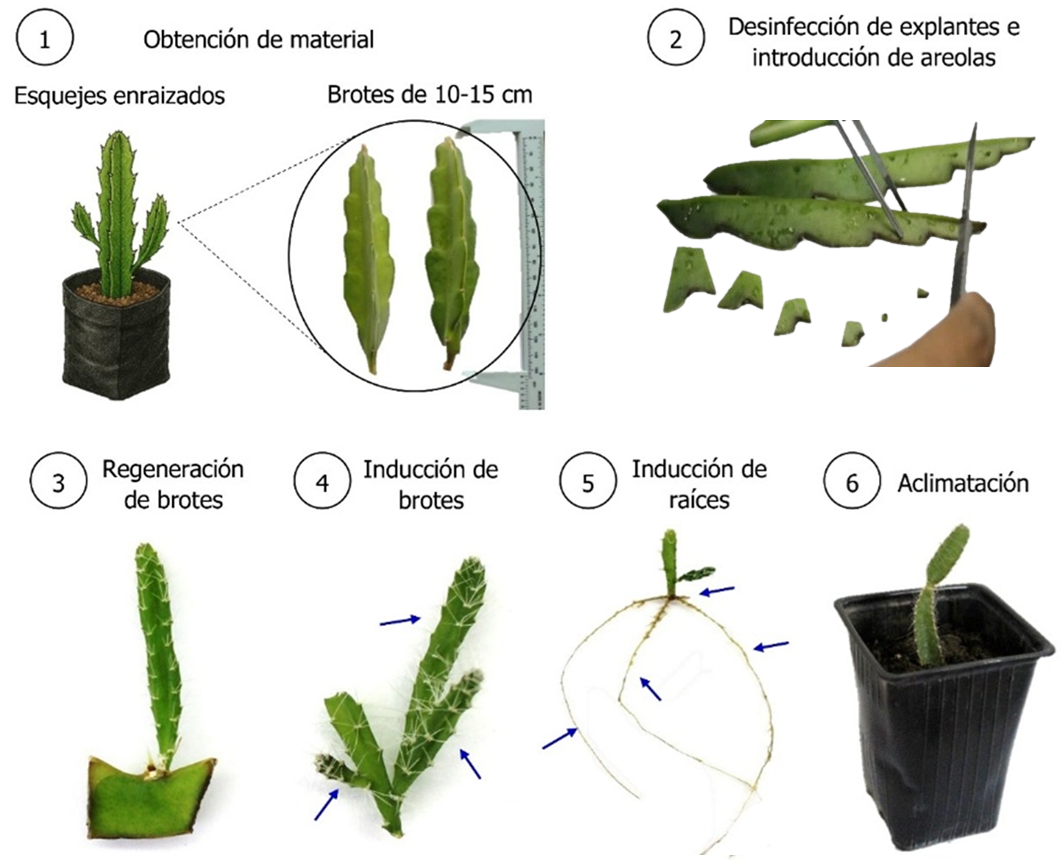
La micropropagación in vitro de pitahaya se ha presentado como una alternativa para la obtención de material vegetal de alta calidad y producción masiva en espacios reducidos y controlados. El presente estudio tuvo como objetivo lograr la regeneración in vitro de brotes y raíces de H. guatemalensis a partir de areolas y su supervivencia durante la aclimatación ex vitro. Se evaluaron diferentes tratamientos con medios de cultivo, reguladores de crecimiento y sustratos para obtener plantas con un desarrollo normal. La regeneración de brotes a partir de areolas se logró desde los 14 días, enriqueciendo el medio Murashige and Skoog (MS) con concentraciones diferentes de bencilaminopurina (BAP). La inducción de brotes sin formación de callos y con una mayor longitud y diámetro de los mismos, se logró empleando medio Woody Plant Medium (WPM) sin citoquininas. Por otro lado, la inducción de raíces inició a los 14 días obteniéndose entre un 90 y 100% de explantes enraizados, siendo el mayor número de raíces producido en medios suplementados con ácido indolbutírico (AIB), y las mayores longitudes con el medio MS sin reguladores. El 100% de supervivencia se alcanzó empleando una mezcla de perlita y turba en proporción 1:1, así como mayores valores de longitud y diámetro de cladodios. Este estudio reporta, por primera vez, un protocolo para la regeneración in vitro de explantes de pitahaya H. guatemalensis a partir de areolas, así como su aclimatación exitosa.
Referências
Amorim, T. A., de Brito Araujo Carvalho, A. J., da Silva Figueiredo, L., Lima, M. dos S., Sarinho, A. M., Santos, N. C., Lisboa, H. M., Souza Gusmão, T. A., & de Pereira Gusmão, R. (2025). Structure-function relationship and antioxidant mechanisms of pectin from red and white pitaya peels for functional food applications. Food Hydrocolloids, 167. https://doi.org/10.1016/j.foodhyd.2025.111455
Bouzroud, S., El Maaiden, E., Sobeh, M., Devkota, K. P., Boukcim, H., Kouisni, L., & El Kharrassi, Y. (2022). Micropropagation of Opuntia and Other Cacti Species Through Axillary Shoot Proliferation: A Comprehensive Review. Front. Plant Sci., 13. https://doi.org/10.3389/fpls.2022.926653
Bozkurt, T., İnan, S., & Dündar, İ. (2020). Micropropagation of Different Pitaya Varieties. International Journal of Agricultural and Natural Sciences, 13(1), 39–46. https://ijans.org/index.php/ijans/article/view/496/474
Bozkurt, T., İnan, S., Dündar, İ., & Özdemir, S. K. (2022). Effect of Different Plant Growth Regulators on Micropropagation of Some Pitaya Varieties. Journal of Tropical Life Science, 12(2), 183–190. https://doi.org/10.11594/jtls.12.02.04
Chhetri, S., Hasan, M. A., & Tamang, A. (2021). Influence of varying length of stem cutting and IBA concentrations on root and shoot growth in Dragon Fruit cv Giant White (Hylocereus undatus). Environment and Ecology, 39(4A), 1114–1118. https://www.researchgate.net/publication/359857530
Chongloi, L., Gunnaiah, R., Hipparagi, K., Guranna, P., Prakasha, D. P., Chittapur, R., & Kamble, A. (2023). Optimization of low-cost potting mixture for hardening of in vitro raised plants of dragon fruit. Journal of Applied Horticulture, 25(3), 286–290. https://doi.org/10.37855/jah.2023.v25i03.51
Cortés-Olmos, C., Guerra-Sandoval, V. M., Guijarro-Real, C., Pineda, B., Fita, A., & Rodríguez-Burruezo, A. (2025). Response to In Vitro Micropropagation of Plants with Different Degrees of Variegation of the Commercial Gymnocalycium cv. Fancy (Cactaceae). Plants, 14(7). https://doi.org/10.3390/plants14071091
Dewir, Y. H., Habib, M. M., Alaizari, A. A., Malik, J. A., Al-Ali, A. M., Al-Qarawi, A. A. A., & Alwahibi, M. S. (2023). Promising Application of Automated Liquid Culture System and Arbuscular Mycorrhizal Fungi for Large-Scale Micropropagation of Red Dragon Fruit. Plants, 12(5), 1037. https://doi.org/10.3390/plants12051037
Espinosa-Leal, C. A., Puente-Garza, C. A., & García-Lara, S. (2018). In vitro plant tissue culture: means for production of biological active compounds. Planta, 248, 1–18. https://doi.org/10.1007/s00425-018-2910-1
Fan, Q. J., Zheng, S. C., Yan, F. X., Zhang, B. X., Qiao, G., & Wen, X. P. (2013). Efficient regeneration of dragon fruit (Hylocereus undatus) and an assessment of the genetic fidelity of in vitro-derived plants using ISSR markers. Journal of Horticultural Science and Biotechnology, 88(5), 631–637. https://doi.org/10.1080/14620316.2013.11513017
Gauer, P. C., Ferreira, A. C. V., Siqueira, M. S., Gimênes-Junior, H., Abe, H. A., Fantini-Hoag, L., Godoy, A. C., & Honorato, C. A. (2025). Hydroalcoholic extract of pitaya (Hylocereus guatemalensis) supplied in the diet for blue Betta splendens and its effects on fish pigmentation. Anais Da Academia Brasileira de Ciencias, 97(2). https://doi.org/10.1590/0001-3765202520240212
Hua, Q., Chen, P., Liu, W., Ma, Y., Liang, R., Wang, L., Wang, Z., Hu, G., & Qin, Y. (2015). A protocol for rapid in vitro propagation of genetically diverse pitaya. Plant Cell Tiss Organ Cult, 120, 741–745. https://doi.org/10.1007/s11240-014-0643-9
Lee, Y. C., & Chang, J. C. (2022). Development of an Improved Micropropagation Protocol for Red-Fleshed Pitaya ‘Da Hong’ with and without Activated Charcoal and Plant Growth Regulator Combinations. Horticulturae, 8(2), 104. https://doi.org/10.3390/horticulturae8020104
Liaotrakoon, W. (2013). Characterization of dragon fruit (Hylocereus spp.) components with valorization potential [PhD thesis]. Ghent University.
Malda, G., Backhaus, R. A., & Martin, C. (1999). Alterations in growth and crassulacean acid metabolism (CAM) activity of in vitro cultured cactus. Plant Cell, Tissue and Organ Culture, 58, 1–9. https://doi.org/https://doi.org/10.1023/A:1006377206855
Marcotrigiano, M., McGlew, S. E., Hackett, G., & Chawla, B. (1996). Shoot regeneration from tissue-cultured leaves of the American cranberry (Vaccinium macrocarpon). Plant Cell, Tissue and Organ Culture, 44, 195–199. https://doi.org/https://doi.org/10.1007/BF00048524
Martínez Arroyo, M. C., Mancilla-Álvarez, E., Spinoso-Castillo, J. L., & Bello-Bello, J. J. (2023). Evaluation of the effect of different culture systems on photomixotrophic capacity during in vitro multiplication of pitahaya (Hylocereus undatus). South African Journal of Botany, 159, 396–404. https://doi.org/10.1016/j.sajb.2023.06.013
Menezes, T. P., Gomes, W. de A., Pio, L. A. S., Pasqual, M., & Ramos, J. D. (2012). Micropropagação e endorreduplicação em pitaya vermelha, Hylocereus undatus HAW. Bioscience Journal, 28(6), 868–876.
Mercado-Silva, E. M. (2018). Pitaya— Hylocereus undatus (Haw). Exotic Fruits, 339–349. https://doi.org/10.1016/b978-0-12-803138-4.00045-9
Mohamed-Yasseen, Y. (2002). Micropropagation of pitaya (Hylocereus undatus Britton et Rose). In Vitro Cellular and Developmental Biology - Plant, 38(5), 427–429. https://doi.org/10.1079/IVP2002312
Navarro-Sandoval, B. G., & Canales-Carrera, E. E. (2021). Efecto de diferentes concentraciones de benzilaminopurina (BAP) sobre el establecimiento in vitro de pitahaya (Hylocereus guatemalensis). Revista De Innovación Y Transferencia Productiva, 2(1), e002. https://doi.org/10.54353/ritp.v2i1.e002
Phillips, G. C., & Garda, M. (2019). Plant tissue culture media and practices: an overview. In Vitro Cellular and Developmental Biology - Plant, 55(3), 242–257. https://doi.org/10.1007/s11627-019-09983-5
Qin, J., Wang, Y., He, G., Chen, L., He, H., Cheng, X., Xu, K., & Zhang, D. (2017). High-efficiency micropropagation of dormant buds in spine base of red pitaya (Hylocereus polyrhizus) for industrial breeding. International Journal of Agriculture and Biology, 19(1), 193–198. https://doi.org/10.17957/IJAB/15.0264
Rodrigues, M. A., da Silveira, F. A., Moreira, R. A., Pádua, M. S., Pinto, J. E. B. P., Pio, L. A. S., dos Santos, D. N., de Sousa Bueno Filho, J. S., & Reis, L. A. C. (2022). Regeneration of pitaya by indirect organogenesis evaluated by scanning electron microscopy and flow cytometry. Pesquisa Agropecuaria Brasileira, 57. https://doi.org/10.1590/S1678-3921.pab2022.v57.02312
Salas, L., Foroughbackch, R., Díaz, M., Ávila, M., & Flores, A. (2011). Germinación in vitro de cactáceas, utilizando zeolita como sustrato alternativo. Revista Mexicana de Ciencias Agrícolas, 3, 565–575.
Shah, K., Chen, J., Chen, J., & Qin, Y. (2023). Pitaya Nutrition, Biology, and Biotechnology: A Review. Int. J. Mol. Sci., 24. https://doi.org/10.3390/ijms241813986
Trivellini, A., Lucchesini, M., Ferrante, A., Massa, D., Orlando, M., Incrocci, L., & Mensuali-Sodi, A. (2020). Pitaya, an attractive alternative crop for mediterranean region. Agronomy, 10(8). https://doi.org/10.3390/agronomy10081065
Vargas Gutiérrez, K., & López Montañez, R. N. (2020). Guía técnica del cultivo de pitahaya (Hylocereus megalanthus) en la región Amazonas (Instituto Nacional de Innovación Agraria (INIA), Ed.).
Verona-Ruiz, A., Urcia-Cerna, J., & Paucar-Menacho, L. M. (2020). Pitahaya (Hylocereus spp.): Cultivo, características fisicoquímicas, composición nutricional y compuestos bioactivos. Scientia Agropecuaria, 11(3), 439–453. https://doi.org/10.17268/sci.agropecu.2020.03.16
Viñas, M., Fernández-Brenes, M., Azofeifa, A., & Jiménez, V. M. (2012). In vitro propagation of purple pitahaya (Hylocereus costaricensis [F.A.C. Weber] Britton & Rose) cv. Cebra. In Vitro Cell.Dev.Biol.-Plant, 48(5), 469–477. https://doi.org/10.1007/s11627-012-9439-y
Wan Anuar, W. N. H., Tan, S. H., Shiekh Mahmud, S. H. R., Mior Norazmi, W. N. B., & Engku Safruddin, E. F. S. (2019). Enhancement effect of BAP and spent mushroom compost in micro-propagation of Sabah snake grass. American Journal of Biochemistry and Biotechnology, 15(4), 190–197. https://doi.org/10.3844/ajbbsp.2019.190.197
Yasmin, A., Sumi, M. J., Akter, K., Rabbi, R. H. M., Almoallim, H. S., Ansari, M. J., Hossain, A., & Imran, S. (2024). Comparative analysis of nutrient composition and antioxidant activity in three dragon fruit cultivars. PeerJ, 12(7). https://doi.org/10.7717/peerj.17719
Publicado
Como Citar
Edição
Seção
Licença
Copyright (c) 2025 Scientia Agropecuaria

Este trabalho está licenciado sob uma licença Creative Commons Attribution-NonCommercial 4.0 International License.
Los autores que publican en esta revista aceptan los siguientes términos:
a. Los autores conservan los derechos de autor y conceden a la revista el derecho publicación, simultáneamente licenciada bajo una licencia de Creative Commons que permite a otros compartir el trabajo, pero citando la publicación inicial en esta revista.
b. Los autores pueden celebrar acuerdos contractuales adicionales separados para la distribución no exclusiva de la versión publicada de la obra de la revista (por ejemplo, publicarla en un repositorio institucional o publicarla en un libro), pero citando la publicación inicial en esta revista.
c. Se permite y anima a los autores a publicar su trabajo en línea (por ejemplo, en repositorios institucionales o en su sitio web) antes y durante el proceso de presentación, ya que puede conducir a intercambios productivos, así como una mayor citación del trabajo publicado (ver efecto del acceso abierto).




