Estrategia para optimizar la reserva de fósforo en el suelo: Un estudio basado en la diversidad de maíces nativos de México y selección de genotipos
DOI:
https://doi.org/10.17268/sci.agropecu.2024.026Palabras clave:
Zea mays L., análisis de clasificación, análisis de componentes principales, germoplasma, semillaResumen
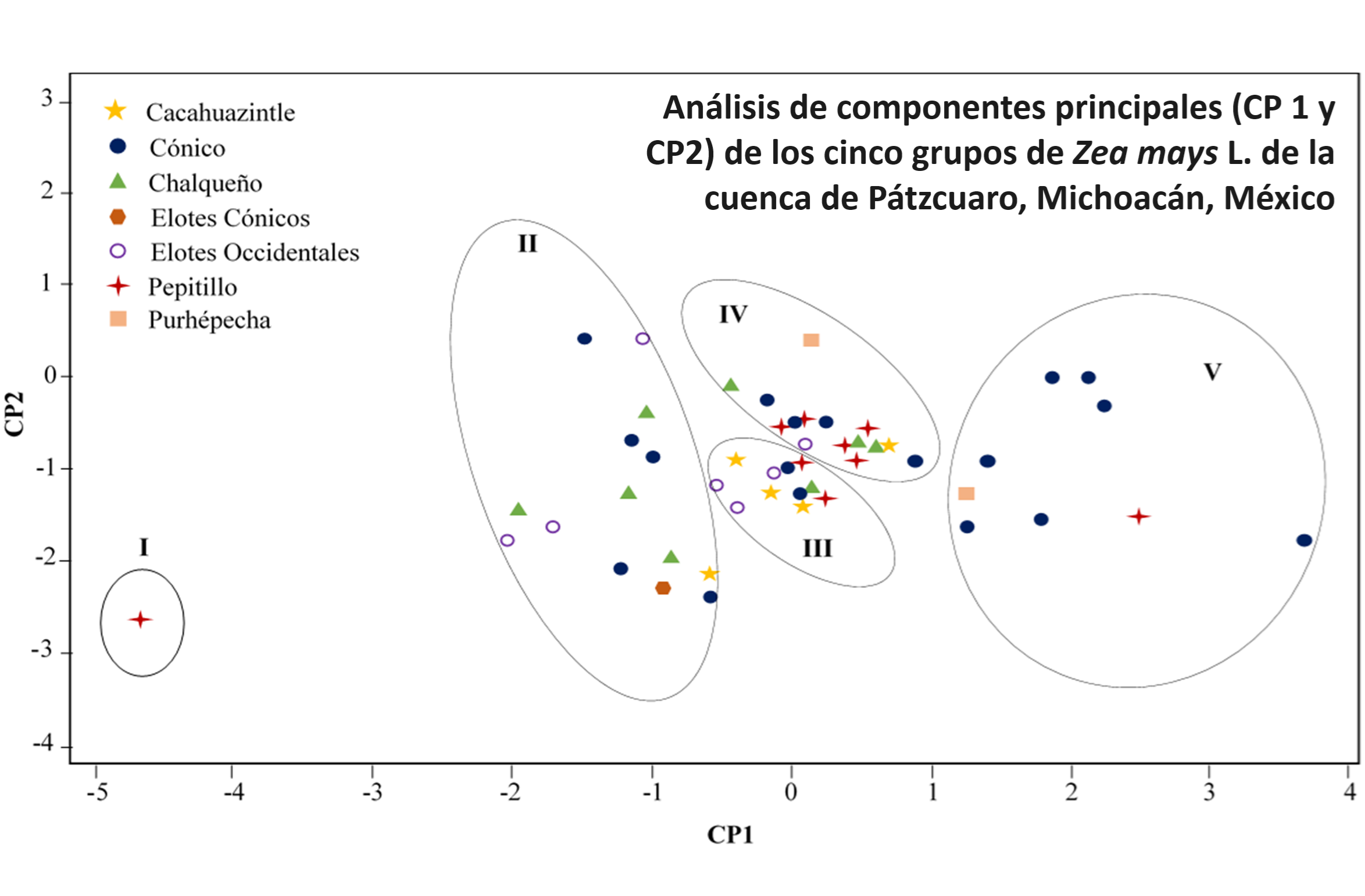
La sustracción ininterrumpida de fósforo (P) por el cultivo, agota la fertilidad del suelo y conduce al uso de fertilizante para la producción agrícola. El fitato es la principal reserva de P en la semilla, pero su contribución a la nutrición humana es reducida. Se caracterizaron 50 genotipos de maíz nativo de la región lacustre de Pátzcuaro, Michoacán, México, con base en las formas de P de la semilla. El promedio de la concentración de P total, fitato y Pi, entre todos los genotipos fue de 3,1, 2,6 y 0,43 mg g-1. La correlación entre el P total y fitato fue positiva (r = 0,98**), lo que sugiere que, un incremento de P total en la semilla conlleva a un aumento en la concentración de fitato. El análisis de conglomerados detectó cinco grupos con 1, 14, 11, 15 y 9 genotipos, respectivamente. Los Grupos I y II incluyeron a los genotipos con la menor concentración de fitato (1,74 mg g-1), mientras que el Grupo V integró a los genotipos con la mayor concentración (4,92 mg g-1). El análisis de componentes principales (CP) junto con la prueba F detectó que el P total y fitato fueron las variables que diferenciaron los grupos. Los dos primeros CP explicaron el 95% de la variación acumulada entre genotipos. Estas observaciones proveen el primer estudio sobre la diversidad de maíces nativos y su potencial para seleccionar genotipos con una menor concentración de P en la semilla y reducir la extracción de P del suelo.
Citas
Astier, M., Pérez-Agiz, E., Orozco-Ramírez, Q., Patricio-Chávez, M., & Moreno-Calles, A. I. (2012). Sistemas agrícolas, conocimiento tradicional y agrobiodiversidad: El maíz en la cuenca del Lago de Pátzcuaro. Conocimiento tradicional, innovación y reapropiación social, 146-172.
Bai, Z., Li, H., Yang, X., Zhou, B., Shi, X., et al. (2013). The critical soil P levels for crop yield, soil fertility and environmental safety in different soil types. Plant and Soil, 372, 27-37. https://doi.org/10.1007/s11104-013-1696-y
Bayuelo-Jiménez, J. S., & Ochoa-Cadavid, I. (2018). Interacción Genotipo x Ambiente para Eficiencia en el Uso de Fósforo en Maíz Nativo de la Meseta Purhépecha. Revista Fitotecnia Mexicana, 41(1), 39-47. https://doi.org/10.35196/rfm.2018.1.39-47
Bhagyawant, S. S., Bhadkaria, A., Gupta, N., & Srivastava, N. (2018). Impact of phytic acid on nutrient bioaccessibility and antioxidant properties of chickpea genotypes. Journal of Food Biochemistry, 42(6), 1-9. https://doi.org/10.1111/jfbc.12678
Bilal, H. M., Aziz, T., Maqsood, M. A., & Farooq, M. (2019). Grain phosphorus and phytate contents of wheat genotypes released during last 6 decades and categorization of selected genotypes for phosphorus use efficiency. Archives of Agronomy and Soil Science, 65(6), 727-740. https://doi.org/10.1080/03650340.2018.1521957
Bloot, A. P. M., Kalschne, D. L., Amaral, J. A. S., Baraldi, I. J., & Canan, C. (2023). A review of phytic acid sources, obtention, and applications. Food Reviews International, 39(1), 73-92.
Bünemann, E. K. (2015). Assessment of gross and net mineralization rates of soil organic phosphorus–A review. Soil Biology and Biochemistry, 89, 82-98.
Chí-Sánchez, F. A., Alvarado-López, C. J., Cristóbal-Alejo, J., González-Moreno, A., & Reyes-Ramírez, A. (2021). Contenido mineral de maíces criollos de Yucatán: análisis mediante μ-Fluorescencia de Rayos X. Terra Latinoamericana, 39, 1-12. https://doi.org/10.28940/terra.v39i0.454
Cong, W. F., Suriyagoda, L. D., & Lambers, H. (2020). Tightening the phosphorus cycle through phosphorus-efficient crop genotypes. Trends in Plant Science, 25(10), 967-975. https://doi.org/10.1016/j.tplants.2020.04.013
Dwivedi, S. L., Garcia-Oliveira, A. L., Govindaraj, M., & Ortiz, R. (2023). Biofortification to avoid malnutrition in humans in a changing climate: Enhancing micronutrient bioavailability in seed, tuber, and storage roots. Frontiers in Plant Science, 14, 1-24. https://doi.org/10.3389/fpls.2023.1119148
Frittelli, A., Botticella, E., Palombieri, S., Masci, S., Celletti, S., Fontanella, M. C., ... & Sestili, F. (2023). The suppression of TdMRP3 genes reduces the phytic acid and increases the nutrient accumulation in durum wheat grain. Frontiers in Plant Science, 14, 1079559.
Galván-Tejeda, N. D., Peña-Ramírez, V., Mora-Palomino, L., & Siebe, C. (2014). Soil P fractions in a volcanic soil chronosequence of Central Mexico and their relationship to foliar P in pine trees. Journal of Plant Nutrition and Soil Science, 177, 792–802.
González-Esquivel, C. E., Gavito, M. E., Astier, M., Cadena-Salgado, M., del-Val, E., Villamil-Echeverri, L., Merlín-Uribe, Y., & Balvanera, P. (2015). Ecosystem service trade-offs, perceived drivers, and sustainability in contrasting agroecosystems in central Mexico. Ecology and Society, 20(1), 38. http://dx.doi.org/10.5751/ES-06875-200138
Gunathunga, C., Senanayake, S., Jayasinghe, M. A., Brennan, C. S., Truong, T., Marapana, U., & Chandrapala, J. (2024). Germination Effects on Nutritional Quality: A Comprehensive Review of Selected Cereal and Pulse Changes. Journal of Food Composition and Analysis, 106024. https://doi.org/10.1016/j.jfca.2024.106024
Han, Y., White, P. J., & Cheng, L. (2022). Mechanisms for improving phosphorus utilization efficiency in plants. Annals of botany, 129(3), 247-258. https://doi.org/10.1093/aob/mcab145
HarvestPlus. (2022). Responding to crisis, building resilience: HarvestPlus 2021 annual report. HarvestPlus Annual Report 11. Washington, DC: International Food Policy Research Institute (IFPRI). https://ebrary.ifpri.org/cdm/ref/collection/p15738coll2/id/136342
Heuer, S., Gaxiola, R., Schilling, R., Herrera‐Estrella, L., López‐Arredondo, D., Wissuwa, M., ... & Rouached, H. (2017). Improving phosphorus use efficiency: a complex trait with emerging opportunities. The Plant Journal, 90(5), 868-885. https://doi.org/10.1111/tpj.13423
Houssni, I. E., Zahidi, A., Khedid, K., & Hassikou, R. (2024). Review of processes for improving the bioaccessibility of minerals by reducing the harmful effect of phytic acid in wheat. Food Chemistry Advances, 4, 100568. https://doi.org/10.1016/j.focha.2023.100568
Instituto Nacional de Estadística, Geografía e Informática (INEGI). (2017). Anuario estadístico y geográfico de Michoacán de Ocampo 2017. https://www.inegi.org.mx/contenidos/productos/prod_serv/contenidos/espanol/bvinegi/productos/nueva_estruc/anuarios_2017/702825092092.pdf
Jaradat, A., & Goldstein, W. (2018). Diversity of maize kernels from a breeding Program for Protein Quality III: Ionome Prof iling. Agronomy, 53, 956-976. https://doi.org/10.3390/agronomy8020009
Kafle, A., Cope, K. R., Raths, R., Krishna Yakha, J., Subramanian, S., Bücking, H., & Garcia, K. (2019). Harnessing soil microbes to improve plant phosphate efficiency in cropping systems. Agronomy, 9(3), 127. https://doi.org/10.3390/agronomy9030127
Kenzhebayeva, S., Abekova, A., Atabayeva, S., Yernazarova, G., Omirbekova, N., et al. (2019). Mutant lines of spring wheat with increased iron, zinc, and micronutrients in grains and enhanced bioavailability for human health. BioMed Research International, 2019, 1-11. https://doi.org/10.1155/2019/9692053
Mo, Q., Li, Z. A., Sayer, E. J., Lambers, H., Li, Y., et al. (2019). Foliar phosphorus fractions reveal how tropical plants maintain photosynthetic rates despite low soil phosphorus availability. Functional Ecology, 33(3), 503-513. https://doi.org/10.1111/1365-2435.13252
Murphy, J., & Riley, J. P. (1962). A modified single solution method for the determination of phosphate in nature waters. Analytical Chemistry Acta, 27, 31-36. https://doi.org/10.1016/S0003-2670(00)88444-5
Nadeem, M., Mollier, A., Morel, C., Vives, A., Prud’homme, L., & Pellerin, S. (2011). Relative contribution of seed phosphorus reserves and exogenous phosphorus uptake to maize (Zea mays L.) nutrition during early growth stages. Plant and Soil, 346, 231-244. https://doi.org/10.1007/s11104-011-0814-y
Nicholson, C. C., Emery, B. F., & Niles, M. T. (2021). Global relationships between crop diversity and nutritional stability. Nature communications, 12(1), 5310. https://doi.org/10.1038/s41467-021-25615-2
Ntswane, M., Labuschagne, M., Shandu, S. F., & Mbuma, N. W. (2023). Variation in seed protein, selected minerals, phytic acid, and potential mineral bioavailability of cowpea [Vigna unguiculata (L.) Walp] mutants and accessions. Crop Science, 1-15. https://doi.org/10.1002/csc2.21163
Núñez-Colín, C. A., & Escobedo-López, D. (2011). Uso correcto del análisis clúster en la caracterización de germoplasma vegetal. Agronomía mesoamericana, 22(2), 415-427.
Orozco-Ramírez, Q., Odenthal, J. & Astier, M. (2017). Diversidad de maíces en Pátzcuaro, Michoacán, México, y su relación con factores ambientales y sociales. Agrociencia, 51, 867-884.
Pang, J., Bansal, R., Zhao, H., Bohuon, E., Lambers, H., et al. (2018). The carboxylate‐releasing phosphorus‐mobilizing strategy can be proxied by foliar manganese concentration in a large set of chickpea germplasm under low phosphorus supply. New Phytologist, 219(2), 518-529. https://doi.org/10.1111/nph.15200
Perera, I., Fukushima, A., Arai, M., Yamada, K., Nagasaka, S., Seneweera, S., & Hirotsu, N. (2019). Identification of low phytic acid and high Zn bioavailable rice (Oryza sativa L.) from 69 accessions of the world rice core collection. Journal of Cereal Science, 85, 206-213. https://doi.org/10.1016/j.jcs.2018.12.010
Perera, I., Seneweera, S., & Hirotsu, N. (2018). Manipulating the phytic acid content of rice grain toward improving micronutrient bioavailability. Rice, 11, 1-13.
Raboy, V., Cichy, K., Peterson, K., Reichman, S., Sompong, U., et al. (2014). Barley (Hordeum vulgare L.) low phytic acid 1-1: an endosperm-specific, filial determinant of seed total phosphorus. Journal of Heredity, 105, 656-665. https://doi.org/10.1093/jhered/esu044
Raboy, V. (2020). Low phytic acid crops: observations based on four decades of research. Plants-Basel, 53, 27-36. https://doi.org/10.3390/plants9020140
Romesburg, H. C. (1984). Cluster Analysis for Researchers. Lifetime Learning Publications Belmont, California. 277 p.
SAS. (2011). SAS User's Guide: Statictics. SAS. Institute, Inc. Cary, North Carolina, USA.
Schneider, K. D., Thiessen Martens, J. R., Zvomuya, F., Reid, D. K., Fraser, T. D., Lynch, D. H., ... & Wilson, H. F. (2019). Options for improved phosphorus cycling and use in agriculture at the field and regional scales. Journal of Environmental Quality, 48(5), 1247-1264. https://doi.org/10.2134/jeq2019.02.0070
Stanton, C., Sanders, D., Krämer, U., & Podar, D. (2022). Zinc in plants: Integrating homeostasis and biofortification. Molecular Plant, 15(1), 65-85. https://doi.org/10.1016/j.molp.2021.12.008
Vaintraub, I. A., & Lapteva, N. A. (1988). Colorimetric determination of phytate in unpurified extracts of seeds and the products of their processing. Analytical Biochemistry, 175, 227-230. https://doi.org/10.1016/0003-2697(88)90382-X
Wang, F., Morrison, J. D., Rose, T., Kretzschmar, T., & Wissuwa, M. (2017). Can natural variation in grain P concentrations be exploited in rice breeding to lower fertilizer requirements? PLoS One, 12(6), 1-17. https://doi.org/10.1371/journal.pone.0179484
Wang, L., Cutforth, H., Lal, R., Chai, Q., Zhao, C., Gan, Y., & Siddique, K. H. (2018). ‘Decoupling’land productivity and greenhouse gas footprints: A review. Land Degradation & Development, 29(12), 4348-4361. https://doi.org/10.1002/ldr.3172
Wang, C., & Ning, P. (2019). Post-silking phosphorus recycling and carbon partitioning in maize under low to high phosphorus inputs and their effects on grain yield. Frontiers in plant science, 784, 1-13. https://doi.org/10.3389/fpls.2019.00784
Wang, X., He, Y., Gao, Q., Yang, D., & Liang, J. (2021). Approaches to evaluate nutrition of minerals in food. Food Science and Human Wellness, 10(2), 141-148. https://doi.org/10.1016/j.fshw.2021.02.002
Wu, D., Tanaka, R., Li, X., Ramstein, G. P., Cu, S., Hamilton, J. P., ... & Gore, M. A. (2021). High-resolution genome-wide association study pinpoints metal transporter and chelator genes involved in the genetic control of element levels in maize grain. G3, 11(4), jkab059. https://doi.org/10.1093/g3journal/jkab059
Zhao, H., Frank, T., Tan, Y., Zhou, C., Jabnoune, M., et al. (2016). Disruption of OsSULTR3; 3 reduces phytate and phosphorus concentrations and alters the metabolite profile in rice grains. New Phytologist, 211, 926-939. https://doi.org/10.1111/nph.13969
Publicado
Cómo citar
Número
Sección
Licencia
Derechos de autor 2024 Scientia Agropecuaria

Esta obra está bajo una licencia internacional Creative Commons Atribución-NoComercial 4.0.
Los autores que publican en esta revista aceptan los siguientes términos:
a. Los autores conservan los derechos de autor y conceden a la revista el derecho publicación, simultáneamente licenciada bajo una licencia de Creative Commons que permite a otros compartir el trabajo, pero citando la publicación inicial en esta revista.
b. Los autores pueden celebrar acuerdos contractuales adicionales separados para la distribución no exclusiva de la versión publicada de la obra de la revista (por ejemplo, publicarla en un repositorio institucional o publicarla en un libro), pero citando la publicación inicial en esta revista.
c. Se permite y anima a los autores a publicar su trabajo en línea (por ejemplo, en repositorios institucionales o en su sitio web) antes y durante el proceso de presentación, ya que puede conducir a intercambios productivos, así como una mayor citación del trabajo publicado (ver efecto del acceso abierto).




