Protocolo para germinação e micropropagação in vitro de Himatanthus Sucuuba (Spruce ex Müll. arg.) Woodson
DOI:
https://doi.org/10.17268/sci.agropecu.2025.032Palabras clave:
Cultura de tecidos, reguladores de crescimento, enraizamento in vitro, espécie medicinal, sucuubaResumen
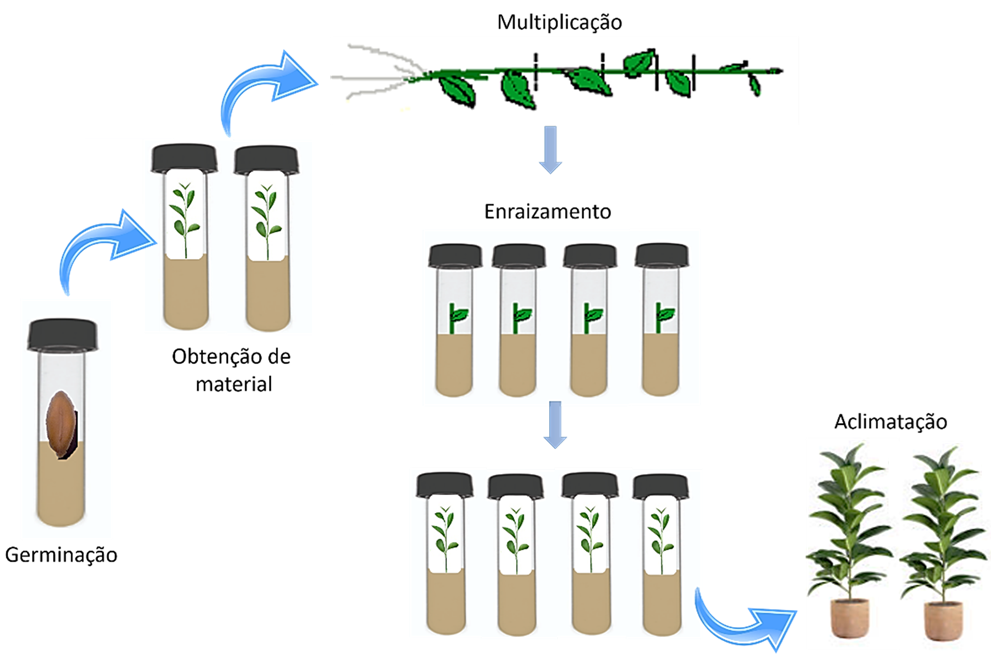
Himatanthus sucuuba possui importância na medicina popular e é amplamente utilizada como antitumoral, antifúngica, vermífuga e anti-anêmica. Nesse contexto, objetivo deste trabalho foi desenvolver protocolo de germinação e micropropagação in vitro de H. sucuuba. As sementes foram imersas em solução de Cabrio Top 1,0% (v/v) por uma hora em agitador magnético e depois em solução de NaOCl diluída a 0,1% (v/v) durante 30 minutos sob agitação, seguido de imersão em álcool 70% por 1 minuto, posteriormente as sementes foram enxaguadas quatro vezes com água destilada estéril, depois foram inoculadas em meio MS suplementados com as auxinas AIA, ANA e AIB, nas concentrações de 0,0; 1,0; 3,0; 5,0 mg L-1. O delineamento experimental foi inteiramente casualizado, utilizando 10 tratamentos com 3 repetições de 10 sementes (n=30). Foi observado que o meio MS suplementado com AIA (5,0 mg L-1) resultou em 80% de germinação e plântulas com 5,97 cm de altura e 4,2 segmentos nodais. Para estimular o enraizamento, os segmentos nodais foram cortados e inoculados em meio MS acrescido de BAP (0,1 mg L-1) e em interação com as auxinas AIA, 2,4-D e ANA, nas concentrações de 0,0; 3,0; 5,0 e 8,0 mg L-1 e, mantidos em sala de crescimento a 25 ± 2 °C, com fotoperíodo de 16 h. A combinação BAP+AIA (0,1 + 8,0 mg L-1) apresentou os melhores resultados com 30% de enraizamento, 100% de brotações e 40% de formação de calos. Em conclusão, a propagação in vitro é uma técnica promissora para produção de mudas in vitro de H. succuba.
Citas
Abd Elaziem, T. M., Ahmed, M. E. salato A. E. naby, & Abou El-Dis, G. R. (2022). In vitro propagation for conservation of the rare date palm (Phoenix dactylifera L.) “Amri” using immature inflorescence. In Vitro Cellular and Developmental Biology - Plant, 58(6), 1048–1056. https://doi.org/10.1007/s11627-022-10296-3
Ai, Y., Chen, Y., Zhu, S., Jiang, L., Chen, J., Li, C., Li, P., Zeng, W., Kuang, D., Liu, Q., & Yang, Y. (2024). The Impacts of Plant Growth Regulators on the Rapid Propagation of Gardenia jasminoides Ellis. in Tissue Culture. Forests, 15(3). https://doi.org/10.3390/f15030446
Alvino, F. de O., & Rayol, B. P. (2007). Efeito de diferentes substratos na germinação de Chroma pyramidale (Cav. ex Lam.) Urb. (Bombacaceae). Ciência Florestal, 17(1), 71–75. https://doi.org/10.5902/198050981937
Boato Da Silva, F. A., Pereira, A. R., Dos, E., & Silveira, S. (2008). Brazilian archives of biology and technology micropropagation of Alibertia edulis Rich. Braz. Arch. Biol. Technol. V, 51(6), 1103–1114.
Braga, F. T., Pasqual, M., Castro, E. M. de, Rafael, G. C., Favero, A. C., & Valente, T. C. T. (2011). Alterações morfofisiolócias de plantas de abacaxizeiro influenciadas por diferentes substratos durante o processo de aclimatização. Ciência e Agrotecnologia, 35(5), 863–868. https://doi.org/10.1590/s1413-70542011000500001
Cordeiro, S. Z., Simas, N. K., Henriques, A. B., & Sato, A. (2014). Micropropagation and callogenesis in Mandevilla guanabarica (Apocynaceae), an endemic plant from Brazil. Crop Breeding and Applied Biotechnology, 14(2), 108–115. https://doi.org/10.1590/1984-70332014v14n2a19
Ferreira, C. da S., Piedade, M. T. F., & Bonates, L. C. (2006). Germinação de sementes e sobrevivência de plântulas de Himatanthus sucuuba (Spruce) Wood. em resposta ao alagamento, nas várzeas da Amazônia Central. Acta Amazonica, 36(4), 413–418. https://doi.org/10.1590/S0044-59672006000400003
Gang, R., Komakech, R., Chung, Y., Okello, D., Kim, W. J., Moon, B. C., Yim, N. H., & Kang, Y. (2023). In vitro propagation of Codonopsis pilosula (Franch.) Nannf. using apical shoot segments and phytochemical assessments of the maternal and regenerated plants. BMC Plant Biology, 23(1), 1–16. https://doi.org/10.1186/s12870-022-03950-w
Herrera-Calderón, O., Calero-Armijos, L. L., Cardona-G, W., Herrera-R, A., Moreno, G., Algarni, M. A., Alqarni, M., & Batiha, G. E. S. (2021). Phytochemical screening of Himatanthus sucuuba (Spruce) woodson (apocynaceae) latex, in vitro cytotoxicity and incision wound repair in mice. Plants, 10(10). https://doi.org/10.3390/plants10102197
Junghans, T. G., & Souza, S. A. (2013). Aspectos prácticos da micropropagação de plantas. 407.
Komakech, R., Kim, Y. G., Kim, W. J., Omujal, F., Yang, S., Moon, B. C., et al. (2020). A micropropagation protocol for the endangered medicinal tree Prunus africana (Hook f.) Kalkman: Genetic fidelity and physiological parameter assessment. Frontiers in Plant Science, 11. https://doi.org/10.3389/fpls.2020.548003
Lemos, S. D. D. C., Santana, I. C., Marques, M., & Albarello, N. (2019). Desenvolvimento e produção in vitro de compostos fenólicos de Ruta graveolens L. exposta a fenantreno e benzo[a]pireno. Revista Virtual de Quimica, 11(5), 1418–1432. https://doi.org/10.21577/1984-6835.20190098
Magalhães, K. do N., Guarniz, W. A. S., Sá, K. M., Freire, A. B., Monteiro, M. P., Nojosa, R. T., Bieski, I. G. C., Custódio, J. B., Balogun, S. O., & Bandeira, M. A. M. (2019). Medicinal plants of the Caatinga, northeastern Brazil: Ethnopharmacopeia (1980–1990) of the late professor Francisco José de Abreu Matos. Journal of Ethnopharmacology, 237(March), 314–353. https://doi.org/10.1016/j.jep.2019.03.032
Merkle, S. A., Koch, J. L., Tull, A. R., Dassow, J. E., Carey, D. W., Barnes, B. F., Richins, M. W. M., et al. (2023). Application of somatic embryogenesis for development of emerald ash borer-resistant white ash and green ash varietals. New Forests, 54(4), 697–720. https://doi.org/10.1007/s11056-022-09903-3
Miranda, N. A., Titon, M., Pereira, I. M., Sebastião, J., Fernandes, C., Santos, M., & Oliveira, R. N. De. (2018). Antioxidants, sucrose and agar in the in vitro multiplication of Eremanthus incanus. Floresta, 48(3), 311–320. https://doi.org/10.5380/rf.v48i3.51365
Murashige, T., & Skoog, F. A. (1962). Revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiol Plant, 15, 473–497.
Nilanthi, D., & Yang, Y. (2014). Efeitos da sacarose e outros aditivos no crescimento e desenvolvimento in vitro de coneflower roxo (Echinacea purpurea L.). Av. Biol. 2014, 1–4. https://doi.org/10.1155/2014/402309
Oliveira, L. S. de, Dias, P. C., & Brondani, G. E. (2013). Micropropagação de espécies florestais brasileiras. Pesquisa Florestal Brasileira, 33(76), 439–453. https://doi.org/10.4336/2013.pfb.33.76.481
Oliveira, K. S., Aurélio, F., Freire, D. M., Ahmed, M., & Aloufa, I. (2016a). Efeito de 6-benzilaminopurina e ácido naftalenoacético sobre a propagação in vitro de Hancornia speciosa Gomes. Floresta, 46, 335–342. https://doi.org/10.5380/rf.v46i3.43993
Oliveira, K. S., Freire, F. A. de M., & Aloufa, M. A. I. (2016b). Efeito de 6-benzilaminopurina e ácido naftalenoacético sobre a propagação in vitro de Hancornia speciosa Gomes. Floresta, 46(3), 335–342. https://doi.org/10.5380/rf.v46i3.43993
Patel, D. K. (2023). Biological importance, therapeutic benefits, and analytical aspects of active flavonoidal compounds ‘corylin’ from Psoralea corylifolia in the field of medicine. Infectious Disorders - Drug Targets, 23(1), e250822208005. https://doi.org/10.2174/1871526522666220825160906
Patel, D. K. (2022). Biological importance, therapeutic benefit, and medicinal importance of flavonoid, cirsiliol for the development of remedies against human disorders. Current Bioactive Compounds, 18(3), Article e240821195804. https://doi.org/10.2174/1573407217666210824125427
Santos, T. P., Sá, M. E., Malagutti, E. S., et al. (2022). Effects of gibberellic acid concentration and fruit maturation stage on seed germination and vigor of pitahaya seedlings. Brazilian Journal of Biology. https://doi.org/10.1590/1519-6984.260650
Singh, R., Kharb, P., & Kanta, R. (2011). Rapid micropropagation and callus induction of Catharanthus roseus in vitro using different explants. World Journal of Agricultural Sciences, 7(6), 699–704.
Soares, F. P., Paiva, R., Alvarenga, A. A. de, Nogueira, R. C., Emrich, E. B., & Martinotto, C. (2007). Organogênese direta em explantes caulinares de mangabeira (Hancornia speciosa Gomes). Ciência e Agrotecnologia, 31(4), 1048–1053. https://doi.org/10.1590/s1413-70542007000400016
Souza, K. P. (2017). Propagação in vitro de Himatanthus sucuuba WOOD uma espécie medicinal da amazônia. Universidade do Estado do Amazonas.
Sungkumlong, & Deb, C. R. (2009). Regeneration competence of Tainia latifolia (Lindl.) Benth ex Hook pseudobulb segments: An in vitro study. Indian Journal of Biotechnology, 8(1), 121–126.
Verma, A. K., Singh, R. R., & Singh, S. (2012). Improved alkaloid content in callus culture of Catharanthus roseus. Botanica Serbica, 36 (2), 123–130.
Descargas
Publicado
Cómo citar
Número
Sección
Licencia
Derechos de autor 2025 Scientia Agropecuaria

Esta obra está bajo una licencia internacional Creative Commons Atribución-NoComercial 4.0.
Los autores que publican en esta revista aceptan los siguientes términos:
a. Los autores conservan los derechos de autor y conceden a la revista el derecho publicación, simultáneamente licenciada bajo una licencia de Creative Commons que permite a otros compartir el trabajo, pero citando la publicación inicial en esta revista.
b. Los autores pueden celebrar acuerdos contractuales adicionales separados para la distribución no exclusiva de la versión publicada de la obra de la revista (por ejemplo, publicarla en un repositorio institucional o publicarla en un libro), pero citando la publicación inicial en esta revista.
c. Se permite y anima a los autores a publicar su trabajo en línea (por ejemplo, en repositorios institucionales o en su sitio web) antes y durante el proceso de presentación, ya que puede conducir a intercambios productivos, así como una mayor citación del trabajo publicado (ver efecto del acceso abierto).




