RESEARCH ARTICLE
Morphological, molecular and pathogenic characterization of Rhizoctonia isolates causing a banded spot of corn sheath in northern Sinaloa
Caracterización morfológica, molecular y patogenicidad de aislados de Rhizoctonia causantes de la mancha bandeada de la vaina del maíz en el norte de Sinaloa
Karen Rabago-Zavala1 ; Fernando A. Valenzuela-Escoboza1 * ; Blanca E. López-Valenzuela1
Quintín A. Ayala-Armenta1 ; Glenda Judith Lizárraga-Sánchez2
1 Colegio de Ciencias Agropecuarias, Facultad de Agricultura del Valle del Fuerte, Universidad Autónoma de Sinaloa, Ahome, 81110, Sinaloa, México.
2 Universidad Autónoma de Occidente, Unidad Regional Los Mochis, Departamento de Ciencias Naturales y Exactas, Los Mochis, 81223, Sinaloa, México.
* Corresponding author: fernando.vzla@favf.mx (F. A. Valenzuela-Escoboza).
Received: 19 November 2024. Accepted: 29 March 2025. Published: 14 April 2025.
Abstract
Corn production is affected by fungi of the genus Rhizoctonia. The objective of this study was to characterize, using morphology, DNA sequence analysis, and pathogenicity, Rhizoctonia isolates associated with corn with banded leaf spot symptoms in commercial fields in northern Sinaloa. Diseased plants were collected in the municipalities of Ahome, El Fuerte, and Guasave, obtaining 27 isolates. Morphological characterization on PDA showed colonies with whitish to brown mycelium, pigment release into the medium, and amorphous, red and brown sclerotia with a diameter < 1 mm, characteristics described for Rhizoctonia. For molecular characterization, genomic DNA was extracted, part of the RPB2 gene was amplified by PCR, and the amplified products were sequenced. Phylogenetic analysis confirmed the identification of 18 isolates as Rhizoctonia zeae and 9 isolates as Rhizoctonia solani. The R. solani isolates correspond to the anastomosis group (AG): AG-4. Three of them correspond to the anastomosis subgroup AG-4 HGI and the other 6 to the subgroup AG-4 HGIII. The pathogenicity and severity of the isolates were evaluated in corn plants 34 days after planting, revealing significant differences (p > 0.05). This study will allow the development of disease management strategies and future research into biological and chemical control of Rhizoctonia species.
Keywords: anastomosis; RPB2; severity; sclerotia; evolutionary tree analysis; cladistic analysis.
Resumen
La producción de maíz es afectada por hongos del género Rhizoctonia. El objetivo de este estudio fue caracterizar mediante morfología, análisis de secuencias de ADN y patogenicidad aislados de Rhizoctonia asociados a maíz con síntomas de mancha bandeada de la hoja en lotes comerciales del norte de Sinaloa. Se recolectaron plantas enfermas en los municipios de Ahome, el Fuerte y Guasave, obteniendo 27 aislados. La caracterización morfológica en PDA mostró colonias con micelio blanquecino a café, se observó la liberación de pigmento en el medio, esclerocios amorfos, rojos y cafés, con un diámetro <1 mm, caracteres descritos para Rhizoctonia. Para la caracterización molecular, se extrajo ADN genómico, se amplificó por PCR parte del gen RPB2, y los productos amplificados se secuenciaron. El análisis filogenético confirmó la identificación de 18 aislados como Rhizoctonia zeae, y 9 aislados como Rhizoctonia solani. Los aislados de R. solani corresponden al grupo de anastomosis (AG): AG-4. 3 de ellos corresponden al subgrupo de anastomosis AG-4 HGI y el 6 al subgrupo AG-4 HGIII. La patogenicidad y severidad de los aislados se evaluó en plantas de maíz a los 34 días después de la siembra, mostrando diferencias significativas (p > 0,05). Este estudio permitirá generar estrategias de manejo para la enfermedad y futuras investigaciones en control biológico y químico de especies de Rhizoctonia.
Palabras clave: anastomosis; RPB2; severidad; sclerotia; análisis de árboles evolutivos; análisis cladístico.
DOI: https://doi.org/10.17268/sci.agropecu.2025.021
Cite this article:
Rabago-Zavala, K., Valenzuela-Escoboza, F. A., López-Valenzuela, B. E., Ayala-Armenta, Q. A., & Lizárraga-Sánchez, G. J. (2025). Caracterización morfológica, molecular y patogenicidad de aislados de Rhizoctonia causantes de la mancha bandeada de la vaina del maíz en el norte de Sinaloa. Scientia Agropecuaria, 16(2), 263-269.
1. Introducción
El maíz (Zea mays L.) es uno de los principales cultivos de importancia económica, por su productividad y adaptabilidad, se cultiva en todo el mundo, forma parte de la dieta humana y animal (Minaya
& Reyes, 2017). Es el cereal más producido a nivel mundial, con una producción estimada de alrededor de 1,240 millones de toneladas métricas, esto lo coloca por delante del trigo y el arroz (Orus, 2025).
México es el tercer mayor productor de este grano, después de Estados Unidos y Croacia, cuya producción anual es de 27,549,917.53 toneladas (SIAP, 2023). El Estado de Sinaloa produce 6,656,330.77 toneladas, lo que lo posiciona como el principal de este cultivo (SIAP, 2023), aunque la producción se ve limitada por una serie de factores adversos, tanto ambientales como biológicos. En estos últimos destacan enfermedades que ocasionan pérdidas en el maíz, como la pudrición del tallo y raíces, ocasionadas por un complejo de hongos fitopatógenos como: Fusarium, Sclerotium, Phytium, Phitophthora, Macrophomina y Rhizoctonia (McNab & Castro, 2004).
Los últimos años, en las parcelas de maíz en el norte de Sinaloa, se ha presentado una mancha bandeada en la vaina de la hoja de maíz, la cual se ha convertido en un problema latente y severo, ocasionando clorosis y debilitamiento de las plantas. El agente causal de la enfermedad ha sido estudiado previamente en otros países, como Filipinas (Muis & Quimio, 2006) y la India (Singh et al, 2014), donde reportan a R. solani asociada a la mancha bandeada de la hoja y la vaina del maíz. En China, reportan a R. solani (AG-1 I A, AG-1 I C, AG-2, AG-3, AG-4 y AG-5); R. zeae y Rhizoctonia binucleada AG-A y AG-K (Zhang & Chen, 1986; Li et al., 1998; Yang et al., 2014). El AG-2 de R. solani estuvo implicado en la pudrición de la raíz del maíz y AG-4 en la necrosis del hipocótilo, mientras que R. zeae fue menos virulento que AG-2 y AG-4 de R. solani, causó lesiones de color marrón claro en las raíces primarias y laterales (Telmadarrehei et al., 2011) y una podredumbre esclerocial del maíz.
En Argentina, estudios basados en la morfología de las hifas y colonias, la condición nuclear y la reacción de la anastomosis, identificaron a R. zeae como agente causal de la mancha de la vaina del maíz (Gutiérrez et al., 2007). En el norte de Sinaloa, se observaron algunos síntomas diferentes a las descritas. Por ejemplo, las lesiones eran más oscuras que las descritas previamente por Telmadarrehei et al. (2011), y de color rojizo a marrón oscuro. Además, se observaron esclerocios muy pequeños, rojizos amorfos en las lesiones y su desarrollo fue más lento. El clima es muy cálido y húmedo en el norte de Sinaloa y la morfología y virulencia de las especies de Rhizoctonia puede diferir en las regiones.
En consecuencia, el objetivo de este estudio fue identificar las especies de Rhizoctonia asociadas con la enfermedad de la mancha bandeada de la vaina del maíz y determinar la patogenicidad de los aislados de maíz.
2. Metodología
Toma de muestras y aislamiento del hongo
Se inspeccionaron treinta campos comerciales de maíz en los municipios de Ahome, el Fuerte y Guasave. Del 1ero de noviembre de 2021 al 15 de marzo de 2022 se recolectaron plantas que presentaban síntomas similares a los inducidos por Rhizoctonia, dos plantas de cada esquina y el centro, totalizando 10 muestras por cada campo. Las muestras se colocaron en bolsas plásticas y se transportaron al laboratorio en una hielera a 8-10 °C. Se obtuvieron fragmentos (0,5 X 0,5 cm) del tejido afectado, principalmente en la vaina de la hoja basal y el primer nudo. Se desinfectaron en condiciones asépticas en una solución de hipoclorito de sodio al 0,5% durante 3 min, luego se lavaron durante 3 min en agua destilada estéril y se secaron en papel de filtro Whatman No. 1. Luego, los fragmentos se colocaron en un diámetro de 90 mm de agar agua al 1,5% (WA) modificado con sulfato de estreptomicina (Sigma Aldrich a 50 mg/litro) (Muzhinji et al., 2015). Los aislamientos se transfirieron a placas Petri con agar agua (WA) y se incubaron durante 24 horas a 25 °C; Posteriormente, bajo un microscopio de disección, se transfirió una punta de hifa de cada aislado a PDA (Sneh, 1996). Los aislados se conservaron en tubos de PDA inclinados con aceite mineral (Ohkura et al., 2009).
Caracterización nuclear
Para el conteo de núcleos por célula hifal, fue necesario, reactivar los aislados de Rhizoctonia, se colocaron trozos de 5 mm en cajas Petri con PDA y se incubaron durante 3 días a 25 °C. El margen de las colonias se transfirió a un portaobjetos, donde se mezcló el micelio con NaOH al 3% y Safranina O (Kronland & Stanghellini, 1988). Luego se examinaron las células de cada aislado en busca de núcleos con un aumento de 40X utilizando un microscopio de campo claro. Se contó el número de núcleos de las cepas en al menos 20 células de hifas jóvenes por cada aislado (Rabago et al., 2024).
Morfología de colonias y características esclerociales de Rhizoctonia spp.
Para analizar el patrón de crecimiento de los aislados de Rhizoctonia de maíz, se transfirió a cada uno de ellos a cajas Petri con PDA y se incubaron a 25 °C durante 25 días. En ese lapso se documentaron el color de las colonias, el diámetro y color de los esclerocios mediante observación visual (Singh et al., 2015).
Extracción de ADN genómico y amplificación por PCR
Para la identificación molecular, se extrajo ADN genómico de cada uno de los dos aislados, La extracción de ADN se realizó a partir de 50 a 100 mg de micelio por el método CTAB (Murray & Thompson, 1980; Porebski et al., 1997). y se amplificaron fragmentos parciales de la segunda subunidad más grande del gen de la ARN polimerasa II (rpb2), y se secuenciaron con los pares de cebadores RBP2-980F (5’-TGYCCIGCIGARACICCHGARGG-3’) Y RPB2-7Cr (5’-CCCATRGCTTGYTTRCCCAT-3’) (Liu et al., 1999; Reeb et al., 2004), respectivamente.
Posteriormente se secuenció la muestra. Los datos de las secuencias obtenidas se compararon mediante búsqueda BLAST en la base de datos del Centro Nacional de Información Biotecnológica (NCBI) para determinar el AG de los aislados individuales. Las secuencias se alinearon con el algoritmo Clustal W integrado en el paquete de software MEGA 6.0 (Tamura et al., 2013) y la relación filogenética entre aislados se calculó utilizando el método de unión de vecinos (NJ) bajo el modelo de dos parámetros de Kimura (1983) como modelo de sustitución, omitiendo todos los sitios con espacios vacíos. Para fines de comparación, se obtuvieron de GenBank secuencias de ADNr ITS de otros aislados de AG conocidos y se utilizaron para la filogenia. El análisis Bootstrap se realizó utilizando 1000 pseudoréplicas del conjunto de datos. La secuencia de Botryobasidium simile (número de acceso de GenBank GEL2348) se utilizó como grupo externo para la raíz.
Pruebas de patogenicidad
La patogenicidad de los aislados de Rhizoctonia spp. se realizó en macetas con suelo estéril, por maceta se colocó una semilla de maíz y se dejó crecer durante un mes después de la siembra. Para el experimento se utilizaron 27 tratamientos, que representaron a cada uno de los aislados) y el testigo, cada maceta representaba una unidad experimental. Por tratamiento se hicieron cuatro réplicas (4 macetas, cada una con una semilla). Plantas de maíz de un mes de edad se inocularon en la vaina de la hoja basal, se incluyeron controles no infectados en cada prueba de patogenicidad. La temperatura del suelo durante los experimentos de invernadero varió de 20 a 35 °C y de 16 a 27 °C en el primer y segundo experimento, respectivamente. Los tratamientos se dispusieron en un diseño completamente aleatorizado. Las plantas inoculadas y no inoculadas se fertilizaron una vez por semana con fertilizante Miracle-Gro (The Scotts Company LLC; Marysville, Ohio, EE. UU.) siguiendo las recomendaciones del fabricante y se regaron según fuera necesario.
El grado de patogenicidad de los aislados se evaluó 14 días después de la inoculación y se calculó con base al área de la vaina de hoja afectada (AVHA); para ello se utilizó una hoja de plástico transparente cuadriculada de 7 X 7 cm con cuadros de 0,5 X 0,5 cm. la cual se colocó sobre las lesiones cuantificando el número de puntos sobre las mismas siguiendo el procedimiento Zadoks & Schein (1979).
Análisis estadístico
Los datos obtenidos del área afectada por tizón de la vaina de la hoja del maíz (cm2) se analizaron utilizando ANOVA y la separación de medias siguiendo la prueba de Tukey, como se describió previamente (Little & Hills, 1973). Los análisis estadísticos se realizaron utilizando INFOSTAD.
3. Resultados y discusión
Aislamiento de Rhizoctonia spp. maíz
La incidencia de Rhizoctonia se presentó en los 30 campos comerciales de maíz muestreados en el norte de Sinaloa, en un rango de 15%, 40% y 70%, respectivamente, 2 a 3 semanas antes de la cosecha del lote. Se realizaron cinco aislamientos del hongo de cada campo, finalmente, se seleccionaron 27 aislados los cuales se nombraron como FAVF475 hasta FAVF501 (Tabla 1).
En recorridos en campo, los síntomas observados en los cultivos de maíz en los municipios del Fuerte, Ahome y Guasave fueron manchas bandeadas en la vaina de la hoja (Figura 1A), tal como los describe Sagar & Bhusal (2019) para Rhizoctonia spp., además asociado a esto también se encontraron cancros obscuros y pudriciones de raíz (Figura 1B),

Figura 1. Síntomas generados por Rhizoctonia en campo A. Mancha bandeada en la primera vaina de la hoja de maíz. B. Cancro obscuro en raíz.
Caracterización morfológica
Los aislados de Rhizoctonia mostraron un crecimiento micelial hialino a las 24 horas y después de las 96 horas el micelio tomaba un color blanco y café, y tornaban el medio de cultivo a un color ámbar (Figura 2A).
Tabla 1
Características morfológicas de Rhizoctonia spp. de maíz
Aislado | Tiempo de colonización en el medio (días) | Color del micelio | Diámetro del micelio (μm) | Numero de núcleos por célula hifal | Color del esclerocio | Forma del esclerocio |
FAVF475 | 2.75 AB | Blanco | 3.50 | 5.60 | Rojo | Irregular |
FAVF476 | 4.50 B | Crema | 3.20 | 8.10 | Café | Irregular |
FAVF477 | 2.50 A | Blanco | 3.50 | 6.10 | Rojo | Irregular |
FAVF478 | 3.50 AB | Blanco | 3.35 | 8.40 | Rojo | Irregular |
FAVF479 | 2.50 A | Blanco | 4.00 | 6.20 | Rojo | Irregular |
FAVF480 | 2.75 AB | Blanco | 4.55 | 6.45 | Rojo | Irregular |
FAVF481 | 3.00 AB | Crema | 3.95 | 5.20 | Café | Irregular |
FAVF482 | 3.00 AB | Blanco | 3.55 | 6.15 | Rojo | Irregular |
FAVF483 | 3.25 AB | Blanco | 3.65 | 6.50 | Rojo | Irregular |
FAVF484 | 3.00 AB | Blanco | 3.35 | 6.70 | Rojo | Irregular |
FAVF485 | 3.00 AB | Blanco | 3.70 | 6.75 | Rojo | Irregular |
FAVF486 | 3.25 AB | Blanco | 3.80 | 6.35 | Rojo | Irregular |
FAVF487 | 3.50 AB | Blanco | 3.90 | 7.20 | Rojo | Irregular |
FAVF488 | 2.75 AB | Blanco | 3.80 | 6.86 | Rojo | Irregular |
FAVF489 | 2.75 AB | Blanco | 4.05 | 6.90 | Rojo | Irregular |
FAVF490 | 3.25 AB | Blanco | 4.60 | 6.90 | Rojo | Irregular |
FAVF491 | 3.50 AB | Blanco | 4.25 | 7.20 | Rojo | Irregular |
FAVF492 | 3.50 AB | Crema | 4.20 | 7.70 | Café | Irregular |
FAVF493 | 3.50 AB | Blanco | 4.15 | 6.80 | Rojo | Irregular |
FAVF494 | 3.25 AB | Crema | 4.65 | 7.00 | Café | Irregular |
FAVF495 | 4.50 B | Crema | 4.70 | 6.95 | Café | Irregular |
FAVF496 | 3.75 AB | Crema | 4.00 | 7.15 | Café | Irregular |
FAVF497 | 4.25 AB | Blanco | 4.50 | 6.65 | Rojo | Irregular |
FAVF498 | 4.50 B | Blanco | 3.85 | 6.95 | Rojo | Irregular |
FAVF499 | 4.50 B | Crema | 3.90 | 6.85 | Café | Irregular |
FAVF500 | 3.75 AB | Crema | 4.00 | 6.85 | Café | Irregular |
FAVF501 | 4.00 AB | Crema | 3.85 | 7.00 | Café | Irregular |
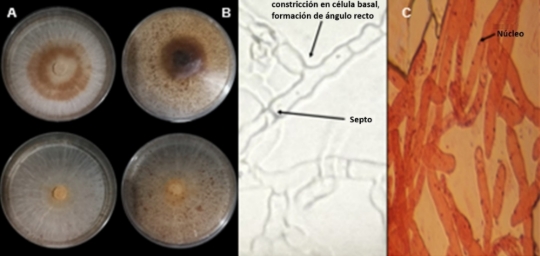
Figura 2. Morfología colonial de los aislados de Rhizoctonia spp. de maíz. A. Colonias con micelio blanco y café, formación de esclerocios rojos y café, cambio de color del medio. B. Micelio septado, con constricción en célula basal, ramificaciones con formación de ángulos rectos. C. Hifas multinucleadas.
Todos los aislados formaron esclerocios de forma irregular algunos de color rojo y café (Tabla 1). El micelio de los aislados es septado, hialino, con constricción en la célula basal, formando ramas en ángulo recto, hifas con un diámetro de 3-5 μm de ancho y esclerocios de <1 mm de diámetro, sin presencia de esporas (Figura 2B), características típicas del género Rhizoctonia spp. (Sneh et al., 1991). La tinción de núcleos reveló la presencia de aislados multinucleadas únicamente (Figura 2C).
Identificación molecular
Fragmentos parciales de la segunda subunidad más grande del gen de la ARN polimerasa II (rpb2), con los pares de cebadores RBP2-980F Y RPB2-7Cr, permitieron determinar que los 27 aislados secuenciados de maíz tenían un 99% - 100% de similitud con el género Rhizoctonia spp. con secuencias homólogas de NCBI. El análisis filogenético, se realizó con las secuencias de los aislados de Rhizoctonia solani, Rhizoctonia zeae y Botryobasidium simile. Se procesó una matriz integrada por las regiones RPB2 de 42 aislados, incluyendo los del presente estudio y 15 cepas de referencia. Este análisis estableció la identidad de dos especies, donde 18 de los aislados corresponden a Rhizoctonia zeae y el resto a Rhizoctonia solani con un solo grupo de anastomósis AG-4, y dos subgrupos de este; donde 3 aislados resultaron pertenecer al AG-4 HGI y 6 aislados al subgrupo AG-4 HGIII (Figura 3).

Figura 3. Filogenia por MV de las secuencias concatenadas de los genes RPB2 de 27 aislados de Rhizoctonia spp. obtenidos de plantas de maíz con síntomas de mancha bandeada de la vaina y pudrición de raíz. Bootstrap de 1000 réplicas; grupo externo: Botryobasidium simile. AG=Grupo anastomósico.
En países como estados unidos, Canadá, Europa, Japón, Turquía y Venezuela, se han reportado a Rhizoctonia solani y Rhizoctonia zeae infectando a un amplio rango de hospedantes entre ellos el maíz (Demirci & Kordali, 1999). Estudios en México han registrado la presencia de Rhizoctonia solani AG-4 subgrupos de anastomosis HGI y HGIII incidiendo en cultivos como Jamaica, papa, chile, tomate y sandia (Montero et al., 2013; Ortega et al., 2021), pero no en maíz. Sin embargo, investigaciones en otros países productores de maíz, reportan infección por los grupos de anastomosis AG-1, AG-2, AG-4, AG-5, AG-6 y AG-11 (Ohkura et al., 2009). En el norte del estado de Sinaloa, México, este es el primer reporte donde se identifica a las especies Rhizoctonia zeae y Rhizoctonia solani AG-4 HGI y HGIII infectando a maíz, generando la mancha bandeada y pudrición de raíces en los municipios del Fuerte, Ahome, y Guasave.
Pruebas de patogenicidad
En la prueba de patogenicidad todos los aislados resultaron patogénicos. Los síntomas asociados a Rhizoctonia solani y Rhizoctonia zaea incidieron a los 14 días después de la inoculación, las plantas infectadas presentaron un atizonamiento en la vaina de la hoja, y pudrición. Los tratamientos aplicados tuvieron diferencias significativas (p > 0,05) comparadas con el control (Figura 4), siendo los aislados FAVF488, FAVF 491 Y FAVF493 los más severos, mismos que fueron identificados como Rhizoctonia zeae.
Esto demuestra que los hongos aislados de Rhizoctonia solani AG-4 HGI y HGIII y Rhizoctonia zeae son agentes causales de la mancha bandeada de la vaina del maíz en el norte de Sinaloa. La severidad de los aislados evidenció que estos patógenos son capaces de limitar el desarrollo del cultivo y debido a esto baja el rendimiento y la producción de este grano, derivando pérdidas económicas a causa de enfermedades radiculares en las regiones estudiadas.
4. Conclusiones
Las especies Rhizoctonia solani y Rhizoctonia zeae se encontraron ocasionando manchas bandeadas atizonadas en las vainas de la hoja basal, cancros negros y pudriciones de raíz en los cultivos de maíz en el norte de Sinaloa, en los municipios de Ahome, el Fuerte y Guasave.
El grupo de anastomosis de Rhizoctonia solani que está presente en el cultivo de maíz en el norte de Sinaloa es el AG-4 y sus subgrupos HGI y HGIII.

Figura 4. Patogenicidad de los aislados de Rhizoctonia spp. de maíz. Prueba de Tukey. Medias con una letra en común no son significativamente diferentes (p > 0,05).
Las pruebas de patogenicidad indicaron que ambas especies causan enfermedad en el maíz, siendo sumamente severos manifestando la mancha bandeada del maíz.
Estudios futuros deberán de centrarse en el control de la enfermedad y patogenicidad en otros cultivos, para generar una estrategia en el manejo contra los diferentes grupos y subgrupos de anastomosis de Rhizoctonia solani y Rhizoctonia zeae.
ORCID
K. Rabago-Zavala https://orcid.org/0009-0004-1566-8705
F. A. Valenzuela-Escoboza https://orcid.org/0000-0001-6203-1695
B. E. López-Valenzuela https://orcid.org/0000-0001-6383-6145
Q. A. Ayala-Armenta https://orcid.org/0000-0002-8083-4261
G. J. Lizárraga-Sánchez https://orcid.org/0000-0001-9816-9290
Referencias bibliográficas
Demirci, E., & Kordali, S. (1999). Rhizoctonia Species and Anastomosis Groups from Corn Kernels in Turkey. Plant desease, 83(3), 879. https://doi.org/10.1094/PDIS.1999.83.9.879C
Gutiérrez, S.A., Cundom, M. A., Barrera, V., & Gason, L. (2007). First record of Rhizoctonia zeae on corn in Argentina. Australasian Plant Disease Notes, 2, 137-138. https://doi.org/10.1071/DN07054
Kimura, M. (1983). The Neutral Theory of Molecular Evolution. Cambridge: Cambridge University Press.
Kronland, W. C., & Stangellini, M. E. (1988). Clean slide technique for the observation of anastomosis and nuclear condition of Rhizoctonia solani. Phytopatology, 78, 820-822. https://doi.org/10.1094/phyto-78-820
Li, H. R., Wu, B. C., & Yan S. Q. (1998). Aetiology of Rhizoctonia in sheath blight of maize in Sichuan. Plant Pathology, 47, 16–21. https://doi.org/10.1046/j.1365-3059.1998.00201.x
Little, T. M., & Hills, F. J. (1989). Métodos estadísticos para la investigación en la agricultura. Ed. trillas 2a edición. México, D. F. 125-143 pp.
Liu, Z. L., & Sinclair J. B. (1993). Differentiation of intraspecific groups within anastomosis group 1 of Rhizoctonia solani using ribosomal DNA internal transcribed spacer and isozyme comparisons. Canadian Journal of Plant Pathology, 15(4), 272-280. https://doi.org/10.1080/07060669309501923
McNab, A., & Castro, C. (2004). Enfermedades del maíz: una guía para su identificación en el campo. http://hdl.handle.net/10883/715
Minaya, E., & Reyes, E. (2017). Identificación y caracterización del agente causal de la pudrición de la raíz y tallo del maíz (Zea mays L.). Aporte Santiaguino, 9(1), 69-80. http://dx.doi.org/10.32911/as.2016.v9.n1.214
Montero, V., Guerrero, B. Z., Anaya, J. L., Martínez, T. O., Guevara, L., & González, M. M. (2013). Diversidad genética de aislados de Rhizoctonia solani (Kuhn) de Chile en México. Rev. Mex. Cienc. Agríc., 4(7), 1043-1054.
Muis, A., & Quimio, A. J. (2006). Biological control of banded leaf and sheath blight disease (Rhizoctonia solani kuhn) in corn with formulated Bacillus subtilis BR23. Indonesian Journal of Agricultural Science, 7(1), 1-7.
Murray, M. G., & Thompson, W. F. (1980). Rapid isolation of high molecular weight plant DNA. Nucleic Acids Research, 8(19),4321-4325. http://dx.doi.org/10.1093/nar/8.19.4321
Muzhinji, N., Truter, M., Woodhall, J. W., & Van der Waals, J. E. (2015). Anastomosis groups and pathogenicity of Rhizoctonia solani and binucleate Rhizoctonia from potatoes in South Africa. Plant Disease, 99(12), 1970-1802. https://doi.org/10.1094/PDIS-02-15-0236-RE
Ohkura, M., Abawi, G. S., Smart, C. D., & Hodge, K. T. (2009). Diversity and aggressivensess of Rhizoctonia solani and Rhizoctonia-like fungi of vegetables in New York. Plant Dis., 93, 615-624. https://doi.org/10.1094/pdis-93-6-0615
Ortega-Acosta, S. A., Palemón-Alberto, F., Terrones-Salgado, J., Molina-Gayosso, E., Romero-Ramírez, Y., Toribio-jimenez, J., Villar-Luna, E., Barcenas-Santana, D., Juarez-Lopez, P., Cruz-Lagunas, B., & Reyes-Garcia, G. (2021). First report of Rhizoctonia solani AG-4 HG-I causing fruit rot on tomato in Mexico. Plant. Dis., 106, 1531. https://doi.org/10.1094/PDIS-09-21-2005-PDN
Orus, A. (2025). Volumen de maíz producido en los Estados Unidos desde 2011 hasta 2023. Statista. http://es.statista.com/estadisticas/517323/produccion-de-maiz-en-los-ee-uu/
Porebski, S.; Bailey, L. G., & Baum, B. R. (1997). Modification of a CTAB DNA extraction protocol for plants containing high polysaccharide and polyphenol components. Plant Mol. Biol. Reporter, 15(1), 8-15. https://doi.org/10.1007/BF02772108
Rabago-Zavala, K., Valenzuela-Escoboza, B. E., Lizarraga-Sanchez, G. J. & Valenzuela-Escoboza, F. V (2024). Morphological, molecular and pathogenic caracterization of Rhizoctonia solani isolate associated whit been drying in Northern Sinaloa, Mexico. Agro Productividad, 17(11) supplement, 253-261. https://doi.org/10.32854/agrop.v17i11.3143
Reeb, V., Lutzoni, F., & Roux, C. (2004). Contribution of RPB2 to multilocus phylogenetic studies of the euascomycetes (Pezizomycotina, fungi) with special emphasis on the lichen forming Acarosporaceae and evolution of polyspory. Molecular Phylogenetics and Evolution, 32, 1036-1060. https://doi.org/10.1016/j.ympev.2004.04.012
Sagar, G. C., & Bhusal, K. (2019). Banded Leaf and Sheath Bight (BLSB) of maize, its introduction, losses and management. Journal of Soil Science and Plant Physiology, 1(2), 1-6.
SIAP. (2023). Portal de Servicio de Información Agroalimentaria y Pesca. www.siap.sagarpa.gob.mx
Singh, V., Kumar, S., Lal, M., & Hooda K. S (2014). Cultural and morphological variability among Rhizoctonia solani isolates from trans-gangetic plains of India. Research on Crops, 15(3), 644-650. http://dx.doi.org/10.5958/2348-7542.2014.01390.4
Singh, R., Murti S., Mehilalm, Tomer, A., & Prasad D. (2015). Virulence Diversity in Rhizoctonia Solani Causing Sheath Blight in Rice. J Plant Pathol Microb, 6, 296. https://doi.org/10.4172/2157-7471.1000296
Sneh, B. (1996). Anastomosis groups of multinucleate Rhizoctonia spp. In: Sneh B, Jabaji-Hare S, Neate S, Dijst G, eds. Rhizoctonia Species: Taxonomy, Molecular Biology, Ecology, Pathology and Disease Control. Dordrecht, the Netherlands: Kluwer Academic Publishers, 67–75.
Tamura, K., & Nei, M. (1993). Estimation of the number of nucleotide substitutions in the control region of mitochondrial DNA in humans and chimpanzees. Molecular Biology and Evolution, 10, 512-526. https://doi.org/10.1093/oxfordjournals.molbev.a040023
Telmadarrehei, T., Ghambury, M. A. T., Rahimian, H., Rezazadeh, A., & Javadi, M. A. (2011). Isolation and some pathologic properties of Rhizoctonia zeae from cultural soils of Golestan and Mazandarán provinces, Iran. World Applied Sciences Journal, 14(3), 374-377.
Yang, Y. G., Zhao, C., Guo, Z. J., & Wu, X. H. (2014). Anastomosis groups and pathogenicity of binucleate Rhizoctonia isolates associated with stem canker of patato in China. Journal of Plant Pathology, 139, 535-544. https://doi.org/10.1007/s10658-014-0409-6
Zadoks, J. C., & Schein, R. D. (1979). Epidemiology and plant disease management. Oxford University Press. 427 p.
Zhang, D. H., & Chen, Y. X. (1986). Anastomosis grouping of binucleate Rhizoctonia. Chinese Journal of Plant Pathology, 16, 139–144.