RESEARCH ARTICLE
Foliar phytopathogenic fungi associated with the cultivation of Prunus persica L.: Morphological and molecular identification, and biological control with Trichoderma asperelloides
Hongos fitopatógenos foliares asociados al cultivo de Prunus persica L.: Identificación morfológica y molecular, y control biológico con Trichoderma asperelloides
Ángel Ceballos-Chávez1 ; Fernando Valenzuela Escoboza1 ; Quintín Ayala Armenta1 ;
Everardo López Bautista1 ; Héctor Márquez Lujan2 ; Blanca López-Valenzuela1 *
1 Universidad Autónoma de Sinaloa, Facultad de Agricultura del Valle del Fuerte. Av. Japaraqui y Calle 16 S/N, CP. 81110, Juan José Ríos, Sinaloa, México.
2 Universidad Tecnológica de la Babícora, Departamento de Agricultura Sustentable y Protegida. Carretera Soto Máynez, Gómez Farias, Col. Oscar Soto Máynez, C.P. 31963, Namiquipa, Chihuahua, México.
* Corresponding author: blancalopezvzla@favf.mx (B. López-Valenzuela).
Received: 4 August 2024. Accepted: 29 January 2025. Published: 18 February 2025.
Abstract
The presence of foliar phytopathogenic fungi causes severe damage to leave and fruits of peach (Prunus persica L.), in producing areas of southern Chihuahua, Mexico, which has caused a decrease in production by 30%. The objective of this work was to identify morphologically and molecularly the foliar phytopathogenic fungi associated with the peach tree crop, evaluating the pathogenicity in one-year-old plants against Trichoderma asperelloides. Leaves with brown and brown lesions were collected from mummified fruits on the plant from 19 commercial peach orchards distributed in three municipalities of regional and national production in the State of Chihuahua, Mexico. Fungal identification of four representative isolates was performed using morphological methods. characterization and phylogenetic analysis based on the internal transcribed spacer region (ITS1 and ITS4) of ribosomal DNA, part of the translation elongation factor 1-alpha (TEF) a second secondary primer for each of the genera for, Collectotrichum ACT-512F and ACT-583R, Fusarium with EF1. For plant confrontations, a concentration of 1x106 conidia was inoculated. mL-1 of pathogens such as T. asperelloides, evaluating leaf diameter and length, height, severity and incidence. It was possible to identify the presence of Fusarium sambucinum, Collectotrichum gleosporoides and Monilinia frutícola, in addition the B-F-M1-A2-ACCH-3 strain of F. Sambucinum obtained the highest values in the inhibition of the response variables and in severity Monilinia frutícola presented 61.23% as the highest value. It is recommended to use strain 3 as a biological control of foliar phytopathogens.
Keywords: Molecular analysis; biocontrol; plant confrontation; fungus; identification; T. asperelloides.
Resumen
La presencia de hongos fitopatógenos foliares ocasiona severos daños en hojas y frutos de durazno (Prunus persica L.), en zonas productoras del sur de Chihuahua, México, lo que ha ocasionado una disminución en su producción en un 30%. El objetivo de este trabajo fue identificar morfológica y molecularmente los hongos fitopatógenos foliares asociados al cultivo del duraznero evaluando la patogenicidad en plantas de un año contra Trichoderma asperelloides. Se recolectaron hojas con lesiones color café y marrón en frutos momificados en planta de 19 huertos comerciales de durazno distribuidos en tres municipios de producción regional y nacional en el Estado de Chihuahua México. La identificación de hongos de cuatro aislamientos representativos se realizó utilizando métodos morfológicos. caracterización y análisis filogenético basado en la región espaciadora transcrita interna (ITS1 e ITS4) de ADN ribosomal, parte del factor de elongación de traducción 1-alfa (TEF) un segundo cebador secundario por cada uno de los géneros para, Collectotrichum ACT-512F y ACT-583R, Fusarium con EF1. Para las confrontaciones en planta se inoculo una concentración de 1x106 conidios. mL-1 de patógenos como de T. asperelloides, evaluando el diámetro y longitud de hoja, altura, severidad e incidencia. Se logró identificar la presencia de Fusarium sambucinum, Collectotrichum gleosporoides y Monilinia frutícola, además la cepa B-F-M1-A2-ACCH-3 de F. Sambucinum obtuvo los valores más altos en la inhibición de las variables de respuesta y en severidad Monilinia frutícola presentó 61,23% como el valor más alto. Se recomienda usar la cepa 3 como control biológico de fitopatógenos foliares.
Palabras clave: Análisis molecular; biocontrol; confrontación en planta; hongo; identificación; T. asperelloides.
DOI: https://doi.org/10.17268/sci.agropecu.2025.013
Cite this article:
Ceballos-Chávez. Á., Valenzuela Escoboza, F., Ayala Armenta, Q., López Bautista, E., Márquez Lujan, H. & López-Valenzuela, B. (2025). Hongos fitopatógenos foliares asociados al cultivo de Prunus persica L.: Identificación morfológica y molecular, y control biológico con Trichoderma asperelloides. Scientia Agropecuaria, 16(2), 155-165.
1. Introducción
El melocotón (Prunus persica (L.) Batsch) es un árbol o arbusto de hoja caduca de la familia de las Rosáceas que se cultiva en todo el mundo (Luo et al., 2022), sus frutos son en forma de drupa y sin hueso se consumen popularmente por su sabor dulce y su valor nutricional (Ren et al., 2019). Recientemente este frutal ha disminuido su producción en un 30% en la última década a nivel mundial (Manganaris et al., 2022) atribuyéndose a que alberga naturalmente un reservorio de hongos y bacterias sin causar enfermedades visibles (Gununu et al., 2019), por lo que pueden afectar significativamente el rendimiento y la calidad de la fruta y la longevidad de los árboles (Luo et al., 2022).
Por mencionar algunos se encuentran la pudrición parda causada por Monilinia spp, la mancha bacteriana causada por Xanthomonas arboricola pv. pruni (Xap), pudrición de la raíz por Armillaria, cancro bacteriano causado principalmente por Pseudomonas syringae y mildiú polvoriento causado por Podosphaera pannosa (Luo et al., 2022).
Los principales síntomas causados por Monilinia spp. es tizón de las flores, cancros de las ramitas, en algunos casos, las infecciones de las ramitas progresan hasta la muerte regresiva además las flores infectadas (es decir, el tizón floral) normalmente se vuelven marrones y se marchitan, seguido de la infección y colonización de los brotes (Luo et al., 2022). De igual manera Collectotrichum spp. es un hongo que por su parte afecta la producción y rendimiento en el cultivo del melocotón causando grandes pérdidas económicas, las cuales infectan principalmente la fruta, pero también pueden causar lesiones en hojas o ramitas. Las lesiones en los frutos aparecen como áreas firmes, marrones y hundidas, con anillos concéntricos y pequeños acervolos anaranjados ocasionado que los frutos no alcancen la madurez adecuada (Tan et al., 2022).
Por otro lado, se han identificado especies de Fusarium spp. que ocasionan la pudrición de las raíces, tronco, flores, ramas y frutos. Infecta principalmente el sistema vascular, se agrupan y destruyen los tejidos y producen toxinas, lo que provoca el marchitamiento y en última instancia, la muerte de los hospedantes (Dong et al., 2023), además se considera la especie de F.sambucinum como el primer reporte afectando al cultivo de durazno en México, así como C. gloesporoides afectando el tallo de la planta, de igual manera se reporta Alternaria como la primer reporte en el sur de la entidad federativa del sur de Chihuahua afectando a frutales con hueso. Por lo tanto, el objetivo de este estudio fue identificar morfológica y molecularmente los hongos fitopatógenos foliares asociados al cultivo del duraznero evaluando la patogenicidad en plantas de un año de edad contra Trichoderma asperelloides.
2. Metodología
2.1. Recolección de muestras. Se recolectaron hojas y frutos del cultivo del duraznero con síntomas típicos de hongos fitopatógenos en nueve huertos de consumo local, regional e internacional de durazno distribuidos en los municipios de Morelos, Balleza y Batopilas, ubicados en el sur de Chihuahua, México. Se tomaron las lecturas del GPS (Tabla 1) y las colecciones se llevaron al laboratorio en bolsas de plástico Ziplock.
2.2. Aislamiento y purificación. Las hojas sintomáticas se lavaron con jabón neutro y se esterilizó la superficie con alcohol al 96% durante 30 s. Los trozos de hojas (5 mm2) de los márgenes entre los tejidos necróticos y sanos se esterilizaron superficialmente con hipoclorito de sodio al 1% durante 60 s. Los trozos de hoja se lavaron con agua destilada estéril y el exceso de líquido se eliminó con papel de filtro estéril. Los trozos de hojas se colocaron en placas de PDA y se incubaron a 27 °C durante 9 días en oscuridad. Los tapones de micelio del borde de las hifas fúngicas que se desarrollaron a partir de los tejidos se transfirieron asépticamente a PDA fresco y se incubaron a 27 °C durante 9 días en oscuridad (Gerardo-Lugo et al., 2020).
Para realizar las purificaciones monoconidiales se utilizó el método descrito por Battistini et al. (2022). Se prepararon suspensiones de conidios a partir de las cajas Petri con hongos fitopatógenos y se diluyeron a una concentración de 106 conidios/mL.
Tabla 1
Ubicación de sitios de recolección frutos y hojas sintomáticas en diferentes municipios del estado de Chihuahua, México
Variedad | Identificación de los aislados | Localidad, municipio | Localización geográfica |
Criollo | B-F-M1-A2-ACCH-3 | Balleza, Balleza | 26° 56´ 48.8” N, 106° 21´ 17,3” W, 3100 msnm |
Criollo | B-F-M1-A3-AACH-5 | Balleza, Balleza | 26° 56´ 54.7” N, 106° 21´ 07,2” W, 3100 msnm |
Blanco | LJ-M2-H-ACCH-7 | Las Joyitas, Morelos | 26° 37´ 45.3” N, 107° 44´ 37,9” W 1238 msnm |
Amarillo | Y-M1-F-ACCH-8 | Yoquivo, Batopilas | 27° 00´ 58.4” N, 107° 32´ 31,7” W, 2800 msnm. |
Identificación de aislados: B: Balleza, LJ: Las Joyitas, Y: Yoquivo. F: Fruto, M1.M2: Número de muestra, A, A2, A3=Número de aislado en aislamiento, H: Hoja, ACCH: Ángel Ceballos Chávez, 3,5,7,8: Número de aislado identificado molecularmente.
Las suspensiones se extendieron sobre cajas de PDA y los conidios individuales se transfirieron con una aguja de disección esterilizada a cajas Petri con PDA nuevas. Cada colonia cultivada a partir de conidios individuales se consideró un aislado monoconidial. Los cultivos purificados se almacenaron en tubos con PDA cubiertos con aceite mineral estéril y papel filtro almacenándose a 4 °C (Gerardo-Lugo et al., 2020).
2.3. Caracterización morfológica y tasa de creci-miento micelial. Para la identificación de las características macroscópicas y microscópicas de los 50 aislamientos representativos de los géneros Monilinia, Fusarium y Collectotrichum de sitios de recolección de durazno en Chihuahua, se determinó la tasa de crecimiento micelial de cada aislado, se tomaron discos con micelio de 6 mm de diámetro de cultivos de 10 días y se colocaron en PDA.
Las cajas se incubaron a 27 °C en oscuridad realizándose ocho réplicas de cada aislado y se examinaron diariamente durante 9 días. La tasa de crecimiento (TC) se calculó con la función de crecimiento lineal. Umax= mm/t (días) donde umax es la velocidad de crecimiento, t es el tiempo y mm es el crecimiento (Iñiguez-Moreno et al., 2023) y se expresó en mm desde el día 1. Después de 9 días de crecimiento se identificaron las características de crecimiento de las colonias, incluido el color de la colonia frontal y reverso y presencia de micelio aéreo. El experimento se realizó por duplicado.
Para los caracteres macromorfológicos de los conidios, clamidosporas, fiálides, macroconidios, microconidios, mesoconidios, largo y ancho de micelio, así como presencia o ausencia de septos en cada uno de los géneros analizados, se prepararon diversos medios de cultivo para la observación de las estructuras de resistencia del género Fusarium se utilizó agar hojas clavel (CLA), durante 4 días de incubación, Collectotrichum y Monilinia se usó agar dextrosa papa (PDA) con 7 días y 12 días de crecimiento en caja Petri, todo el material fúngico se mantuvo a una temperatura de ± 27 °C con 14 horas luz y 10 horas obscuridad. Para la observación en microscopio se prepararon montajes con glicerina, azul de algodón, safranina y aceite de inmersión (Agu & Chidozie, 2021), mismos que fueron fotografiados por un microscopio compuesto (Imager M2) (n = 50) se visualizaron con el software ZEN.
2.4. Extracción de ADN, amplificación por PCR y secuenciación. El ADN genómico total se extrajo de micelio de hongos frescos, raspados del margen de cada una colonia, cultivado en cajas Petri con PDA, incubado a ± 27 °C, con el reactivo DNAzol (Invitrogen), siguiendo las instrucciones del fabricante (Rios-Hernández et al., 2021). Para la identificación molecular se amplificó el espaciador transcripto interno (ITS) y el gen parcial de factor de elongación 1 alfa (TEF), mediante PCR utilizando los cebadores ITS1 (5′-TCCGTAGGTGAACCTGCGG-3′) / ITS4 (5′-TCCTCCGCTTATTGATATGC-3′) para todos los géneros (White, 1990) y se utilizó un segundo cebador secundario por cada uno de los géneros, es decir para, Collectotrichum ACT-512F (5′- ATGTGCAAGGCCGGTTTCGC-3′) y ACT-583R (5′- TACGAGTCCTTCTGGCCCAT-3′) (Huang et al., 2013), Fusarium con EF1 (5′- ATGGGTAAGGARGACAAGAC-3′) (Karlsson et al., 2016) respectivamente, para el caso de Monilinia se consideró utilizar el ITS1 e ITS4 ya que en ambos experimentos se tuvo 100% de identidad con el género y especie. La reacción de PCR se realizó en un volumen final de 25 uL, los cuales contenían 1 μL de ADN genómico, Buffer 1X, 1.25 mM de MgCl2, 0,2 mM de cada iniciador, 0,2 mM de dNTP´s y 1U de Taq polimerasa (Invitrogen). Las condiciones de amplificación fueron las siguientes; desnaturalización inicial fue a 95 °C durante 5 min, con 35 ciclos de desnaturalización por 95 °C y 1 min, el anillamiento por 55 °C por un lapso de 1 min (ITS) / 59 °C a 1,5 min, extensión a 72 °C por 40 s (ITS) / 1,5 min (TEF), con una extensión final de 72 °C durante 5 min. La visualización de los fragmentos amplificados fue en gel de agarosa al 1%, fue teñido con bromuro de etidio, en un fotodocumentador (BIO-RAD). Una vez obtenidos los productos amplificados se secuenciaron utilizando Macrogen (Corea) los cuales se anclan en los ADNr.
2.5. Análisis filogenéticos. Para editar las secuencias se utilizó el software BioEdit versión 7.0.5.3 (Hall, 1999), se compararon con la base de datos GenBank, empleando el algoritmo BLASTn. Las cadenas de cada gen/región fueron alineadas a un set de cadenas de referencia de los géneros Monilinia, Collectotrichum y Fusarium y la cadena de Protocrea farinosa CBS 121551 en ITS1 e ITS4 y para los marcadores secundarios se utilizó Anabaena variabilis AB0 16520.1 para con el alineador MUSCLE (Edgar, 2004) e implementado con MEGA11 (Zhan et al. 2018). Los alineamientos concatenaron en MEGA y la matriz resultante se analizó en PartitionFinder versión 1.1.1 (Lanfear et al., 2012) para determinar el mejor esquema de particiones. Con respecto al árbol filogenético se llevó a cabo por el método de Máxima Verosimilitud en RAXML versión 7.2.8 (Stamatakis, 2006; Voglmayr et al., 2016), empleando el modelo GTRGAMMAI y 1000 réplicas Bootstrap. Se utilizo el software FigTree versión 1.4.0 para editar el filograma.
2.6. Confrontación en planta. Se realizó una prueba de confrontación en planta de los 4 aislamientos seleccionados con base a un análisis filogenético inicial de, Fusarium spp. (dos aislados), Collectotrichum sp. (un aislado) y Monilinia sp. (un aislado) contra la cepa 3 de Trichoderma asperelloides previamente identificada (3=SP-M-M5-R-T), las inoculaciones de los fitopatógenos se realizaron mediante la suspensión de esporas de 1x106 conidios. mL-1 dando ventaja de 3 días de crecimiento de los patógenos para posteriormente inocular el antagonista, mediante la técnica de aspersión de acuerdo con Udhayakumar et al. (2019), usando atomizadores diferentes para cada aislado sobre plantas de durazno variedad prisco inoculando de 3-4 hojas desarrolladas durante un año de crecimiento. Las plantas inoculadas permanecieron en condiciones de cámaras húmedas en invernadero durante el transcurso de la prueba de confrontación (27 ± 2 °C) con HR 85%, haciendo observaciones cada 24 horas después de la inoculación (ddi) durante 60 días (Moreno et al., 2018). Cada combinación (fitopatógeno-Trichoderma) contó con cuatro repeticiones más un testigo por tratamiento, sembradas en bolsas de polietileno de kg.
2.7. Valoración de las variables de respuesta. Los factores estudiados fueron diámetro de hoja (cm), longitud de hoja (cm) altura (cm) medidos con un vernier digital (marca: LEIDSANY serie: B09XQ987RZ), la severidad se clasificó mediante la escala propuesta por Arafat et al. (2021), en cuatro grados (Tabla 2) con variabilidad de porcentajes.
La severidad se estimó por la fórmula:
DSI (o/o): severidad promedio: Σ (v * n) 100
N * V
Donde v: valor numérico de la enfermedad escala de índice, n: número de plantas asignadas a la escala del índice de enfermedad, N: número total de las plantas, y V: valor numérico de la escala de índice de enfermedad más alta.
El nivel de incidencia de cada tratamiento se calificó por el porcentaje de esporulación después de 7 días de evaluación de acuerdo con la escala propuesta por Özer et al. (2021) considerando el 0% extremadamente sensible, 0,1% - 5,0% altamente resistente, 5,1% - 25% resistente, 25,1% - 50% sensible, 50,1% - 75% muy sensible y ≥ 75% extremadamente sensible, para la resistencia de la hoja con la misma cantidad de inoculo.
2.8. Análisis estadístico
Para determinar la severidad e incidencia en plantas de un año se utilizó un diseño completamente al azar de 4 aislados x 4 repeticiones (más los controles), los datos obtenidos se sometieron a un análisis de varianza (ANOVA) y para la comparación de medias se determinó de acuerdo con la prueba de Tukey-Kramer (p ≤ 0,05), empleando el programa estadístico SAS versión 9.4. (Statistical Analisis Sistem - SAS Institite Inc., 2022).
3. Resultados y discusión
3.1. Aislamientos de hongos. El aislamiento de frutos y hojas de durazno sintomáticas resultó en numerosos hongos, siendo los aislados similares a Fusarium, Monilinia y Collectotrichum los más comunes, basado en la caracterización fenotípica inicial, siguiendo los rasgos morfológicos descritos por Yikilmazsoy & Tosun, et al. (2021), Baltazar et al. (2023) y Silva-Neto et al. (2023). Los síntomas observados por Fusarium fueron marchitamiento y amarillamiento sobre las hojas y en el fruto se observó puntos de color café a oscuro, así como descomposición completa (Figura 1a), coincidiendo con lo reportado por Dong et al. (2023) al realizar pruebas de patogenicidad en rama y varetas de durazno, al presentar lesiones ovaladas de color marrón en la herida de las ramas del durazno con micelio denso en la superficie de las lesiones.

Figura 1. Síntomas en fruto y hoja de durazno asociados a hongos fitopatógenos foliares observados en campo.
Tabla 2
Escala de severidad en planta de durazno variedad prisco
Grado | Numero de lesiones | Porcentaje de afectación |
1 | 1-3 | Se produjeron manchas graduales entre el 1 y el 25 % de las hojas. |
2 | 4-6 | Se produjeron manchas graduales en el 26-50 % de las hojas. |
3 | 7-9 | Se produjeron manchas graduales en el 51-75 % de las hojas. |
4 | ≥10 | Se produjeron manchas graduales en el 76-100 % de las hojas. |
También se pudieron identificar síntomas preliminares de Monilinia con momificación de frutos sobre la superficie del suelo como en la parte aérea de la planta y en algunos casos pudrición café sobre los mismos, así como atizonamiento (necrosis) de las hojas con presencia de micelio blanquecino sobre el haz (Figura 1c) mismos a los que hacen referencia los investigadores Iqbal et al. (2022) quienes mencionan los síntomas principales causados por este género suelen ser cancros en las ramas, pudrición en los frutos y tizón en las flores. De igual manera se pudo observar magulladuras circulares hundidas de color negro sobre el fruto y pequeñas lesiones color café sobre las hojas con un halo color amarillento lográndose identificar el género de Collectotrichum (Figura 1b), sin embargo, se han observado anillos concéntricos y pequeños acérvulos anaranjados los cuales producen conidios que se propagan principalmente por la lluvia y las salpicaduras (Tan et al., 2022).
3.2. Características Morfológicas y Culturales. Las características culturales de las colonias en agar medio papa dextrosa (PDA) mostró variación entre diferentes aislados. Se lograron obtener cuatro aislados con características morfológicas y culturales tipológicas de los géneros Fusarium sambucinum (B-F-M1-A2-ACCH-3 y B-F-M1-A3-AACH-5,), Collectotrichum gloesporoides (LJ-M2-H-ACCH-7) y Monilinia frutícola (Y-M1-F-ACCH-8).
Al principio, las cepas de F. sambucinum se mostraron de color blancas con micelio aplanado, después de nueve días de incubación el micelio alcanzó el borde del agar cubriendo completamente la caja Petri, apareciendo de marrón a rojizo, formando manchas sólidas con diferentes tonalidades, especialmente en el centro en un punto de crecimiento o en zonas concéntricas se formó el micelio de color blanquecino aéreo sobre la superficie del medio empleado, diferenciado de las cepas obtenidas por Yikilmazsoy & Tosun (2021) quienes obtuvieron cepas de F. sambucinum aisladas de tubérculo de Solanum tuberosum con características específicas de coloración rosa blanco con abundante micelio algodonoso sobre la caja Petri, con formación de macroconidios, microconidos tipos de fiálides y presencia de clamidosporas. Las cepas aisladas en el sur de Chihuahua mostraron un crecimiento promedio de 13,42 mm/dia-1 en la cepa B-F-M1-A2-ACCH-3 y 16.75 mm/dia-1 en la cepa B-F-M1-A3-AACH-5. Este género formó micelio septado de 6,38 de ancho y 17,99 μm de largo y estructuras conidiales en forma de plátano de diferente crecimiento de macroconidios y microconidios de 1 a 3 septos y 2,32 de ancho y 4,64 μm de largo, mesoconidios, con de 4 a 6 septos con 2,0 de ancho y 5,32 μm de largo distribuidos en cadena y de forma libre en ambas ambos aislados, con fiálides en forma alargada de 5,60 de ancho y 12,97 μm de largo, con formación de conidióforos y esporodoquios ramificados de 29,42 μm de largo así como el crecimiento de clamidosporas filamentosas en cadena de forma circular a ovoide de 32,64 μm de diámetro (Figura 2). Es importante mencionar que esta especie de hongo se puede crecer en medio de cultivo de diferente coloración de blanco a rosa, de blanco a crema y de blanco a rojo con crecimiento con formación de esporodoquios de color naranja, con crecimiento de 2 cm por día y formación de conidios de 24,8 – 35,3 μm de largo y 3,67 – 4,46 μm de ancho con septos de tres a cinco por conidio, sin presencia de microconidios ni formación de clamidosporas (Almaraz-Sánchez et al., 2018).
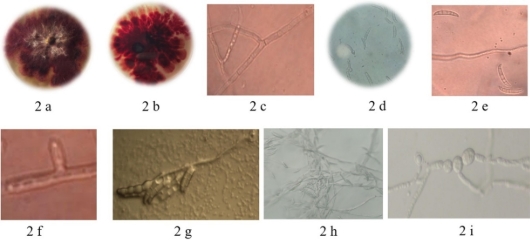
Figura 2. Morfología de F. sambucinum a-b) colonia de frente y reverso, c) micelio septado, d) macro y microconidios, e) Mesoconidios, f) fiálides, g) conidióforos en cadena, h) conidióforos ramificados y esporodoquios, i) clamidosporas y filamentos.
Él aislado de C. gloesporoides, desarrolló una formación de micelio blanco-gris claro, ligeramente algodonoso, con abundantes masas de conidios naranja brillante en círculos concéntricos, algunos de ellos produjeron un micelio blanco con pocas masas conidiales cubriendo la caja Petri en 7 días de incubación, mostrando un crecimiento promedio de 18,33 mm/dia, de igual manera Da Silva Neto et al. (2018) reportaron diversidad de coloración en aislados de C. gloesporoides aislados de Magnifera indica los cuales produjeron colonias ligeramente grisáceas sin masa conidial visible, otros desarro-llaron masa micelial gris con masa conidial oscura en el centro y las regiones oscuras laterales, así como un color ligeramente salmón con masa conidial anaranjada y oscura en el centro y el último grupo de asilados mostraron micelio ligeramente grisáceo con poca masa conidial anaranjada visible coincidiendo esta última descripción con los aislados obtenidos del cultivo de durazno en el sur de Chihuahua.
Se identificaron diversos morfotipos de estructuras de supervivencia de este hongo el cual desarrolló micelio liso con formación de células granuladas con dimensiones de 5,87 de ancho y 19,50 μm de largo, además de formar conidios hialinos en forma de lobulados y alargados de 6,29 de ancho y 15,26 μm de largo, además de formar peritecios esféricos y agrupados a los 28 días de crecimiento y crecimiento de conidiomas que dan lugar la formación de ascas con ascosporas en proceso de maduración desarrolladas en conjunto o libres con un diámetro de 16,18 μm (Figura 3), así mismo se han identificado conidios rectos con forma cilíndrica con extremos ampliamente redondeados de (14,8 −) 16,7 − 17,3 (− 19,5) × (4,3 −) μm, con apresorios simples o en un grupo pequeño, subglobosos o elipsoides y rara vez irregulares de (5,2 −) 6,7 − 7,6 (− 8,9) × (2,7 −) μm (Wang et al., 2020).
Por otro lado, la cepa de M. frutícola presentó un aspecto pulverulento con colores beige a café obscuro con márgenes ondulados y formación de anillos dispersos después de los 21 días de crecimiento formando estromas de color blanquecinos a naranjas con abundante micelio aéreo de color blanco-grisáceo desarrollando un crecimiento promedio de 16,00 mm/dia-1. Estos resultados coinciden con los reportados por Yin et al. (2021) al aislar M. frutícola del cultivo de Eriobotrya japonica y desarrollaron colonias de gris a marrón con abundante coloración. Además, las colonias aisladas en el sur de Chihuahua se observaron conidios son de forma ovalada o elipsoide globosa y medianos de 23.15 µm de diámetro, estructurados en cadena, con crecimiento de micelio liso hialino después de madurar a torna a color oscuro, también se encontró cadenas ramificadas agrupadas de color gris a oscuro y formación de apotecios pedicelados en forma de copa rellenas de ascosporas en proceso de maduración (Figura 4), estas características son específicas de este género ( Yin et al., 2020).
3.3. Filogenia. Al comprar la secuencia de la región ITS, de la base de datos de GenBank, presento 99% de igualdad con las especies del género; Monilinia fruticola (LC312668, MK834756) (Baltazar et al., 2023), además las especies de C. gloesporoides mostraron 100% de similitud (JN887343, MK569271) (Grano-Maldonado et al., 2021), y Fusarium sambucinum mostró 100% con respecto a OP125543 y X65482 (Figura 5a).

Figura 3. Morfología de C. gloesporoides a-b) colonia de frente y reverso, c) micelio liso granulado, d) conidios, e) conidiomas, f) peritecios, g) ascas con ascosporas, h) ascosporas inmaduras durante la división, i) ascosporas maduras libres.

Figura 4. Morfología de M. frutícola. a-b) colonia de frente y reverso, c) micelio liso hialino, d) conidios en cadena e) formación de apotecios relleno de ascosporas.
Al comparar las secuencias parciales del gen EF1, los resultados mostraron un 99% de similitud de todas las cepas con Fusarium sambucinum (KX632088.1:18-614 y KX632088.1:24-612) (Dong et al., 2023) y para C. gloesporoides mostró 99% (KT282614. 1:86-275) de similitud (Figura 5b y c). El análisis filogenético multigen confirmó que las cepas de Monilinia, Fusarium y Collectotrichum estudiadas, pertenecen a las especies de M. fruticola, F. sambucinum y C. gloesporoides con Bootstrap de 84%.
3.4. Confrontación en plantas de un año de edad
3.4.1. Diámetro de hoja. Los análisis de varianza (ANOVA) indican el efecto del crecimiento de diámetro de hoja entre los tratamientos y las diferencias significativas con respecto al testigo, entre la inhibición de T. asperelloides versus Fusarium sambucinum, Collectotrichum gloesporoides y Monilinia frutícola, siendo altamente significativo (p < 0,05) con R2 de 0,0770 para la cepa B-F-M1-A2-ACCH-3, correspondiente al género F. Sambucinum y la cepa LJ-M2-H-ACCH-7 de C. gloesporoides. En la Figura 6 se observa que todos los tratamientos tuvieron un efecto similar sobre el control de los patógenos, favoreciendo el crecimiento de la planta de Prunus persica.
3.4.2. Longitud de hoja. En la Figura 7 se muestran los resultados de la prueba de medias de Tukey de los datos correspondientes a la longitud de hoja obtenido en cada tratamiento del experimento, con un crecimiento promedio de 3.326 cm para la cepa de B-F-M1-A2-ACCH-3, correspondiente al género F. Sambucinum y la cepa LJ-M2-H-ACCH-7 de C. gloesporoides con 3.206 cm, mostrando diferencia significativa con respecto al testigo con una R2 de 0.988.
3.4.3. Altura. La evaluación realizada entre los diferentes tratamientos demostró la eficiencia de la cepa de T. asperelloides sobre las cepas de los patógenos confrontados, pudiéndose demostrar el efecto sobre las tres cepas de F. sambucinum, C. gloesporoides y M. frutícola, con excepción de la cepa B-F-M1-A3-AACH-5 de F. sambucinum (Figura 8), la cual mantuvo una estrecha correlación de 81,674 cm con respecto al testigo arrojando diferencias significativas con una R2 de 0,935.
3.4.4. Severidad. Las hojas inoculadas desarrollaron lesiones irregulares de color marrón con abundante clorosis y marchitamiento sobre la planta, 38 días después de la inoculación las lesiones se volvieron negras y se comenzó a observar destrucción foliar leve y necrosis sobre el mismo síntoma similares a los observados en hojas de durazno naturalmente infectadas. Por otro lado, las hojas del testigo se mantuvieron sin síntomas. La severidad promedio en hojas de durazno inoculadas artificialmente se observan en la Tabla 3. Los aislados mostraron diferencias significativas (P 0.05) con respecto al testigo.
Algunos investigadores han reportado el biocontrol de T. asperelloides vs F. Oxysporum en planta de Solanum lycopersicum de 47% de reducción de síntomas en sobre las ramas de la hortaliza (Ramírez- Cariño et al., 2020).
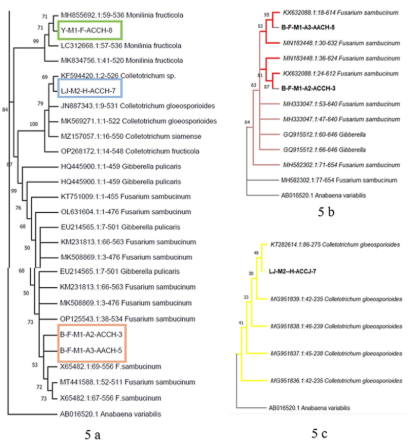
Figura 5. Árbol filogenético de los géneros Monilinia, Fusarium y Collectotrichum, a) inferido por Máxima Verosimilitud a partir del alineamiento concatenado de la zona ITS y b, c) la cadena parcial del gen característico del factor de elongación (TEF). La escala representa las sustituciones del promedio por sitio. Los datos bootstrap ≥84% se muestran arriba de las ramas, junto a los internodos. Las especies estudiadas en esta investigación se exponen en negritas y subrayadas.
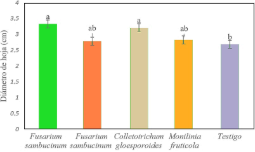
Figura 6. Diámetro de hoja por género evaluado vs T. asperelloides en condiciones controladas. *Letras diferentes, entre filas, indican diferencias significativas según la prueba de Tukey-Kramer (p ≤ 0,05).
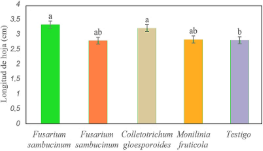
Figura 7. Longitud de hoja por género evaluado vs T. asperelloides en condiciones controladas. *Letras diferentes, entre filas, indican diferencias significativas según la prueba de Tukey-Kramer (p ≤ 0,05).

Figura 8. Altura por género evaluado vs T. asperelloides en condiciones controladas. *Letras diferentes, entre filas, indican diferencias significativas según la prueba de Tukey-Kramer (p ≤ 0,05).
Además, se ha encontrado la reducción de la invasión de Rhizoctonia solani en respuesta a T. asperelloides sobre el cultivo de tomate inhibiendo significativamente en dos bioensayos de 83,3% evaluando los efectos con escala de severidad e incidencia y evaluación microscópica sobre micoparasitismo (Heflish et al., 2021).
3.4.5. Incidencia. En cuanto a la incidencia de los fitopatógenos (4 aislados), éstos presentaron micelio color blanco y después de los siete días se tornó a color grisáceo sobre la hoja y tallo, lesiones de color marrón al inicio durante el desarrollo de maduración del hongo reaparecieron coloraciones café obscuro generando necrosamiento en la parte foliar (Figura 9), desarrollando un 100% en los bioensayos, por lo que son considerados extrema-damente sensibles para el cultivo del duraznero de la zona sur de Chihuahua. Cabe resaltar que, en Puebla, México se reportó el género M. fruticula afectando en cosecha del duraznero entre 33% y 70% (Huilotl-Luna, 2024). Además, Dini (2021) explica que los brotes y las ramas atacadas por M. frutícola presentan cancros y la muerte de la porción distal desde el cancro al ápice y las hojas ubicadas en brotes afectados mueren, quedando adheridas al mismo. Así mismo se han encontrado estudios sobre el efecto de T. asperelloides y T. asperellum sobre C. gloesporoides en plántulas de chile desarrolladas en laboratorio para atacar antracnosis manteniendo una incidencia de 62,07% (Boukaew et al., 2024), por otro lado, especies de Trichoderma han reducido la podredumbre de raíz en 87,5% de F. solani en el crecimiento radicular del Duraznero (Mannai & Boughalleb-M’Hamdi, 2022).

Figura 9. Síntomas por fitopatógenos en planta de durazno de un año a) lesiones en hoja por C. gloesporoides b) necrosis sobre el follaje por M. fruticola, c) amarillamiento de hoja por F. sambucinum d) invasión micelial de tallo y lesiones sobre la hoja por F. sambucinum.
Tabla 3
Porcentaje de severidad en hoja
Aislado | Género | Grado de escala | Número de lesiones | Severidad (%) |
B-F-M1-A2-ACCH-3 | Fusarium sambucinum | 1 | 2 | 11.25 bc |
B-F-M1-A3-AACH-5 | Fusarium sambucinum | 2 | 5 | 32.8 ab |
LJ-M2-H-ACCH-7 | Collectotrichum gleosporoides | 1 | 3 | 22.7 b |
Y-M1-F-ACCH-8 | Monilinia frutícola | 3 | 7 | 61.23 a |
Testigo | Test | 0 | 0 | 0 c |
*Letras diferentes, entre filas, indican diferencias significativas según la prueba de Tukey-Kramer (p ≤ 0,05).
4. Conclusiones
Las cuatro cepas de los fitopatógenos aisladas de hoja y fruto de plantas de durazno (Prunus persica) en el sur de Chihuahua, fueron caracterizados morfológica y molecularmente, y se determinó que pertenecen a las especies de Fusarium sambucinum, Collectotrichum gleosporoides y Monilinia frutícola.
En cuanto al diámetro y longitud de hoja se presentó mayor crecimiento en la cepa B-F-M1-A2-ACCH-3 de F. sambucinum y en la cepa de LJ-M2-H-ACCH-7 correspondiente a C. gloesporoides mostrando diferencia significativa respecto al testigo, en cambio en la altura se destaca que T. asperelloides no promovió el desarrollo de la planta, con respecto a la cepa B-F-M1-A3-AACH-5 de F. Sambucinum, ya que se mostró similar o menor crecimiento al testigo sin inoculación. Todos los aislados mostraron incidencia en todas las unidades experimentales evaluadas en condiciones de invernadero, además de presentar de dos hasta siete lesiones ubicándose en la escala de severidad 1-3, considerando a Monilinia frutícola como uno de los hongos con mayor afectación al cultivo del duraznero.
La cepa 3 de T. asperelloides presenta un alto potencial para el control in vivo frente a los fitopatógenos foliares en plantas de durazno de un año.
Se recomienda probar como biocontrol T. asperelloides en floración, producción de frutos y aceleración en el proceso de germinación de semillas, así como en el crecimiento radicular contra patógenos de suelo y foliares, además de probar la patogenicidad en otros frutales de importancia económica.
Contribución de los autores
Á. R. Ceballos-Chávez: protocolo, investigación y desarrollo experimental de la investigación; B. E. López Valenzuela: proporcionó los equipos para la identificación morfológica y molecular de los aislados obtenidos; F. A. Valenzuela Escoboza, Q. Ayala Armenta y E. López Bautista: revisión y análisis estadístico para el procesamiento de datos; H. A. Márquez Lujan: Levantamiento de datos de las salidas a muestreo de campo, desarrollo experimental y escritura. Todos los autores contribuyeron en la revisión del documento.
Agradecimientos
Al CONAHCyT de México por otorgar la beca de estudios de posgrado al primer autor, que permitió realizar esta investigación. También a la Universidad Autónoma de Occidente, Universidad Tecnológica de la Tarahumara por permitir el uso de los equipos para la ejecución de este proyecto y a Dra. Karla Yeriana Leyva Madrigal, M.C. Leidy Erisleida Chávez García, Lic. Zaira Morenos Lazos, Lic. Raquel Molina Ponce y Gema Bustillos Bustillos quienes participaron como colaboradores del trabajo experimental.
Conflicto de intereses
Los autores declaran no tener conflictos de interés.
ORCID
Á. Ceballos-Chávez https://orcid.org/0000-0002-8332-0389
F. Valenzuela Escoboza https://orcid.org/0000-0001-6203-1695
Q. Ayala Armenta https://orcid.org/0000-0002-8083-4261
E. López Bautista https://orcid.org/0000-0003-0111-3683
H. Márquez Lujan https://orcid.org/0009-0000-8358-4715
B. López-Valenzuela https://orcid.org/0000-0001-6383-6145
Referencias bibliográficas
Agu, K. C., & Chidozie, C. P. (2021). An improved slide culture technique for the microscopic identification of fungal species. International Journal of Trend in Scientific Research and Development, 6(1), 243-254.
Almaraz-Sánchez, A., Ayala-Escobar, V., Tlatilpa-Santamaría, I. F., & Nieto-Angel, D. (2018). Fusarium sambucinum Fuckel agente causal de la pudrición de frutos de chile manzano (Capsicum pubescens) en México. Revista Mexicana de Fitopatología, 37(1). https://doi.org/10.18781/r.mex.fit.1810-2
Arafat, K. H., Hassan, M., & Hussein, E. A. (2021). Detection, disease severity and chlorophyll prediction of date palm leaf spot fungal diseases. New Valley Journal of Agricultural Science, 1(2), 98-110.
https://doi.org/10.21608/nvjas.2022.110022.1027
Baltazar, E., Rodrigues, S., Ares, A., Camelo, A., Brandão, I., et al. (2023). Morphological, Molecular and Genomic Identification and Characterisation of Monilinia fructicola in Prunus persica from Portugal. Agronomy, 13(6), 1493. https://doi.org/10.3390/agronomy13061493
Battistini, G., Gazzetti, K., & Collina, M. (2022). A New Approach: Determining cyt b G143A Allele Frequency in Zymoseptoria tritici by Digital Droplet PCR. Biology, 11(2), 240. https://doi.org/10.3390/biology11020240
Boukaew, S., Chumkaew, K., Petlamul, W., Srinuanpan, S., Nooprom, K., & Zhang, Z. (2024). Biocontrol effectiveness of Trichoderma asperelloides SKRU-01 and Trichoderma asperellum NST-009 on postharvest anthracnose in chili pepper. Food Control, 163, 110490. https://doi.org/10.1016/j.foodcont.2024.110490
Da Silva Neto, J. A., De Queiroz Ambrósio, M. M., Araújo, M. B. M., Da Silva, R. M., Pinto, P. S. L., & Holanda, I. S. A. (2022). Morphological, molecular and pathogenic characterization of Colletotrichum gloeosporioides isolated from mango. Revista Caatinga, 35(3), 514-527. https://doi.org/10.1590/1983-21252022v35n302rc
Dini, M., Raseira, M., Scariotto, S., Marchi, P., & Mello-Farias, P. (2021). Research article peach phenological characters: heritability, maternal effect and correlation with brown rot. Genetics and Molecular Research, 20(1). https://doi.org/10.4238/gmr18684
Dong, J., Shi, H., Wu, Y., Yang, L., Zhu, F., & Ji, Z. (2023). Identification and pathogenicity analysis of Fusarium spp. on peach in China. BMC Microbiology, 23, 211. https://doi.org/10.1186/s12866-023-02958-y
Edgar, R. C. (2004). Muscle: multiple sequence alignment with high accuracy and high throughput. Nucleic Acids Research, 32(5), 1792-1797. https://doi.org/10.1093/nar/gkh340
Gerardo-Lugo, S. S., Tovar-Pedraza, J. M., Maharachchikumbura, S. S., Apodaca-Sánchez, M. A., Correia, K. C., et al. (2020). Characterization of Neopestalotiopsis species associated with mango grey leaf spot disease in Sinaloa, Mexico. Pathogens, 9(10), 788. https://doi.org/10.3390/pathogens9100788
Gununu, P. R., Munhuweyi, K., Obianom, P. C., & Sivakumar, D. (2019). Assessment of eleven South African peach cultivars for susceptibility to brown rot and blue mould. Scientia Horticulturae, 254, 1-6. https://doi.org/10.1016/j.scienta.2019.04.067
Grano-Maldonado, M. I., Ramos-Payan, R., Rivera-Chaparro, F., Aguilar-Medina, M., Romero-Quintana, J. G., Rodríguez-Santiago, A., & Nieves-Soto, M. (2021). First Molecular Characterization of Colletotrichum sp. and Fusarium sp. Isolated from Mangrove in Mexico and the Antagonist Effect of Trichoderma harzianum as an Effective Biocontrol Agent. Plant Pathology Journal, 37(5), 465-475. https://doi.org/10.5423/ppj.oa.03.2021.0048
Hall, T. A. (1999). BioEdit: a user-friendly biological sequence alignment editor and analysis program for Windows 95/98/NT. Nucleic acids symposium series, 41(49), 95-98.
Heflish, A. A., Abdelkhalek, A., Al-Askar, A. A., & Behiry, S. I. (2021). Protective and Curative Effects of Trichoderma asperelloides Ta41 on Tomato Root Rot Caused by Rhizoctonia solani Rs33. Agronomy, 11(6), 1162. https://doi.org/10.3390/agronomy11061162
Huang, R., Sun, W., Wang, L., Li, Q., Huang, S., et al. (2021). Identification and characterization of Colletotrichum species associated with anthracnose disease of banana. Plant Pathology, 70(8), 1827-1837. https://doi.org/10.1111/ppa.13426
Huilotl-Luna, M. L., Gil-Muñoz, A., Hernández-Romero, E., López, P. A., & Martínez-Carrera, D. C. (2024). Manejo de la pudrición café (Monilinia fructicola) del duraznero por productores de la Sierra Nevada de Puebla. Agricultura Sociedad y Desarrollo, 21(4). https://doi.org/10.22231/asyd.v21i4.1679
Iñiguez-Moreno, M., Sandoval-Contreras, T., Ragazzo-Sánchez, J. A., & Calderón-Santoyo, M. (2023). Modelado del crecimiento de hongos fitopatógenos aislados de frutos de aguacate Hass. Acta de Ciencia en Salud, 20(7), 1-5.
Iqbal, S., Abbas, A., Mubeen, I., Sathish, M., Razaq, Z., Mubeen, M., Kamran, M., Haroon, M., Syed, S., Naqvi, S., & Ahmed, M. A. A. (2022). Taxonomy, distribution, epidemiology, disease cycle and management of brown rot disease of peach (Monilinia spp.). Notulae Botanicae Horti Agrobotanici Cluj-Napoca, 50(1), 12630. https://doi.org/10.15835/nbha50112630
Karlsson, I., Edel-Hermann, V., Gautheron, N., Durling, M. B., Kolseth, A. K., et al. (2016). Genus-specific primers for study of Fusarium communities in field samples. Applied and environmental microbiology, 82(2), 491-501. https://doi.org/10.1128/AEM.02748-15
Lanfear, R., Calcott, B., Ho, S. y. W., & Guindon, S. (2012). PartitionFinder: Combined Selection of Partitioning Schemes and Substitution Models for Phylogenetic Analyses. Molecular Biology And Evolution, 29(6), 1695-1701. https://doi.org/10.1093/molbev/mss020
Luo, C., Schnabel, G., Hu, M., & De Cal, A. (2022). Global distribution and management of peach diseases. Phytopathology Research, 4(1). https://doi.org/10.1186/s42483-022-00134-0
Mannai, S., & Boughalleb-M’Hamdi, N. (2022). In vitro and in planta potential effect of some indigenous antagonists against Fusarium and pythiaceous species associated with peach seedlings decline. Egyptian Journal of Biological Pest Control, 32(1). https://doi.org/10.1186/s41938-022-00540-8
Manganaris, G. A., Minas, I., Cirilli, M., Torres, R., Bassi, D., & Costa, G. (2022). Peach for the future: A specialty crop revisited. Scientia Horticulturae, 305, 111390. https://doi.org/10.1016/j.scienta.2022.111390
Moreno, L. J. P., Prado, D. A. A., & Herrera, S. Y. A. (2018). Hongos fitopatógenos asociados a enfermedades foliares de Cattleya, Miltoniopsis y Oncidium en víveros de fusagasugá (Cundinamarca, Co). Revista de Fitopatología Colombiana, 42(1), 13-16.
Özer, N., Uzun, H. İ., Aktürk, B., Özer, C., Akkurt, M., & Aydın, S. (2021). Resistance assessment of grapevine leaves to downy mildew with sporulation area scoring. European Journal Of Plant Pathology, 160(2), 337-348. https://doi.org/10.1007/s10658-021-02247-2
Ramírez-Cariño, H. F., Guadarrama-Mendoza, P. C., Sánchez-López, V., Cuervo-Parra, J. A., Ramírez-Reyes, T., Dunlap, C. A., & Valadez-Blanco, R. (2020). Biocontrol of Alternaria alternata and Fusarium oxysporum by Trichoderma asperelloides and Bacillus paralicheniformis in tomato plants. Antonie Van Leeuwenhoek, 113(9), 1247-1261. https://doi.org/10.1007/s10482-020-01433-2
Ren, F., Dong, W., & Yan, D. (2019). Organs, cultivars, soil, and fruit properties affect structure of endophytic mycobiota of pinggu peach trees. Microorganisms, 7(9), 322. https://doi.org/10.3390/microorganisms7090322
Rios-Hernández, T. A., Uc-Varguez, A., & Evangelista-Martínez, Z. (2021). Biological control of Fusarium oxysporum causal agent of gladiolus corm rot by streptomycetes. Revista Mexicana de Fitopatología, 39(3). https://doi.org/10.18781/r.mex.fit.2105-3
Silva-Neto, J. A. D., Ambrósio, M. M. D. Q., Araújo, M. B. M., Silva, R., Pinto, P. S. L., & Holanda, I. S. A. (2022). Morphological, molecular and pathogenic characterization of Colletotrichum gloeosporioides isolated from mango. Revista Caatinga, 35, 514-527. https://doi.org/10.1590/1983-21252022v35n302rc
Stamatakis, A. (2006). RAxML-VI-HPC: maximum likelihood-based phylogenetic analyses with thousands of taxa and mixed models. Bioinformatics, 22(21), 2688-2690. https://doi.org/10.1093/bioinformatics/btl446
Statistical Analysis Software. (SAS). (2012). Users’ Guide Statistics Version 9.4. SAS Institute Inc., Cary. https://support.sas.com/software/94/
Tan, Q., Schnabel, G., Chaisiri, C., Yin, L. F., Yin, W. X., & Luo, C. X. (2022). Colletotrichum species associated with peaches in China. Journal of Fungi, 8(3), 313. https://doi.org/10.3390/jof8030313
Udhayakumar, R., Usharani, S., & Muthukumar, A. (2019). Pathogenicity variation, morphological and cultural characteristic of Colletotrichum gloeosporioides isolates. Plant Archives, 19(1), 425-430.
Voglmayr, H, Akulov, O. Y., & Jaklitsch, W. M. (2016). Reassessment of Allantonectria, phylogenetic position of Thyronectroidea, and Thyronectria caraganae sp. nov. Mycological Progress, 15(9), 921–937. https://doi.org/10.1007/s11557-016-1218-4
Wang, Q., Fan, K., Li, D., Han, C., Qu, Y., Qi, Y., & Wu, X. (2020). Identification, Virulence and Fungicide Sensitivity of Colletotrichum gloeosporioides s.s. Responsible for Walnut Anthracnose Disease in China. Plant Disease, 104(5), 1358-1368. https://doi.org/10.1094/pdis-12-19-2569-re
White, T., Bruns, T., Lee, S., & Taylor, J. (1990). Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics. En Elsevier eBooks (pp. 315-322). https://doi.org/10.1016/b978-0-12-372180-8.50042-1
Yikilmazsoy, G., & Tosun, N. (2021). Characterization of Fusarium sambucinum isolates associated with potato dry rot and evaluation of cultivar susceptibility and fungicides. Turkish Journal of Agriculture and Forestry, 45(2), 222-233. https://doi.org/10.3906/tar-2006-100
Yin, L., Zhang, S., Du, J., Wang, X., Xu, W., & Luo, C. (2021). Monilinia fructicola on loquat: An old pathogen invading a new host. Journal Of Integrative Agriculture, 20(7), 2009-2014. https://doi.org/10.1016/s2095-3119(20)63375-5
Yin, L. F., Mo, W., Guo, D. Y., & Luo, C. X. (2020). First Report of Brown Rot of Prunus mume Caused by Monilinia fructicola in China. Plant Disease, 104(4), 1253. https://doi.org/10.1094/pdis-09-19-1847-pdn
Zhan, Q., Wang, N., Jin, S., Tan, R., Jiang, Q., & Wang, Y. (2018) ProbPFP: A multiple sequence alignment algorithm combining partition function and hidden markov model with particle swarm optimization. IEEE International conference on bioinformatics and biomedicine (BIBM) 1290-1295. https://doi.org/10.1109/BIBM.2018.8621220