RESEARCH ARTICLE
A strategy to optimize soil phosphorus reserve: A study based on native maize of Mexico and genotype selection
Estrategia para optimizar la reserva de fósforo en el suelo: Un estudio basado en la diversidad de maíces nativos de México y selección de genotipos
Selene Guadalupe Salazar-Mejía1 ; Jeannette S. Bayuelo Jiménez1,*
1 Instituto de Investigaciones Agropecuarias y Forestales, Universidad Michoacana de San Nicolás de Hidalgo. Km 9 Carretera Morelia-Zinapécuaro. Tarímbaro. Michoacán, C.P. 58800. México.
* Corresponding author: bayuelo@umich.mx (J. S. Bayuelo Jiménez).
Received: 6 November 2023. Accepted: 18 May 2024. Published: 8 June 2024.
Abstract
Continual removal of phosphorus (P) by the crop gradually decreases soil fertility and drives the need for fertilizer inputs for agricultural production. Phytate is considered as the major storage pool for P in the seeds, but its contribution to human nutrition is low. The objective of this study was to characterize quantitative P concentrations (phytate, inorganic P and total P) of 50 native maize genotypes of Zea mays L. of the Patzcuaro lake, Michoacan, Mexico. The average total P and phytate concentration observed across all the genotypes was 3,1, 2,64, and 0,43 mg g-1, respectively. The relationship between phytate and total P was strong (r= 0,98**). This clearly suggests that with an increase in total P there is a corresponding increase in phytate concentration. Cluster analysis of data indicated five distinct groups with 1, 14, 11, 15 and 9 genotypes, respectively. Clusters I and II contained low phytate genotypes (1,74 mg g-1) while cluster V grouped most of the high phytate (4,9 mg g-1) contenting genotypes. Principal component analysis and F test showed the attributes more influencing group separation. Those attributes were total P and phytate. The first two components explained the 95% of the accumulation variation among groups. The race of the genotypes, however, was no clearly related to the group differentiation. These observations provide the first study on the genetic variety for breeding maize with lower P concentration to reduce P extraction from maize field at harvest.
Keywords: Zea mays L.; cluster analysis; principal component analysis; germplasm; seed.
Resumen
La sustracción ininterrumpida de fósforo (P) por el cultivo, agota la fertilidad del suelo y conduce al uso de fertilizante para la producción agrícola. El fitato es la principal reserva de P en la semilla, pero su contribución a la nutrición humana es reducida. Se caracterizaron 50 genotipos de maíz nativo de la región lacustre de Pátzcuaro, Michoacán, México, con base en las formas de P de la semilla. El promedio de la concentración de P total, fitato y Pi, entre todos los genotipos fue de 3,1, 2,6 y 0,43 mg g-1. La correlación entre el P total y fitato fue positiva (r = 0,98**), lo que sugiere que, un incremento de P total en la semilla conlleva a un aumento en la concentración de fitato. El análisis de conglomerados detectó cinco grupos con 1, 14, 11, 15 y 9 genotipos, respectivamente. Los Grupos I y II incluyeron a los genotipos con la menor concentración de fitato (1,74 mg g-1), mientras que el Grupo V integró a los genotipos con la mayor concentración (4,92 mg g-1). El análisis de componentes principales (CP) junto con la prueba F detectó que el P total y fitato fueron las variables que diferenciaron los grupos. Los dos primeros CP explicaron el 95% de la variación acumulada entre genotipos. Estas observaciones proveen el primer estudio sobre la diversidad de maíces nativos y su potencial para seleccionar genotipos con una menor concentración de P en la semilla y reducir la extracción de P del suelo.
Palabras clave: Zea mays L.; análisis de clasificación; análisis de componentes principales; germoplasma; semilla.
DOI: https://doi.org/10.17268/sci.agropecu.2024.026
Cite this article:
Salazar-Mejía, S. G., & Bayuelo Jiménez, J. S. (2024). Estrategia para optimizar la reserva de fósforo en el suelo: Un estudio basado en la diversidad de maíces nativos de México y selección de genotipos. Scientia Agropecuaria, 15(3), 349-359.
1. Introducción
El fósforo (P) es un macronutriente esencial para la producción agrícola (Schneider et al., 2019). A pesar de que el contenido de P total en el suelo es alto (200 a 3000 mg kg-1), solo un reducido porcentaje (< 0,1%) está disponible para el crecimiento del cultivo (Wang et al., 2021). Diversos procesos fisicoquímicos (sorción-desorción y precipitación-disolución) y biológicos (inmovilización y minera-lización) regulan la disponibilidad de P en solución (Bünemann, 2015). De tal forma que, el mante-nimiento del nivel crítico de P en el suelo constituye el punto de partida para sustentar sistemas agrícolas productivos y sostenibles. Se espera que el rendimiento máximo (90% a 95%) de un cultivo se alcance con un valor crítico de P (disponible) en el suelo (Schneider et al., 2019). Por ejemplo, el maíz, trigo y arroz requieren de un valor crítico de P en el suelo (de 10 a 28 mg P kg-1) para obtener un rendimiento óptimo (Bai et al., 2013). Sin embargo, las propiedades fisicoquímicas del suelo, la morfología de la raíz, las condiciones ambientales y el manejo agrícola (fertilización) afectan dicha disponibilidad (Schneider et al., 2019). En sistemas agrícolas intensivos, el uso indiscriminado de enmiendas químicas (fertilizantes) y orgánicas (estiércol) que exceden a las necesidades del cultivo, incrementan las reservas recalcitrantes de P y la concentración de P disponible en solución, potenciando su pérdida y contaminación hacia aguas superficiales (Wang & Ning, 2019). En sistemas agrícolas rurales, cuya disponibilidad de P en el suelo es baja, la continua remoción de P por el cultivo disminuye gradualmente su fertilidad. El trigo, por ejemplo, extrae de 25 a 30 kg de P año-1, mientras que el arroz remueve hasta 15 kg P año-1 (Heuer et al., 2017; Wang et al., 2018). A lo anterior, se suma la amenaza del suministro de P debido el agotamiento de la roca fosfórica, el costo del fertilizante y su ineficiente uso (15% a 35%) (Cong et al., 2020). La capacidad productiva de un suelo, por tanto, necesita de cultivos eficientes que optimicen el uso de P y restituyan el que extraen durante su ciclo de vida (Wang & Ning, 2019).
La eficiencia en el uso de fósforo (EUP) de un cultivo está modulada por los componentes de adquisición (EAP), utilización (EUtP), movilización (ERP) y la concentración de P (ácido fítico) en la semilla (Cong et al., 2020). La EAP se rige por estrategias que: (i) optimizan la exploración de P de la superficie del suelo mediante modificaciones en la morfología de la raíz (Pang et al., 2018), (ii) favorecen la solubilización de P con protones, ácidos orgánicos y fosfatasas exudadas por la raíz (Wang & Ning, 2019) e (iii) incrementan la exploración del suelo con hongos micorrícicos arbusculares y bacterias solubilizadoras (Kafle et al., 2019). La EUtP o la capacidad de producir más biomasa o grano por unidad de P absorbido, se regula mediante un adecuado transporte y distribución de P en la planta (Han et al., 2022). La ERP, por otro lado, asegura la producción de materia seca y la movilización de P entre órganos vegetativos y reproductivos (Cong et al., 2020). Se estima que, entre 10% a 70% del P contenido en órganos senescentes, se moviliza hacia tejidos jóvenes, mediante el reciclaje de P de la vacuola y por la liberación de Pi de acervos orgánicos (lípidos-Pi, esteres-P y ácidos nucleicos-P) (Mo et al., 2019). Por último, la identificación o desarrollo de variedades con una baja concentración de fitato en la semilla, puede mejorar la EUP y optimizar las reservas de P en el suelo (Stanton et al., 2022).
Se estima que, aproximadamente el 65% del P que se adiciona al suelo como fertilizante, se almacena en la semilla en la forma de ácido fítico [myo-inositol (1, 2, 3, 4, 5, 6) hexakisfosfato, IP6] (Perera et al., 2019; Raboy, 2020). El ácido fítico se deposita mayormente en la forma de fitato combinado con iones minerales de Ca, Fe y Zn y constituye la fuente principal de P para la germinación de la semilla y el desarrollo de la plántula (Perera et al., 2019). Sin embargo, es un compuesto con actividad antinutricional para el hombre y animales monogástricos debido a su capacidad de formar compuestos insolubles con minerales (Zn y Fe) e interferir con su asimilación por el organismo en condiciones fisiológicas (Cong et al., 2020; Raboy, 2020). Además, la excreción de altas cantidades de fitato y el inadecuado manejo de sus desechos repercute negativamente en el ambiente (Raboy, 2020).
A la fecha, se reconocen tres estrategias que aminoran la acumulación de fitato en la semilla y reducen su efecto adverso en el ambiente y la nutrición humana (Bhagyawant et al., 2018). En la primera, se irrumpe la síntesis del fitato durante el desarrollo de la semilla mediante métodos clásicos y/o moleculares (Bhagyawant et al., 2018; Houssni et al., 2024). La segunda utiliza técnicas moleculares para identificar los mutantes (lpa) y transportadores (HsST, OsSULTR3, TdMRP3) que regulan la movilización y acumulación de fitato en la semilla de cebada (Raboy et al., 2014), arroz (Perera et al., 2018), trigo (Perera et al., 2018; Kenzhebayeva et al., 2019) y maíz (Raboy, 2020). La tercera alude a la identificación, selección y aprovechamiento de la variación intra e interespecífica de fitato en la semilla de cultivos de interés económico (Kenzhebayeva et al., 2019; Perera et al., 2019; Raboy, 2020).
Diversos estudios señalan que existe variación en la concentración de fitato en el germoplasma de cereales (trigo, maíz, avena, cebada, triticale, arroz, sorgo y centeno) (Bilal et al., 2019; Wang & Ning, 2019; Raboy, 2020; Bloot et al., 2021) y leguminosas (frijol, lenteja, soya, garbanzo y chícharo) (Bhagyawant et al., 2018). En cereales, la concentración de fitato varía de 1 a 22 mg g-1, mientras que, en leguminosas es de 0,2 a 44 mg g-1. En cultivares de maíz, el fitato está en el rango de 2,4 a 11 mg g-1 (Bloot et al., 2021) y en variedades nativas, se encuentra entre 2,6 y 5,7 mg g-1 (Chí-Sánchez et al., 2021). Este germoplasma es necesario para reducir la cantidad de P que se exporta a la semilla, mejorar la EUP y optimizar la reserva de P en el suelo.
El objetivo de este estudio fue caracterizar genotipos nativos de Zea mays L. en la región lacustre de Pátzcuaro, Michoacán, México con base en la concentración de P en la semilla (P total, fitato y P inorgánico) y diferenciar grupos de variación entre materiales genéticos utilizando técnicas de análisis multivariado.
2. Metodología
2.1 Germoplasma, área de estudio y condiciones de crecimiento
El estudio incluyó 50 genotipos de maíz nativo provenientes de la región lacustre de Pátzcuaro, ubicadas en centro del Eje Neovolcánico Transversal, en el estado de Michoacán (Tabla 1). En esta región prevalece un clima templado sub-húmedo con lluvias en verano, temperatura promedio anual de 22 ºC y altitud de 2100 a 3200 m. La precipitación promedio es de 1110 mm anuales (INEGI, 2017). En este sitio predomina la agricultura de humedad y temporal, asociada con suelos tipo Andosol y Acrisol, respectivamente (Astier et al., 2012). Los Acrisoles son suelos ácidos (pH 4.5 a 6), ricos en sexquióxidos y arcillas (65% a 70%), pero pobres en carbono orgánico (< 18 mg C g-1) y N total (< 1,6 mg g-1) (González-Esquivel et al., 2015). Los Andosoles se distinguen por la presencia de materiales amorfos como el alófano, imogolita, ferrihidrita y complejos de aluminio-humus (Galván-Tejeda et al., 2014). También se distinguen por su alto contenido de materia orgánica (1,1 a 8,6%), CIC (12 a 75 cmol kg-1), retención de fosfatos (33 a 85%), pH de 4,9 a 6,9 y limitada disponibilidad de P (< 8 mg P kg-1) (González-Esquivel et al., 2015).
El estudio se realizó en la localidad de Erongarícuaro, Michoacán (19° 35’ N y 101° 43’ O) en condiciones de temporal durante el ciclo primavera-verano 2022. Se empleó un diseño experimental de bloques completos al azar con tres repeticiones. La unidad experimental la conformó dos surcos de 0,60 m de ancho y 5 m de longitud. La semilla se sembró a 6 cm de profundidad y a 60 cm de distancia entre plantas. La fertilización fosfatada consistió en una dosis de 50 kg ha-1 de superfosfato triple de calcio y la nitrogenada de 60 kg N ha-1 de urea. La primera dosis de urea se aplicó a la siembra y la segunda a los 48 días después de la siembra. El manejo de arvenses se realizó manualmente. Una vez que el grano alcanzó la humedad adecuada (12%; DICKEY-John MiniGAC moisture tester), se seleccionó al azar una muestra de 1 kg de los diferentes maíces nativos. Las muestras se enviaron al Laboratorio de Nutrición Vegetal del Instituto de Investigaciones Agropecuarias y Forestales, Universidad Michoacana de San Nicolás de Hidalgo. Los genotipos de maíz se subdividieron en tres grupos de acuerdo con el número de días que requieren para alcanzar la etapa de floración masculina: Grupo I de ciclo precoz (75-85 d), Grupo II intermedio (85-95 d) y Grupo III de ciclo tardío (95-110 d).
2.2 Evaluación de la concentración de fitato en semilla
Se utilizó el método colorimétrico propuesto por Vaintraub & Lapteva (1988) para la cuantificación de la concentración de fitato en las muestras de semilla. Se pesaron cuatro sub-muestras de 70 mg cada una en una balanza analítica (Sartorius modelo Quintix-224) y colocaron en tubos Eppendorff de 2 mL. A cada submuestra se le agregó 700 μl de HCl 0.65 M. Los tubos se agitaron durante 12 h a temperatura ambiente en un agitador horizontal (Marconi modelo MA 139/CFT/Mx). Una vez concluido el tiempo de agitación, los extractos se recuperaron por centrifugación a 3000 rpm por 20 min (Centrifuga Eppendorff modelo 5417 C). Se preparó una solución estándar de fitato de sodio (Sigma P-8810) en 25 ml de HCl 0.65 M. A partir de esta solución, se prepararon diluciones (0,0, 0,5, 1,0, 1,5, 2,0, 3,0 mg/ml). De cada dilución, se utilizó una alícuota de 30 μl y se le añadió 200 μL de Reactivo Wade. Este último se preparó con 2,5 g de ácido 5-sulfosalicílico monohidratado (C7H6O6S.H2O) y 0,25 g de cloruro férrico hexa hidratado (FeCl3.6H2O) en 150 mL de agua desionizada. Éste se refrigeró por 12 h y su pH se ajustó a 3,05 con NaOH 2.5 M. Posteriormente, se midió la absorbancia la 492 nm (Multiskan modelo 354). Se utilizaron alícuotas de 30 μL del extracto (triplicado) y 200 μL de reactivo de Wade para la valoración de fitato en cada extracto. Cada muestra por triplicado reposó durante 15 min a temperatura ambiente y, posteriormente, se midió la absorbancia a 492 nm contra un blanco de agua desionizada. Los valores de absorbancias obtenidas por cada muestra se interpolaron en la curva de calibración. El ácido fítico se convirtió en fitato dividiendo por un factor de 3,55.
2.3 Evaluación de fósforo inorgánico en semilla
La semilla se desinfectó con hipoclorito al 20% por 5 minutos y enjuagó con agua desionizada. Posteriormente, se molió en un molino (Retsch modelo MM 200). De este tejido se pesaron cuatro sub-muestras de 70 mg cada una en una balanza analítica (Sartorius modelo Quintix-224).
Tabla 1
Genotipos de maíz nativo cultivados en Erongarícuaro, Michoacán
ID | Genotipos | Color | Mad† | Procedencia | Municipio | Raza | LN‡ | LO§ | Altitud |
14 | NPZ-5 | Blanco | P | Napízaro | Erongarícuaro | Cónico | 19° 35' 51" | 101° 41' 35" | 2060 |
20 | UR-7 | Blanco | P | Uricho | Erongarícuaro | Chalqueño | 19° 34' 19" | 101° 42' 58" | 2040 |
29 | UR-10 | Blanco | P | Uricho | Erongarícuaro | Chalqueño | 19° 34' 19" | 101° 42' 58" | 2040 |
94 | UR-11 | Morado | P | Uricho | Erongarícuaro | Elotes Occ | 19° 34' 19" | 101° 42' 58" | 2040 |
95 | UR-2 | Negro | P | Uricho | Erongarícuaro | Cónico | 19° 34' 19" | 101° 42' 58" | 2040 |
16 | NPZ-1 | Blanco | I | Napízaro | Erongarícuaro | Cónico | 19° 35' 51" | 101° 41' 35" | 2060 |
31 | NPZ-4 | Blanco | I | Napízaro | Erongarícuaro | Cónico | 19° 35' 51" | 101° 41' 35" | 2060 |
26 | UR-12 | Blanco | I | Uricho | Erongarícuaro | Cacahuazintle | 19° 34' 19" | 101° 42' 58" | 2040 |
101 | UR-3 | Morado | I | Uricho | Erongarícuaro | Cacahuazintle | 19° 34' 19" | 101° 42' 58" | 2040 |
17 | ZPT-2 | Blanco | P | El Zapote | Pátzcuaro | Cónico | 19° 31' 13" | 101° 29' 42" | 2160 |
96 | ZPT-4 | Morado | P | El Zapote | Pátzcuaro | Cacahuazintle | 19° 31' 13" | 101° 29' 42" | 2160 |
100 | ZPT-3 | Morado | P | El Zapote | Pátzcuaro | Cacahuazintle | 19° 31' 13" | 101° 29' 42" | 2160 |
19 | TZU-2 | Blanco | P | Tzurumútaro | Pátzcuaro | Pepitillo | 19° 32' 49" | 101° 35' 19" | 2060 |
27 | TZU-6 | Blanco | P | Tzurumútaro | Pátzcuaro | Chalqueño | 19° 32' 49" | 101° 35' 19" | 2060 |
1 | ZPT-9 | Blanco | I | El Zapote | Pátzcuaro | Chalqueño | 19° 31' 13" | 101° 29' 42" | 2160 |
10 | ZPT-6 | Amarillo | I | El Zapote | Pátzcuaro | Cónico | 19° 31' 13" | 101° 29' 42" | 2160 |
22 | ZPT-5 | Blanco | I | El Zapote | Pátzcuaro | Cónico | 19° 31' 13" | 101° 29' 42" | 2160 |
28 | ZPT-10 | Amarillo | I | El Zapote | Pátzcuaro | Chalqueño | 19° 31' 13" | 101° 29' 42" | 2160 |
93 | ZPT-11 | Morado | I | El Zapote | Pátzcuaro | Elotes Occ | 19° 31' 13" | 101° 29' 42" | 2160 |
97 | ZPT-12 | Negro | I | El Zapote | Pátzcuaro | Elotes Occ | 19° 31' 13" | 101° 29' 42" | 2160 |
8 | SHUI-4 | Negro | I | Huiramangaro | Pátzcuaro | Pepitillo | 19° 34' 07" | 101° 45' 55" | 2200 |
55 | AJ-7 | Blanco | T | Ajuno | Pátzcuaro | Pepitillo | 19° 34' 06" | 101° 43' 20" | 2100 |
67 | AJ-4 | Blanco | T | Ajuno | Pátzcuaro | Pepitillo | 19° 34' 06" | 101° 43' 20" | 2100 |
71 | AJ-8 | Blanco | T | Ajuno | Pátzcuaro | Pepitillo | 19° 34' 06" | 101° 43' 20" | 2100 |
21 | TZU-5 | Blanco | T | Tzurumútaro | Pátzcuaro | Cónico | 19° 32' 49" | 101° 35' 19" | 2060 |
2 | SANAZ-7 | Blanco | I | Ziróndaro | Quiroga | Cónico | 19° 41' 01" | 101° 37' 56" | 2060 |
104 | SANAZ-8 | Rojo | I | Ziróndaro | Quiroga | Cónico | 19° 41' 01" | 101° 37' 56" | 2060 |
4 | SANAZ-5 | Blanco | T | Ziróndaro | Quiroga | Chalqueño | 19° 41' 01" | 101° 37' 56" | 2060 |
11 | SANAZ-1 | Blanco | T | Ziróndaro | Quiroga | Chalqueño | 19° 41' 01" | 101° 37' 56" | 2060 |
72 | CB-1 | Blanco | I | Casas Blancas | Escalante | Purhépecha | 19° 24' 00" | 101° 38' 01" | 2280 |
87 | CB-8 | Negro | I | Casas Blancas | Escalante | Cónico | 19° 24' 00" | 101° 38' 01" | 2280 |
83 | OP-4 | Negro | I | Opopeo | Escalante | Elotes cónicos | 19° 24' 45" | 101° 36' 19" | 2240 |
80 | CB-3 | Negro | T | Casas Blancas | Escalante | Cónico | 19° 24' 00" | 101° 38' 01" | 2280 |
56 | OP-7 | Blanco | T | Opopeo | Escalante | Cónico | 19° 24' 45" | 101° 36' 19" | 2240 |
38 | SC-JC-11 | Blanco | T | Santa Clara | Escalante | Purhépecha | 19° 24' 19" | 101° 38' 18" | 2240 |
66 | PICH-10 | Amarillo | P | Pichátaro | Tingambato | Cónico | 19° 34' 15" | 101° 48' 25" | 2240 |
69 | PICH-3 | Blanco | P | Pichátaro | Tingambato | Pepitillo | 19° 34' 15" | 101° 48' 25" | 2240 |
76 | PICH-13 | Blanco | P | Pichátaro | Tingambato | Pepitillo | 19° 34' 15" | 101° 48' 25" | 2240 |
90 | PICH-6 | Morado | P | Pichátaro | Tingambato | Elotes Occ | 19° 34' 15" | 101° 48' 25" | 2240 |
60 | PICH-11 | Blanco | I | Pichátaro | Tingambato | Cónico | 19° 34' 15" | 101° 48' 25" | 2240 |
65 | PICH-12 | Blanco | I | Pichátaro | Tingambato | Pepitillo | 19° 34' 15" | 101° 48' 25" | 2240 |
79 | PICH-4 | Negro | I | Pichátaro | Tingambato | Elotes Occ | 19° 34' 15" | 101° 48' 25" | 2240 |
85 | PICH-17 | Negro | I | Pichátaro | Tingambato | Elotes Occ | 19° 34' 15" | 101° 48' 25" | 2240 |
86 | PICH-15 | Negro | I | Pichátaro | Tingambato | Chalqueño | 19° 34' 15" | 101° 48' 25" | 2240 |
89 | PICH-18 | Morado | T | Pichátaro | Tingambato | Cacahuazintle | 19° 34' 15" | 101° 48' 25" | 2240 |
25 | NURO-2 | Blanco | P | Nuevo Rodeo | Tzintzunzan | Cónico | 19° 35' 16" | 101° 32' 23" | 2240 |
98 | NURO-3 | Colorado | P | Nuevo Rodeo | Tzintzunzan | Elotes Occ | 19° 35' 16" | 101° 32' 23" | 2240 |
18 | EJG-1 | Blanco | I | El Jagüey | Tzintzunzan | Cónico | 19° 34' 39" | 101° 31' 19" | 2240 |
9 | NURO-1 | Blanco | T | Nuevo Rodeo | Tzintzunzan | Cónico | 19° 35' 16" | 101° 32' 23" | 2240 |
† Grupo de madurez: precoz (P), intermedio (I) y tardío (T). ‡LN: Latitud Norte. § LO: Longitud Oeste.
Las muestras se calcinaron a 500 °C en una mufla (Marconi Novus N1200) durante 6 horas. Se utilizó 8 mL de HCl 100 mM para digerir las cenizas por 2 h. Posteriormente, se filtraron con papel Whatman No.1 al vacío. Se utilizó el método colorimétrico de Murphy & Riley (1962) para cuantificar la concen-tración de P. En tubos de 15 ml se agregó una alícuota del filtrado de cada muestra con una dilución de 40 x (100 μL de la muestra vegetal en 3900 μL de agua deionizada) y 1 mL de Reactivo B [50 m L Reactivo A (12 mg Molibdato de amonio, 4,29 g Tartrato de antimonio potásico en H2SO4N), 0,264 g L-ácido ascórbico aforado en 2 L agua deionizada)]. A partir de una solución de fosfato (VW 6294-2) se prepararon 8 concentraciones para la curva estándar (0,0, 0,75, 1,25, 5, 10, 20 y 40 μM). La absorbancia se midió a 880 nm en un espec-trofotómetro (Perkin Elmer modelo Lambda 40).
2.4 Análisis estadístico
Se utilizó el promedio de cada variable de concentración de P en la semilla para realizar un análisis de conglomerados (SAS, 2011). Antes de ello, se utilizó el valor Z para estandarizar cada variable: Z = (Xo – Xp) S-1, donde Z es el valor estandarizado, Xo es el valor original de la variable, Xp es el promedio general para la variable particular y S-1 es el inverso de la desviación estándar. El análisis de conglomerados se llevó a cabo con la distancia euclidiana y las introducciones se agruparon según el método de Ward, que estima la varianza entre grupos y los minimiza (E) (Romesburg, 1984). Con el índice de suma de cuadrados (E), se obtuvo el número óptimo de grupos (Romesburg, 1984). Se recurrió a la Prueba de F para probar la significancia entre las variables cuantitativas de las agrupaciones formadas (SAS, 2011). La prueba de Tukey (p ≤ 0.05) se utilizó para comparar las diferencias entre grupos de precocidad, genotipos y grupos para las variables consideradas.
3. Resultados y discusión
3.1 Variabilidad en la concentración de fósforo en la semilla de maíz
Los genotipos de maíz cultivados en Erongarícuaro Michoacán difirieron en la concentración de P en la semilla (p ≤ 0,001) (Tabla 2). El P total varió de 1,66 mg g-1 (PICH-17) a 6,7 mg g-1 (Corupo). La concentración fitato estuvo en el rango máximo de 5,5 mg g-1 y mínimo de 1,1 mg g-1. Esta fracción representó entre 73 y 93% del P total de la semilla. Pi varió de 0,21 a 0,85 mg g-1.
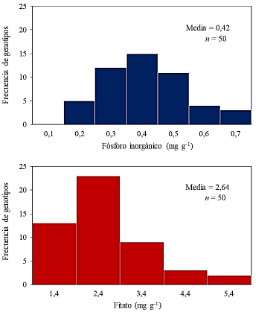
Figura 1. Histograma de frecuencia de la concentración de fitato y fósforo inorgánico en la semilla de 50 genotipos de maíz de Michoacán.
De acuerdo al polígono de frecuencia, se presentaron 5 grupos de genotipos con diferente concentración de P (Figura 1). El primer grupo, lo constituyeron 13 genotipos con la menor concentración de fitato (1,4 mg g-1), debajo de la media poblacional (2,64 mg g-1). Estos genotipos fueron PICH-17 (85), UR-11 (94), UR-2 (95), OP-4 (83), CB-3 (80), ZPT-5 (22), EJG-1 (18), AJ-7 (55), PICH-15 (86), CB-8 (87), PICH-4 (79), ZPT-12 (97) y TZU-6 (27). El segundo grupo, lo conformaron 23 genotipos con un rango de 2,4 a 3,3 mg g-1. En el tercer y cuarto grupo, hubo 9 y 3 genotipos con una variación de 3,4 mg g-1. En el quinto grupo hubo dos genotipos con la concentración más alta de fitato (5,4 mg g-1). En lo que respecta al Pi, el polígono conformó 6 grupos con una concentración que varió de 0,2 a 0,7 mg g-1. Los genotipos de los grupos 5 y 6 registraron la mayor concentración de Pi (> 0,7 mg g-1) (Figura 1).
Los hallazgos de este estudio fueron consistentes con la variación natural de P identificada en la semilla de cultivares de maíz (de 2,4 a 11 mg g-1) (Bloot et al., 2021) y maíces nativos de Centroamérica (de 2,9 a 4,5 mg g-1) (Jaradat & Goldstein, 2018), pero menores a los maíces nativos de Yucatán (< 1 mg g-1) (Chí-Sánchez et al., 2021). En este estudio, varios genotipos de maíz nativo mostraron menor concentración de P (de 1,7 a 3,9 mg g-1), en comparación a Corupo (6,7 mg g-1). Esta reducción (de 42% a 75%) es similar a lo señalado por Wang et al. (2017) en genotipos de arroz (de 21% a 57%).
Es común que, durante la etapa reproductiva, se movilice entre 60% y 85% del P contenido en los órganos vegetativos a la semilla en desarrollo, lo que resulta en una sustracción importante de P del suelo (Mo et al., 2019). A la cosecha, la reserva de P en la semilla es suficiente para cubrir los requerimientos durante la germinación y establecimiento de la plántula (Wang et al., 2021; Gunathunga et al., 2024). Dicho requerimiento, sin embargo, suele exceder las necesidades de la planta. Por consiguiente, es posible reducir la concentración de P sin afectar los procesos fisiológicos del cultivo (Wang et al., 2017; Han et al., 2022; Houssni et al., 2024). Diversos estudios señalan que, la reducción en la acumulación de fitato (de 46% a 75%) en la semilla de arroz (Zhao et al., 2016; Perera et al., 2018), trigo (Kenzhebayeva et al., 2019; Frittelli et al., 2023), maíz (Raboy, 2020) y garbanzo (Wang et al., 2021) no afecta la germinación, vigor de la plántula y desarrollo del cultivo.
En maíz, la concentración de P en semilla se encuentra en el rango de 2,4 a 11 mg P g-1, mientras que en plántula varía de 2,9 a 4,5 mg g-1. Lo anterior señala que, la reserva de P en la semilla es suficiente para cubrir la demanda de la plántula durante su crecimiento, por lo menos, de 10 a 17 días después de la germinación (Nadeem et al., 2011). Posteriormente, el crecimiento del cultivo dependerá de la eficiencia de la raíz para adquirir el P del suelo y/o fertilizante y de los patrones de movilización del nutriente hacia la semilla desarrollo (Wang et al., 2017; Cong et al., 2020).
Tabla 2
Medias de peso seco, concentración de P inorgánico (Pi), fitato y P total en la semilla de 50 genotipos de maíz de Pátzcuaro, Michoacán. Datos ordenados según la concentración de fitato
ID | Nombre | Mad† | Pi | Fitato | P total | Grupo§ |
| mg g -1 |
95 | UR-2 | P | 0,29 | ± | 0,03 | 1,42 | ± | 0,02 | 1,72 | ± | 0,03 | 2 |
27 | TZU-6 | P | 0,40 | ± | 0,03 | 1,88 | ± | 0,03 | 2,28 | ± | 0,03 | 2 |
100 | ZPT-3 | P | 0,59 | ± | 0,02 | 2,24 | ± | 0,12 | 2,83 | ± | 0,07 | 2 |
98 | NURO-3 | P | 0,25 | ± | 0,01 | 2,30 | ± | 0,05 | 2,56 | ± | 0,03 | 2 |
94 | UR-11 | P | 0,43 | ± | 0,07 | 1,39 | ± | 0,00 | 1,82 | ± | 0,04 | 3 |
96 | ZPT-4 | P | 0,47 | ± | 0,04 | 2,20 | ± | 0,00 | 2,67 | ± | 0,02 | 3 |
29 | UR-10 | P | 0,22 | ± | 0,03 | 1,92 | ± | 0,23 | 2,14 | ± | 0,13 | 4 |
90 | PICH-6 | P | 0,42 | ± | 0,01 | 2,55 | ± | 0,22 | 2,97 | ± | 0,12 | 4 |
17 | ZPT-2 | P | 0,22 | ± | 0,03 | 2,67 | ± | 0,32 | 2,89 | ± | 0,18 | 4 |
69 | PICH-3 | P | 0,40 | ± | 0,04 | 2,78 | ± | 0,04 | 3,18 | ± | 0,04 | 4 |
66 | PICH-10 | P | 0,30 | ± | 0,03 | 2,81 | ± | 0,07 | 3,10 | ± | 0,05 | 4 |
76 | PICH-13 | P | 0,36 | ± | 0,03 | 283 | ± | 0,07 | 3,19 | ± | 0,05 | 4 |
19 | TZU-2 | P | 0,31 | ± | 0,04 | 3,25 | ± | 0,11 | 3,55 | ± | 0,08 | 4 |
20 | UR-7 | P | 0,30 | ± | 0,07 | 3,32 | ± | 0,08 | 3,62 | ± | 0,08 | 4 |
25 | NURO-2 | P | 0,50 | ± | 0,01 | 3,50 | ± | 0,15 | 4,00 | ± | 0,08 | 5 |
14 | NPZ-5 | P | 0,24 | ± | 0,04 | 4,52 | ± | 0,10 | 4,76 | ± | 0,07 | 5 |
85 | PICH-17 | I | 0,52 | ± | 0,04 | 1,14 | ± | 0,09 | 1,66 | ± | 0,07 | 2 |
83 | OP-4 | I | 0,53 | ± | 0,01 | 1,51 | ± | 0,11 | 2,03 | ± | 0,06 | 2 |
22 | ZPT-5 | I | 0,21 | ± | 0,02 | 1,64 | ± | 0,00 | 1,85 | ± | 0,01 | 2 |
18 | EJG-1 | I | 0,21 | ± | 0,01 | 1,66 | ± | 0,38 | 1,87 | ± | 0,20 | 2 |
86 | PICH-15 | I | 0,49 | ± | 0,01 | 1,68 | ± | 0,15 | 2,17 | ± | 0,08 | 2 |
87 | CB-8 | I | 0,63 | ± | 0,02 | 1,72 | ± | 0,10 | 2,35 | ± | 0,06 | 2 |
79 | PICH-4 | I | 0,44 | ± | 0,05 | 1,73 | ± | 0,31 | 2,17 | ± | 0,18 | 2 |
28 | ZPT-10 | I | 0,27 | ± | 0,02 | 1,95 | ± | 0,13 | 2,22 | ± | 0,08 | 2 |
1 | ZPT-9 | I | 0,37 | ± | 0,04 | 2,33 | ± | 0,02 | 2,69 | ± | 0,03 | 2 |
97 | ZPT-12 | I | 0,58 | ± | 0,08 | 1,84 | ± | 0,01 | 2,42 | ± | 0,05 | 3 |
93 | ZPT-11 | I | 0,41 | ± | 0,04 | 2,11 | ± | 0,05 | 2,52 | ± | 0,05 | 3 |
101 | UR-3 | I | 0,53 | ± | 0,05 | 2,42 | ± | 0,12 | 2,95 | ± | 0,09 | 3 |
8 | SHUI-4 | I | 0,55 | ± | 0,07 | 2,54 | ± | 0,14 | 3,09 | ± | 0,11 | 3 |
65 | PICH-12 | I | 0,41 | ± | 0,02 | 2,55 | ± | 0,18 | 2,96 | ± | 0,10 | 3 |
60 | PICH-11 | I | 0,44 | ± | 0,02 | 2,63 | ± | 0,01 | 3,07 | ± | 0,02 | 3 |
72 | CB-1 | I | 0,28 | ± | 0,01 | 2,90 | ± | 0,11 | 3,18 | ± | 0,07 | 4 |
26 | UR-12 | I | 0,38 | ± | 0,03 | 3,40 | ± | 0,20 | 3,77 | ± | 0,12 | 4 |
10 | ZPT-6 | I | 0,37 | ± | 0,07 | 3,58 | ± | 0,23 | 3,95 | ± | 0,15 | 4 |
2 | SANAZ-7 | I | 0,64 | ± | 0,04 | 3,89 | ± | 0,14 | 4,53 | ± | 0,09 | 5 |
31 | NPZ-4 | I | 0,31 | ± | 0,02 | 4,22 | ± | 0,10 | 4,53 | ± | 0,06 | 5 |
104 | SANAZ-8 | I | 0,38 | ± | 0,02 | 4,35 | ± | 0,10 | 4,73 | ± | 0,06 | 5 |
16 | NPZ-1 | I | 0,73 | ± | 0,03 | 5,66 | ± | 0,13 | 6,39 | ± | 0,08 | 5 |
55 | AJ-7 | T | 0,45 | ± | 0,01 | 1,66 | ± | 0,02 | 2,12 | ± | 0,02 | 1 |
80 | CB-3 | T | 0,85 | ± | 0,07 | 1,62 | ± | 0,09 | 2,48 | ± | 0,08 | 2 |
89 | PICH-18 | T | 0,34 | ± | 0,05 | 2,01 | ± | 0,55 | 2,34 | ± | 0,30 | 3 |
21 | TZU-5 | T | 0,52 | ± | 0,08 | 2,21 | ± | 0,27 | 2,74 | ± | 0,18 | 3 |
4 | SANAZ-5 | T | 0,49 | ± | 0,11 | 2,45 | ± | 0,48 | 2,94 | ± | 0,30 | 3 |
67 | AJ-4 | T | 0,28 | ± | 0,04 | 2,54 | ± | 0,14 | 2,81 | ± | 0,09 | 4 |
9 | NURO-1 | T | 0,30 | ± | 0,03 | 2,66 | ± | 0,07 | 2,96 | ± | 0,05 | 4 |
71 | AJ-8 | T | 0,29 | ± | 0,03 | 2,71 | ± | 0,24 | 3,01 | ± | 0,14 | 4 |
11 | SANAZ-1 | T | 0,35 | ± | 0,03 | 2,93 | ± | 0,09 | 3,28 | ± | 0,08 | 4 |
38 | SC-JC-11 | T | 0,66 | ± | 0,01 | 3,33 | ± | 0,20 | 3,99 | ± | 0,11 | 5 |
56 | OP-7 | T | 0,49 | ± | 0,05 | 3,42 | ± | 0,05 | 3,92 | ± | 0,05 | 5 |
124 | Corupo | T | 1,22 | ± | 0,00 | 5,49 | ± | 0,00 | 6,71 | ± | 0,00 | 5 |
| Media general | 0,43 | ± | 0,04 | 2,64 | ± | 0,14 | 3,07 | ± | 0,09 | |
| DMS¶ 0.05 | | 0,12 | | | 0,58 | | | 0,57 | | | |
| | | Valores de F | |
| Genotipo | | 0,06 | *** | 2,54 | *** | 2,63 | *** |
| Precocidad | | 0,14 | *** | 0,13 | NS | 0,16 | NS |
| Gen × Prec | | 0,06 | *** | 2,65 | *** | 2,74 | *** |
† Tipos de madurez: precoz (P), intermedio (I) y tardío (T). ‡ Peso seco de 10 semillas. § Grupos identificados por análisis de conglomerados. ¶ Diferencia Mínima Significativa (p ≤ 0,05).
3.2 Formación de conglomerados y similitud morfológica entre grupos
Los recursos genéticos vegetales son la principal fuente de variación para mejorar la calidad nutricional de la semilla (Orozco-Ramírez et al., 2017; Cong et al., 2020; Nicholson et al., 2021). El mayor énfasis de mejoramiento, sin embargo, se ha encauzado al incremento del rendimiento y la concentración de nitrógeno (N) y fósforo (P) en la semilla (Nicholson et al., 2021). A pesar de que el fitato es un importante reservorio de P y energía para la plántula en desarrollo, su capacidad quelante lo convierte en un compuesto antinutricional que limita la biodisponibilidad de Ca, Zn y Fe en la ingesta humana (Perera et al., 2018; Raboy, 2020). Por tanto, para incrementar la disponibilidad de estos nutrientes es necesario reducir la concentración de este com-puesto.
En este contexto, la caracterización morfométrica y el uso del germoplasma para mejoramiento genético requiere de herramientas estadísticas que permitan identificar grupos de diversidad basados en características de importancia agronómica (Bhagyawant et al., 2018). Entre estas herramientas destaca el cálculo de índices de similitud o disimilitud entre pares de unidades básicas de caracterización (UBC’s) en n atributos evaluados y la formación de grupos de UBS´s con atributos afines representados gráficamente en un dendrograma (Núñez & Escobedo, 2011).
En la Figura 2 se muestra la conformación de las cinco agrupaciones.
El Grupo I consistió en 1 genotipo de maduración tardía, de la raza Pepitillo. El Grupo II estuvo compuesto por 14 genotipos, de los cuales 25%, 41% y 8% fueron precoces, intermedios y tardíos, mayormente de las razas Cónico (36%), Chalqueño (29%) y Elotes Occidentales (21%). El Grupo III lo integraron 11 genotipos, con el mismo orden de maduración (12,5%, 27% y 25%) y pertenecientes a las razas Cacahuazintle (27%), Elotes Occidentales (27%) y Cónico (18%). El Grupo IV constituido por 15 genotipos, con 50%, 14% y 33% de precoces, intermedios y tardíos, de las razas Pepitillo (33%), Cónico (27%) y Chalqueño (20%). El Grupo V con 18 y 25% genotipos de maduración intermedia y tardía de la raza Cónico (78%).
La Tabla 3 muestra el promedio de los cinco grupos en que se clasificaron los genotipos mediante el análisis de conglomerados. Los Grupos I y II sobresalieron por su baja concentración de P total (2,1 a 2,5 mg g-1), fitato (1,7 a 2,0 mg g-1) y P inorgánico (0,43 a 0,47 mg g-1). El Grupo III produjo semillas con una mayor concentración de P total (2,5 mg g-1), pero una baja contenido de fitato (2 mg g-1). El Grupo IV, mostró la menor concen-tración de Pi, pero con un incremento en P total y fitato. Por el contrario, los genotipos del Grupo V mostraron el valor más alto de P total (5,8 mg g-1), fitato (4,9 mg g-1) y P inorgánico (0,8 mg g-1).
3.3 Variabilidad entre genotipos
Según el análisis de componentes principales (CP) de las formas de P (P, fitato y P total) en la semilla de 50 genotipos, los CP1 y CP2 aportaron con el 62% y 33%, respectivamente, de la variación entre grupos. En suma, el 95% de la variación total observada se debió a estos componentes. En el CP1, la variabilidad la aportó el P total (0,70) y la concentración de fitato (0,68). El CP2, estuvo influenciado negativamente por la concentración de Pi (-0,96).
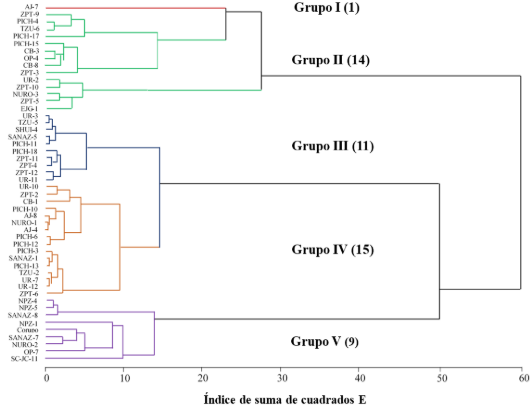
Figura 2. Dendrograma de la varianza mínima de Ward de 50 genotipos de maíz de Michoacán.
Tabla 3
Características cuantitativas usadas para la identificación de diferentes grupos de maíz de Pátzcuaro, Michoacán
Grupo† | NG‡ | Rango | Pi | Rango | Fitato | Rango | P total |
mg g-1 |
I | 1 | - | 0,45 | a | - | 1,66 | c | - | 2,12 | c |
II | 14 | 0,21 – 0,63 | 0,43 | a | 1,14 – 2,33 | 1,74 | c | 1,66 – 2,69 | 2,18 | c |
III | 11 | 0,34 – 0,58 | 0,47 | a | 1,39 – 2,63 | 2,01 | c | 1,82 – 3,09 | 2,46 | b |
IV | 15 | 0,22 – 0,42 | 0,32 | b | 1,92 – 3,58 | 2,75 | b | 2,14 – 3,95 | 3,05 | b |
V | 9 | 0,38 – 1,22 | 0,80 | a | 3,33 – 6,51 | 4,92 | a | 3,92 – 7,73 | 5,83 | a |
† Grupos identificados por análisis de conglomerados. NG: Número de genotipos por grupo. Medias con letras iguales en cada variable son iguales entre sí según Tukey (p ≤ 0,05).
En la Figura 3 se muestra la formación de grupos según el CP1 y CP2 y se constata la misma separación de los grupos definidos en el análisis de conglomerados (Figura 2). De acuerdo con esta clasificación, los Grupos 1 y II exhibieron para el CP1 la concentración más baja de P total y fitato en la semilla. Por el contrario, en el CP2, los genotipos del Grupo V mostraron la concentración más alta de P total, fitato y Pi.
Los resultados demostraron que, en la región de Pátzcuaro, Michoacán existe una alta riqueza de razas de maíz (Astier et al., 2012). Las razas Cónico, Pepitillo, Chalqueño y Elotes Occidentales fueron las más representativas. A pesar de que este estudio no describió la diversidad de maíces nativos, tipo de agro-ambientes y distribución, se comprobó que los genotipos con menor concentración de fitato (Grupo II), de ciclo corto e intermedio, se ubican en la localidad El Zapote, en el municipio de Pátzcuaro. Estos genotipos pertenecen a las razas Cónico, Chalqueño y Elotes Occidentales. Según Astier et al. (2012), estas razas se asocian con paisajes de agricultura de temporal y con suelos ácidos tipo Acrisol (Orozco-Ramírez et al., 2017). Otro patrón prevaleció en la localidad de Pichátaro, municipio de Tingambato con la raza Pepitillo (Grupos III y IV). En este agro-ambiente se encuentran tierras de humedad residual y suelos de Ando (González-Esquivel et al., 2015; Orozco-Ramírez et al., 2017). Por último, en la localidad de Napízaro, municipio de Erongarícuaro, prevaleció la raza Cónico (Grupo V) con genotipos de maduración intermedia. Este agro-ambiente presenta suelos tipo Ando y agricultura de temporal (INEGI, 2017).
Con el análisis de componentes fue posible reconocer la concentración de fitato como un parámetro morfométrico crítico para discriminar entre el germoplasma de maíz nativo para calidad nutricional de la semilla. Los genotipos del Grupo II se distinguieron por una reducida concentración de fitato, 34% y 36% menor a la registrada en los genotipos del Grupo IV y V. Esta información es relevante en el proceso de selección y desarrollo de variedades de maíz que optimicen el uso de P del suelo y/o fertilizante mediante una mayor EUP. Específicamente, la variación intra-específica de la EUP del maíz nativo se vincula con la EUtP (Han et al., 2022). La mayor EUtP y estabilidad en ambientes donde prevalecen condiciones de deficiencia de P (suelos de Ando), se relacionó con la acumulación y distribución de materia seca (IC = 80% a 85%) e índice de acumulación de P (ICP= 48% a 63%) a la semilla en desarrollo (Bayuelo-Jiménez & Ochoa-Cadavid, 2018).
De especial interés en un proceso de selección para concentración de P es la relación entre la concentración de fitato y el peso de la semilla. Dado que en este estudio se cuantificó la concentración de fitato en la semilla molida y aproximadamente el 90% de éste se encuentra en el embrión (Stanton et al., 2022), es de esperar que las semillas de mayor peso (más endospermo), tengan una concentración diluida de fitato (Bloot et al., 2021). En este estudio, no hubo correlación entre variables (r = -0,13). Por tanto, el fitato fue independiente del peso seco del grano.
Este estudio destaca la variabilidad del germoplasma de maíz nativo de Michoacán y su potencial utilización en el manejo sostenible del suelo. La disminución de fitato en la semilla puede reducir la extracción de P y la dosis de fertilizante requerido para subsanar la pérdida del nutriente (Wang et al., 2018). El cultivo de arroz, por ejemplo, puede extraer hasta 15 kg de P año-1, pero una reducción de 1 mg g-1 de P en el grano (de 3 a 2 mg-1; con un rendimiento de 5 ton ha-1), disminuye la cantidad de P removido del suelo (de 15 a 10 kg de P) (Wang et al., 2018). Además, desde el punto de vista genético, una menor concentración de fitato en la semilla podría potenciar una mayor biodisponibilidad de Zn y Fe (46% a 75%) (Dwivedi et al., 2023; Ntswane et al., 2023). A la fecha, se ha reportado una importante variación genética disponible en la concentración de micronutrientes en la semilla de cereales y leguminosas (harvestplus, 2022). En maíz, la concentración de Fe y Zn en la semilla varía de 0,015 – 0,145 mg g-1 y 0,013 – 0,096 mg mg g-1, respectivamente (Wu et al., 2021).
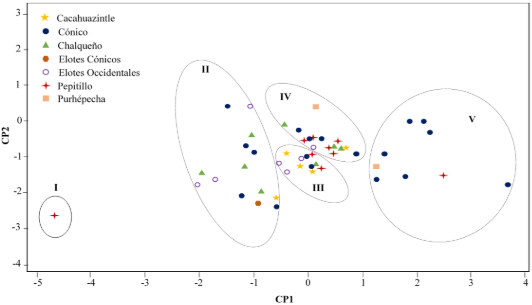
Figura 3. Análisis de componentes principales (CP 1 y CP2) de los cinco grupos de Zea mays L. de la cuenca de Pátzcuaro, Michoacán.
4. Conclusiones
La región lacustre de Pátzcuaro, Michoacán, se distingue por la alta variabilidad genética en el germoplasma de Zea mays L. Dicha variabilidad se manifiesta en las fracciones de P total, fitato y Pi en la semilla. El análisis de componentes principales explicó la variabilidad observada entre los grupos definidos por el análisis de conglomerados y confirmó que la concentración de P total y fitato fueron las características dominantes. Los resultados señalan la factibilidad para identificar y seleccionar genotipos de maíz con la mejor calidad nutricional, en términos de una menor concentración de fitato en la semilla y, consecuentemente, en una mayor EUP que optimice las reservas de P en el suelo. En particular, en suelos ácidos cuya disponibilidad de P es reducida.
La sostenibilidad de los sistemas agrícolas de Andosoles depende de la selección de genotipos que optimicen el uso eficiente de P. En particular, la eficiencia en la utilización (EUtP) y removilización (ERP) de P. Un adecuado transporte y distribución de P entre los órganos de la planta podría incrementar la producción de grano con una menor extracción de P del suelo y acumulación de fitato en la semilla. Además de estas estrategias, el reconocimiento de la variación en la concentración de fitato en la semilla es un indicador de que los genotipos tienen potencial para reducir el uso de fertilizante sintético e incrementar la biodisponibilidad de micronutrientes en la ingesta humana. A pesar de la importancia de estas estrategias, existe poca información sobre la variación inter e intraespecífica de la EUtP y ERP de los cultivos y los factores que la desencadenan, lo que justifica mayores estudios.
Agradecimientos
El presente estudio fue financiado del proyecto de la Coordinación de Investigación Científica de la Universidad Michoacana de San Nicolás de Hidalgo (6.11/2021-2022). Al Consejo Nacional de Humanidades, Ciencia y Tecnología por la beca otorgada para estudios de posgrado (764706).
ORCID
S. G. Salazar-Mejía https://orcid.org/0009-0005-3918-0672
J. S. Bayuelo Jiménez https://orcid.org/0000-0002-6253-4126
Referencias bibliográficas
Astier, M., Pérez-Agiz, E., Orozco-Ramírez, Q., Patricio-Chávez, M., & Moreno-Calles, A. I. (2012). Sistemas agrícolas, conocimiento tradicional y agrobiodiversidad: El maíz en la cuenca del Lago de Pátzcuaro. Conocimiento tradicional, innovación y reapropiación social, 146-172.
Bai, Z., Li, H., Yang, X., Zhou, B., Shi, X., et al. (2013). The critical soil P levels for crop yield, soil fertility and environmental safety in different soil types. Plant and Soil, 372, 27-37. https://doi.org/10.1007/s11104-013-1696-y
Bayuelo-Jiménez, J. S., & Ochoa-Cadavid, I. (2018). Interacción Genotipo x Ambiente para Eficiencia en el Uso de Fósforo en Maíz Nativo de la Meseta Purhépecha. Revista Fitotecnia Mexicana, 41(1), 39-47. https://doi.org/10.35196/rfm.2018.1.39-47
Bhagyawant, S. S., Bhadkaria, A., Gupta, N., & Srivastava, N. (2018). Impact of phytic acid on nutrient bioaccessibility and antioxidant properties of chickpea genotypes. Journal of Food Biochemistry, 42(6), 1-9. https://doi.org/10.1111/jfbc.12678
Bilal, H. M., Aziz, T., Maqsood, M. A., & Farooq, M. (2019). Grain phosphorus and phytate contents of wheat genotypes released during last 6 decades and categorization of selected genotypes for phosphorus use efficiency. Archives of Agronomy and Soil Science, 65(6), 727-740. https://doi.org/10.1080/03650340.2018.1521957
Bloot, A. P. M., Kalschne, D. L., Amaral, J. A. S., Baraldi, I. J., & Canan, C. (2023). A review of phytic acid sources, obtention, and applications. Food Reviews International, 39(1), 73-92.
Bünemann, E. K. (2015). Assessment of gross and net mineralization rates of soil organic phosphorus–A review. Soil Biology and Biochemistry, 89, 82-98.
Chí-Sánchez, F. A., Alvarado-López, C. J., Cristóbal-Alejo, J., González-Moreno, A., & Reyes-Ramírez, A. (2021). Contenido mineral de maíces criollos de Yucatán: análisis mediante μ-Fluorescencia de Rayos X. Terra Latinoamericana, 39, 1-12. https://doi.org/10.28940/terra.v39i0.454
Cong, W. F., Suriyagoda, L. D., & Lambers, H. (2020). Tightening the phosphorus cycle through phosphorus-efficient crop genotypes. Trends in Plant Science, 25(10), 967-975. https://doi.org/10.1016/j.tplants.2020.04.013
Dwivedi, S. L., Garcia-Oliveira, A. L., Govindaraj, M., & Ortiz, R. (2023). Biofortification to avoid malnutrition in humans in a changing climate: Enhancing micronutrient bioavailability in seed, tuber, and storage roots. Frontiers in Plant Science, 14, 1-24. https://doi.org/10.3389/fpls.2023.1119148
Frittelli, A., Botticella, E., Palombieri, S., Masci, S., Celletti, S., Fontanella, M. C., ... & Sestili, F. (2023). The suppression of TdMRP3 genes reduces the phytic acid and increases the nutrient accumulation in durum wheat grain. Frontiers in Plant Science, 14, 1079559.
Galván-Tejeda, N. D., Peña-Ramírez, V., Mora-Palomino, L., & Siebe, C. (2014). Soil P fractions in a volcanic soil chronosequence of Central Mexico and their relationship to foliar P in pine trees. Journal of Plant Nutrition and Soil Science, 177, 792–802.
González-Esquivel, C. E., Gavito, M. E., Astier, M., Cadena-Salgado, M., del-Val, E., Villamil-Echeverri, L., Merlín-Uribe, Y., & Balvanera, P. (2015). Ecosystem service trade-offs, perceived drivers, and sustainability in contrasting agroecosystems in central Mexico. Ecology and Society, 20(1), 38. http://dx.doi.org/10.5751/ES-06875-200138
Gunathunga, C., Senanayake, S., Jayasinghe, M. A., Brennan, C. S., Truong, T., Marapana, U., & Chandrapala, J. (2024). Germination Effects on Nutritional Quality: A Comprehensive Review of Selected Cereal and Pulse Changes. Journal of Food Composition and Analysis, 106024. https://doi.org/10.1016/j.jfca.2024.106024
Han, Y., White, P. J., & Cheng, L. (2022). Mechanisms for improving phosphorus utilization efficiency in plants. Annals of botany, 129(3), 247-258. https://doi.org/10.1093/aob/mcab145
HarvestPlus. (2022). Responding to crisis, building resilience: HarvestPlus 2021 annual report. HarvestPlus Annual Report 11. Washington, DC: International Food Policy Research Institute (IFPRI). https://ebrary.ifpri.org/cdm/ref/collection/p15738coll2/id/136342
Heuer, S., Gaxiola, R., Schilling, R., Herrera‐Estrella, L., López‐Arredondo, D., Wissuwa, M., ... & Rouached, H. (2017). Improving phosphorus use efficiency: a complex trait with emerging opportunities. The Plant Journal, 90(5), 868-885. https://doi.org/10.1111/tpj.13423
Houssni, I. E., Zahidi, A., Khedid, K., & Hassikou, R. (2024). Review of processes for improving the bioaccessibility of minerals by reducing the harmful effect of phytic acid in wheat. Food Chemistry Advances, 4, 100568. https://doi.org/10.1016/j.focha.2023.100568
Instituto Nacional de Estadística, Geografía e Informática (INEGI). (2017). Anuario estadístico y geográfico de Michoacán de Ocampo 2017. https://www.inegi.org.mx/contenidos/productos/prod_serv/contenidos/espanol/bvinegi/productos/nueva_estruc/anuarios_2017/702825092092.pdf
Jaradat, A., & Goldstein, W. (2018). Diversity of maize kernels from a breeding Program for Protein Quality III: Ionome Prof iling. Agronomy, 53, 956-976. https://doi.org/10.3390/agronomy8020009
Kafle, A., Cope, K. R., Raths, R., Krishna Yakha, J., Subramanian, S., Bücking, H., & Garcia, K. (2019). Harnessing soil microbes to improve plant phosphate efficiency in cropping systems. Agronomy, 9(3), 127. https://doi.org/10.3390/agronomy9030127
Kenzhebayeva, S., Abekova, A., Atabayeva, S., Yernazarova, G., Omirbekova, N., et al. (2019). Mutant lines of spring wheat with increased iron, zinc, and micronutrients in grains and enhanced bioavailability for human health. BioMed Research International, 2019, 1-11. https://doi.org/10.1155/2019/9692053
Mo, Q., Li, Z. A., Sayer, E. J., Lambers, H., Li, Y., et al. (2019). Foliar phosphorus fractions reveal how tropical plants maintain photosynthetic rates despite low soil phosphorus availability. Functional Ecology, 33(3), 503-513. https://doi.org/10.1111/1365-2435.13252
Murphy, J., & Riley, J. P. (1962). A modified single solution method for the determination of phosphate in nature waters. Analytical Chemistry Acta, 27, 31-36. https://doi.org/10.1016/S0003-2670(00)88444-5
Nadeem, M., Mollier, A., Morel, C., Vives, A., Prud’homme, L., & Pellerin, S. (2011). Relative contribution of seed phosphorus reserves and exogenous phosphorus uptake to maize (Zea mays L.) nutrition during early growth stages. Plant and Soil, 346, 231-244. https://doi.org/10.1007/s11104-011-0814-y
Nicholson, C. C., Emery, B. F., & Niles, M. T. (2021). Global relationships between crop diversity and nutritional stability. Nature communications, 12(1), 5310. https://doi.org/10.1038/s41467-021-25615-2
Ntswane, M., Labuschagne, M., Shandu, S. F., & Mbuma, N. W. (2023). Variation in seed protein, selected minerals, phytic acid, and potential mineral bioavailability of cowpea [Vigna unguiculata (L.) Walp] mutants and accessions. Crop Science, 1-15. https://doi.org/10.1002/csc2.21163
Núñez-Colín, C. A., & Escobedo-López, D. (2011). Uso correcto del análisis clúster en la caracterización de germoplasma vegetal. Agronomía mesoamericana, 22(2), 415-427.
Orozco-Ramírez, Q., Odenthal, J. & Astier, M. (2017). Diversidad de maíces en Pátzcuaro, Michoacán, México, y su relación con factores ambientales y sociales. Agrociencia, 51, 867-884.
Pang, J., Bansal, R., Zhao, H., Bohuon, E., Lambers, H., et al. (2018). The carboxylate‐releasing phosphorus‐mobilizing strategy can be proxied by foliar manganese concentration in a large set of chickpea germplasm under low phosphorus supply. New Phytologist, 219(2), 518-529. https://doi.org/10.1111/nph.15200
Perera, I., Fukushima, A., Arai, M., Yamada, K., Nagasaka, S., Seneweera, S., & Hirotsu, N. (2019). Identification of low phytic acid and high Zn bioavailable rice (Oryza sativa L.) from 69 accessions of the world rice core collection. Journal of Cereal Science, 85, 206-213. https://doi.org/10.1016/j.jcs.2018.12.010
Perera, I., Seneweera, S., & Hirotsu, N. (2018). Manipulating the phytic acid content of rice grain toward improving micronutrient bioavailability. Rice, 11, 1-13.
Raboy, V., Cichy, K., Peterson, K., Reichman, S., Sompong, U., et al. (2014). Barley (Hordeum vulgare L.) low phytic acid 1-1: an endosperm-specific, filial determinant of seed total phosphorus. Journal of Heredity, 105, 656-665. https://doi.org/10.1093/jhered/esu044
Raboy, V. (2020). Low phytic acid crops: observations based on four decades of research. Plants-Basel, 53, 27-36. https://doi.org/10.3390/plants9020140
Romesburg, H. C. (1984). Cluster Analysis for Researchers. Lifetime Learning Publications Belmont, California. 277 p.
SAS. (2011). SAS User's Guide: Statictics. SAS. Institute, Inc. Cary, North Carolina, USA.
Schneider, K. D., Thiessen Martens, J. R., Zvomuya, F., Reid, D. K., Fraser, T. D., Lynch, D. H., ... & Wilson, H. F. (2019). Options for improved phosphorus cycling and use in agriculture at the field and regional scales. Journal of Environmental Quality, 48(5), 1247-1264. https://doi.org/10.2134/jeq2019.02.0070
Stanton, C., Sanders, D., Krämer, U., & Podar, D. (2022). Zinc in plants: Integrating homeostasis and biofortification. Molecular Plant, 15(1), 65-85. https://doi.org/10.1016/j.molp.2021.12.008
Vaintraub, I. A., & Lapteva, N. A. (1988). Colorimetric determination of phytate in unpurified extracts of seeds and the products of their processing. Analytical Biochemistry, 175, 227-230. https://doi.org/10.1016/0003-2697(88)90382-X
Wang, F., Morrison, J. D., Rose, T., Kretzschmar, T., & Wissuwa, M. (2017). Can natural variation in grain P concentrations be exploited in rice breeding to lower fertilizer requirements? PLoS One, 12(6), 1-17. https://doi.org/10.1371/journal.pone.0179484
Wang, L., Cutforth, H., Lal, R., Chai, Q., Zhao, C., Gan, Y., & Siddique, K. H. (2018). ‘Decoupling’land productivity and greenhouse gas footprints: A review. Land Degradation & Development, 29(12), 4348-4361. https://doi.org/10.1002/ldr.3172
Wang, C., & Ning, P. (2019). Post-silking phosphorus recycling and carbon partitioning in maize under low to high phosphorus inputs and their effects on grain yield. Frontiers in plant science, 784, 1-13. https://doi.org/10.3389/fpls.2019.00784
Wang, X., He, Y., Gao, Q., Yang, D., & Liang, J. (2021). Approaches to evaluate nutrition of minerals in food. Food Science and Human Wellness, 10(2), 141-148. https://doi.org/10.1016/j.fshw.2021.02.002
Wu, D., Tanaka, R., Li, X., Ramstein, G. P., Cu, S., Hamilton, J. P., ... & Gore, M. A. (2021). High-resolution genome-wide association study pinpoints metal transporter and chelator genes involved in the genetic control of element levels in maize grain. G3, 11(4), jkab059. https://doi.org/10.1093/g3journal/jkab059
Zhao, H., Frank, T., Tan, Y., Zhou, C., Jabnoune, M., et al. (2016). Disruption of OsSULTR3; 3 reduces phytate and phosphorus concentrations and alters the metabolite profile in rice grains. New Phytologist, 211, 926-939. https://doi.org/10.1111/nph.13969