1. Introducción
El mercado de pasifloras a nivel mundial moviliza más de un millón de toneladas de frutos, con Brasil como el mayor exportador seguido por Colombia e Indonesia (Altendorf, 2018). El género Passiflora comprende 573 especies ampliamente distribuidas a lo largo del trópico (POWO, 2023).
De acuerdo con Da Silva et al. (2020), la producción comercial de ciertos tipos de cultivos se enfoca principalmente en la utilización de frutos y en algunos casos de hojas, lo que lleva a valores de hasta el 75 % de la biomasa vegetal sin aprovechamiento. Con el fin de disminuir la generación de residuos y valorar subproductos agrícolas a partir de varios cultivos, diferentes industrias, como la farmacéutica, están explorando nuevas posibilidades para su incorporación como materias primas, para lo cual se han implementado estrategias de extracción y comercialización de metabolitos secundarios a partir de hojas (Zhang et al., 2023).
En la industria farmacéutica, los flavonoides representan una alternativa para el manejo de diversos tipos de cáncer con acciones sinérgicas en tratamientos con enfoque combinatorio (Kiyohara et al., 2004; Li & Weng 2017; Thomford et al., 2018). Estos metabolitos secundarios, son moléculas fenólicas de bajo peso molecular, que presentan una amplia diversidad química (Liu et al., 2021). En Passiflora son el grupo fenólico con mayor abundancia y diversidad, de los cuales se han reportado antinflamatorios, analgésicos, neuroprotectores, antiproliferativos, citotóxicos, antidepresivos, ansiolíticos y sedantes (Gosmann et al., 2011; Pedone et al., 2015; Dzobo, 2022; Murillo et al., 2023). Algunas moléculas asociadas con estos efectos son: quercetina, isoquercitrina, rutina, apigenina, luteolina, kaempferol, orientina, isoorientina, vitexina e isovitexina (Dhawan et al., 2004; Sharan et al., 2011; Rey et al., 2020; He et al., 2020; Liu et al., 2021; Rai et al., 2022) (Figura A1, Anexo). Además, en varias especies de Passiflora se han reportado más de 70 flavonoides y derivados con diversos patrones de glicosilación (Cruz et al., 2022; Hernández-Martínez et al., 2023; Murillo et al., 2023; Zhang et al., 2023).
A nivel químico, los flavonoides se clasifican en ocho subtipos principales: flavonas, flavonoles, flavanonas, flavanonoles, flavanos, flavanoles, isoflavonas y chalconas (Nabavi et al., 2020; Hodaei et al., 2018). Su biosíntesis es mixta, es decir, son producidos en las plantas a partir de la unión de dos rutas biosintéticas distintas que se combinan para formar nuevos metabolitos (Figura A2, Anexo). El ácido shikímico junto con la Acetil Coenzima A dan origen a la Fenilalanina, la cual ingresa a la vía fenilpropanoide dando origen a la p-Cumaroil CoA. En este punto la Chalcona Sintasa (CHS, EC 2.3.1.74) transforma el cumaroil en naringenina chalcona y se da inicio a la vía de los flavonoides (Hodaei et al., 2018; Nabavi et al., 2020).
La biosíntesis y acumulación de flavonoides en algunos tejidos vegetales, está influenciada por diversas condiciones ambientales, tipo de estrés, condiciones de manejo agronómico, disponibilidad de agua y de nutrientes en el suelo (Reimberg et al., 2008; Sesan et al., 2020; Shah & Smith, 2020). Algunos de los nutrientes que se relacionan con la concentración de flavonoides en hojas de Passiflora son el fósforo disponible, la saturación de magnesio y la relación calcio-magnesio (Ca/Mg) (Hernández-Martínez et al., 2023).
La disponibilidad de nutrientes puede alterar la biosíntesis de metabolitos secundarios por el aumento del estrés en la planta debido a la deficiencia de fósforo o magnesio o generar cambios en la señalización y regulación génica en concentraciones adecuadas de calcio (Hernández-Martínez et al., 2023). También influye sobre la actividad enzimática, como lo reportan Li et al. (2021), quienes encontraron correlación positiva del carbono y negativa del nitrógeno con las enzimas Fenilalanina Amonio Liasa (PAL, EC 4.3.1.24), Cinamato 4-Hidroxilasa (CH4, EC 1.14.13.11), 4-Cumarato-CoA Ligasa (4CL, EC 6.2.1.12).
Las condiciones bióticas que pueden alterar los perfiles y el contenido de flavonoides incluyen la presencia de insectos, nemátodos, mamíferos herbívoros y microorganismos fitopatógenos (Shah & Smith, 2020). Tikhonovich & Provorov (2007), encontraron que la colonización por hongos formadores de micorriza arbuscular y con microorganismos patógenos modula positivamente la expresión de las enzimas Chalcona Isomerasa (CHI, EC 5.5.1.6) y de la Isoflavona Reductasa (IFR, EC 1.6.4.2).
Así, el objetivo de este trabajo fue recopilar y analizar evidencia científica publicada sobre el efecto de diferentes factores bióticos y abióticos sobre el contenido de flavonoides foliares en Passiflora sp.
2. Metodología
En este estudio se realizaron búsquedas de literatura científica y procesos de revisión que se resumen en la Figura 3. El proceso de recopilación y estructuración de documento fue dividido en: 1) Selección de términos clave con sus respectivos sinónimos y redacción de ecuaciones de búsqueda, 2) Selección de artículos científicos, 3) Creación de tabla de conocimiento y 4) Análisis de la información recopilada.
La estrategia de búsqueda estableció como palabras claves: producción, biótico, abiótico, factores ambientales, hongos, bacterias, virus, medio ambiente, flavonoides y Passiflora. En el planteamiento de las ecuaciones de búsqueda se utilizó el siguiente código booleano: “Passiflora AND Flavonoid* AND (Biotic AND Abiotic) factor*”.
A partir de 823 títulos y resúmenes obtenidos en la búsqueda se escogieron los trabajos que cumplieran con los parámetros de inclusión y exclusión establecidos en la Figura 1, excluyendo principalmente documentos que abarcan patentes, estandarización y desarrollo de técnicas de detección de flavonoides, estudios realizados en cultivos celulares, flavonoides presentes en órganos diferentes a hojas, organismos y microorganismos recombinantes, biosíntesis química de flavonoides y producción heteróloga de metabolitos.
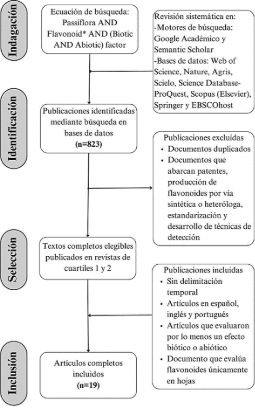
Figura 1. Secuencia metodológica para la revisión sistemática del efecto de factores bióticos y abióticos sobre el contenido de flavonoides en Passiflora sp.
Creación tabla de conocimiento
Para la elaboración de la Tabla 1 se utilizaron 16 artículos indexados que tuvieran en cuenta las siguientes categorías: especie vegetal, país de estudio, tipo de flavonoide, tipo de extracción, técnica de cuantificación, variables bióticas (microorganismos, virus), variables abióticas (estrés oxidativo, acondicionadores orgánicos, intensidad lumínica, manejo agronómico, daños mecánicos, deficiencia de nutrientes), tratamiento con mayor contenido de flavonoides, relación entre el control y los tratamientos, cálculo del incremento del contenido de flavonoides.
Análisis y síntesis de la información revisada
Se realizó la normalización de las unidades de medida para la comparación de la influencia del tratamiento en el contenido de flavonoides expre-sado en porcentaje (FP) (Ecuación 1):
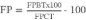 Ecuación 1
Ecuación 1
Donde FPBT es la producción de flavonoides en el mejor tratamiento y FPCT corresponde a la produc-ción de flavonoides en el tratamiento de control.
3. Resultados y discusión
A partir de la línea de comando se obtuvieron 10 artículos en Web of Science, 13 en Nature, 1290 en Google Académico, 49 en Semantic Scholar, 6 en Agris, 43 en Scielo, 34 en Science Database-ProQuest, 47 en Scopus, 368 en Springer y 43 en EBSCOhost, en este estudio se incluyeron 19 documentos.
Se identificaron limitaciones relacionadas con el tipo de extracción del metabolito secundario y su respectiva cuantificación, pues los artículos reportan análisis cromatográficos y/o colorimétricos (Tabla 1). Esta variación no permite la comparación directa entre los estudios, sin embargo, al aplicar la Ecuación 1 se normalizaron los datos. Además, la cuantificación colorimétrica que usa Cloruro de Aluminio presenta variaciones en la absorbancia que dependen de la solución estándar (equivalentes de rutina o equivalentes de quercetina) (Shraim et al., 2021).
En plantas del género Passiflora existen cambios en el contenido de flavonoides por efecto de condiciones bióticas y abióticas (Tabla 1), así como en otras especies vegetales (Yang et al., 2018; Shah y Smith, 2020). Sin embargo, aún se desconocen los mecanismos por los cuales se producen estos cambios. Solamente dos artículos estudiaron la interacción de dos o más factores bióticos y abióticos simultáneamente, lo cual es fundamental para entender y estandarizar los procesos de producción de este metabolito en campo (Oliveira et al., 2015; Oliveira et al., 2019a). Otra limitación encontrada fue la metodología empleada para la detección y cuantificación de flavonoides, pues hay diferencia entre las sensibilidades de las técnicas cromatográficas y colorimétricas (Huang et al., 2018; Shraim et al., 2021).
Las variables abióticas fueron las más estudiadas con 52,1% del total de las investigaciones, seguidas por las variables bióticas con 34,7% y, por último, la interacción de variables con un 13,1%, mostrando que las variables pueden genera efectos positivos en la producción de flavonoides en plantas del género Passiflora (Tabla 1).
Autores como Mendonça et al. (2007), Guimaraes et al. (2012) y Ming et al. (2012), reportan que el contenido de flavonoides totales varía de acuerdo con el estadio de desarrollo de la planta e indican diferencias entre la etapa de desarrollo de las hojas, la floración (ramas secundarias) y la maduración de frutos (escala 1, 6 y 8 de BBCH, respectivamente) (Rodríguez-León et al., 2015).
Variables Bióticas
Estado fenológico del cultivo
Las plantas en las etapas de desarrollo vegetal escala BBCH 3 (elongación del tallo principal), 5 (aparición y desarrollo del órgano floral en ramas secundarias), 6 (floración), 7 (formación del fruto) y 8 (maduración de frutos), presentan diferencias en el contenido de flavonoides totales (Mendonça et al., 2007; Guimaraes et al., 2012; Ming et al., 2012) (Tabla 2). Ming et al. (2012), reportan rangos de aumento de diferentes tipos de flavonoides entre 272% al 914% durante la maduración del fruto, indicando este estado fenológico como el de mayor acumulación de estos metabolitos.
Inoculación de hongos saprófitos y simbióticos
La inoculación foliar de un consorcio de hongos promotores de crecimiento vegetal del género Trichoderma, produjo un incremento del 50% en la concentración de flavonoides foliares, resultados que se relacionan con la inducción de resistencia sistémica en la planta (Dini et al., 2020). También se reporta que las plantas inoculadas con Acaulospora longula, hongo formador de micorriza arbuscular, producen entre el 29% y el 64% más de flavonoides que las plantas no inoculadas (Oliveira et al., 2019b). Las características químicas del sustrato de siembra de esas plantas fueron pH 4,7; P 4,5 mg kg-1; K 0,071 mg kg-1; Al 0,68 mg kg-1; Ca 0,45 mg Kg-1. En otro trabajo utilizando Entrophospora etunicata, Gigaspora albida y A. longula, se observó un aumento del 29%, 55% y 64%, respectivamente, de la concentración de vitexina a nivel foliar (Oliveira et al., 2019b). En este estudio, las caracte-rísticas químicas del suelo fueron: pH 6.1; P 2,7 mg kg-1; K 0,21 mg kg-1; Ca 3,18 mg kg-1. Las diferencias significativas en la producción de flavonoides se pueden asociar a un proceso de reconocimiento específico entre el hongo y la planta (Ming et al., 2012; Chagnon et al., 2013), como se demostró en los estudios realizados en plantas de Arabidopsis sp. en donde se identificó que diferentes hongos formadores de micorriza activaban diferentes grupos de genes asociados a la ruta metabólica de fenilpropanoide, mecanismo no nutricional en la modulación de metabolitos secundarios (Oliveira et al., 2018). En relación con el aspecto nutricional, los hongos formadores de micorriza tienen la capacidad translocar agua y nutrientes, lo que influye positivamente en metabolismo vegetal (Amani-Machiani et al., 2022).
Infección viral
La infección con el virus del mosaico del pepino (CMV) mostró resultados promisorios al aumentar un 58% la producción de flavonoides, pero se reportan algunas dificultades técnicas, económicas y fitosanitarias al utilizar este tratamiento a nivel industrial (Lan et al., 2020). La principal, es que en la actualidad la extracción de flavonoides se realiza a partir de material seco que se obtiene de plantas que ya dieron fruto, por lo cual las empresas reciben beneficios económicos de la producción de la fruta y de la extracción de flavonoides. Si se infectan las plantas sanas con un virus, la fruta ya no se podrá comercializar por motivos fitosa-nitarios, siendo una limitación en la rentabilidad del cultivo (Lan et al., 2020).
Variables Abióticas
Fertilizantes minerales
El estado nutricional de las plantas tiene un efecto directo sobre el contenido de flavonoides (Deng et al., 2019). La disponibilidad de nitrógeno en la planta genera competencia entre las rutas biosintéticas de proteínas y compuestos fenólicos, fenilpropanoides y derivados como flavonoides, taninos y lignina (Haukioja et al., 1998; Taiz et al., 2015; Ranjan et al., 2023). Mendonça et al. (2008), encontraron un aumento del 46% en el contenido de vitexina en plantas cultivadas en suelo con deficiencia del elemento. De otra parte, en suelos con bajas concentraciones de fósforo y potasio se presentó un incremento del 16% y 18% de los flavonoides totales, mientras que la deficiencia de calcio y boro afectan negativamente la concen-tración de la vitexina disminuyéndola en un 22% y 33%, respectivamente (Mendonça et al., 2008). De otra parte, existen otros elementos que para pasifloras no presentan efecto en la concentración de vitexina, éstos son el magnesio, el azufre, el hierro, el manganeso, el zinc y el cobre (Freitas et al., 2008; Deng et al., 2019).
Aunque los resultados obtenidos con los fertilizantes minerales muestran menores valores a los obtenidos con otros factores presentados en la Tabla 1, se destaca la necesidad de suplementar los sustratos de siembra de futuros experimentos con boro en concentraciones cercanas a 6,7 mg kg-1 que no son tóxicas para la planta o el microbioma (Barp et al., 2006; Goulart et al., 2019). Este microelemento es el más limitante en producción de flavonoides en Passiflora sp., ya que, aunque ningún flavonoide reportado en la actualidad lo tenga en su estructura o en sus sustituciones (Julkunen et al., 2015), es un microelemento esencial en varias vías metabólicas (Lewis, 2019). Finalmente, otro aspecto que se ha evaluado es el daño mecánico, con aumento de 380% en la concentración de flavonoides totales respecto a plantas sin ningún tipo de daño (Pagassini et al., 2021).
Fertilizantes orgánicos
Cuando se utilizó el vermicompost se obtuvo un aumento del 491% en el contenido de flavonoides totales en la planta. Es probable que el resultado se deba a la combinación de la concentración de materia orgánica (20,5 g kg-1), de fósforo (27,27 mg kg-1), de potasio (0,97 mg kg-1), de hierro (62,3 mg kg-1) y al pH (6,4) (Oliveira et al., 2014). Se ha reportado que este abono orgánico puede aumentar la sucesión bacteriana en el suelo generando una sobreexpresión de flavonoides como mecanismo de control de colonización de la planta por diferentes microorganismos rizosféricos (Antognoni et al., 2007; Ghasemzadeh et al., 2016).
Exposición a Luz UV
Desde hace más de 50 años se viene estudiando en diferentes modelos vegetales el efecto que puede tener la exposición a ciertas longitudes de onda en la biosíntesis de metabolitos segundarios, en la reducción en tiempos de cultivo y en la protección contra patógenos (Sesan et al., 2020). En el caso de Passiflora sp., solamente se ha realizado un experimento con luz UV-B que aumentó la producción de vitexina y quercetina en 60% (Ni et al., 2020). En presencia de luz LED, la concentración de flavonoides totales en P. edulis aumentó 229% respecto al control (Ni et al., 2020). Estos hallazgos se comparan con los obtenidos en plantas de Zea mays, Guadua angustifolia, Hordeum vulgare y Solanum lycopersicum, en donde la exposición de la planta a luz UV aumentó la biosíntesis de alcaloides, terpenos y flavonoides en un 400% (Pedone et al., 2015; Silva et al., 2019; Yang et al., 2018). Se sabe que los metabolitos de naturaleza flavonoide absorben a nivel foliar las diferentes longitudes de onda asociadas con la radiación UV para proteger y reducir la producción de especies reactivas de oxígeno que puede desencadenar daño del material genético y activar procesos apoptóticos en las células vegetales (Silva et al., 2019). Aunque se acepta actualmente que la síntesis de flavonoides es uno de los mecanismos de protección de las plantas a luz UV, aún no se conoce el efecto que generan las diferentes longitudes de onda en las comunidades microbianas rizosféricas ni cómo estos cambios se reflejan en la producción de flavonoides indispensables en la señalización molecular en la biota del suelo (Reimberg et al., 2008).
Condiciones ambientales
El incremento de 1,5 veces en la concentración de ozono en condiciones controladas produce un aumento del 319% en el contenido de flavonoides totales, agentes antioxidantes que evitan la fotoxidación y daño en las macromoléculas celulares (Shen et al., 2022). También, a lo largo de las 20 primeras semanas de establecimiento del cultivo, las variaciones van desde el 0,02% hasta el 4,89%, siendo el último valor el dato correspondiente a la semana 20 (Reimberg, et al., 2009).
Combinación de factores
Dentro de la combinación de factores evaluados se encuentra el uso de fertilizantes orgánicos (vermicompost) y de inoculantes de hongos formadores de micorriza arbuscular. Oliveira et al. (2015), reportan que el uso simultáneo del fertilizante con inoculantes que contienen Gigaspora sp. produjo un aumento de 492% en el contenido de flavonoides totales en hojas y con inoculantes que contienen Acaulospora longula, un aumento de 142%, mientras que bajo la aplicación de solo el último inoculante el incremento de vitexina fue del 63%. Lo anterior se atribuye a la capacidad del micelio externo de la micorriza de aumentar el área de exploración del suelo y de movilizar hacia la planta formas disponibles de nutrientes como el fósforo, que tiene efecto en la ruta fenilpropanoide. Es importante reconocer que este tratamiento fue replicado en dos experimentos por los mismos investigadores en los años 2014 y 2015, sin lograr los mismos resultados de aumento en la concentración de flavonoides (159% en el 2014 y 431% en el 2015). Una posible explicación de la diferencia en la biosíntesis de flavonoides es que el suelo no se esterilizó en ninguno de los ensayos, lo cual implica que las poblaciones de microorganismos en los sustratos de siembra eran altas y seguramente diversas (Campos et al., 2015; Guimaraes et al., 2020). Entendiendo que la biosíntesis de flavonoides es específica y se da también en respuesta a los microorganismos presentes en la rizosfera, la variación en la composición de estas comunidades microbianas puede alterar la producción de estos metabolitos (Pang et al., 2021).
4. Conclusiones
La evidencia científica muestra que diferentes factores bióticos, abióticos y sus interacciones tienen una incidencia en la concentración de flavonoides presentes en plantas del género Passiflora. Los factores bióticos, además del estado fenológico del cultivo, la inoculación con hongos de micorriza arbuscular induce aumento en el contenido de flavonoides totales. Los factores abióticos, la concen-tración de ozono, la estacionalidad y el tipo de manejo agronómico tienen efecto positivo en la producción de estos metabolitos. Finalmente, el mayor aumento en el contenido de flavonoides totales se produce con la interacción de varios factores, como lo reportado en el caso de los hongos de micorriza arbuscular y vermicompost.
Se resalta la necesidad de caracterizar, dentro de las condiciones de evaluación para producción de metabolitos, el estado fenológico del cultivo, las propiedades del suelo, las comunidades microbianas del suelo y de la rizosfera y las condiciones climáticas, geográficas y ambientales para establecer relaciones multiparamétricas que determinan la producción de metabolitos de interés a partir de Passiflora sp. con potencial uso en la industria farmacéutica. Otro de los aspectos que requiere mayor exploración, es la identificación de los grupos de flavonoides que producen diferentes especies de Passiflora y el efecto de las condiciones estudiadas en este trabajo sobre aquellos con mayor actividad biológica.
Agradecimientos
Los autores agradecen al Ministerio de Ciencia, Tecnología e Innovación, al Ministerio de Educación Nacional, al Ministerio de Industria, Comercio y Turismo e ICETEX (792–2017) 2ª Convocatoria Ecosistema Científico – Colombia Científica para la Financiación de Proyectos de I + D + i), al Banco Mundial y a la Vicerrectoría de Investigaciones, Pontificia Universidad Javeriana, Bogotá, Colombia (Contrato número FP44842-221-2018).
Contribuciones de los autores
Para este trabajo los autores desarrollaron las siguientes actividades: Conceptualización: Mateus-Maldonado, J. F.; Díaz-Gallo, S. A.; Pedroza, A. M.; Costa, G. M.; Díaz-Ariza, L.A. Adquisición de datos: Mateus-Maldonado, J.F.; Díaz-Gallo, S. A.; Albornoz-Molano. A. Análisis de datos: Mateus-Maldonado, J. F.; Díaz-Gallo, S. A.; Albornoz, Díaz-Ariza, L. A. Diseño de metodología: Mateus-Maldonado, J. F.; Díaz-Gallo, S. A.; Diaz-Ariza, L. A. Redacción y edición: Mateus-Maldonado, J. F.; Díaz-Gallo, S. A.; Albornoz-Molano. A.; Diaz-Ariza, L. A, Costa, G. M; Pedroza, A. M.
ORCID
J. F. Mateus-Maldonado https://orcid.org/0000-0001-8271-7715
A. Marina Pedroza https://orcid.org/0000-0002-1200-0265
S. A. Díaz-Gallo https://orcid.org/0009-0000-4274-2983
A. J. Albornoz-Molano https://orcid.org/0009-0008-3790-398X
G. Modesti Costa https://orcid.org/0000-0003-2449-1986
L. A. Díaz-Ariza https://orcid.org/0000-0001-5736-6335
Referencias bibliográficas
Altendorf, S. (2018). Minor Tropical Fruits: Mainstreaming a niche market. Food Outlook, 67-75 of OMS.
Amani-Machiani, M., Javanmard, A., Habibi Machiani, R., & Sadeghpour, A. (2022). Arbuscular mycorrhizal Fungi and Changes in Primary and Secondary Metabolites. Plants, 11(17), 2183. https://doi.org/10.3390/plants11172183
Antognoni, F., Zheng, S., Pagnucco, C., Baraldi, R., Poli, F., & Biondia, S. (2007). Induction of flavonoid production by UV-B radiation in Passiflora quadrangularis callus cultures. Fitoterapia, 78, 345-352. https://doi:10.1016/j.fitote.2007.02.001
Barp, E. A., Soares, G. L., Gosmann, G., Machado, A. M., Vecchi, C., & Moreira, G. R. (2006). Phenotypic plasticity in Passiflora suberosa L. (Passifloraceae): induction and reversion of two morphs by variation in light intensity. Brazilian journal of biology, 66(3), 853-862. https://doi.org/10.1590/s1519-69842006000500011
Campos, M., Uliana, M., Montero, D. V., Lima, G., & Ming, L. C. (2015). Effects of organic fertilization on biomass production and bioactive compounds in Passiflora incarnata L. Int J Phytomedicine, 2, 1-4. https://doi.org/10.15171/ijpni.2015.11
Chagnon, P. L., Bradley, R. L., Maherali, H., & Klironomos, J. N. (2013). A trait-based framework to understand life history of mycorrhizal fungi. Trends Plant Sci, 18(9), 484-491. https://doi.org/10.1016/j.tplants.2013.05.001
Cruz, J., Pereira, Z., Corrêa, R., Lamarão, C., Sanches, E., Campelo, P., & Bezerra, J. (2022). Bioactive compounds, functional properties, and technological application of Passiflora quadrangularis: A review. JSFA Reports, 3(4), 150-160. https://doi.org/10.1002/jsf2.108
Da Silva, A. P., Segatto, M. L., Stahl, A. M., & Gomes, V. (2020). Development and application of green and sustainable analytical methods for flavonoid extraction from Passiflora waste. BMC Chemistry, 14, 56. https://doi.org/10.1186/s13065-020-00710-5
Deng, B., Li, Y., Lei, G., & Liu, G. (2019). Effects of nitrogen availability on mineral nutrient balance and flavonoid accumulation in Cyclocarya paliurus. Plant Physiol. Biochem, 135, 111-118. https://doi.org/10.1016/j.plaphy.2018.12.001
Dhawan, K., Dhawan, S., & Sharma, A. (2004). Passiflora: a review update. J. Ethnopharmaco, 94(1), 1-23. https://doi.org/10.1016/j.jep.2004.02.023
Dini, I., Graziani, G., Fedele, F. L., Sicari, A., Vinale, F., Castaldo, L., & Ritieni, A. (2020). Effects of Trichoderma biostimulation on the phenolic profile of extra-virgin olive oil and olive oil by-products. Antioxidants, 9(4), 284. https://doi.org/10.3390/antiox9040284
Dzobo, K. (2022). The role of natural products as sources of therapeutic agents for innovative drug discovery. In: Comprehensive Pharmacology. Ed: Terry Kenakin, pp 408-422. https://doi.org/10.1016/B978-0-12-820472-6.00041-4
Fernandes, F. F., Wsposito, M. P., Gonçalves da Silva, M. R., Cardoso-Gustavson, P., Furlan, C. M., Hoshika, Y., Carrari, E., Magni, G., Domingos, M., & Paoletti, E. (2019). The passion fruit liana (Passiflora edulis Sims, Passifloraceae) is tolerant to ozone. Science of The Toal Environment, 656, 1091-1101. https://doi.org/10.1016/j.scitotenv.2018.11.425
Ghasemzadeh, A., Ashkani, S., Baghdadi, A., Pazoki, A., Jaafar, H. Z. E., & Rahmat, A. (2016). Improvement in Flavonoids and Phenolic Acids Production and Pharmaceutical Quality of Sweet Basil (Ocimum basilicum L.) by Ultraviolet-B Irradiation. Molecules, 21, 1-15. https://doi:10.3390/molecules2109120
Gosmann, G., Provensi. G., Comunello, L. N., & Rates, S. M. K. (2011). Composição química e aspectos farmacológicos de espécies de Passiflora L. (Passifloraceae). Revista Brasileira de Biociencias, 9(1), 88-99.
Goulart, M. C., Cueva, L. G., Hidalgo, K. J., Attili‐Angelis, D., & Fantinatti‐Garboggini, F. (2019). Comparison of specific endophytic bacterial communities in different developmental stages of Passiflora incarnata using culture‐dependent and culture‐independent analysis. Open Microbiol. J, 12, 1-16. https://doi.org/10.1002/mbo3.896
Guimaraes, S. F., Lima, I. M., & Modolo, L. V. (2020). Phenolic content and antioxidant activity of parts of Passiflora edulis as a function of plant developmental stage. Acta Bot. Bras, 34, 74-82. https://doi.org/10.1590/0102-33062019abb0148
Haukioja, E., Ossipov, V., Koricheva, J., Honkanen, T., Larsson, S., & Lempa, K. (1998). Biosynthetic origin of carbon-based secondary compounds: cause of variable responses of woody plants to fertilization? Cheoecology, 8, 133-139. https://doi.org/10.1007/s000490050018
He, X., Luan, F., Yang, Y., Wang, Z., Zhao, Z., et al. (2020). Passiflora edulis: An Insight Into Current Researches on Phytochemistry and Pharmacology. Front. Pharmacol, 11, 617. https://doi.org/10.3389/fphar.2020.00617
Hernández-Martínez, A., Lozano-Puentes, H., Camacho-Montealegre, C., Costa, G., & Díaz-Ariza, L. (2023). Establishing the Relationship Between Flavonoid Content, Mycorrhization, and Soil Nutritional Content in Different Species of the Genus Passiflora in Colombia. ACS Omega, 8, 40647-40656. https://doi.org/10.1021/acsomega.3c05606
Hodaei, M., Rahimmalek, M., Arzani, A., & Talebi, M. (2018). The effect of water stress on phytochemical accumulation, bioactive compounds and expression of key genes involved in flavonoid biosynthesis in Chrysanthemum morifolium L. Ind. Crop. Prod, 120, 295–304. https://doi.org/10.1016/j.indcrop.2018.04.073.
Huang, R., Wu, W., Shen, S., Fan, J., Chang, Y., Chen, S., & Ye, X. (2018). Evaluation of colorimetric methods for quantification of citrus flavonoids to avoid misuse. Anal. Methods, 10(22), 2575-2587. https://doi.org/10.1039/C8AY00661J
Julkunen, R., Nenadis, N., Neugart, S., Robson, M., Agati, G., et al. (2015). Assessing the response of plant flavonoids to UV radiation: an overview of appropriate techniques. Phytochem. Ver, 14, 273-297. https://doi.org/10.1007/s11101-014-9362-4
Kiyohara, H., Matsumoto, T., & Yamada, H. (2004). Combination Effects of Herbs in a Multi-herbal Formula: Expression of Juzen-taiho-to’s Immuno-modulatory Activity on the Intestinal Immune System. Evid. Based Complementary Alterna. Med, 1(1), 83-91. https://doi.org/10.1093/ecam/neh004
Lan, H., Lai, B., Zhao, P., Dong, X., Wei, W., Ye, Y., & Wu, Z. (2020). Cucumber mosaic virus infection modulated the phytochemical contents of Passiflora edulis. Microb. Pathog, 138, 1-8. https://doi.org/10.1016/j.micpath.2019.103828
Lewis, D. (2019). Boron: the essential element for vascular plants that never was. New Phytol, 221(4), 1685-1690. https://doi.org10.1111/nph.15519
Li, S., & Weng, J. (2017). Demystifying traditional herbal medicine with modern approach. Nat. Plants, 3(8), 17109. https://doi.org/10.1038/nplants.2017.109
Li, Z., Jiang, H., Yan, H., Jiang, X., Ma, Y., & Qin, Y. (2021). Carbon and nitrogen metabolism under nitrogen variation affects flavonoid accumulation in the leaves of Coreopsis tinctoria. Peer J, 9, 12152. https://doi.org/10.7717/peerj.12152
Liang, D., Yousef, A. F., Wei, X., Moaaz, M., Yu, W., Yang, L., Oelmüller, R., & Chen, F. (2021). Increasing the performance of Passion fruit (Passiflora edulis) seedlings by LED light regimes. Sci. Rep, 11, 20967.https://doi.org/10.1038/s41598-021-00103-1
Liu, W., Feng, Y., Yu, S., Fan, Z., Li, X., Li, J., & Yin, H. (2021). The flavonoid biosynthesis network in plants. Int. J. Mol. Sci, 22(23), 12824. https://doi.org/10.3390/ijms222312824
Mendonça, F. S. M., Monnerat, P. H., Vieira, I. J. C., & De Carvalho, A. J. C. (2007). Flavonóides e composição mineral de folhas de maracujazeiro amarelo em função da posição da folha no ramo. Cienc. Rural, 37(6), 1634-1639. https://doi.org/10.1590/s0103-84782007000600020
Mendonça. F. M. S., Monnerat, P. H., & Curcino Vieira, I. J. (2008). Mineral Deficiency in Passiflora alata Curtis: Vitexin Bioproduction. J. Plant. Nutr. Soil Sci, 31(10), 1844-1854. http://dx.doi.org/10.1080/01904160802325552
Ming, L. C., Maia, C. L., Conceicao, D. M., Yuhara, T. Y., Mayo Marques, M. O., et al. (2012). Phytomass and flavonoid production in different organs and phenological stages of Passiflora alata Dryander. Res. J. Med. Plant, 6(45), 5695-5700. http://dx.doi.org/10.5897/JMPR12.432
Muñiz, B.C., Falcão, E. L., Bastos, C. J. A., & Barbosa da Silva, F. S. (2023). Cultivation protocol using a coir-based substrate modulates the concentration of bioactive compounds and the antioxidant activity of Passiflora alata Curtis seedlings. Ciênc. Agrotec., 47, e014922. https://doi.org/10.1590/1413-7054202347014922
Muñiz, B. C., Falcão, E. L., Bastos, C. J. A., & Barbosa da Silva, F. S. (2022). The application of coir dust modulates the production of phytochemicals in mycorrhizal Passiflora alata Curtis. Rhizosphere., 23, 100573. https://doi.org/10.1016/j.rhisph.2022.100573
Muniz, B. C., Falcão, E. L., Monteiro, R. P., dos Santos, E. L., Bastos, C. J. A., & Barbosa da Silva, F. S. (2021). Acaulospora longula España & N.C. Schenck: A low-cost bioinsumption to optimize phenolics and saponins production in Passiflora alata Curtis. Ind. Crops Prod, 167, 113498. https://doi.org/10.1016/j.indcrop.2021.113498
Murillo, E., Jiménez, A., Velásquez, A., Clavijo, H., & Velásquez, C. (2023). Phenolic Components and Antioxidant Capacity of Six Wild Passiflora Species from the Andean Region of Colombia. J. Herbs Spices Med. Plants, 29(4), 319-335. https://doi.org/10.1080/10496475.2023.2181260
Nabavi, S. M., Šamec, D., Tomczyk, M., Milella, L., Russo, D., et al. (2020). Flavonoid biosynthetic pathways in plants: Versatile targets for metabolic. Engineering. Biotechnol. Adv, 38, 107316. https://doi.org/10.1016/j.biotechadv.2018.11.005
Ni, Y., Lin, K., Chen, K., Wu, C., & Chang, Y. (2020). Flavonoid Compounds and Photosynthesis in Passiflora Plant Leaves under Varying Light Intensities. Plants, 9(5), 633. https://doi.org/10.3390/plants9050633
Oliveira, M.S., Campos, M. A. S., & Silva, F. S. B. (2014). Arbuscular mycorrhizal fungi and vermicompost to maximize the production of foliar biomolecules in Passiflora alata Curtis seedlings. J. Sci. Food Agric, 95, 522-528. https://doi.org/10.1002/jsfa.6767
Oliveira, M. S., Pinheiro, I. O., & Silva, F. S. B. (2015). Vermicompost and arbuscular mycorrhizal fungi: An alternative to increase foliar orientin and vitexin-2-O-ramnoside synthesis in Passiflora alata curtis seedlings. Ind. Crops Prod, 77, 754-757. https://doi.org/10.1016/j.indcrop.2015.09.061
Oliveira, M. V., Oliveira, L. L., & Costa, A. M. (2018). Effect of training system and climate conditions on phytochemicals of Passiflora setacea, a wild Passiflora from Brazilian Savannah. Food Chem, 266, 350-358. https://doi.org/10.1016/j.foodchem.2018.05.097
Oliveira, P. T., Lima dos Santos, E., Viturino da Silva, W. A., Assunção Ferreira, M. R., Lira Soares, L. A., Alves da Silva, F., & Barbosa da Silva, F. S. (2019a). Use of mycorrhizal fungi releases the application of organic fertilizers to increase the production of leaf vitexin in yellow passion fruit. J. Sci. Food Agric, 100, 1816–1821. https://doi.org/10.1002/jsfa.10197
Oliveira, P. T., Lima dos Santos, E., Viturino da Silva, W. A., Assunção Ferreira, M. R., Lira Soares, L. A., Alves da Silva, F. A., & Barbosa da Silva, F. S. (2019b). Production of biomolecules of interest to the anxiolytic herbal medicine industry in yellow passionfruit leaves (Passiflora edulis f. flavicarpa) promoted by mycorrhizal inoculation. J. Sci. Food Agric, 99(7), 3716-3720. https://doi.org/10.1002/jsfa.9598
Pagassini, J. A. V., de Godoy, L. J. G., Campos, F. G., Barzotto, G. R., Ribeiro, M. A., & Gernandes, C. S. (2021). Silicon and mechanical damage increase polyphenols and vitexin in Passiflora incarnata L. Sci. Rep, 11, 22064. https://doi.org/10.1038/s41598-021-01647-y
Pang, Z., Chen, J., Wang, T., Gao, C., Li, Z., Guo, L., Xu, J., & Cheng, Y. (2021). Linking plant secondary metabolites and plant microbiomes: a review. Front in Plant Sci, 12, 621276. https://doi.org/10.3389/fpls.2021.621276
Pedone, M. V. L., Silva, F. S., & Maia, L. C. (2015). Production of secondary metabolites by mycorrhizal plants with medicinal or nutritional potential. Acta Physiol. Plant, 37, 1-12. https://doi.org/10.1007/s11738-015-1781-3
POWO. (2023). "Plants of the World Online”. Facilitated by the Royal Botanic Gardens, Kew. Published on the Internet; http://www.plantsoftheworldonline.org/
Rai, S., Nagar, J. C., & Mukin, M. (2022). Pharmacological and Medicinal Importance of Passiflora edulis: A Review. Int. J. Res. Rev, 9(4), 341-349. https://doi.org/10.52403/ijrr.20220442
Ramaiya, S. D., Lee, H. H., Xiao, Y., Shahbani, N. S., Zakaria, M. H., & Bujang, J. S. (2021). Organic cultivation practices enhanced antioxidant activities and secondary metabolites in giant granadilla (Passiflora quadrangularis L.). PloS one, 16(7), e0255059. https://doi.org/10.1371/journal.pone.0255059
Ranjan, R., Kishore, K., Ranjan, R., Sheikh, T. J., Kumar, A., Kumar, B., Kumar, S., & Kumar, R. (2023). Nutraceutical Potential of Vitexin: A Flavone Glycoside. J. Phytopharm, 12(1), 44-50. http://10.31254/phyto.2023.12107
Reimberg, M. C., Colombo, R., & Yariwake, J. H. (2008). Multivariate analysis of the effects of soil parameters and environmental factors on the flavonoid content of leaves of Passiflora incarnata L., Passifloraceae. Rev. Bras. Farmacogn, 19(4), 853-859. http://dx.doi.org/10.1590/S0102-695X2009000600010
Rey, D., Alves, T., Miranda, P. M., Gonçalves, R., Sepulveda, M., et al. (2020). Cellular target of isoquercetin from Passiflora ligularis Juss for glucose uptake in rat soleus muscle. Chem. Biol. Interact, 330, 109198. https://doi.org/10.1016/j.cbi.2020.109198
Rodríguez-León, A., Rodríguez-Carlosama, A., Melgarejo, L. M., & Miranda, D. (2015). Caracterización fenológica de granadilla (Passiflora ligularis Juss) crecida a diferentes altitudes en el departamento del Huila. In: Granadilla (Passiflora ligularis Juss): Caracterización ecofisiológica del cultivo. In: Chapter: Caracterización fenológica de granadilla (Passiflora ligularis Juss) crecida a diferentes altitudes en el departamento del Huila. Publisher: Universidad Nacional de Colombia, Bogotá Ed: Luz Marina Melgarejo, pp.53-90.
Sesan, T. E., Oancea, A. O., Stefan, L. M., Mănoiu, V. S., Ghiurea, M., Răut, L., et al. (2020). Effects of Foliar Treatment with a Trichoderma Plant Biostimulant Consortium on Passiflora caerulea L. Yield and Quality. Microorganisms, 8(1), 2-17. https://doi:10.3390/microorganisms8010123
Shah, A., & Smith, D.L. (2020). Flavonoids in agriculture: Chemistry and roles in, biotic and abiotic stress responses, and microbial associations. Agronomy, 10(8), 1209. https://doi.org/10.3390/agronomy10081209
Sharan, S., Soni, H., Mishra, K., & Kumar, A. (2011). Recent updates on the genus Passiflora: A review. Int. J. Res. Phytochem. Pharmacol, 1(1), 1-16.
Shen, N., Wang, T., Gan, Q., Liu, S., Wang, L., & Jin, B. (2022). Plant flavonoids: Classification, distribution, biosynthesis, and antioxidant activity. Food Chem, 383, 132531. http://doi.org/10.1016/j.foodchem.2022.132531
Shraim, A.M., Ahmed, T.A., Rahman, M.M., Hijji, Y.M. (2021). Determination of total flavonoid content by aluminum chloride assay: A critical evaluation. LWT, 150, 111932. https://doi.org/10.1016/j.lwt.2021.111932
Silva, F. A., Maia, L. C., & Silva, F. S. B. (2019). Arbuscular mycorrhizal fungi as biotechnology alternative to increase concentrate of secondary metabolites in Zea mays L. Rev. Bras. Bot, 42, 189-193. https://doi.org/10.1007/s40415-018-0508-2
Taiz, L., Zeiger, E., Møller, I. M., & Murphy, A. (2015). Plant physiology and development. Ed. VI Sinauer Associates Incorporated.
Thomford, N. E., Senthebane, D. A., Rowe, A., Munro, D., Seele, P., Maroyi, A., & Dzobo, K. (2018). Natural Products for Drug Discovery in the 21st Century: Innovations for Novel Drug Discovery. Int. J. Mol. Sci, 19, 1578. https://doi.org/10.3390/ijms19061578
Tikhonovich, I. A., & Provorov, N. A. (2007). Beneficial plant-microbe interactions. Comprenhensive and Molecular Phytopathology, 365-420. https://doi.org/10.1016/B978-044452132-3/50018-3
Yang, L., Wen, K. S., Ruan, X., Zhao, Y. X., Wei, F., & Wang, Q. (2018). Response of Plant Secondary Metabolites to Environmental Factors. Molecules, 23, 1-26. https://doi:10.3390/molecules23040762
Zhang, J., Tao, S., Hou, G., Zhao, F., Meng, Q., & Tan, S. (2023). Phytochemistry, nutritional composition, health benefits and future prospects of Passiflora: A review. Food Chem., 428, 136825. https://doi.org/10.1016/j.foodchem.2023.136825
Ecuación 1