1. Introducción
Una de las hortalizas que tiene una aportación importante y nutricional en la dieta humana es el tomate (Solanum lycopersicum L.), pertenece a la familia de las Solanáceas, siendo el género más grande y con mayor importancia económica, con origen en Sudamérica y amplia extensión de cultivo en el mundo (Tamburino et al., 2020). El cultivo de esta hortaliza se encuentra constantemente en ajuste sobre el manejo agronómico de los sistemas productivos intensivos (Zhu et al., 2018). Sin embargo, los sistemas productivos se encuentran con restricciones por el cambio climático que limitan fuertemente el desarrollo del cultivo de tomate (Mutale-joan et al., 2020), originando la aparición de enfermedades y de insectos plaga, que sin el control oportuno, limitan el rendimiento y la eventual perdida de la producción (Liu & Wang, 2020).
Una de estas plagas que causan daños económicos en el tomate y otras solanáceas es el psílido B. cockerelli. presente en el sur de Canadá, Estados Unidos y México principalmente (Sumner et al., 2020). El daño que efectúa es de manera directa por la alimentación de la savia de la planta e indirecta por la transmisión de Candidatus Liberibacter solanacearum (CLso) (Gutiérrez-Ramírez et al., 2021), siendo responsable de la disminución de hasta un 60% en los rendimientos esperados (Rivera-Martínez et al., 2018). Recientemente, se determinó la distribución del haplotipo Central de B. cockerelli en Aguascalientes, Zacatecas, Jalisco, Guanajuato, Hidalgo, Puebla, San Luis Potosí, Nayarit, Nuevo León, Durango, Michoacán, Coahuila y Tamaulipas, en México; así como se determinó la presencia de CLso en el 88.57% de las poblaciones B. cockerelli procedentes de los estados antes mencionados (Cerna et al., 2021).
El manejo agronómico de B. cockerelli se ha realizado de manera cultural con mallas de poro pequeño que limitan el acceso del psílido a las zonas de cultivo y trampas pegajosas de color amarillo (Roller Trap) (Vereijssen et al., 2018); eliminar hospederos alternos dentro y fuera del cultivo (Delgado-Ortiz et al., 2019); así como acolchados plásticos de color gris-plata (Lozano et al., 2018). El manejo químico es el más usado por su rápido efecto y su alta mortandad sobre el insecto para la protección de la planta (Tucuch-Haas et al., 2020); efectuándose hasta 30 aplicaciones en el cultivo de papa para el manejo esta plaga (Cerna et al., 2012), con insecticidas superficiales (mineral de aluminosilicato, aceites minerales) (Vereijssen et al., 2018), de contacto (cipermetrina, cyfluthrin, dimetoato, pyriproxifen, esfenvalerato, spiromesifen) (Beltran et al., 2015; Cerna et al., 2012; Tucuch-Haas et al., 2010) y sistémicos (abamectina, aldicarb, cianiliprol, ciantraniliprol, imidacloprid, espirotetramat, endosulfan, disulfoton, ditiofosfato, tiametoxam, thiacloprid, methamidophos) (Carmo-Sousa et al., 2020; Tucuch-Haas et al., 2020).
Sin embargo, los métodos de control químico han desarrollado resistencia en B. cockerelli, la eliminación de enemigos naturales, fitotoxicidad en los suelos y cultivos agrícolas (Kolomiiets et al., 2019). Una alternativa biorracional a esta problemática es el manejo a través de extractos de plantas (Barrios-Díaz et al., 2016), por su baja toxicidad para el ser humano y el ambiente, así como la baja resistencia que pueda llegar a generar en el insecto (Delgado-Oramas et al., 2020).
La planta Crotalaria longirostrata (Hook. & Arn.), de la familia Fabaceae (Mateos-Maces et al., 2020), una planta nativa de América central y México (Jiménez & Grusak, 2015). Conocida como chipilín y empleada como alimento por su alto contenido de aminoácidos esenciales como arginina, histidina, isoleucina, lisina, leucina, treonina y valina (Mateos-Maces et al., 2020); presenta un alto contenido de metabolitos secundarios como ácidos orgánicos, flavonoides, compuestos fenólicos y alcaloides, con actividad biológica en plagas y enfermedades (Cruz-Rodríguez et al., 2020; Rovira et al., 2019).
Se ha reportado el efecto inhibitorio del extracto acuoso de hojas C. longirostrata, el cual presentó acción fungistática a las 96 h sobre Fusarium sp. (31%), F. solani (21%), F. oxysporum (27%) y la fracción de éter etílico generó únicamente actividad bactericida sobre Staphylococcus epidermidis (27%) (Miranda-Granados et al., 2018). Al igual que el extracto metanólico de las raíces inhibieron el crecimiento micelial y la esporulación sobre F. verticillioides (71%, respectivamente); los extractos metanólicos de ramas, tallo y raíz inhibieron el crecimiento micelial y la esporulación de Aspergillus flavus en un 90% (Cruz-Rodríguez et al., 2017). De lo anterior, para el manejo de F. verticillioides en el cultivo de Zea mays, se reporta la presencia de ácido cafeico, ácido gálico y el alcaloide pirrolizidínico (AP) monocrotalina, como los compuestos con mayor abundancia del extracto crudo de ramas de C. longirostrata, como los posibles responsables de la acción fungistática, los cuales generaron una disminución en la incidencia y severidad del 11 y 30%, respectivamente (Cruz-Rodríguez et al., 2020). Se ha demostrado el control de Meloidogyne incognita y M. arenaria en el cultivo de tomate bajo invernadero, mediante el manejo de residuos en suelo de C. longirostrata del 2% (p/p); obteniendo una disminución del daño en un 71% (Del Prado-Vera et al., 2018).
Se ha identificado que el género Crotalaria muestra contenidos elevados de APs como la monocrotalina, que inhibe las proteasas de los herbívoros generalistas asociados con los cultivos agrícolas. Así mismo, dichos APs hacen que las plantas de Crotalaria sean atrayentes de enemigos naturales de insectos como Chrysoperla externa, Doru luteipes, Nephila clavipes, Orius insidiosus y Trichogramma papilionis (Rech et al., 2022).
Hasta el momento no existe evidencia del efecto insecticida de C. longirostrata, sin embargo, en otras especies del género Crotalaria se ha demostrado este efecto insecticida, como con C. retusa para el control de Callosobruchus maculatus con la cual se obtuvo una mortalidad de hasta el 54% y la reducción del 62% de emergencia de adultos (Obembe & Kayode, 2013). Las semillas de C. pallida se han empleado para la elaboración del extracto de diclorometano; el cual desencadenó un efecto insecticida sobre pupas y larvas de Drosophila melanogaster con una CL50 de 7,95 ppm de usamarina y 156,47 ppm, respectivamente (Peñaloza & Peláez, 2014). El estigmasterol extraído de semillas de C. juncea presentó efecto insecticida sobre pupas de D. melanogaster a una concentración de CL50 de 178,8 ppm (Peñaloza & Peláez, 2017). Por lo anterior, el objetivo de la investigación fue identificar los compuestos del extracto metanólico crudo de hojas de C. longirostrata, así como evaluar su actividad biológica sobre ninfas de B. cockerelli.
2. Materiales y métodos
Colonia de Bactericera cockerelli
El insecto fue obtenido en 2018 de zonas de cultivo de papa y tomate en Nuevo León y Coahuila.
El mantenimiento y desarrollo de la colonia se ha llevado a cabo en jaulas entomológicas con plantas de tomate variedad Río Grande, con un fotoperiodo de 14:10 h (Luz/Oscuridad) a 22 °C en el invernadero del departamento de parasitología agrícola, de la Universidad Autónoma Agraria Antonio Narro (Roque-Enríquez et al., 2021).
Muestreo y obtención de extracto de Crotalaria longirostrata
El muestreo fue realizado según lo descrito por Miranda-Granados et al. (2018, con modificaciones), la colecta se llevó a cabo en el municipio de Chiapa de Corzo, Chiapas, México. Se recolectaron tallos con hojas y se trasladaron en bolsas de papel. Posteriormente se eligieron únicamente hojas (con foliolos elíptico-obovados y cara adaxial sin puntos glandulares) para secarlas a la sombra por siete días, después se pulverizaron en una licuadora (Waring Commercial, modelo 7011s), se sometió a maceración en metanol al 96% (Meyer, CDMex, México) durante 30 días (0,2 g de materia seca/ mL de solvente). Después se filtró con ayuda de una bomba de vacío y papel Whatman N° 1, se almacenó el extracto crudo en un frasco ámbar a 4 °C hasta su uso.
Análisis de Cromatografía de Gases acoplada a Espectrometría de Masas (GC-MS)
Se llevó a cabo en el laboratorio de Biogeoquímica (UBIPRO) de la Universidad Nacional Autónoma de México, Iztacala, México. Los metabolitos presentes en el extracto de hojas de C. longirostrata se identificaron en un cromatógrafo de gases modelo 6850 (Agilent Technologies, USA) empleando una columna HP-5MS (Agilent) con longitud de 30 m x 250 mm de diámetro interno y una película de 0,25 µm; el horno se programó a una temperatura de 150 °C por 2 minutos, enseguida se incrementó 10 °C/min hasta 300 °C por 4 minutos, en la fase móvil se utilizó Helio (flujo 1 mL/min). El detector de espectrometría de masas 5975C (Agilent Technologies, USA) se acondiciono a un barrido completo en un rango de masas de 35 a 400 m/z, a una ionización de 70 eV, con temperatura de la fuente de ionización de 230 °C y temperatura del cuadrupolo 150 °C. La tipificación de los compuestos se estableció con base en los espectros generados, usando la base de datos del Instituto Nacional de Estándares y Tecnología (por sus siglas en inglés, NIST versión 08 MS).
Densidad relativa
Esta determinación fue realizada según lo descrito por Solihah et al. (2018, con modificaciones), a partir del extracto metanólico de hojas de C. longirostrata con un picnómetro Gay-Lussac de 25 ml (Brand 16038, Alemania) a 24 °C. Se calculó la densidad del extracto mediante la fórmula:
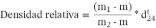
Donde, m es la masa del picnómetro vacío (g), m1 la masa del picnómetro con la muestra de ensayo (g), m2 masa del picnómetro con agua (g) y 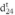 es la densidad del agua a 24 °C (0,997299 g/cm3). Los resultados se expresaron en mg/mL. Se ha reportado la perdida de acción biológica al fraccionar el extracto de C. longirostrata (Cruz-Rodríguez et al., 2020); debido a dicho antecedente, en este estudio se optó por trabajar el extracto crudo sin fraccionar y la preparación de las concentraciones se empleó como base el porcentaje de abundancia del compuesto 1β,2β-epoxy-1α-metoximetil-8α-pirrolizidina obtenido del análisis de GC-MS.
es la densidad del agua a 24 °C (0,997299 g/cm3). Los resultados se expresaron en mg/mL. Se ha reportado la perdida de acción biológica al fraccionar el extracto de C. longirostrata (Cruz-Rodríguez et al., 2020); debido a dicho antecedente, en este estudio se optó por trabajar el extracto crudo sin fraccionar y la preparación de las concentraciones se empleó como base el porcentaje de abundancia del compuesto 1β,2β-epoxy-1α-metoximetil-8α-pirrolizidina obtenido del análisis de GC-MS.
Bioensayo
Empleando el calculó de las concentraciones del alcaloide pirrolizidínico 1β,2β-epoxy-1α-metoximetil-8α-pirrolizidi-na, se estableció una ventana de respuesta biológica con las concentraciones de 10, 20, 40, 60, 80 y 100 mg/mL, un testigo absoluto con agua destilada estéril. Se empleó el método de prueba de susceptibilidad número 032 versión 1 del Comité de Acción de Resistencia a Insecticidas (IRAC, 2014) con modificaciones. A partir de la ventana biológica se prepararon siete tratamientos a 2, 4, 8, 12, 16, 20 y 30 mg/mL para posteriormente sumergir en ellos las hojas de tomate variedad Río Grande en cada tratamiento con 11 ninfas del 3ro y 4to instar de B. cockerelli durante 5 segundos, así como en agua destilada como testigo absoluto; las hojas se dejaron secar y posteriormente se colocaron dentro de cajas Petri con papel filtro saturado con agua destilada estéril. Considerando cada hoja infestada como una unidad experimental. El ensayo se mantuvo a una temperatura de 23 °C con un fotoperiodo de 14:10 h (luz/oscuridad). La evaluación de la mortalidad se realizó cada 24 h posteriores a la aplicación del extracto. Se utilizó un microscopio estereoscópico (Carl Zeiss Stemi DV4) para registrar el número de ninfas muertas, comprobando con ayuda de un pincel la respuesta de algún movimiento coordinado del insecto.
Análisis de datos
Los resultados se expresaron como porcentaje de mortalidad y se corrigió la mortalidad empleando la fórmula de Abbott (Abbott, 1925). El análisis Probit se efectuó con la mortalidad corregida para curva de concentración-mortalidad. Posteriormente los datos fueron sometidos a un análisis de varianza (ANOVA) y las medias se compararon a través de la prueba de Tukey (p = 0,05), bajo un diseño completamente al azar, mediante el programa estadístico SAS versión 9.0.
3. Resultados y discusión
El análisis cromatográfico (GC-MS) demostró la presencia de 25 metabolitos secundarios, en la Tabla 1 se observa el alcaloide pirrilozidinico 1β,2β-epoxy-1α-metoximetil-8α-pirrolizidina con mayor abundancia (10,2 %) presente en el extracto metanólico de hojas de C. longirostrata.
Tabla 3
Efecto del extracto metanólico de C. longirostrata sobre el porcentaje de mortalidad de ninfas de B. cockerelli
Tratamientos (mg/mL) | Horas posteriores a la aplicación |
24 | 48 | 72 |
Testigo | 0 ± 0d | 0 ± 0d | 0 ± 0d |
2 | 2,5 ± 5d | 4,8 ± 5,52d | 24,1 ± 18,26c |
4 | 26,8 ± 12,48c | 50,9 ± 15,08c | 75,2 ± 17,58b |
8 | 36,6 ± 12,47c | 73,2 ± 20,55b | 95,2 ± 5,52ab |
12 | 70,7 ± 8,28b | 90,2 ± 0,45ab | 100 ± 0a |
16 | 92,7 ± 4,87ª | 100 ± 0a | 100 ± 0a |
20 | 82,9 ± 9,46ab | 95,2 ± 5,52ab | 100 ± 0a |
30 | 97,5 ± 5ª | 100 ± 0a | 100 ± 0a |
p-valor | 0,0001 | 0,0001 | 0,0001 |
* Medias con la misma letra en cada columna no son estadísticamente diferentes (Tukey; p < 0,05).
Tabla 4
Concentraciones letales y limites fiduciales del extracto metanólico de C. longirostrata sobre ninfas de B. cockerelli
Concentración Letal | Limites fiduciales (95 %) | Ecuación de predicción | Coeficiente de correlación |
LFI-LFS |
CL50 4,78 | 3,52 - 6,05 | Y=-2,3180x + 3,4102 | 0,623 |
CL95 14,52 | 10,83 - 23,76 | | |
CL: Concentración Letal (en mg/mL); LFI: Limite Fiducial Inferior; LFS: Límite Fiducial Superior.
Asimismo, en larvas de Heliothis virescens se logró un efecto insecticida suministrando una dieta con hojas de C. pallida con una concentración de 1,29x10-3 μg AP/mg de hoja (Cogni & Trigo, 2016). La especie Jacobaea vulgaris (Asteraceae) presenta APs (senecionina, senkirkine y retrorsina) que inhibieron la supervivencia en ninfas de Frankliniella occidentalis del 40 al 100% con la concentración de 50 ppm y monocrotalina hasta el 80% (Macel et al., 2005). Liu et al. (2017) reportan la mortalidad de larvas del segundo estadio de F. occidentalis por el metabolito jacobina obtenida de la planta J. vulgaris a una concentración de 2,45 ppm.
Este efecto insecticida probablemente se deba a que los alcaloides de manera general afectan en el insecto las conexiones nerviosas, alteraciones de la membrana celular y cambios en el citoesqueleto; los AP interactúan con los microorganismos del tracto digestivo debido a la alcalinidad del intestino del insecto, generando una toxicidad y una actividad sinérgica con algunas enzimas como la P450 (Fürstenberg-Hägg et al., 2013; Tlak Gajger & Dar, 2021); la inhibición de enzimas de insectos como la trehalasa presente en el intestino delgado (esta enzima genera la energía a través de la hidrólisis del disacárido trehalosa para el crecimiento, síntesis de quitina, metamorfosis y energía para el vuelo del insecto), esta glucosidasa es inhibida en ambos subsitios en el centro catalítico; por lo que los iminoazúcares naturales podrían funcionar como insecticidas o larvicidas (Shukla et al., 2015). De igual manera, se observó la inhibición de la enzima α-glucosidasa del psílido Cacopsylla bidens por los compuestos 1-deoxynojirimycina, N-butyl-deoxyno-jirimycina y N-butyl-deoxygalctonojirimycina (hasta el 90 % a las 24 h) (Ya’kobovitz et al., 2016).
4. Conclusiones
Los resultados demuestran que el extracto metanólico crudo obtenido de las hojas de chipilín contiene AP del grupo de las iminoazúcares (1β,2β-epoxy-1α-metoximetil-8α-pirrolizidina); reportándose como el compuesto de mayor abundancia en el extracto de hojas de chipilín, que ocasionó la mortandad de las ninfas del psílido B. cockerelli. Alcanzando a las 48 h una mortalidad del 73,2-100% en los tratamientos 8, 12, 16, 20 y 30 mg/mL, obteniéndose una CL50 de 4,78 mg/mL y una CL95 de 14,52 mg/mL. Demostrando con esta investigación el potencial como insecticida del extracto de C. longirostrata para ser empleado como un insecticida alternativo en el control de B. cockerelli. Las investigaciones futuras deberían de considerar la evaluación de su eficacia contra diferentes plagas de insectos; así como el posible impacto en el ciclo de desarrollo de la plaga objetivo y su efecto con las enfermedades trasmitidas por el insecto.
Declaración de intereses
Los autores declaran que no tienen intereses en conflicto.
Agradecimientos
Al Consejo Nacional de Ciencia y Tecnología (CONACyT) por la beca otorgada para la realización del Posgrado a Henry López. Así como al apoyo del Proyecto 1048 del programa Cátedras CONACyT.
ORCID
H. López López https://orcid.org/0000-0003-1551-3055
M. Beltrán Beache https://orcid.org/0000-0002-3109-9360
Y. M. Ochoa Fuentes https://orcid.org/0000-0001-7859-8434
E. Castro del Ángel https://orcid.org/0000-0002-5534-1262
E. Cerna Chávez https://orcid.org/0000-0003-2263-4322
J. C. Delgado Ortiz https://orcid.org/0000-0003-4899-9995
Referencias bibliográficas
Abbott, W. S. (1925). A method of computing the effectiveness of an insecticide. Journal of Economic Entomology, 18(2), 265–267.
Ali, A., Javaid, A., & Shoaib, A. (2017). GC-MS analysis and antifungal activity of methanolic root extract of Chenopodium album against Sclerotium rolfsii. Planta Daninha, 35, 1–8.
Ara, I., Shinwari, M. M. A., Rashed, S. A., & Bakir, M. A. (2013). Evaluation of Antimicrobial Properties of Two Different Extracts of Juglans regia Tree Bark and Search for Their Compounds Using Gas Chromatography-Mass Spectrum. International Journal of Biology, 5(2), 92–102.
Barrios-Díaz, B., Arellano-Fuentes, M. E., Vázquez-Huerta, G., Barrios-Díaz, J. M., Berdeja-Arbeu, R., & Hernández-Tapia, M. del R. (2016). Control alternativo de paratrioza (Bactericera cockerelli Sulc.) en chile serrano (Capsicum annuum L.). Entomología mexicana, 3(2014), 146–152.
Banaras, S., Javaid, A., & Khan, I. H. (2020). Potential antifungal constituents of Sonchus oleraceous against Macrophomina phaseolina. International Journal of Agriculture and Biology, 24(5), 1376–1382.
Banaras, S., Javaid, A., & Khan, I. H. (2021). Bioassays Guided Fractionation of Ageratum conyzoides Extract for the Identification of Natural Antifungal Compounds against Macrophomina phaseolina. International Journal of Agriculture and Biology, 25(4), 761–767.
Beltran, B. M., Cerna, C. E., Delgado, O. J. C., & Ochoa, F. Y. M. (2015). Evaluación de la actividad insecticida de Heliopsis longipes (A. Gray) S. F. Blake sobre ninfas de Bactericera cockerelli (Sulc.) (Hemiptera: Triozidae). Investigación y Ciencia, 23(66), 12–15.
Carmo-Sousa, M., Garcia, R. B., Wulff, N. A., Fereres, A., & Miranda, M. P. (2020). Drench application of systemic insecticides disrupts probing behavior of diaphorina citri (Hemiptera: Liviidae) and inoculation of candidatus liberibacter asiaticus. Insects, 11(5), 1–12.
Casimiro, D. A., Fechine, J., Dos Santos, P. F., Castello, M. V. S., De Fátima, M., Subrinho, F. L., Braz-Filho, R., & Da Silva, M. S. (2013). Structural elucidation and NMR assignments of a new pyrrolizidine alkaloid from Crotalaria vitellina Ker Gawl. Magnetic Resonance in Chemistry, 51(8), 497–499.
Castañeda-Ramírez, G. S., Torres-Acosta, J. F. de J., Sandoval-Castro, C. A., Borges-Argáez, R., Cáceres-Farfán, M., Mancilla-Montelongo, G., & Mathieu, C. (2019). Bio-guided fractionation to identify Senegalia gaumeri leaf extract compounds with anthelmintic activity against Haemonchus contortus eggs and larvae. Veterinary Parasitology, 270, 13–19.
Cerna, E., Ail, C., Landeros, J., Sanchez, S., Badii, M., Aguirre, L., & Ochoa, Y. (2012). Comparison of toxicity and selectivity of the pest Bactericera cockerelli and its predator Chrysoperla carnea. Agrociencia, 46(8), 783–793.
Cerna, E., Beltrán, M., Ochoa, Y. M., Hernández, O., & Delgado, J. C. (2021). Bactericera cockerelli vector de Candidatus Liberibacter solanacearum, morfometría y haplotipos en poblaciones de México. Revista Mexicana de Ciencias Agrícolas, 26, 81–94.
Chen, T., Mei, N., & Fu, P.P. (2010). Genotoxicity of pyrrolizidine alkaloids. Journal of Applied Toxicology, 30(3), 183–196.
Cogni, R., & Trigo, J. R. (2016). Pyrrolizidine Alkaloids Negatively Affect a Generalist Herbivore Feeding on the Chemically Protected Legume Crotalaria pallida. Neotropical Entomology, 45(3), 252–257.
Cruz-Rodríguez, R. I., Cruz, S. A., Ruiz, L. N., Pérez, V. J. I., Esquinca, A. H. A., & Meza, G. R. (2020). Potential Application of Crotalaria longirostrata Branch Extract to Reduce the Severity of Disease Caused by Fusarium. Agronomy, 10, 1-11.
Cruz-Rodríguez, R. I., Meza, G. R., Rodríguez, M. M. A., Arias, C. C., Mancilla, M. N. A., et al. (2017). Antifungal activity of Crotalaria longirostrata Hook. & Arn. extracts against phytopathogen fungi from maize. Gayana Botanica, 74(1), 167–175.
Dehoux-Baudoin, C., & Génisson, Y. (2019). C-Branched Imino Sugars: Synthesis and Biological Relevance. European Journal of Organic Chemistry, 2019(30), 4765–4777.
Del Prado-Vera, I. C., Franco-Navarro, F., & Godínez-Vidal, D. (2018). Plant Parasitic Nematodes and Management Strategies of Major Crops in Mexico. In S.S. & C.J. (Eds.), Plant Parasitic Nematodes in Sustainable Agriculture of North América. Sustainability in Plant and Crop Protection. Springer International Publishing. Pp. 31–68.
Delgado-Oramas, B. P., González, M. I., Rodríguez, H. M. G., & Pino, P. O. (2020). La resistencia inducida por productos derivados de plantas: alternativa para el manejo de plagas agrícolas. Revista de Protección Vegetal, 35(3), 1–12.
Delgado-Ortiz, J. C., Beltrán-Beache, M., Cerna-Chávez, E., Aguirre-Uribe, L. A., Landero-Flores, J., Rodríguez-Pagaza, Y., & Ochoa-Fuentes, Y. M. (2019). Candidatus Liberibacter solanacearum patógeno vascular de solanáceas: Diagnóstico y control. Revista Especializada en Ciencias Químico-Biológicas, 22, 1–12.
Diaz, G. J. (2015). Toxicosis by plant alkaloids in humans and animals in Colombia. Toxins, 7(12), 5408–5416.
Dreger, M., Stanislawska, M., Krajewska-Patan, A., Mielcarek, S., Mikolajczak, P. L., & Buchwald, W. (2009). Pyrrolizidine alkaloids - chemistry, biosynthesis, pathway, toxicity, safety and perspectives of medicinal usage. Herba Polonica, 55(4), 127–147.
Esposito, A., D’alonzo, D., De Fenza, M., De Gregorio, E., Tamanini, A., et al. (2020). Synthesis and therapeutic applications of iminosugars in cystic fibrosis. International Journal of Molecular Sciences, 21(9), 1-34.
Farag, M., Ahmed, M. H. M., Yousef, H., & Abdel-Rahman, A. A. H. (2011). Repellent and insecticidal activities of Melia azedarach L. against Cotton leafworm, Spodoptera littoralis (Boisd.). Zeitschrift fur Naturforschung - Section C Journal of Biosciences, 66 C(3–4), 129–135.
Farag, S. M., Essa, E. E., Alharbi, S. A., Alfarraj, S., & Abu El-Hassan, G. M. M. (2021). Agro-waste derived compounds (flax and black seed peels): Toxicological effect against the West Nile virus vector, Culex pipiens L. with special reference to GC–MS analysis. Saudi Journal of Biological Sciences, 28(9), 5261–5267.
Fletcher, M. T., McKenzie, R. A., Blaney, B. J., & Reichmann, K. G. (2009). Pyrrolizidine alkaloids in Crotalaria taxa from Northern Australia: Risk to grazing livestock. Journal of Agricultural and Food Chemistry, 57(1), 311–319.
Fürstenberg-Hägg, J., Zagrobelny, M., & Bak, S. (2013). Plant defense against insect herbivores. International Journal of Molecular Sciences, 14(5), 10242–10297.
Gutiérrez-Ramírez, J. A., Betancourt-Galindo, R., Aguirre-Uribe, L. A., Cerna-Chávez, E., Sandoval-Rangel, A., et al. (2021). Insecticidal Effect of Zinc Oxide and Titanium Dioxide Nanoparticles against Bactericera cockerelli Sulc. (Hemiptera: Triozidae) on Tomato Solanum lycopersicum. Agronomy, 11(8), 1-20.
Hartmann, T., Theuring, C., Beuerle, T., Ernst, L., Singer, M. S., & Bernays, E. A. (2004). Acquired and partially de novo synthesized pyrrolizidine alkaloids in two polyphagous arctiids and the alkaloid profiles of their larval food-plants. Journal of Chemical Ecology, 30(2), 229–254.
IRAC. (2014). susceptibility test method 032. Insecticide Resistance Action Committee.
Jiang, H., Wang, J., Song, L., Cao, X., Yao, X., Tang, F., & Yue, Y. (2018). Chemical composition of an insecticidal extract from Robinia pseudacacia L. seeds and it’s efficacy against aphids in oilseed rape. Crop Protection, 104, 1–6.
Jiménez, A. D. M., & Grusak, M. A. (2015). Evaluation of Minerals, Phytochemical Compounds and Antioxidant Activity of Mexican, Central American, and African Green Leafy Vegetables. Plant Foods for Human Nutrition, 70(4), 357–364.
Joshi, T., Pandey, S. C., Maiti, P., Tripathi, M., Paliwal, A., Nand, M., Sharma, P., Samant, M., Pande, V., & Chandra, S. (2021). Antimicrobial activity of methanolic extracts of Vernonia cinerea against Xanthomonas oryzae and identification of their compounds using in silico techniques. PLoS ONE, 16(6), 1–15.
Kolomiiets, Y. V., Grygoryuk, I. P., Butsenko, L. M., & Kalinichenko, A. V. (2019). Biotechnological control methods against phytopathogenic bacteria in Tomatoes. Applied Ecology and Environmental Research, 17(2), 3215–3230.
Lawal, O., Opoku, A., & Ogunwande, I. (2015). Phytoconstituents and Insecticidal Activity of Different Solvent Leaf Extracts of Chromolaena odorata L., against Sitophilus zeamais (Coleoptera: Curculionidae). European Journal of Medicinal Plants, 5(3), 237–247.
Liu, X., Klinkhamer, P. G. L., & Vrieling, K. (2017). The effect of structurally related metabolites on insect herbivores: A case study on pyrrolizidine alkaloids and western flower thrips. Phytochemistry, 138, 93–103.
Lozano, G. J., Salas, L. K. Y., Lara, H. A., España, L. M. P., Balleza, C. J., & Hernández, M. C. A. (2018). Bactericera cockerelli Sulc. 1909 (Hemiptera: Triozidae) en doce cultivares de chile en acolchados de color verde y gris- plata, en Morelos, Zacatecas, México. Entomología Agrícola, 5, 419–423.
Macel, M., Bruinsma, M., Dijkstra, S. M., Ooijendijk, T., Niemeyer, H. M., & Klinkhamer, P. G. L. (2005). Differences in effects of pyrrolizidine alkaloids on five generalist insect herbivore species. Journal of Chemical Ecology, 31(7), 1493–1508.
Mala, R., Celsia, R. A. S., Devi, M. S., & Geerthika, S. (2017). Comparison on bactericidal and cytotoxic effect of silver na-noparticles synthesized by different methods. IOP Conference Series: Materials Science and Engineering, 225, 1–11.
Mateos-Maces, L., Chávez-Servia, J. L., Vera-Guzmán, A. M., Aquino-Bolaños, E. N., Alba-Jiménez, J. E., & Villagómez-González, B. B. (2020). Edible Leafy Plants from Mexico as Sources of Antioxidant Compounds, and Their Nutritional, Nutraceutical and Antimicrobial Potential: A Review. Antioxidants, 9(541), 1–24.
Miranda-Granados, J., Chacón, C., Ruiz-Lau, N., Vargas-Díaz, M. E., Zepeda, L. G., et al. (2018). Alternative use of extracts of Chipilín leaves (Crotalaria longirostrata Hook. & Arn) as antimicrobial. Sustainability, 10(3), 1-7.
Mutale-joan, C., Redouane, B., Najib, E., Yassine, K., Lyamlouli, K., Laila, S., Zeroual, Y., & Hicham, E. A. (2020). Screening of microalgae liquid extracts for their bio stimulant properties on plant growth, nutrient uptake and metabolite profile of Solanum lycopersicum L. Scientific Reports, 10(1), 1–12.
Obembe, O. M., & Kayode, J. (2013). Insecticidal activity of the aqueous extracts of four under-utilized tropical plants as protectant of cowpea seeds from Callosobruchus maculatus infestation. Pakistan Journal of Biological Sciences, 16(4), 175–179.
Okonkwo, C. O., & Moses, S. E. (2017). Insecticidal Potentials and Chemical Composition of Ethanol Extracts from the Leaves of Acanthus montanus on Selected Insect Pests. Journal of Chemical and Pharmaceutical Research, 9(10), 111–116.
Páez-León, S., Carrillo-Morales, M., Gómez-Rodríguez, O., López-Guillén, G., Castañeda-Ramírez, G., Hernández-Núñez, E., Aguilar-Marcelino, L. (2022). Nematicidal activity of leaf extract of Moringa oleifera Lam. against Haemonchus contortus and Nacobbus aberrans. Journal of Helminthology, 96, E13.
Peñaloza, A. G. C., & Peláez, J. C. A. (2014). Evaluación de la actividad biológica de extractos de semillas de Crotalaria pallida (cascabelito) sobre el modelo Drosophila melanogaster. Revista Cubana de Plantas Medicinales, 19(3), 144–153.
Peñaloza, A. G. C., & Peláez, J. C. A. (2017). Aislamiento del estigmasterol de las semillas de Crotalaria juncea L. (cascabelito) y su bioactividad sobre Drosophila melanogaster. Revista Cubana de Plantas Medicinales, 22(3). 1-10.
Prada, F., Stashenko, E. E., & Martínez, J. R. (2020). LC/MS study of the diversity and distribution of pyrrolizidine alkaloids in Crotalaria species growing in Colombia. Journal of Separation Science, 43(23), 4322–4337.
Rafiq, M., Javaid, A., & Shoaib, A. (2021). Antifungal activity of methanolic leaf extract of Carthamus oxycantha against Rhizoctonia solani. Pakistan Journal of Botany, 53(3), 1133–1139.
Ramesh, N. G. (2020). Iminosugars. In Carbohydrates in Drug Discovery and Development Elsevier Inc. Pp. 331–381.
Ravi, R., Husna Zulkrnin, N. S., Rozhan, N. N., Nik Yusoff, N. R., Mat Rasat, M. S., et al. (2018). Evaluation of Two Different Solvents for Azolla pinnata Extracts on Chemical Compositions and Larvicidal Activity against Aedes albopictus (Diptera: Culicidae). Journal of Chemistry, 2018, 1–8.
Rech, C., Ribeiro, L. P., Bento, J. M. S., Pott, C. A., & Nardi, C. (2022). Monocrotaline presence in the Crotalaria (Fabaceae) plant genus and its influence on arthropods in agroecosystems. Brazilian Journal of Biology, 84, 1–14.
Rivera-Martínez, R., Ramírez-Dávila, J. F., & Acosta-Guadarrama, A. D. (2018). Distribución espacial de las poblaciones de huevos de Bactericera cockerelli Sulc. en el cultivo de tomate de cáscara (Physalis ixocarpa Brot.). Acta Universitaria, 28(5), 24–33.
Robinson, B., & Gummow, B. (2015). A field investigation into a suspected outbreak of pyrrolizidine alkaloid toxicosis in horses in western Queensland. Preventive Veterinary Medicine, 118(4), 378–386.
Roque-Enríquez, A., Delgado-Ortiz, J.C., Beltrán-Beache, M., Ochoa-Fuentes, Y.M., & Cerna-Chávez, E. (2021). Parámetros agronómicos del tomate (Solanum lycopersicum L.) inoculado con “Candidatus Liberibacter solanacearum” y tratados con fosfitos. Ecosistemas y Recursos Agropecuarios, 8(1), e2552.
Romeh, A.A. (2013). Phytochemicals from Ficus sycomorus L. leaves act as insecticides and acaricides. African Journal of Agricultural Research, 8(27), 3571–3579.
Rovira, D., Alfaro, C., Martínez, V., & Menjívar, I. (2019). Respiration rate and shelf-life study of Crotalaria longirostrata (chipilín). Journal of Food Measurement and Characterization, 13(4), 3025–3032.
Schramm, S., Köhler, N., & Rozhon, W. (2019). Pyrrolizidine alkaloids: Biosynthesis, biological activities and occurrence in crop plants. Molecules, 24(3), 1-44.
Sedivy, C., Dorn, S., Widmer, A., & Müller, A. (2013). Host range evolution in a selected group of osmiine bees (Hymenoptera: Megachilidae): the Boraginaceae-Fabaceae paradox. Biological Journal of the Linnean Society, 108(2), 349–360.
Solihah, I., Mardiyanto, M., Fertilita, S., Herlina, H., & Charmila, O. (2018). The Standardization of Ethanolic Extract of Tahongai Leaves (Kleinhovia hospita L.). Science and Technology Indonesia, 3(1), 14–18.
Shukla, E., Thorat, L. J., Nath, B. B., & Gaikwad, S. M. (2015). Insect trehalase: Physiological significance and potential applications. Glycobiology, 25(4), 357–367.
Sumner, K. J. C., Highet, F., Arnsdorf, Y. M., Back, E., Carnegie, M., Madden, S., et al. (2020). ‘Candidatus Liberibacter solanacearum’ distribution and diversity in Scotland and the characterisation of novel haplotypes from Craspedolepta spp. (Psyllidae: Aphalaridae). Scientific Reports, 10(1), 1–12.
Tamburino, R., Sannino, L., Cafasso, D., Cantarella, C., Orrù, L., Cardi, T., et al. (2020). Cultivated Tomato (Solanum lycopersicum L.) Suffered a Severe Cytoplasmic Bottleneck during Domestication: Implications from Chloroplast Genomes. Plants, 9, 1-15.
Tay, Z. H., & Chong, K. P. (2016). The potential of papaya leaf extract in controlling Ganoderma boninense. IOP Conference Series: Earth and Environmental Science, 36, 1–7.
Tlak Gajger, I., & Dar, S. A. (2021). Plant allelochemicals as sources of insecticides. Insects, 12(3), 1-21.
Tucuch-Haas, I. J., Silva-Aguayo, G., & Rodríguez-Maciel, C. J. (2020). Oviposition of Bactericera cockerelli (Sulc) (Hemiptera: Triozidae) on Capsicum chinense (Jacq) treated with spiromesifen or spirotetramat. Revista Fitotecnia Mexicana, 43(3), 317–323.
Tucuch-Haas, J. I., Rodríguez-Maciel, C. J., Lagunes-Tejeda, Á., Silva-Aguayo, G., Aguilar-Medel, S., Robles-Bermudez, A., & González-Camacho, J. M. (2010). Toxicidad de spiromesifen en los estados biológicos de Bactericera cockerelli (Sulc) (Hemiptera: Triozidae). Neotropical Entomology, 39(3), 436–440.
Vereijssen, J., Smith, G. R., & Weintraub, P. G. (2018). Bactericera cockerelli (Hemiptera: Triozidae) and Candidatus liberibacter solanacearum in potatoes in New Zealand: Biology, transmission, and implications for management. Journal of Integrated Pest Management, 9(1), 1–21.
Ya’kobovitz, M. K., Butters, T. D., & Cohen, E. (2016). Inhibition of α-glucosidase activity by N-deoxynojirimycin analogs in several insect phloem sap feeders. Insect Science, 23(1), 59–67.
Zhu, G., Wang, S., Huang, Z., Zhang, S., Liao, Q., Zhang, C., et al. (2018). Rewiring of the Fruit Metabolome in Tomato Breeding. Cell, 172(1–2), 249-261.e12.
es la densidad del agua a 24 °C (0,997299 g/cm3). Los resultados se expresaron en mg/mL. Se ha reportado la perdida de acción biológica al fraccionar el extracto de C. longirostrata (Cruz-Rodríguez et al., 2020); debido a dicho antecedente, en este estudio se optó por trabajar el extracto crudo sin fraccionar y la preparación de las concentraciones se empleó como base el porcentaje de abundancia del compuesto 1β,2β-epoxy-1α-metoximetil-8α-pirrolizidina obtenido del análisis de GC-MS.