REPTILES Y MAMÍFEROS DE UN SECTOR DE LA QUEBRADA EL GALLO (VALPARAÍSO - CHILE): UN ACERCAMIENTO A LA HIPÓTESIS DE PARTICIÓN DE CLAROS A PEQUEÑA ESCALA
REPTILES AND MAMMALS FROM A SECTOR OF EL GALLO STREAM (VALPARAISO- CHILE): AN APPROACH TO THE HYPOTHESIS OF SMALL-SCALE GAP PARTITIONING
César Chávez-Villavicencio 1,2,*, Elier Tabilo-Valdivieso 1,2
1 Universidad Católica del Norte. Universidad La Serena. Programa de doctorado en Biología y Ecología Aplicada. Coquimbo, Chile.
2 Centro Neotropical de Entrenamiento en Humedales. Coquimbo, Chile.
César Chávez-Villavicencio:
Artículo original
Recibido: 8 de noviembre de 2022
Aceptado: 10 de enero de 2023
Resumen
Los claros (0,1 - 10 ha) son perturbaciones a pequeña escala que influyen en la estructura y biodiversidad del bosque. Las altas densidades de vástagos en los claros son la razón de la alta diversidad (hipótesis de claros de Denslow). Estudios con flora probaron o refutaron esta hipótesis, pero, se desconoce la relación con fauna silvestre. Por lo tanto, se puso a prueba esta hipótesis usando reptiles y mamíferos como modelo de estudio. El objetivo fue comparar las riquezas y abundancias entre un claro y bosque con cobertura, en la quebrada el Gallo. Los datos se tomaron por observación directa y trampas Sherman (febrero - noviembre 2016), en tres polígonos de 12 ha cada uno. Dos con cobertura y uno con un claro producido por deslizamiento rocoso. Se analizó el índice de similitud de Chao-Jaccard y una prueba de comparaciones múltiples de Tukey, para determinar las diferencias entre polígonos. La similitud de reptiles fue 100% entre los tres polígonos y no hubo diferencias en las riquezas. La similitud de mamíferos entre los polígonos 1 y 2 fue 100%; 1 y 3, 83% y; 2 y 3, 97%. El polígono 3 presentó mayor riqueza que el polígono 2 y fue similar al polígono 1. La abundancia acumulada de reptiles probó la hipótesis de Denslow, mientras que la riqueza no. En mamíferos, tanto la abundancia acumulada como el promedio de la riqueza de especies, probaron la hipótesis. La fauna responde de manera similar a la vegetación en los procesos de claros.
Palabras clave: Beilschmiedia miersii, Cordillera el Melón, Hipótesis de Denslow, Manejo forestal, Tukey
Abstract
Gaps (0.1 - 10 ha) are small-scale disturbances that influence forest structure and biodiversity. High stem densities in gaps are the reason for high diversity (Denslow's gap hypothesis). Studies with flora proved or refuted this hypothesis, but the relationship with wildlife is unknown. Therefore, the hypothesis was tested using reptiles and mammals as a study model. The objective was to compare the richness and abundance between a gap and covered forest in the El Gallo stream. Data were collected by direct observation and Sherman traps (February - November 2016), in three polygons of 12 ha each. Two with cover and one the gap produced by rocky landslide. The Chao-Jaccard similarity index and a Tukey's multiple comparisons test were analyzed to determine differences between polygons. Reptile similarity was 100% among the three polygons and there were no differences in richness. The similarity of mammals between polygons 1 and 2 was 100%; 1 and 3, 83% and; 2 and 3, 97%. Polygon 3 had higher richness than polygon 2 and was similar to polygon 1. The cumulative abundance of reptiles supported Denslow's hypothesis, while richness did not. In mammals, both cumulative abundance and average species richness proved the hypothesis. Fauna respond similarly to vegetation in gap processes.
Keywords: Beilschmiedia miersii, Melon Cordillera, Denslow Hypothesis, Forest management, Tukey
* Autor para correspondencia: cchavez@ucn.cl
Citar como:
Chávez-Villavicencio, C., & Tabilo-Valdivieso, E. 2022. Reptiles y mamíferos de un sector de la quebrada el Gallo (Valparaíso- Chile): Un acercamiento a la hipótesis de partición de claros a pequeña escala. REBIOL, 42(2): 223-230.
1. Introducción
Un claro en el dosel del bosque, se define como un área abierta que se forma cuando uno o más árboles se pierden dañados por insectos (enfermedades), tala u otras causas de mortalidad (Araki & Awaya, 2020). Estos claros se consideran como una perturbación a pequeña escala cuando comprenden entre 0,1 y 10 ha (Busing & White, 1997). La dinámica del claro, desde su formación hasta la regeneración de los retoños (tallo nuevo que brota de un árbol o de una planta), influye en la estructura y la biodiversidad del bosque (Nakashizuka & Iida, 1995). Por lo tanto, entender la dinámica del claro es importante para el manejo adaptativo, mientras se monitorea el estado del bosque, se evalúa la biodiversidad o restaura el paisaje (Yamamoto, 2000).
Normalmente, a la apertura de un claro le sigue la regeneración forestal (Marks, 1974), proceso que se trató de explicar con algunas hipótesis, cómo la de partición de claros con base en la regeneración de nichos (Ricklefs, 1977; Denslow, 1980). Esta hipótesis evolucionó hasta situar al tamaño del claro como tema central (Hartshorn, 1978; Whitmore, 1978; 1982; 1988; 1989; Denslow, 1980; Pickett, 1983), convirtiéndose en la hipótesis de partición de claros por tamaño (Busing & White, 1997). Sin embargo, una hipótesis alternativa, que no consideró los argumentos de regeneración de nicho, planteó que el interior de los claros son fuentes importantes de diversidad simplemente porque son los sitios primarios de regeneración (Busing & White, 1997). Denslow (1995) planteó la hipótesis de que las altas densidades de vástagos en los claros son la razón principal de la alta diversidad. Aunque, muchos de los trabajos que probaron o refutaron esta hipótesis, se basaron en regeneración de árboles y flora en general (Huston, 1979; Denslow, 1980; Prentice & Leemans, 1990; Denslow, 1995; Busing & White, 1997, Van Couwenberghe, et al., 2010; Gonzáles et al., 2015), se desconoce la existencia de trabajos que relacionen estas hipótesis con fauna silvestre.
En Chile, también se trató el tema de claros relacionado a aspectos forestales (Armesto & Fuentes, 1988; Donoso, 1993; Gonzáles et al., 2015). Algunos de estos trabajos se realizaron en el sitio prioritario para la conservación Cordillera El Melón (SPCEM. Región de Valparaíso, Chile), donde existe bosque higromórfico y esclerófilo de quebradas, con presencia de belloto del norte (Beilschmiedia miersii (Gay) Kosterm), especie endémica de Chile y fuertemente amenazada (Brito-Rozas & Flores-Toro, 2014).
En el sector sur oeste del SPCEM se ubica la quebrada el Gallo. Esta quebrada, en septiembre de 2011, se vio afectada por un deslizamiento de rocas que generó un claro en la formación de bosque higromórfico y esclerófilo de quebradas. La aparición de este claro se presentó como una oportunidad para documentar un aspecto poco conocido de esta dinámica en relación a la fauna silvestre. Usando el enfoque de Deslow (1980), se planteó como hipótesis que, si los claros proporcionan recursos o condiciones que estimulan la presencia de especies especializadas, la riqueza de reptiles y mamíferos debería ser mayor en el claro que en los sectores de bosque no afectados. Por lo tanto, el objetivo de este trabajo fue comparar las riquezas y abundancias de reptiles y mamíferos en el claro y en los sectores de bosque no afectado de la quebrada el Gallo para comprobar el cumplimiento de la hipótesis de Denslow, (1995) en estos grupos faunísticos.
2. Material y Métodos
Área de estudio
La quebrada El Gallo (800 msnm) se ubica en la Región de Valparaíso (-32,637077°, -71,117067°). Para efectos de este trabajo, el área se dividió en tres polígonos de 12 ha cada uno (Fig. 1). El polígono 1 se ubicó en un sector de la ladera sureste. Las especies representativas fueron Cryptocaya alba, (Molina) Looser; Lithrea caustica, (Molina) Hook. et Arn y Myrceugenia obtusa (Hook. & Arn.) O. Berg. Las especies acompañantes fueron Peumus boldus, Molina; Colliguaja odorífera, Molina y Azara celastrina D. Don. Las especies comunes fueron Sophora mayo, Sm; Aristotelia chilensis (Molina) Stuntz; Escallonia pulverulenta (Ruiz y Pav.) Pers. El grado de cubrimiento de la vegetación fue claro a poco denso, lo que le otorgó una apariencia oscura y cerrada al bosque. La altura de la vegetación varió entre 4 y 8 m. La mayor parte de las copas se sobrepusieron unas con otras. Dadas sus características, el polígono 1 se encontró en un estado de sucesión avanzado no tardío o final. El polígono 2 se ubicó en el sector sur de la ladera de exposición sureste, el eje de la quebrada y el sector sur de la ladera noroeste. Las especies representativas fueron C. alba y L. caustica. Las especies acompañantes fueron P. boldus y M. obtusa. Las especies comunes fueron A. celastrina, A. chilensis y Myrceugenia obtusa (Hook. y Arn.) O. Berg. El grado de cubrimiento de la vegetación fue escaso a poco denso con menores rangos de cubrimiento que el polígono 1. La altura de la vegetación varió entre 4 y 6 m. El estado de sucesión avanzado fue muy similar al polígono 1. El polígono 3 se ubicó al norte del polígono 2, en la ladera de exposición noroeste. Las especies representativas fueron C. alba, P. boldus y L. caustica. Las especies acompañantes fueron A. celastrina, muehlenbeckia hastulata (Sm.) I. M. Johnst y M. obtusa. Las especies comunes fueron A. chilensis, Schinus latifolius, (Gill. ex Lindl.) Engler; Aextoxicon punctatum Ruiz et Pav. y Quillaja saponaria Molina. Este polígono, en septiembre de 2011, fue afectado por el deslizamiento de rocas desde la parte superior, formándose un claro de aproximadamente 10 ha en el bosque. Este deslizamiento generó una configuración inversa respecto a los polígonos 1 y 2. El rango de densidad de las copas fue de escaso a poco denso. El mayor grado de cubrimiento de la superficie fue del tipo herbáceo y el tipo leñoso alto en menor grado. La altura de la vegetación varió entre 2 a 4 m. La vegetación se encontró en un estado de sucesión temprano o intermedio. Predominó la presencia de rocas con diámetros de hasta 10 m.
Colecta de datos
Se realizó entre febrero y noviembre de 2016. El área de estudio se visitó una vez por semana, completando un total de 36 muestreos. Los reptiles se registraron mediante observación y conteo directo sobre 18 transectos establecidos de manera aleatoria todos en dirección norte (Fig. 1). Cada transecto midió 50 m de largo con ancho variable, de acuerdo al acceso y visibilidad que permitió la vegetación (Sutherland, 1996). Los registros se realizaron de 10:00 a 12:00 horas y de 14:00 a 17:00 horas. El registro de mamíferos medianos se realizó sobre los mismos transectos usados para los reptiles. Los mamíferos se registraron usando 80 trampas Sherman, colocadas en pares opuestas, cada 10 m, en una línea de 400 m, en cada polígono (Pearson & Ruggiero 2003), haciendo un total de 240 trampas (Fig. 1). Las trampas permanecieron activas dos noches cada semana. Los individuos capturados se marcaron con corte de pelo para evitar dobles conteos por recapturas. Las trampas se activaron a las 18:00 horas y se revisaron al siguiente día a las 8:00 horas. La captura de mamíferos se realizó con el permiso del Servicio Agrícola y Ganadero mediante Resolución Exenta N° 8781/2017 del 24 de noviembre de 2015.
La abundancia de reptiles y mamíferos fue el valor máximo de las sumatorias de las abundancias en los transectos de cada polígono. El alcance del inventario de reptiles y mamíferos se evaluó con la curva de acumulación de especies fijando como asíntota el índice de Chao1 (Moreno, 2001). La curva de acumulación de especies y el índice de Chao1 se calculó con el paquete BiodiversityR (Team, 2021). Los índices de similitud de Chao-Jaccard (Chao et al. 2005) se calcularon con el programa EstimateS (Colwell, 2005). Finalmente, se realizó una prueba de comparaciones múltiples (contrastes de Tukey) con el programa R (Team, 2021) para analizar las diferencias en los promedios de las riquezas entre los polígonos.
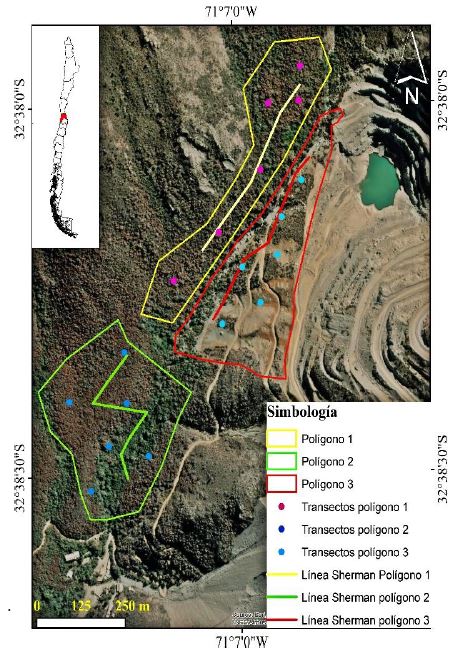
Figura 1. Área de estudio. Los puntos indican el inicio de cada transecto de colecta de datos para reptiles y mamíferos, en dirección norte. Las líneas indican la ubicación de trampas Sherman. Quebrada El Gallo (Valparaíso – Chile).
3. Resultados
Reptiles
Se registró un total de tres especies de reptiles en cada polígono de muestreo. La especie dominante en cada polígono evaluado fue Liolaemus tenuis (Duméril & Bibrion, 1837. Lagartija esbelta), seguida de Liolaemus fuscus (Boulenger, 1933. Lagartija oscura) y Liolaemus monticola (Müller & Hellmich, 1932. Lagartija de los montes). Durante las estaciones de otoño e invierno no se registró L. monticola. El polígono 3 presentó mayor abundancia acumulada de individuos por especie (Fig. 2). Tanto en el polígono 1 como en el polígono 2, los reptiles fueron observados en pequeños claros sobre troncos caídos o piedras, en aparente estado de termorregulación. En el polígono 3 (claro de 10 ha), los reptiles fueron observados sobre las rocas presentes en el área en aparente estado de termorregulación.
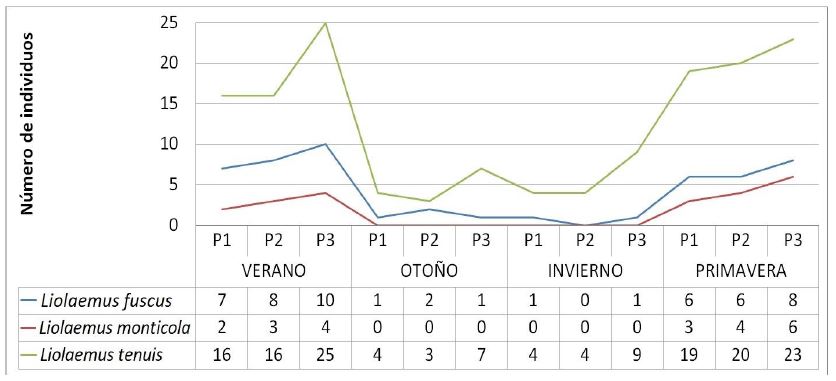
Figura 2. Variación de las abundancias por especie, por polígono (P1, P2, P3) y por estación del año en el área de estudio.
El índice de Chao1 basado en abundancia para el polígono 1, 2 y 3, determinó que el número de especies esperado para cada polígono fue 3 (IC95% 3 – 3). La curva de acumulación de especies (Fig. 3) mostró que la riqueza llegó a su asíntota en cada polígono. Esto significa que el inventario de reptiles, para el periodo de estudio, alcanzó el 100%.
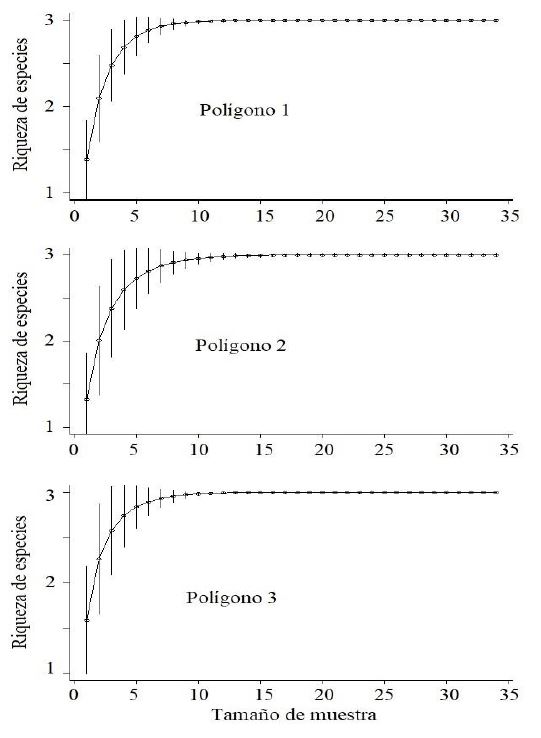
Figura 3. Curvas de acumulación de especies de reptiles para cada polígono del área de estudio.
La similitud calculada con el índice de Chao-Jaccard basado en abundancia fue de 100% entre los tres polígonos. No se encontró diferencias en los promedios de las riquezas de reptiles, entre los polígonos evaluados.
Mamíferos
Se registró un total de siete especies de mamíferos que varió de acuerdo al polígono y la estación del año. El polígono 3 registró las siete especies durante todo el estudio, excepto en invierno cuando registró seis especies. La especie dominante también presentó variaciones, aunque se presentó una tendencia de dominancia de Octodon degus (Molina, 1782. Ratón cola de pincel). El polígono 3 presentó mayor abundancia acumulada de individuos por especie (Fig. 4).
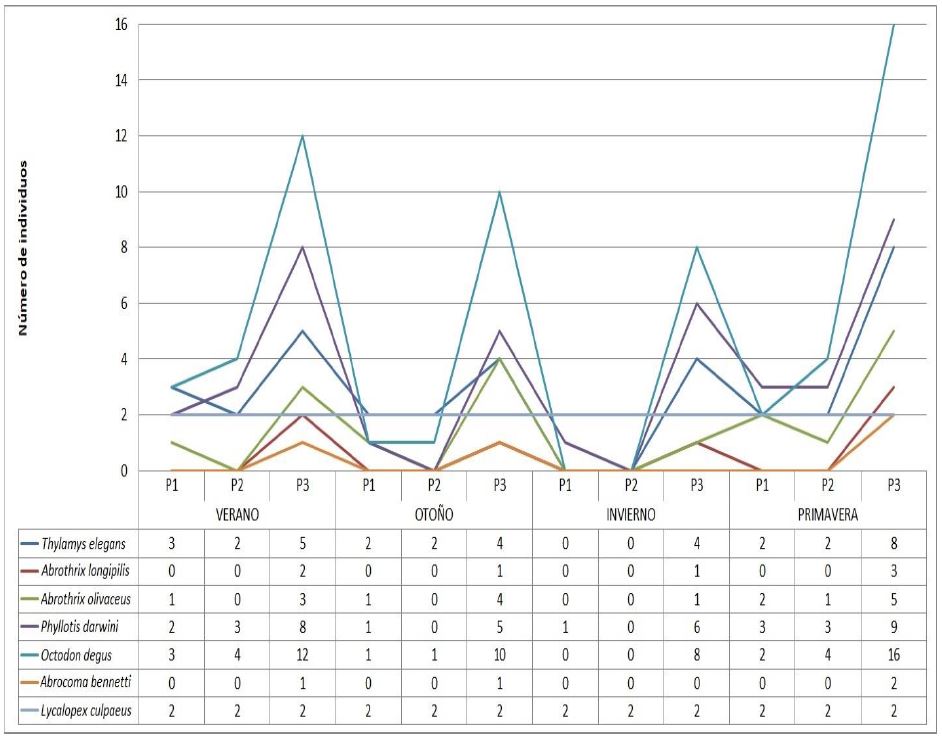
Figura 4. Variación de las abundancias por especie, por polígono (P1, P2, P3) y por estación del año en el área de estudio.
El índice de Chao1 basado en abundancia determinó que el número de especies esperado para el polígono 1 fue 5 (IC95% 4,8 - 5,2), para el polígono 2 también fue 5 (IC95% 3,5 - 5,2) y para el polígono 3 fue 7 (IC95% 6,9 - 7,1). La curva de acumulación de especies (Fig. 5) mostró que las riquezas de especies de los polígonos 1 y 3 alcanzaron su asíntota. El polígono 2 estuvo cerca de alcanzarla. Esto significó que el inventario de mamíferos, para el periodo de estudio, prácticamente alcanzó el 100%.
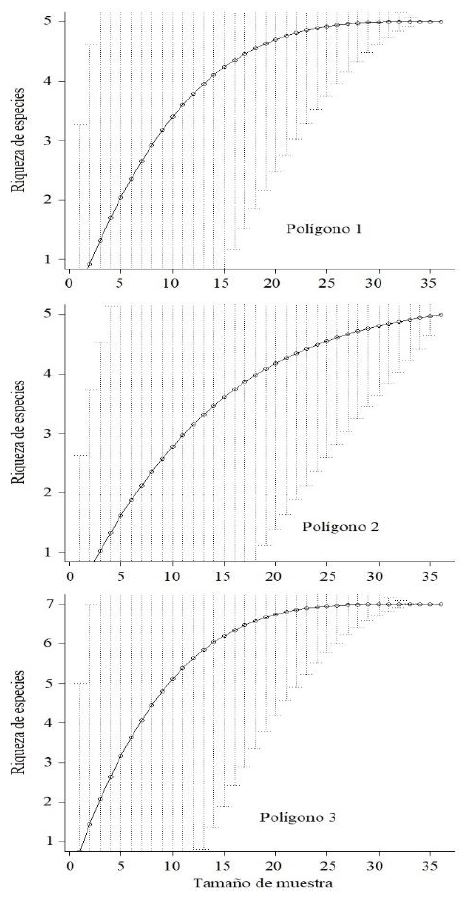
Figura 5. Curvas de acumulación de especies de mamíferos para cada polígono del área de estudio.
La similitud calculada con el índice de Chao-Jaccard basado en abundancia fue de 100% entre los polígonos 1 y 2. El polígono 3 tuvo una similitud de 83% con el polígono 1 y de 97% con el polígono 2. La prueba de comparaciones múltiples determinó que el polígono 3 presentó mayor promedio de riqueza de mamíferos que el polígono 2 y estuvo cerca de tener mayor promedio de riqueza que el polígono 1 (Fig. 6).
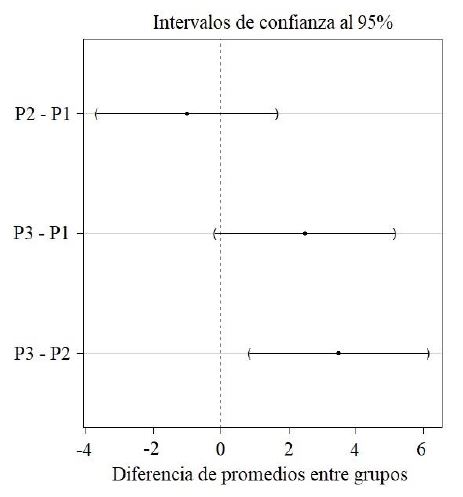
Figura 6. Intervalos de confianza al 95% de la diferencia en los promedios de la riqueza de especies de mamíferos entre los polígonos evaluados. P1=polígono 1. P2=polígono 2. P3=polígono 3.
4. Discusión
El SPCEM recibió atención científica por la presencia del belloto el norte (Beilschmiedia miersii (Gay) Kosterm), especie de árbol endémico de Chile central, vulnerable a la extinción, sobre el cual se estudió su estructura y dinámica (Brito-Rozas & Flores-Toro, 2014). Sin embargo, la fauna de este sitio no recibió la misma atención, los reportes existentes son técnicos, aunque puntualizan que este componente taxonómico estuvo bien estudiado, hacen referencia solo a especies potenciales de reptiles como Liolaemus chiliensis (Lesson, 1830), Liolaemus fuscus, Liolaemus lemniscatus (Gravenhorst, 1838), Liolaemus tenuis y Callopistes maculatus (Núñez & Veloso, 2001); y mamíferos como Thylamys elegans (Waterhouse, 1839), Octodon degus, Abrothrix longipilis (Waterhouse, 1837), Phyllotis darwini (Waterhouse, 1837), Oligoryzomys longicaudatus (Bennett, 1832), Abrothrix olivaceus (Waterhouse, 1837), Spalacopus cyanus (Molina, 1782), Leopardus colocola (Molina, 1782), Galictis cuja (Molina, 1782), Pseudalopex culpaeus (Molina, 1837), Pseudalopex griseus (Gray, 1837) (Mansilla 2007). Por lo tanto, las especies de reptiles y mamíferos reportados en este trabajo, fueron los primeros en darse a conocer en una instancia científica, dejando de ser potenciales para el área de trabajo.
La abundancia acumulada por polígono mostró que el polígono 3 (claro) fue mayor que en los otros polígonos. L. fuscus, L. monticola y L. tenuis fueron especies de reptiles que se registraron en los tres polígonos estudiado sin mostrar diferencias. Incluso L. tenuis, especie descrita como de hábitos arborícolas (Mella, 2017), fue más abundante en el polígono 3, donde fue observada sobre rocas completamente expuestas al sol. Estos resultados dieron una idea del patrón de la abundancia de reptiles respecto de la hipótesis planteada por Deslow (1995), sugiriendo que la abundancia de los reptiles podría responder a un patrón probado en plantas, sin embargo, la riqueza no respondió en favor de la hipótesis.
De las especies de mamíferos registrados en este estudio, seis coincidieron con las especies potenciales de Mansilla (2007). A. longipilis solo se registró en el polígono 3, aunque debería estar presente en el Bosque dado que habita diferentes ambientes como sabanas, matorrales, bosques, rocas y pastizales (Spotorno et al., 2000). Abrocoma bennetti (Waterhouse, 1837), especie que habita en zonas arbustivas (Cortés et al., 1994) no fue considerada para el sitio como especie potencial, sin embargo, se capturó en el polígono 3, donde existió presencia de arbustos de hasta 4 m de altura, lo que explicaría su presencia. Al igual que con el grupo de reptiles, el polígono 3 presentó mayor registro de abundancias acumuladas de mamíferos, sin embargo, la riqueza en este polígono fue mayor en promedio que en el polígono 2. El grupo de mamíferos, también respondió a la hipótesis de Deslow (1995), es decir, que la riqueza de especies, incluso sus abundancias, fue mayor en el gap que en el bosque.
Este trabajo no pretende decir que la destrucción de bosques favorece el incremento de las abundancias o riquezas de reptiles y mamíferos, solo comparte el planteamiento de Schnitzer & Carson (2001) respecto de la apertura de claros en los bosques, es decir, la generación de cambios a nivel de la riqueza de especies. Los resultados conducen a plantearse la pregunta de si las riquezas registradas en el claro (polígono 3), al sucederse la regeneración del bosque, se equipararán con las riquezas del polígono 1 y 2. El monitoreo del área a largo plazo podría responder la pregunta siempre que se determine en cuántos años el bosque alcanzará sus condiciones de clímax.
5. Conclusiones
Sin considerar los argumentos de regeneración de nicho, la abundancia acumulada de reptiles aportó parcialmente a probar la hipótesis de Denslow (1995), mientras que el promedio de la riqueza no respondió como se esperaba. En el caso de los mamíferos, tanto la abundancia acumulada como el promedio de la riqueza de especies, respondieron de acuerdo a la hipótesis de Denslow (1995). Al parecer, la fauna respondió de manera similar a como responde la vegetación cuando se trata de procesos de claros.
6. Agradecimiento
A Anglo American Chile y sus funcionarios por facilitar el acceso al área de estudio.
7. Contribución de los autores
CCHV (1) y ETV (2) la concepción y el diseño del estudio, los registros, fotografías, elaboración de figuras, redacción del borrador del artículo y la revisión crítica del contenido y la aprobación final.
8. Conflicto de intereses
Los autores declaran que no existe conflicto de intereses.
9. Referencias Bibliográficas
Araki., K, & Awaya, Y. (2020). Analysis and prediction of gap dynamics in a secondary deciduous broadleaf forest of central japan using airborne multi-liDAR observations. Remote Sensing 13, 100.
Armesto, J., & Fuentes, E. (1988). Tree species regeneration in a mid-elevation, temperate rain forest in Isla de Chiloe, Chile. Vegetatio 74, 151-159.
Brito-Rozas, E., & Flores-Toro, E. (2014). Estructura y dinámica de los bosques de belloto el norte (Beilschmiedia miersii) de la Cordillera El Melón, comuna de Nogales, región de Valparaíso, Chile. Bosque. 35, 13-21.
Busing, R., & White, P. (1997). Species diversity and small-scale disturbance in an old-growth temperate forest: a consideration of gap partitioning concepts. Oikos 78, 562-568.
Chao, A, Chazdon, A., Colwell, R., & Shen, T. (2005). A new statistical approach for assessing similarity of species composition with incidence and abundance data. Ecology Letters 8, 148–159.
Colwell, R. (2005). EstimateS: Statiscal estimation of species richness and shared species from samples. Version 7.5. Presistent.
Cortés, A., Pino, C., & Rosenmann. M. (1994). Balance hídrico del ensamble de micromamíferos de dos localidades de la región mediterránea árida del norte de Chile central: un estudio de campo. Revista Chilena de Historia Natural, 67,65-77
Denslow, J. (1980). Gap partitioning among tropical rainforest trees. Biotropica, 12: 47-55.
Denslow, J. (1995). Disturbance and diversity in tropical rain forests: the density effect. Ecological Applications 5, 962-968.
Donoso, C. (1993). Bosques templados de Chile y Argentina. Variación, Estructura y Dinámica. Santiago, Chile. Editorial Universitaria. 484 p.
González ME, PJ Donoso, P Szejner. (2015). Tree-fall gaps and patterns of tree recruitment and growth in Andean old-growth forests in south-central Chile. Bosque 36(3): 383-394.
Hartshorn GS. (1978). Tree falls and tropical forest dynamics. En Tomlinson PB, MH Zimmerman eds. Tropical trees as living systems. Cambridge Univ. Press, Cambridge, pp. 617-638.
Mansilla, S. (2007). Línea de base estrategia regional de biodiversidad sitio: “Cordillera el Melón”. Unidad de Protección de Recursos Naturales, CONAMA Región de Valparaíso. Gobierno de Chile.
Mella J. (2017). Guía de Campo de Reptiles de Chile. Tomo 1: Zona Central. Peñaloza A.P.G. (Ed) Santiago, Chile. 320 pp.
Marks PL. (1974). The role of pin cherry (Prunus pensylvancia l.) in the maintenance of stability in northern hardwood ecosystems. Ecological Monographs 44: 73–88.
Moreno C. (2001). Métodos para medir la biodiversidad. M&T –Manuales y Tesis SEA, vol. 1. Zaragoza, España. 83pp.
Nakashizuka, T., & Iida, S. (1995). Composition, dynamics and disturbance regime of temperate deciduous forests in Monsoon Asia. Vegetatio, 121, 23-30.
Pearson, D., & Ruggiero, E. (2003). Transect versus grid trapping arrangements for sampling small-mammal communities. Wildlife Society Bulletin 31(2): 454-459.
Pickett STA. (1983). Differential adaptation of tropical tree species to canopy gaps and its role in community dynamics. Tropical Ecology 24: 68-84.
Ricklefs, R. (1977). Environmental heterogeneity and plant species diversity: a hypothesis. The American Naturalist 111: 376-381.
Sutherland, W. (1996). Ecological Census Techniques a handbook. Cambridge University Press., Great Britain. 336 pp.
Team, R. (2021). R: A language and environment for statistical computing. R Foundation for Statistical Computing, Vienna, Austria. ISBN 3-900051-07-0.
Van Couwenberghea, R., Collet, C., Lacombea, E., Pierrat, J., & Gégouta, J. (2010). Gap partitioning among temperate tree species across a regional soil gradient in windstorm- disturbed forests. Forest Ecology and Management, 260, 146-154.
Whitmore, T. (1978). Gaps in the forest canopy. En Tomlinson PB, MH Zimmerman eds. Tropical trees as living systems. Cambridge Univ. Press, Cambridge, pp. 639-655.
Whitmore, T. (1982). On pattern and process in forests. En Newman EI ed. The plant community as a working mechanism. Blackwell, Oxford, pp. 45-59.
Whitmore, T. (1988). The influence of tree population dynamics on forest species composition. En Davy AJ, MJ Hutchings, AR Watkinson eds. Plant population ecology. Blackwell, Boston, 28, 271-291.
Whitmore, T. (1989). Canopy gaps and the two major groups of forest trees. Ecology 70(3), 536-538.
Yamamoto S. 2000. Forest Gap Dynamics and Tree Regeneration. Journal of Forest Research 5: 223–229.