LICÓFITOS Y HELECHOS EN BOSQUE PRIMARIO Y PLANTACIÓN DE Elaeis guineensis, SHANUSI
LICOPHYTES AND FERNS IN PRIMARY FOREST AND PLANTATION OF Elaeis guineenses, SHANUSI
Freddy Peláez Peláez 1 *, Narda Alarcón Rojas 1, William Zelada Estraver 1, Jorge Torres Delgado 2, Homan Castillo Benites 3, Segundo Vergara Medrano 4, Demetria Martha Mondragón Chaparro 5
1 Facultad de Ciencias Biológicas, Universidad Nacional de Trujillo, Av. Juan Pablo II s/n- Ciudad Universitaria, Trujillo, Perú
2 Centro de Investigación, Gestión y Consultoría S.A.C (CEICA S.A.C) Tarapoto Perú
3 Área de Zoología de Vertebrados, Museo de Zoología Juan Ormeña Rodríguez, Universidad Nacional de Trujillo
4 Universidad Nacional de Jaén, Carretera Jaén-San Ignacio Km 24
5 Instituto Politécnico Nacional. Centro interdisciplinario de investigación para el desarrollo integral regional (CIIDIR) unidad Oaxaca, Calle Hornos N° 1033. Sta. Cruz Xoxocotlán, Oaxaca, México C.P 71230
Artículo original
Recibido: 24 de octubre 2022
Aceptado: 5 enero 2023
Resumen
Con el objetivo de determinar la composición de licófitos y helechos en bosque primario y en plantación de Elaeis guineensis “palma aceitera”, comparando la riqueza y formas de vida en los dos ecosistemas, se realizaron dos salidas de campo, en enero y julio del 2022, seleccionando 6 zonas de muestreo, 5 ubicadas en bosque primario y 1 en plantación, para esta última, se eligió la parcela con mayor cobertura vegetal y presencia de epífitos en el estípite de “palma aceitera”. Se evaluaron transectos en faja, siguiendo 5 trochas de 200 m de largo y 5 m de ancho, que permitió realizar el inventario y la colecta de ejemplares, los cuáles fueron trasladados al HUT, para su respetiva determinación. Se registraron 47 especies de helechos y 3 licófitos, reunidas en 16 familias y 32 géneros. Las familias Pteridaceae y Dryopteridaceae fueron las más representativas tanto en géneros como en especies. La zona de bosque albergó 42 especies y la zona de plantación 13 especies, (cinco especies habitan tanto en el área de plantación como de bosque). En la zona de plantación, por presentar una baja riqueza, se diferenció claramente de los puntos ubicados en la zona de bosque, en donde el punto Cainarachi se desemparejó de los demás, debido al fenómeno de decaimiento de la semejanza florística por distanciamiento. Las especies Adiantum macrophyllum, A. pulverulentum, A. tetraphyllum, A. tomentosum, Asplenium serratum, Pelazoneuron abruptum var. grande, Lomariopsis fendlerii y Tectaria incisa presentaron amplia distribución (PC de 66,7%). Esto permite concluir que la riqueza en la zona de Shanusi es baja en comparación con otras zonas similares de la región, además, la zona de bosque albergó a la mayoría de las especies donde predominaron las formas de vida terrestre, mientras que, en la zona de plantación la mayoría fueron epífitas.
Palabras clave: Shanusi, licófitos y helechos, Elaeis guineensis
Abstract
In order to determine the composition of lycophytes and ferns in primary forest and in plantations of Elaeis guineensis "oil palm", comparing the richness and forms of life in the two ecosystems, two field trips were conducted in January and July 2022, selecting 6 sampling areas, 5 located in primary forest and 1 in a plantation, for the latter, the plot with the highest vegetation cover and presence of epiphytes in the stipe of "oil palm" was chosen. Transects were evaluated in a strip, following 5 trails of 200 m long and 5 m wide, which allowed the inventory and collection of specimens, which were transferred to the HUT, for their respective determination. Forty-seven species of ferns and three lycophytes were recorded, grouped into 16 families and 32 genera. The families Pteridaceae and Dryopteridaceae were the most representative in terms of genera and species. The forest zone had 42 species and the plantation zone 13 species (five species inhabit both the plantation and forest areas). In the plantation zone, because of its low richness, it was clearly differentiated from the points located in the forest zone, where the Cainarachi point was unpaired from the others, due to the phenomenon of decay of the floristic similarity due to distancing. The species Adiantum macrophyllum, A. pulverulentum, A. tetraphyllum, A. tomentosum, Asplenium serratum, Pelazoneuron abruptum var. grande, Lomariopsis fendlerii and Tectaria incisa were widely distributed (PC of 66.7%). This allows us to conclude that the richness in the Shanusi zone is low compared to other similar zones in the region, in addition, the forest zone harbored most of the species where terrestrial life forms predominated, while, in the plantation zone most were epiphytes.
Keywords: Shanusi, Lycophytes and Ferns, Elaeis guineensis
* Autor para correspondencia: fpelaez@unitru.edu.pe
Citar como:
Peláez, F., Alarcón, N., Zelada, W., Torres, J., Castillo, H., Vergara, S. & Mondragón, D. 2022. Licófitos y helechos en bosque primario y plantación de Elaeis guineensis, Shanusi. REBIOL, 42(2): 199-212.
1. Introducción
Los licófitos y helechos están entre los más antiguos linajes de plantas terrestres (Sessa, 2018). Son plantas vasculares que se dispersan por esporas y tienen un ciclo de vida con 2 generaciones (gametofito y esporofito), de vida libre (Morán, 2019). El esporofito tiene una gran variedad de formas y tamaños (Arana & Bianco, 2011; Moran, 2008). Son aproximadamente 12 000 especies (10 500 helechos y 1 300 licófitos), representando alrededor del 4% de la flora vascular (PPG I, 2016; Christenhusz & Chase, 2014; Smith et al., 2006; Tryon & Stolze, 1989a). Se les puede encontrar como colonizadores de paisajes disturbados y también dispersos entre las rocas de desiertos semiáridos, sabanas, costas y altas montañas alpinas, donde resisten la sequía, fuego y bajas temperaturas (Hietz, 2010; Sharpe et al., 2010; Christenhusz et al., 2011). No obstante, la riqueza de estos grupos de plantas, sigue un gradiente latitudinal mostrando su mayor esplendor en los ecosistemas tropicales, subtropicales, temperados y boreales; formando parte de los diferentes bosques y hasta flotando o sumergidos en los cuerpos de agua (Kessler, 2010).
En Sudamérica se estima entre 3 000 y 3 500 especies de helechos y licófitos (Morán, 2008; Tryon & Tryon, 1982). En Perú la riqueza de estas plantas es de 1200 especies (Kessler & Smith, 2017; Smith et al., 2005; Almeida & Salino, 2016), distribuyéndose principalmente en los departamentos de Amazonas, Huánuco, Junín, Pasco, Cusco y San Martín (Tryon et al., 1994), siendo ésta última región, la que alberga la mayor riqueza con 611 especies de helechos (Peláez et al., 2010).
Sin embargo, esta riqueza natural está viéndose afectada por la pérdida de bosques, causada por distintas actividades antrópicas como la deforestación, la agricultura a gran escala, ocupación desordenada del territorio, creciente demanda selectiva de productos de la biodiversidad, minería ilegal, ganadería extensiva y algunos cultivos permanentes como “café”, “cacao” y “palma aceitera”. Reportes del 2007, muestran una deforestación de más de 500 hectáreas vinculadas a cultivos industriales de “palma aceitera” y “cacao”, en las regiones de San Martín y Loreto (GIZ, 2016), cifra que se incrementa a 30 215,57 ha, entre el 2010 y 2014, incluyendo a Ucayali (Dammert, 2014). En particular, el valle de Shanusi, ubicado en San Martín y Loreto, está experimentando una drástica transformación, por efecto del cambio de uso de los suelos y la fragmentación del bosque, impactando directamente en la diversidad biológica que alberga.
Estos acontecimientos nos llevan a cuestionar cuanta diferencia existe en términos de riqueza de especies de licófitos y helechos, tanto en bosque primario, como en plantación de Elaeis guineensis “palma aceitera”; por ello, la presente investigación, tuvo la finalidad de determinar la composición de licófitos y helechos en ambos ecosistemas, además de comparar la riqueza y formas de vida.
2. Materiales y Métodos
Área de estudio
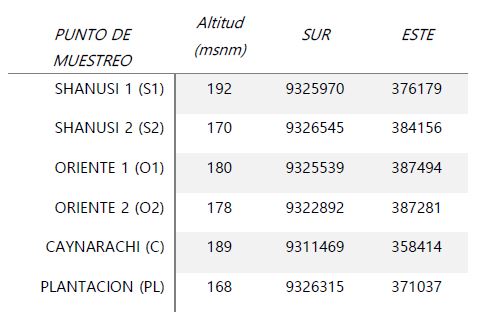
El valle Shanusi está ubicado a 65 Km al Este de la ciudad de Tarapoto, en la carretera Tarapoto- Yurimaguas, pertenece a predios privados que cuentan con áreas de bosques primarios y plantaciones de E. guineensis y Theobroma cacao “cacao, y en esta zona se ubicaron los puntos de muestreo (Tabla 1, Fig. 1).
Toma de datos
El registro de licófitos y helechos se llevó a cabo en 2 salidas, enero y julio del 2022. Las zonas de muestreo fueron seleccionadas de acuerdo a las rutas de acceso establecidas, considerando bosques primarios y plantación; para ésta última, se eligió la parcela que presentaba una mayor cobertura vegetal y presencia de epífitos en el estípite de E. guineensis. El método utilizado para la toma de datos fue el transecto en faja, siguiendo 5 trochas de 200 m de largo y 5 m de ancho, como lo propuesto para la zona de Loreto (Cárdenas et al., 2003).
Colección y tratamiento de las muestras de licófitos y helechos
Durante el recorrido se realizó el inventario de las especies presentes y se colectaron tres ejemplares de cada especie para su determinación. Se tuvo en cuenta las hojas fértiles y el rizoma. Las muestras fueron puestas en papel periódico, esparciendo alcohol etílico al 96% diluido con agua en partes iguales, para evitar el crecimiento de hongos, luego, se colocaron en la prensa botánica, para su transporte y posterior herborización de acuerdo a León (1995). A su vez, se tomaron nota del hábito, hábitat y las características morfológicas (tamaño aproximado, color de los soros, rizoma, escamas, etc.). También se hizo el registro fotográfico, con una cámara Canon SX540 HS.
Tabla 1. Puntos de muestreo de licófitos y helechos en el valle Shanusi, 2022 (coordenadas UTM)
Determinación de las especies de licófitos y helechos
Se realizó la comparación de las muestras colectadas con ejemplares depositados en el Herbarium Truxillense (HUT), también, se usó bibliografía especializada referida a la flora peruana (Tryon & Stolze, 1989a, 1989b, 1991; Tryon et al., 1993; Tryon, et al., 1994; Lehnert, 2011), trabajos de Brasil (Prado et al., 2017) que permitieron registrar datos de la distribución geográfica y altitudinal de las especies, Las páginas web especializadas como Flora do Brasil 2020 (http://floradobrasil.jbrj.gov.br); Trópicos (http://www.tropicos.org/) y World Ferns (https://www.worldplants.de/world-ferns/ferns-andlycophytes-list), apoyaron para la actualización nomenclatural. El arreglo de Familias y Géneros de licófitos y helechos está de acuerdo a PPG-I (2016).
Determinación de la amplitud de distribución
Para cada especie se estimó la amplitud de distribución para lo cual se calculó el Porcentaje de Constancia (PC), con la fórmula propuesta por Madrigal-Sánchez (1967):

Análisis de semejanza
Utilizando los datos de presencia y ausencia de las especies, se determinó la semejanza de composición de especies entre los puntos de muestreo. Con el programa de cálculo PAST 4,12 (Hammer et al., 2001), se calculó el índice de Jaccard y considerando el método de unión el de promedio entre grupos se elaboró un dendrograma para mostrar los resultados.
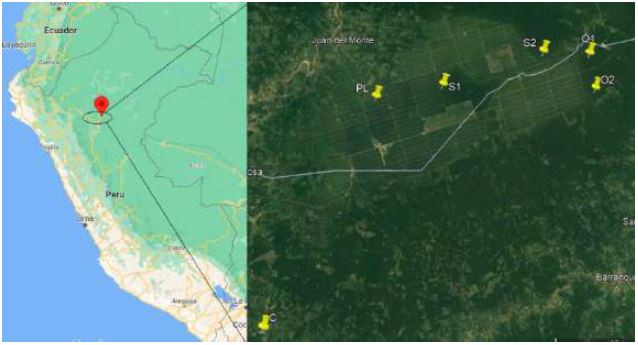
Figura 1. Ubicación puntos de muestreo de licófitos y helechos en el valle Shanusi, 2022. (Fuente Google Earth)
3. Resultados
En las 6 zonas de muestreo de Shanusi, se encontraron 50 especies de licófitos (3) y helechos (47), agrupados en 32 géneros y 16 familias. Las familias mejor representadas son Pteridaceae y Dryopteridaceae con cinco géneros cada una (15,6%), Polypodiaceae y Thelypteridaceae con cuatro géneros cada una (12,5%), Lomariopsidaceae y Dennstaedtiaceae tienen 2 géneros cada una (6,25%) y las 10 familias restantes están representadas por un solo género (3,12%) (Figura 2).
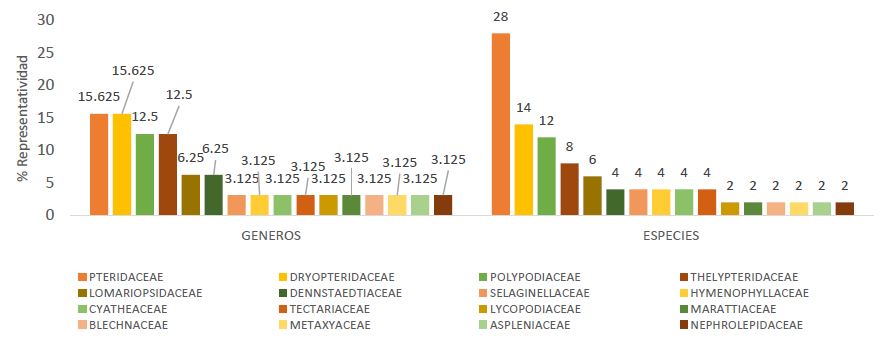
Figura 2. Porcentaje de representatividad de géneros y especies por familias de licófitos y helechos, en el valle Shanusi, 2022.
En cuanto a la representatividad de las especies, destacan las familias Pteridaceae con 28% (14 especies), Dryopteridaceae con 14% (7 especies), Polypodiaceae con 12% (6 especies), Thelypteridaceae con 8% (4 especies), Lomariopsidaceae con 6% (3 especies), Dennstaedtiaceae, Selaginellaceae, Hymenophyllaceae, Cyatheaceae y Tectariaceae con 4% (2 especies) y las familias Lycopodiaceae, Marattiaceae, Blechnaceae, Metaxyaceae, Aspleniaceae y Nephrolepidaceae con una representatividad del 2% (Figura 2)
Así mismo, en la Tabla 2, se muestra el Porcentaje de Constancia (PC), de las especies evaluadas, evidenciándose que Adiantum macrophyllum, A. pulverulentum, A. tetraphyllum, A. tomentosum, Asplenium serratum, Pelazoneuron abruptum var. grande, Lomariopsis fendlerii y Tectaria incisa tienen amplia distribución en el área evaluada, alcanzando un valor de PC de 66,7%, ya que han sido registradas en 4 de las 6 estaciones de muestreo.
Del total de especies registradas, en el área de bosque (puntos de muestreo S1, S2, O1, O2 y C), se encontraron 42 especies de licófitos y helechos, siendo el punto de muestreo O2 el más rico con 22 representantes; mientras que, en la zona de plantación se registraron 13 especies (solo helechos). Cabe señalar que son cinco las especies que crecen tanto en plantación como en bosque (Figura 3 y Tabla 2).
Respecto a las formas de vida de las especies encontradas, 28 son terrestres, 20 epífitas y 2 son hemiepífitas (Tabla 2, Figura 3). En la zona de bosque la mayoría de especies encontradas son terrestres (28), seguidas de las epífitas con 12 representantes y 2 especies hemiepífitas; en cambio, en la zona de plantación, 10 especies son epífitas y tres son terrestres.
En la Tabla 2, también se muestra la distribución geográfica (considerando los departamentos) y altitudinal, así como el nivel de protección legal de licófitos y helechos presentes en la zona de estudio, apreciando que todas ocurren en más de un departamento y con altitudes que van hasta los 2500 msnm. Respecto al estado de conservación, sólo las especies de Cyathea, están consideradas en el apéndice II de CITES-PERU (MINAM, 2016).
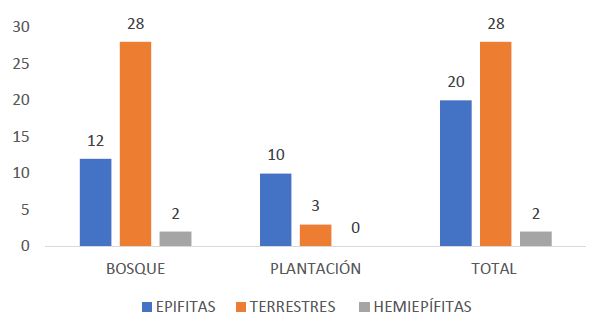
Figura 3. Representatividad especies licófitos y helechos terrestres, epífitos y hemiepífitos en zona de bosque y plantación en el valle Shanusi, 2022
La riqueza de especies por punto de muestreo oscila entre 13 y 22 especies (Tabla 2) y considerando la data de presencia y ausencia, se evaluó la similaridad entre los puntos de muestreo, para lo cual se aplicó el índice Jaccard. Evidenciándose que las estaciones de Bosque están agrupadas, siendo Shanusi 2 y Oriente 1 más semejantes entre sí, que Shanusi 1 y Oriente 2; pero, estas a su vez menos parecidas a la estación Cainarachi. Por otro lado, el dendrograma (Figura 4), deja notar la clara disimilaridad que existe entre las estaciones ubicadas en el Bosque en comparación con la el área de plantación.
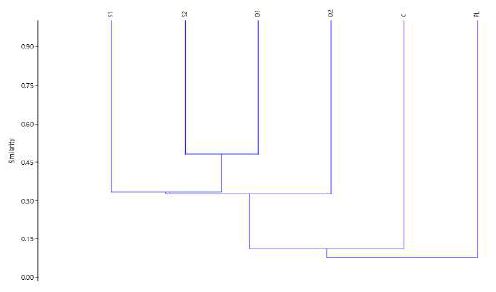
Figura 4. Índice se Similaridad de Jaccard de las diferentes estaciones de muestreo del valle Shanusi, 2022
Tabla 2. Porcentaje de constancia, ocurrencia de las especies por punto de muestreo, formas de vida, distribución geográfica, altitudinal y estado de conservación de licófitos y helechos, del valle de Shanusi, 2022.
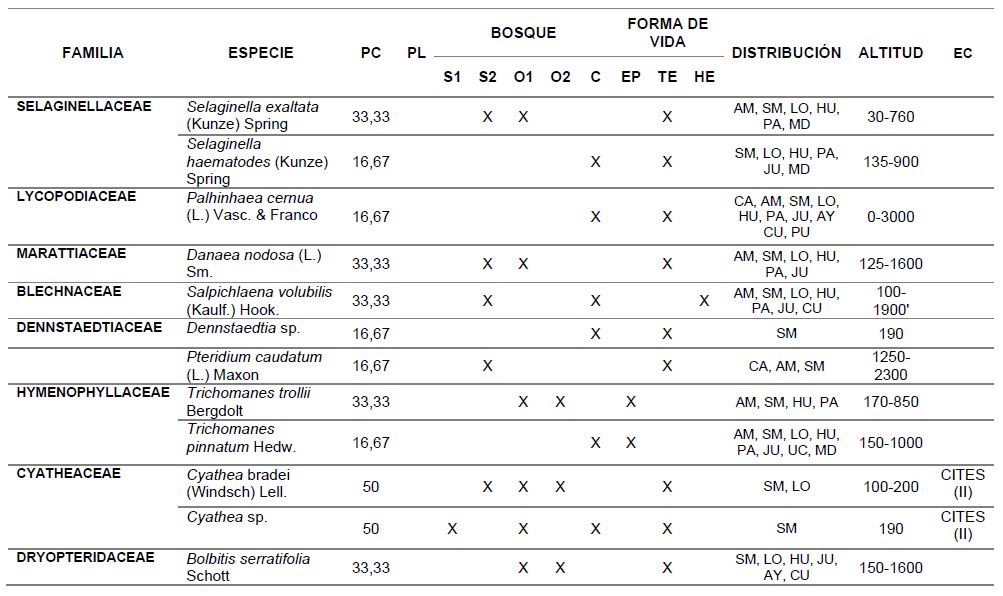
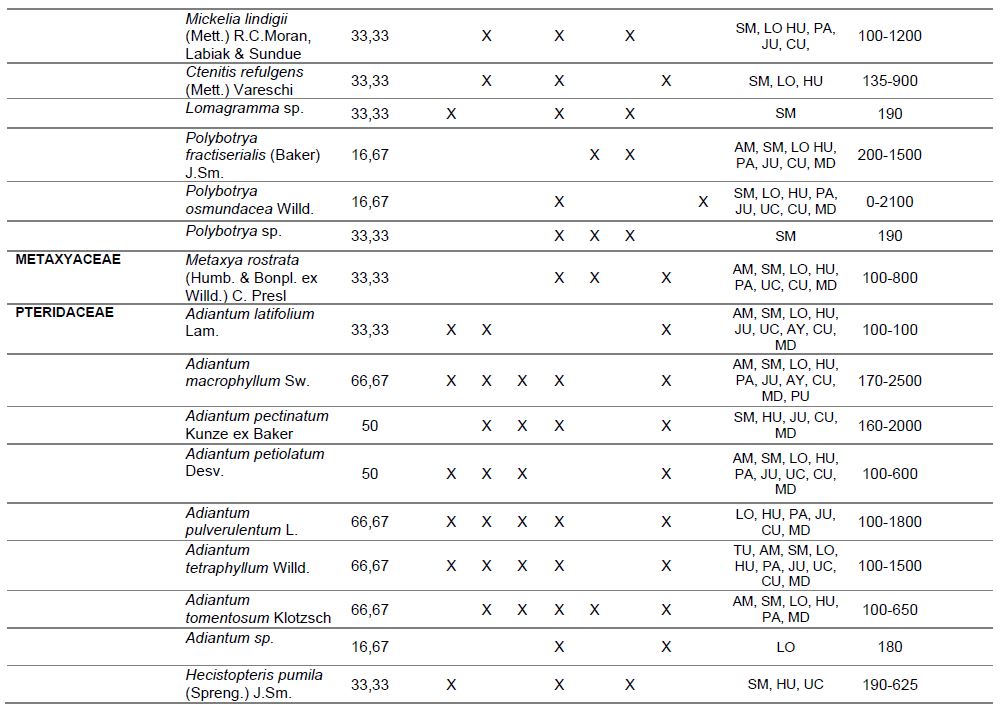
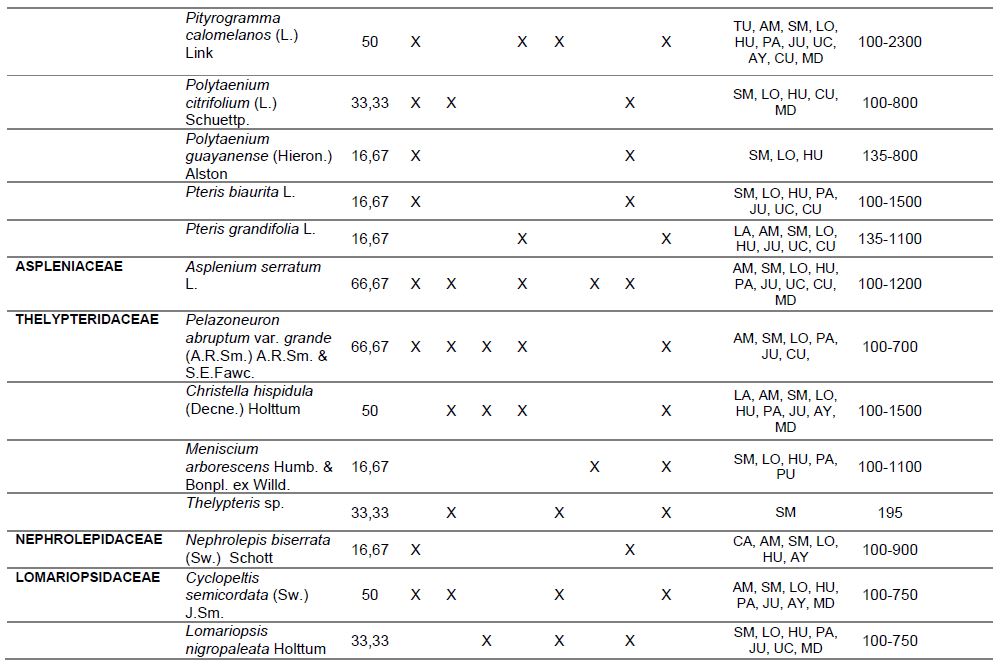
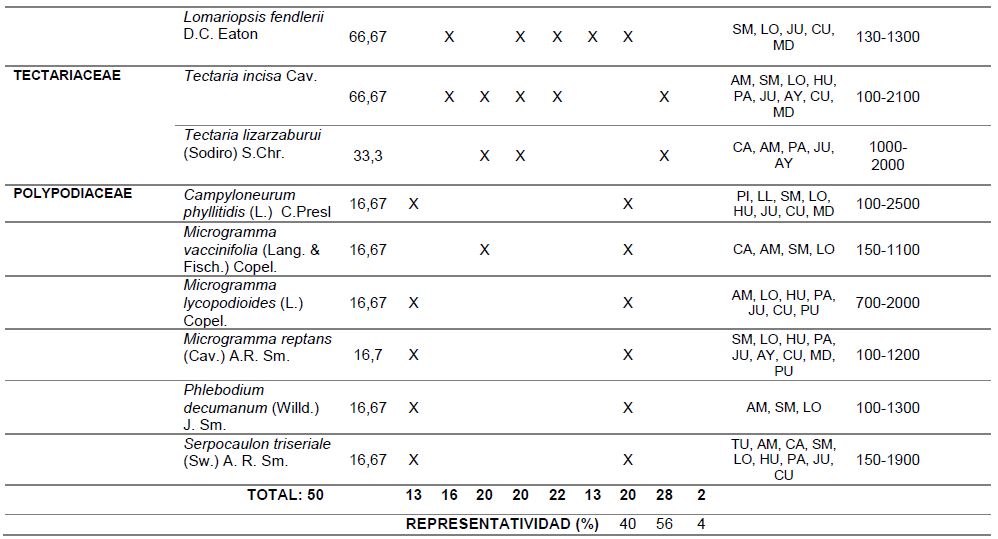
NOTA: PC: porcentaje de constancia, PL: plantación, S1: Shanusi 1, S2: Shanusi 2, O1: Oriente 1, O2: Oriente 2, C: Cainarachi, EP: epífito, TE: Terrestre, HE: Hemiepífito, DG: Distribución Geográfica, AM: Amazonas, SM: San Martín, LO: Loreto, HU: Huánuco, PA: Pasco, MD: Madre de Dios, JU: Junín, CA: Cajamarca, AY: Ayacucho, PU: Puno, CU: Cuzco, UC: Ucayali, TU: Tumbes, DA: Distribución Altitudinal, EC: Estado de Conservación
4. Discusión
Los licófitos y helechos, son elementos importantes de la vegetación de nuestro país (León et al., 2022), distribuyéndose mayoritariamente en áreas de bosques montanos lluviosos o nublados (Tryon et al., 1994). La región San Martín, cuenta con estos ecosistemas y es reconocida por cobijar a 611 especies, siendo por tanto la región con mayor riqueza (Peláez et al., 2010). En el valle Shanusi, ubicado en las regiones de San Martín y Loreto, se han registrado 50 especies (47 helechos y 3 licófitos), valor que está por debajo de las 71 especies reportadas para la Allpahuayo – Mishana, ubicada en la región de Loreto, a una altitud similar (Cárdenas et al., 2003); así mismo, Cárdenas et al. (2007), encontraron 130 especies de pteridofitas en 12,7 ha de bosque amazónico de la Zona del Río Yavarí-Mirín; también, en el bosque de Pabloyacu (provincia de Moyobamba, región San Martín), se resgistraron 136 especies; aunque el área tiene una mayor elevación altitudinal (Alarcón, 2009).
Esta diferencia, puede obedecer a que el valle Shanusi se encuentra interrumpido por grandes extensiones de cultivo de “palma aceitera”, actividad que según Dammert et al. (2014), genera la pérdida de bosque, impactando directamente en la flora y fauna, ya que en las plantaciones no se restablecen las especies afectadas. Asimismo, la zona de estudio corresponde a la llanura amazónica, cuya altitud no supera los 200 m.s.n.m. y tienen valores muy parecidos en Loreto donde reportan entre 6 y 30 especies (Cárdenas et al., 2003); hay que tener en cuenta lo que indica Morán (2008), que en los trópicos, la diversidad de helechos y licófitos no se distribuye uniformemente; las montañas guardan más especies que las tierras bajas, así, los Andes tienen alrededor de 2500 especies mientras que las zonas bajas del centro de Brasil presentan 235 especies, (Morán, 1995).
En la zona de bosque se han registrado 42 especies de licófitos y helechos, mientras que en la zona de plantación hay 13 especies de helechos (5 especies son comunes para ambos ecosistemas). Lo encontrado en plantación, supera ligeramente a lo reportado en otras investigaciones, como en Venezuela donde encontraron 5 especies de licófitos y helechos en este tipo de ecosistemas (Fariñas et al., 2011); en Nigeria 4 especies, aunque en este caso consideran solo las epífitas (Adeleye et al., 2017); en Indonesia indican la presencia de 16 especies epifitas de E. guineensis (Sofiyanti, 2013), Peláez, et al., (2019) reportan 12 especies de helechos epífitos en la misma especie, en Shanusi y Tocache. En general, se puede indicar que el número de especies de helechos registrados en plantación ha disminuido a la tercera parte de lo encontrado en bosque; esta condición es una prueba más de lo que ocurre cuando los hábitats naturales son convertidos a plantaciones, una reducción de la biodiversidad nativa, incluyendo la riqueza de especies hasta en 60%, e interrumpiendo la conectividad en las rutas de migración de los animales. (Dirzo et al., 2014, Dammert, 2014).
En cuanto a la representatividad, las familias Pteridaceae, Dryopteridaceae y Polypodiaceae, sobresalieron tanto en géneros como en especies; condición que se evidencia también a nivel nacional, siendo mencionadas como las familias más importantes de helechos y licófitos en “El mundo vegetal de los Andes peruanos”, en el contexto actual, donde la familia Polypodiaceae ocupa el primer lugar en riqueza de taxones con más de 240 representantes, Pteridaceae constituye la tercera más especiosa y Dryopteridaceae constituye para la flora peruana un componente importantes en todo el territorio (León et al., 2022). Así mismo, en el marco internacional las familias Polypodiaceae y Pteridaceae son las más representativas en México independientemente de las condiciones climáticas y de tipo de vegetación (Martínez-Cabrera et al., 2019).
Adiantum macrophyllum, A. pulverulentum, A. tetraphyllum, A. tomentosum, Asplenium serratum, Pelazoneuron abruptum var. grande, Lomariopsis fendlerii y Tectaria incisa, presentan amplia distribución en la zona de estudio con un valor de PC por encima de 66%, condición que se observa también a nivel nacional ya que se encuentran distribuidos en más de 5 regiones de nuestro país (Tabla 2). Esta amplia distribución, lo presentan aquellas especies que pueden crecer y soportar un amplio espectro de condiciones ambientales (Martínez-Cabrera et al., 2019).
Por otro lado, se ha evidenciado la dominancia de las formas de vida terrestres y epífitas con 56% y 40% respectivamente, reafirmando así, lo manifestado por Pérez-García et al. (1995), quienes señalan que son éstas las formas de vida más comunes en los helechos y licófitos del mundo. En Perú, de las 1200 especies que habitan en nuestro territorio (Kessler & Smith, 2017), 305 tienen forma de vida epífita (Huamán, 2021). En la zona de bosque de Shanusi, se mantiene esta tendencia, siendo 28 especies terrestres y 12 epífitas; en cambio, en la zona de plantación de “palma aceitera”, hay 10 especies de epífitas y 3 terrestres: Peláez et al, (2019), reportaron 12 helechos epífitos, aunque incluye zonas más al sur del presente estudio. Cabe señalar, que la acumulación de residuos y humedad en la base del peciolo de E. guineensis, forma un microambiente adecuado para el crecimiento de epífitas, especialmente helechos (Adeleye et al., 2017; Sofiyanti, 2013).
El análisis similaridad (índice Jaccard), agrupa a los puntos ubicados en la zona de bosque primario, diferenciándose grandemente de la zona de plantación (8 especies exclusivas y 5 comunes), donde claramente hay una reducción de la riqueza de especies, evidenciando así que, en plantaciones agrícolas y forestales a gran escala, como la “palma aceitera”, la degradación de grandes extensiones de bosques nativos va de la mano de la pérdida de biodiversidad. Así mismo, dentro de los diferentes puntos de muestreo en la zona de bosque, se prueba que mientras más cercanos están ubicados los puntos de muestreo, más similares son, como ocurre entre Shanusi 2 - Oriente 1, Shanusi 1 - Oriente 2; en cambio, en Cainarachi, ubicado a mayor distancia (Figura 1), se han reportado 13 especies, 6 de la cuáles no se han encontrado en otros puntos de muestreo. Es en estos casos donde el fenómeno de decaimiento de la semejanza florística por distanciamiento, se evidencia, asumiendo que se genera un cambio en las variables ambientales específicas (altitud, grado de disturbio, luz, precipitación, temperatura, etc.) y en los límites de dispersión y amplitud del nicho entre especies (Nekola y White, 1999; Soininen et al., 2007).
De acuerdo a la distribución geográfica en el país, todas las especies de licófitos y helechos ocurren en más de un departamento, con rango de altitudes que en su mayoría no sobrepasan los 1000 m.s.n.m., excepto Adiantum macrophyllum y Campyloneurum phyllitidis, especies que se pueden encuentran a los 2 500 m.s.n.m. (Lehnert, 2011; Tryon & Stolze, 1989b, 1991, Tryon et al., 1993, 1994). En cuanto a la situación de protección legal, según CITES-Perú, (MINAM, 2016), todas las especies del género Cyathea, están incluidas en el Apéndice II, considerando que son requeridas como sustrato para cultivo de otras especies ornamentales como las “orquídeas”, cuyo mercado es el extranjero.
5. Conclusiones
La composición de licófitos y helechos en Shanusi es baja, en comparación a otras zonas de la región con el mismo tipo de vegetación.
La zona de bosque primario albergó a la mayoría de las especies, en cambio, la zona de plantación de E. guineensis presentó una riqueza mínima.
La forma de vida terrestre de licófitos y helechos, fue más abundante en la zona de bosque primario, en cambio en la zona de plantación de E. guineensis predominan las especies epífitas.
6. Contribución de autores
FPP: participó en la concepción y el diseño del estudio, toma de datos y en la determinación de especies, NMAR: análisis e interpretación de los datos y elaboración de borrador del artículo WZE: toma de datos, análisis e interpretación de los datos y la versión final del manuscrito, JTD: toma de datos, análisis e interpretación de los datos HCB: toma de datos y elaboración del mapa del área de estudio SVM: revisión crítica del contenido; DMMC, revisión crítica del contenido.
7. Conflicto de interés
Los autores declaran que no existe conflicto de interés
8. Referencias Bibliográficas
Adeleye, M., Akinsoji, A., & Adeonipekun, P. (2017). a survey of vascular epiphytes of oil palms (Elaeis guineensis JACQ.) in lekki conservation centre, lagos, Nigeria. trends in Science & Technology Journal, 2(1A), 74-78.
Alarcón, N. (2009). Inventario de Pteridofitos del “Bosque Pablo Yacu”, Moyobamba-San Martín, octubre 2008-marzo 2009. Universidad Nacional De Trujillo.
Almeida, T. E., & Salino, A. (2016). State of the art and perspectives on neotropical fern and lycophyte systematics. Journal of Systematics and Evolution, 54(6), 679–690.
Arana, M. & Bianco, C. (2011). Helechos y Licofitas del centro de Argentina. Editorial UNRC: Río Cuarto. Argentina. 84 pp
Cárdenas, G., Aramburú, C., Castro, L., García, A., Zegarra, A., & Flores, M. (2003). Evaluación de Pterdofitas en Bosques de la Zona Reservada Allpahuayo - Mishana y Santa Rosa, Loreto. Folia Amazónica, 14(1), 111–115.
Cárdenas, G. G., Halme, J. K., Tuomisto, H. (2007). Riqueza y distribución ecológica de especies de pteridofitas en la zona del río Yavarí-Mirín, Amazonía Peruana. Biotropica, 39, 637-646.
Christenhusz, M. J. & Chase, M. W. (2014). Trends and concepts in fern classification. Annals of Botany, 113(4), 571-594.
Christenhusz, M. J. Zhang, X. C., & Schneider, H. (2011). A linear sequence of extant families and genera of lycophytes and ferns. Phytotaxa, 19, 7-54.
Dammert, J. (2014). Cambio de uso de suelos por agricultura a gran escala en la amazonía andina: el caso de la palma aceitera. (USAID, Ed.). Negrapata SAC.
Dirzo, R., Broadbent, E. N., Zambrano, M. A., Picado, A., Moraga, M., & García, D. (2014). Biodiversidad en las Plantaciones de Palma Aceitera de la Región Osa-Golfito. (Stanford Woods, Ed.), Iniciativa INOGO (Vol. Julio). San José.
Fariñas, J., Vásquez, M., Cumana, L. J., Barrios, R., Leonett, L., Rodríguez, G., & Mark, D. (2011). Flórula de plantaciones de palma aceitera establecidas en el estado Monagas, Venezuela. Revista Cientifica UDO Agricola, 11(1), 71–82.
GIZ. (2016). Cambio de uso actual de la tierra en la Amazonía peruana (Doc.Trabaj). Lima: Proambiente.
Hammer, Ø., Natural History Museum, University of Oslo. (2022). PAST: Paleontological statistics. Version 4.12. Reference manual. past4manual.pdf (uio.no)
Hietz, P. (2010). Fern adaptations to xeric environments. In K. Mehltreter, L. R. Walker, & J. M. Sharpe (Eds.), Fern Ecology (pp. 140–176). New York: Cambridge University Press.
Huamán, C. (2021). Riqueza y Distribución de los Helechos Epífitos en el Perú. [Tesis de título, Universidad Nacional de Trujillo. Perú].
Kessler, M. (2010). Biogeography of Ferns. In K. Mehltreter, L. R. Walker, & J. M. Sharpe (Eds.), Fern Ecology (pp. 22-60). New York: Cambridge University Press.
Kessler, M., & Smith, A. R. (2017). Prodromus of a fern flora for Bolivia. I. General introduction and key to families. Phytotaxa, 327(1), 57–89.
Lehnert, M. (2011). The Cyatheaceae (Polypodiopsida) of Peru. Brittonia, 63(1), 11–45.
León, B. (1995). Propuesta de áreas importantes para la conservación de la diversidad de pteridofitos en el Perú. En: Rodríguez, L. 1996. Diversidad Biológica del Perú, zonas prioritarias para su conservación. MINAG, INRENA. Lima. Perú.
León, B., Acuña-Tarazona, M., & Mellado, L.F. (2022). Pteridofitas: Helechos y licófitos de El mundo vegetal de los Andes peruanos en el contexto actual. Revista peruana de biología 29(3): e22890 001-020 (agosto 2022).
Madrigal-Sánchez, X. (1967). Contribución al conocimiento de la ecología de los bosques de Oyamel (Abies religiosa (H.B.K.) Schl. & Cham.) en el Valle de México. Instituto Nacional de Investigaciones Forestales, Boletín Técnico 18. México, D.F., México. 94 pp.
Martínez-Cabrera, D., Hernández-Hernández, B., Isidro-Hernández, A. Hernández-Álvarez, A., & Sánchez- González. A. (2019). Diversidad de licopodios y helechos del bosque tropical subcaducifolio del estado de Hidalgo, México. Acta Botánica mexicana 126: e1434.
MINAM. (2016). Listado de especies peruanas de flora silvestre incluidas en los apéndices de cites, 155pp.
Morán, R. (1995). The importance of mountains to pteridophytes, with emphasis on neotropical montane forests. En Churchil, S. P. et al. Editors. Biodiversity and Conservation of Neotropical Montane Forests. The New York Botanical Garden. 359-363.
Morán, R. (2008). Diversity, Biogeography and Floristic, in Biology and Evolution of Ferns and Lycophytes Edited by Ranker T. & C. Haufler. Cambridge University Press. New York. 367-394.
Morán, R. (2019). Géneros Americanos de Helechos y Licofitas una guía para estudiantes, Nueva york Botanical Garden pag. 150-573.
Nekola, J., & White. P. S. (1999). The distance decay of similarity in biogeography and ecology. Journal of Biogeography 26(4): 867-878.
Peláez, F., Alarcón, N., Vergara, S., & Torres, J. (2010). Nuevos registros de Pteridophyta en la región San Martín-Perú. Sciéndo, 13(2), 28–34.
Peláez, F., Torres, J., Zelada, W., Castillo, H., & Alarcón, N. (2019). Helechos epífitos en Elaeis guineensis “palma aceitera”, en Shanusi y Tocache, San Martín, Perú. REBIOL. 39(1), 10-17.
PPG, I. (2016). A community-derived classification for extant lycophytes and ferns. Journal of Systematics and Evolution, 54(6), 563-603.
Pérez-García, B., Riba, R., & Reyes-Jaramillo, I. (1995). Helechos mexicanos: formas de crecimiento, hábitat y variantes edáficas. Contactos 11: 22-27.
Prado, J., Hirai, R. Y., Moran, R. C., New, T., & Botanical, Y. (2017). Fern and lycophyte flora of Acre state, Brazil Jefferson. Biota Neotropica, 17(4), 1–59.
Sessa, B. (2018). Evolution and classification of ferns and Lycophytes. In Fernández, H. (Ed.), Current advances in fern research (pp. 179-200).
Soininen, J., R. McDonald y H. Hillebrand. (2007). The distance decay similarity in ecological communities. Ecography 30(1), 3-12.
Sharpe, J. M., Mehltreter, K. & Walker, L. R. (2010). Ecological importance of fern. In: Mehltreter K., L. R. Walker y J. A. Sharpe (eds). Fern Ecology. Cambridge University Press. Cambridge. pp. 1-21.
Smith, A. R., León, B., Tuomisto, H., van der Werff, H., Moran, R. C. New Y. B. G., Lehnert, M., & Kessler, M. (2005). New Records of Pteridophytes for the Flora of Peru. Sida, 21(4), 2321–2342.
Smith, A. R., Pryer, K. M., Schuettpelz, E., Korall, P., Schneider, H., & Wolf, P. G. (2006). A classification for extant ferns. Taxon, 55(3), 705–731.
Sofiyanti, N. (2013). The diversity of epiphytic fern on the oil palm tree (Elaeis guineensis Jacq.) In Pekanbaru, Riau. Jurnal Biologi, 17(2), 51–55.
Tryon, R. & Tryon A. (1982). Ferns and Allied Plants. Whit Special Reference to Tropical America. Springer-Verlag New York Inc. U.S.A
Tryon, R. & Stolze, R. (1989a). Pteridophyta of Peru Part I. Ophioglossaceae-12. Cyatheaceae. Fieldiana Botany New Series, 20, 145.
Tryon, R., & Stolze, R. (1989b). Pteridophyta of Peru Part II. 13. Pteridaceae-15. Dennstaedtiaceae. Fieldiana Botany New Series, 22, 128.
Tryon, R., & Stolze, R. (1991). Pteridophyta of Peru Part IV. 17. Dryopteridaceae. Fieldiana, Botany New Series, 27, 176.
Tryon, R., Stolze, R., & León, B. (1993). Pteridophyta of Peru Part V. 18. Aspleniaceae-21. Polypodiaceae. Fieldiana Botany New Series, 32, 190.
Tryon, R., Stolze, R., & Hickey, J. (1994). Pteridophyta of Peru Part VI 22. Marsileaceae-28. Isoetaceae. Fieldiana Botany New Series, 34, 136.
ANEXO 1: Especies de licófitos y helechos de Shanusi, 2022






