BACILOS GRAM NEGATIVOS RESISTENTES A CARBAPENÉMICOS PRODUCTORES DE CARBAPENEMASAS AISLADOS DE PACIENTES DEL HOSPITAL BELÉN DE TRUJILLO
GRAM-NEGATIVE BACILLI RESISTANT TO CARBAPENEMS PRODUCING CARBAPENEMASES ISOLATED FROM PATIENTS AT THE BELEN HOSPITAL IN TRUJILLO
Carlos Eduardo Abanto Díaz1, José Guillermo González Cabeza1, Kelly Castillo Diestra2
1 Facultad de Ciencias de la Salud, Universidad Privada Antenor Orrego, Av. América Sur 3145, Trujillo, Perú
2 Área de Microbiología, Laboratorio Central, hospital Belén de Trujillo
Carlos Eduardo Abanto Díaz:
José Guillermo Gonzáles Cabeza:
Artículo original
Recibido: 9 de octubre 2022
Aceptado: 16 de enero 2023
Resumen
El uso inadecuado que tuvieron los carbapenémicos en las últimas décadas ha empezado a generar el aumento de bacilos Gram negativos resistentes a los carbapenémicos. Dentro de los mecanismos de resistencia la síntesis de carbapenemasas es el más relevante. El objetivo fue detectar la presencia de carbapenemasas en bacilos Gram negativos resistentes a carbapenémicos aislados de pacientes del hospital Belén de Trujillo durante los meses de julio 2018 a julio 2019, a los cultivos se les realizó la determinación de carbapenemasas mediante el Test de Hodge modificado, así como la Prueba de Sinergia con Ácido Fenil Borónico para la detección de serinocarbapenemasas y el Método de Aproximación de discos para la detección de metalocarbapenemasas. Se determinó que del total de resistentes a carbapenémicos encontrados, el 49,5% eran probables productores de carbapenemasas siendo las Serincarbapenemasas las encontradas en mayor frecuencia y Pseudomonas aeruginosa y Acinetobacter baumanii los bacilos encontrados con mayor frecuencia como productores de carbapenemasas.
Palabras clave: carbapenémicos, carbapenemasa, metalocarbapenemasa, serincarbapenemasa
Abstract
The inappropriate use of carbapenems in recent decades has begun to lead to an increase in carbapenem-resistant Gram-negative bacilli. Within the mechanisms of resistance, the synthesis of carbapenemases is the most relevant. The objective was to detect the presence of carbapenemases in Gram-negative bacilli resistant to carbapenems isolated from patients of the Belen de Trujillo hospital during the months of July 2018 to July 2019, the cultures were determined by the Modified Hodge Test, as well as the Synergy Test with Boronic Phenyl Acid for the detection of serinocarbapenemases and the Disc Approximation method for the detection of metallocarbapenemases. It was determined that of the total carbapenem resistant found a little more than half were likely producers of carbapenemases being the Serincarbapenemases the most frequently found and Pseudomonas aeruginosa and Acinetobacter baumanii are the bacilli most frequently found as carbapenemase producers.
Keywords: carbapenems, carbapenemase, metalocarbapenemase, serincarbapenemase
* Autor para correspondencia: cabanto2020@gmail.com
Citar como:
Abanto, C., González, J. & Castillo, K. 2022. Bacilos Gram negativos resistentes a carbapenémicos productores de carbapenemasas aislados de pacientes del hospital Belén de Trujillo. REBIOL, 42(2): 147-159.
1. Introducción
Los carbapenémicos representan uno de los últimos tipos de antibióticos de mayor efectividad con los que todavía se cuenta dentro de los betalactámicos, el uso inadecuado que han tenido los carbapenémicos en las últimas décadas ha empezado a generar el incremento de bacilos Gram negativos poco sensibles a ellos (Faccio & Cuba, 2019), situación altamente preocupante y prioritaria a atender en el ambiente hospitalario (Kelly et al., 2017). Estas bacterias presentan una variedad de estrategias de resistencia, siendo la de mayor importancia, la síntesis de carbapenemasas, grupo de enzimas más variables de las ß-lactamasas, efectivas contra una amplia variedad de antibióticos, la mayoría resistentes a los inhibidores comerciales de ß-lactamasas (Vera et al., 2017). Desde que se empezaron a detectar en 1996, las carbapenemasas han representado una seria amenaza por su diseminación y alta mortalidad (Brink, 2019), el incremento de estas carbapenemasas se debe principalmente a dos vías de dispersión en ocasiones coexistentes (Diene & Rolain, 2014). La primera en que la mayoría de los genes de carbapenemasas, se encuentran formando parte de plásmidos conjugativos, transposones, así como integrones que les permite transmitirse entre las diferentes especies de bacilos Gram negativos (Villa, 2020) y por otro lado la dispersión de clones que sintetizan estas enzimas especialmente exitosas (Diene & Rolain, 2014).
Existen dos grupos de carbapenemasas; serincarbapenemasas y metalocarbapenemasas, las primeras presentan en su sitio activo una serina en la posición 70, pertenecen a este grupo las enzimas de la clase A o D de la clasificación de Ambler, las de clase A está dividida en 5 grupos filogenéticos: GES, KPC, SME, IMI y NMC-A, presentes en cromosomas o en plásmidos (Arias & Bracamonte, 2019). Son inhibidas por ácido fenil borónico, el cual sirve para su detección, ya que se emplean test fenotípicos basados en el efecto de inhibición producido por el ácido fenil borónico (Bueno, 2015). La clase D, son enzimas capaces de hidrolizar antibióticos como oxacilina y cloxacilina razón por la cual son conocidas como oxacilinasas (OXA), las cuales son poco inhibidas por el ácido clavulánico y ácido etilendiaminotetraacético (EDTA) (Vera et al., 2017), son las de más baja actividad hidrolítica frente a carbapenémicos (Martínez & Gonzales, 2014), sin embargo, cuando se combinan con otros mecanismos de resistencia como la pérdida o la modificación de porinas pueden conferir a las bacterias resistencia a los carbapenémicos (Hartl et al., 2013).
En el caso de las metalocarbapenemasas o de clase B, estas enzimas requieren de dos iones zinc como cofactores en su sitio activo que les permite hidrolizar los carbapenémicos, son inhibidas por agentes quelantes como el EDTA, pero son resistentes al ácido clavulánico o el tazobactam, así como al aztreonam, también, están codificadas por genes presentes en cromosomas como en plásmidos, las más importantes incluyen las familias IMP, VIM, SPM y recientemente NDM (Moncada, 2014; Rada et al., 2019).
Detectar fenotípicamente carbapenemasas en los laboratorios de microbiología, actualmente es todo un desafío puesto que muchas bacterias que podrían estar sintetizando carbapenemasas se mostrarían como sensibles a los carbapenémicos en las técnicas de rutina. Para detectar específicamente carbapenemasas se hace uso de pruebas como el Test Modificado de Hodge (TMH) o las sinergias con ácido fenil borónico (AFB) y EDTA (Rodríguez, 2014).
La detección de bacilos Gram negativos productores de carbapenemasas se han venido dando desde principios de los años 90 en todo el mundo (Mayta et al., 2021). En América, carbapenemasas de tipo KPC fueron detectadas por primera vez en Estado Unidos en el 2001 y en Colombia en el 2006 (Vera et al., 2017; Villegas et al., 2006), mientras que en el 2011, las carbapenemasas de tipo NDM fueron detectadas por primera vez en Guatemala (Pasteran et al., 2012), a partir de estos años las carbapenemasas se han venido propagando con éxito por toda América Latina principalmente en países como Brasil, Colombia Argentina y México donde se han reportado los valores más altos (Escandon et al., 2017). En el Perú se han realizado algunas investigaciones para la determinación de carbapenemasas tipo metalobetalactamasas en Pseudomonas aeruginosa y Kpc en Klebsiella pneumoniae (Gonzales et al., 2013; Velásquez et al., 2013). Siendo el Hospital Nacional Arzobispo Loayza donde se detectó el primer aislamiento que sintetizaba carbapenemasa tipo KPC en octubre del 2013 (Gastelo et al., 2016).
Es muy probable que se esté produciendo una diseminación de bacilos Gram negativos productores de estas enzimas en numerosos centros de salud del Perú; sin embargo, todavía se cuenta con poca información sobre este tipo de bacterias, tal es el caso del Hospital Belén de Trujillo donde aún no se ha investigado la presencia de bacilos Gram negativos productores de carbapenemasas, pese a que con cierta regularidad se aíslan cultivos resistentes a carbapenémicos, con la peligrosidad que esto implica ya que estas bacterias son causantes de una amplia variedad de infecciones intrahospitalarias y comunitarias, disminuyen las opciones terapéuticas para el tratamiento de dichas infecciones, limitando a los médicos al momento de decidir que antibiótico administrar, elevan la tasa de muerte y la permanencia de los pacientes en el centro de salud, por todas estas razones se hizo necesario empezar a investigar la presencia de estas bacterias en el hospital Belén de Trujillo. El presente trabajo tuvo como objetivo detectar la presencia de carbapenemasas en bacilos Gram negativos resistentes a carbapenémicos aislados de pacientes del hospital Belén de Trujillo durante los meses de julio 2018 a julio 2019.
2. Materiales y Métodos
Población en estudio
Representado por todos los aislamientos de bacilos Gram negativos provenientes de muestras clínicas de las diferentes áreas de atención del hospital Belén de Trujillo-Perú de julio 2018 a julio 2019.
Muestra
Constituida por los bacilos Gram negativos resistentes a carbapenémicos aislados de muestras clínicas de las diferentes áreas de atención del hospital Belén de Trujillo-Perú de julio 2018 a julio 2019.
Método
- Obtención de cultivos de bacilos Gram negativos resistentes a antibióticos carbapenémicos proporcionados por el hospital.
Los cultivos de bacilos Gram negativos resistentes a Imipenem y Meropenem aislados de muestras clínicas e identificados a través del sistema automatizado Microscan del área de Microbiología del Laboratorio Central del hospital Belén fueron sembrados en frascos de penicilina conteniendo Agar nutritivo y llevados al Laboratorio de Microbiología Molecular y Biotecnología del departamento de Ciencias de la Universidad Privada Antenor Orrego para su posterior reactivación en caldo BHI (Brain Heart Infusion).
- Comprobación fenotípica de la especie y de resistencia antibiótica
Una vez reactivados en caldo BHI se procedió a sembrar a cada uno de los cultivos en Agar Mac Conkey, las colonias obtenidas se sembraron en medios de identificación bioquímica para hacer la comprobación de la especie y determinar si se trataron de bacilos Gram negativos fermentadores o no fermentadores de glucosa, se comprobó además el fenotipo de resistencia para cada uno de los cultivos, con antibiogramas solo con antibióticos de tipo carbapenémico como imipenem y meropenem.
- Detección fenotípica de carbapenemasas
La detección de carbapenemasas se realizó mediante la aplicación de 3 métodos:
.- Detección de Carbapenemasas mediante el Test de Hodge Modificado con Tritón (Pratt, 2018)
Se agregó 50 μL de Tritón X-100 a placas con Agar Mueller Hinton, se esparció con un hisopo por toda la superficie de la placa, hasta que se haya absorbido completamente.
Se diluyó al 1/10 en agua destilada estéril una suspensión de la cepa de Escherichia coli ATCC 25922 sensible a carbapenémicos previamente estandarizada a una turbidez equivalente al 0,5 del tubo de McFarland y se sembró en una placa con agar Mueller Hinton y se dejó secar entre 3-10 minutos, luego se colocó el disco de meropenem (10ug) en el centro de la placa.
Se tomó una colonia del cultivo bacteriano de 18 a 24 horas de incubación proporcionado por el hospital y sospechoso de producir carbapenemasas y se estrió una asada bien cargada del cultivo en la placa, desde el borde del disco de meropenem en línea recta a unos 2 cm hacia el borde de la placa (del centro hacia la periferia), luego se incubó en estufa a 35 °C por 18 a 24 horas.
Un resultado positivo, presenta la formación de una hendidura como punta de flecha en la parte proximal al disco de meropenem debido al crecimiento de la cepa E. coli ATCC 25922 en la intersección entre el halo de inhibición (generado por la difusión del antibiótico) y la estría del cultivo problema productora de carbapenemasas, la cual es liberada al medio, permitiendo el desarrollo de la E. coli.
.- Prueba de Sinergia con Ácido Fenil Borónico (AFB) para la detección de serincarbapenemasas (Pratt, 2018).
De los aislamientos a ensayar se hizo una suspensión de turbidez equivalente al 0,5 del tubo de McFarland, luego se sembró sobre la superficie del agar Muller Hinton. Se colocó un disco de AFB (Ácido fenil borónico) entre los discos de Imipenem y Meropenem a una distancia de 2,5 cm de cada disco incubándolos a 35 °C durante 16-18 horas.
La prueba es positiva por la evidencia de una deformación de los halos en cualquiera de los dos antibióticos hacia el ácido fenil borónico, lo que indicaría que la bacteria es productora de enzima de clase A. Se consideró negativo si no presenta sinergia o deformación.
.- Método de Aproximación de discos (detección de metalocarbapenemasas) (Pratt, 2018).
Se hizo una suspensión semejante al tubo 0,5 de McFarland del cultivo proporcionado por el hospital y sospechoso de producir carbapenemasas y se sembró en una placa de agar Mueller Hinton. Se colocó en esta placa un disco de EDTA entre los discos de meropenem e Imipenem a una distancia de 15 mm de cada disco, luego se incubó a 35 °C por 18 a 24 horas.
Resultado positivo cuando se observa la formación de sinergia o deformación del halo de inhibición de crecimiento bacteriano entre los discos meropenem o imipenem y el disco EDTA, (un incremento del halo de inhibición en cualquiera de los dos antibióticos hacia el disco de EDTA es interpretado como probable presencia de metalocarbapenemasa).
3. Resultados
Se incluyeron 105 cultivos resistentes a carbapenémicos, de los cuales 49,5% salieron positivos al Test de Hodge modificado, como productores de carbapenemasas (Tabla 1). En lo que respecta al tipo de carbapenemasa se encontró que una mayor cantidad de cultivos eran productores de serincarbapenemasas (Tabla 2). Del total de bacilos Gram negativos trabajados en este estudio, fueron los de tipo no fermentadores de glucosa, los encontrados con mayor frecuencia como resistentes a carbapenémicos 90% y productores de carbapenemasas 50,5% principalmente las especies de Pseudomonas aeruginosa y Acinetobacter baumannii (Tabla 3). P. aeruginosa, A. baumannii y Kleibsiella pneumoniae fueron las especies donde se encontró los mayores porcentajes de bacterias productoras de serincarbapenemasas. En cuanto a las enterobacterias se encontró muy pocos cultivos como resistentes a carbapenémicos, pero con elevado porcentaje en cuanto a la producción de carbapenemasas (Tabla 4).
Tabla 1. Cultivos productores de carbapenemasas resistentes a carbapenémicos detectados mediante el Test de Hodge Modificado
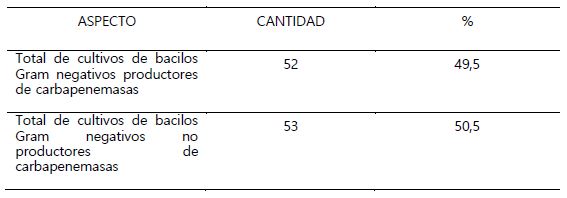
Tabla 2. Cultivos productores de serincarbapenemasas y metalocarbapenemasas resistentes a carbapenémicos detectados mediante la Prueba de Sinergia con Ácido Fenil Borónico y Método de Aproximación de discos
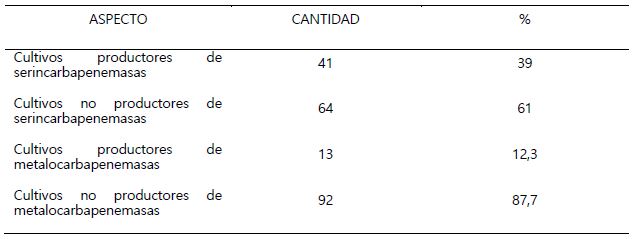
Tabla 3. Especies de bacilos Gram negativos fermentadores y no fermentadores de glucosa encontrados como productores de carbapenemasas mediante el Test de Hodge modificado del total de cultivos resistentes a carbapenémicos aislados
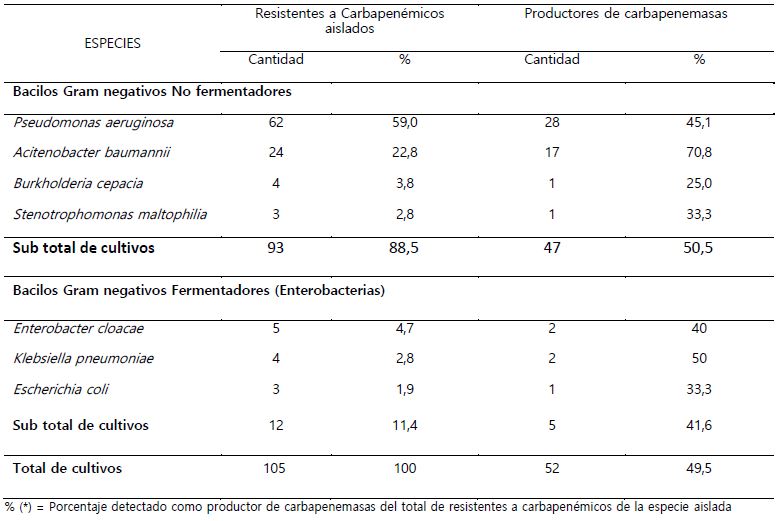
Tabla 4. Porcentaje de especies de bacilos Gram negativos detectados como productores de serincarbapenemasas y metalocarbaepenemasas del total de cultivos resistentes a carbapenémicos
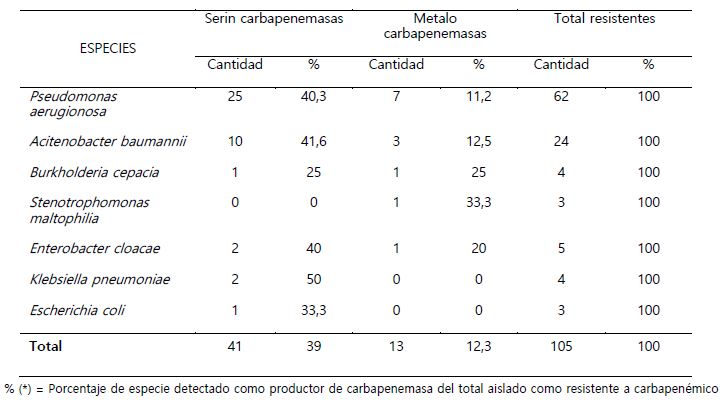

Figura 1: Resultados positivos obtenidos para la detección de carbapenemasas por el método de Hodge modificado
Figura 1 (a, b,c) Se observa la formación de una hendidura como punta de flecha en el halo de inhibición alrededor de la estría de los cultivos en estudio 14, 22 y 24 productores de carbapenemasas. Se interpreta como un resultado positivo para carbapenemasas.
Figura 1 (c) Se observa un halo de inhibición completo (mantiene su forma circular) en la zona alrededor de la estría de los cultivos 4 y 41 no productores de carbapenemasas. Se interpreta como un resultado negativo para carbapenemasas.
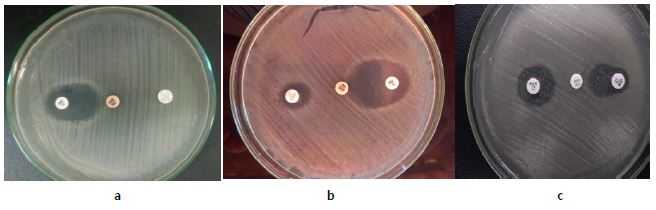
Figura 2: Resultados positivos obtenidos para la detección de sericarbapenemasas por el método de Sinergia con Ácido Fenil Borónico
Figura 2 (a,b) Se evidencia una deformación (alargamiento) del halo de inhibición del disco de imipenem hacia el disco de ácido borónico, (colocado en la parte central) lo que indicaría bacteria es productora de serincarbapenemasa.
Figura 2 (c) Se evidencia deformación (alargamiento) de los halos de inhibición de los dos discos de antibióticos meropenem e imipenem hacia el disco de ácido borónico, (colocado en la parte central) lo que indicaría bacteria productora de serincarbapenemasa.
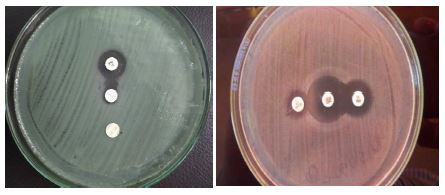
Figura 3 Resultados positivos obtenidos para la detección de metalocarbapenemasas por el método de Aproximación de discos
Figura 3 (a,b) Se observa la formación de sinergia o deformación de los halos de inhibición del disco imipenem hacia el disco de EDTA, (colocado en la parte central) es interpretado como probable presencia de metalocarbapenemasa.
4. Discusión
Los resultados obtenidos en este estudio representan en la ciudad de Trujillo una primera fuente de información acerca del grado de la presencia de bacilos Gram negativos resistentes a carbapenémicos y productores de carbapenemasas. En la tabla 1 se observa que el 49,5% de bacilos productores de carbapenemasas encontrados en el hospital Belén, lo cual representaría todo un reto para los médicos por las bajas posibilidades de tratamiento que podrían tener las infecciones producidas por este tipo de bacterias. Este resultado es similar con los 47,69% obtenidos por Moreno et al. (2013) en el hospital Universitario “Dr. Ángel Larralde” de Carabobo y concordante con lo enunciado por el Complejo Asistencial Universitario de Salamanca, quien en un estudio de las carbapenemasas encontradas desde 2015 hasta el primer trimestre de 2018, reportó un aumento en la aparición de estas enzimas (García, 2018), esto es debido a la facilidad con que se propagan los genes que codifican estas enzimas mediante los diferentes mecanismos de transferencia génica, como por ejemplo la conjugación, a través de la porina receptora del pili sexual denominada OmpA presente en la membrana externa de las bacterias Gram negativas (Maguiña, 2016). En el resto de cultivos la resistencia a los carbapenémicos detectada se debería a otros mecanismos de resistencia, que serán discutidos más adelante.
La figura 1 muestra los cambios que se han observado, durante la realización del Test de Hodge modificado, en la forma de los halos de inhibición de una cepa de E. coli sensible al meropenem, como consecuencia de la producción de enzimas carbapenemasas por parte de los cultivos 14, 22 y 24 aislados del hospital Belén y trabajados en este estudio, esto debido a que éste test se basa en la hidrólisis del antibiótico carbapenémico, el meropenem, por parte de la enzima carbapenemasa producida por la bacteria en estudio y sembrada en estría desde el borde del antibiótico hasta el borde de la placa, lo que permite a un cepa indicadora y sensible a los carbapenemicos como la E. coli extender su crecimiento más cerca del disco de meropenem y a los lados de la estría de la cepa productora de la carbapenemasa haciendo de esta manera que se observe un halo de inhibición distorsionado (Cercenado, 2015). Sin embargo, en el lado de las estrías correspondiente a los cultivos 4 y 41 se observa que el halo de inhibición mantuvo su forma circular lo que demuestra que estos cultivos no son productores de carbapenemasas. Esta técnica permite detectar la producción de carbapenemasas pero no la clase a la que pertenecen (García, 2018).
La tabla 2 muestra que los cultivos productores de serincarbapenemasas fueron detectados en un 39% mientras que los productores de metalocarbapenemasas fueron detectados en un 12,3%, porcentajes menores que los encontrados por el método de Hodge, esto es debido a que en lugares con alta prevalencia de bacterias productoras de BLEE asociado a la pérdida de porinas, como es el caso del hospital Belén de Trujillo donde frecuentemente se reportan aislamientos de bacterias productoras de BLEE, o en casos de hiperproducción de AmpC, hasta un 25% de los casos detectados por el método de Hodge pueden salir falsos positivos (Pratt, 2018), razón por la cual para mejorar la especificidad de estos ensayos también se ha trabajado con métodos que se basan en utilizar compuestos derivados del ácido borónico y EDTA, los cuales tienen la capacidad de inhibir la acción de las serincarbapenemasas, y metalocarbapenemasas.
Precisamente en la figura 2 se muestra los resultados obtenidos en la prueba de sinergia con ácido fenil borónico donde se observó una deformación o alargamiento de los halos de inhibición desde los discos carbapenémicos hacia el disco de ácido fenil borónico ubicado en el centro de la placa, esto debido a un efecto sinérgico que se genera entre ambos discos sobre el crecimiento bacteriano, como consecuencia de la inhibición que ejerce el ácido fenil borónico sobre la serincarbapenemasa producida por los cultivos trabajados en este estudio. Según la literatura la capacidad del boro de formar enlace covalente con el residuo de serina da como resultado la desactivación rápida de la enzima serin carbapenemasa (Tehrani & Martin, 2018; Shoulders et al, 2020), por lo que el ácido borónico es un inhibidor selectivo de las carbapenemasas tipo A - serin carbapenemasas (KPC, Sme, Nmc, IMI y GES) (Pratt, 2018).
De igual manera la figura 3 también muestra los resultados obtenidos en el método de aproximación de discos con EDTA donde se observa el mismo efecto de ampliación del halo de inhibición entre los discos carbapenémicos y el disco EDTA ubicado en el centro de la placa, debido a la potenciación del halo de inhibición que se genera alrededor del disco del antibiótico, cuando este se enfrenta a un disco cargado con un inhibidor de metalocarbapenemasa como el EDTA, originando también un efecto sinérgico entre ambos discos sobre el crecimiento de la bacteria productora de metalocarbapenemasa. El Ácido Etilenodiamino Tetracético (EDTA) es un agente quelante que posee la capacidad de atrapar los iones zinc, cofactores de las metalocarbapenemasas y por consiguiente inhibir la acción de estas enzimas (Perozo et al, 2012)
Dentro de los bacilos productores de serincarbapenemasas encontrados en este estudio también podrían haber bacterias productoras de enzimas tipo AMP-C, ya que estas enzimas también son inhibidas por ácido fenil borónico (Caldera & Robles, 2017), en cuanto a las productoras de metalocarbapenemasas, el 12,3% de bacterias encontradas, son cercanos a los encontrados por (Gonzales et al., 2013), quienes detectaron un 15,7% de cepas productoras de metalobetalactamasas en un estudio realizado en seis hospitales de referencia de Lima. Se ha comprobado que existe un incremento en la producción de estas enzimas puesto que los genes que las codifican se transfieren fácilmente, ya que se encuentran ubicados en genes cassetes, localizados principalmente en integrones tipo I, II así como en plásmidos o transposones, además, están ubicados en los mismos elementos genéticos móviles de otros genes de resistencia como de las enzimas modificadoras de aminoglucósidos, lo cual confiere a las cepas portadoras, resistencia a múltiples antibióticos (Nicolau & Oliver, 2010). En los cultivos que no se evidenció sinergia con ninguno de los inhibidores, se trataría de bacterias que sintetizan carbapenemasas tipo OXA o alguna otra estrategia de resistencia (Caldera & Robles, 2017).
En la tabla 3 se observa que P. aeruginosa y A. baumanni han sido los bacilos más frecuentemente encontrados como resistentes a carbapenémicos y productores de carbapenemasas, resultados similares con los obtenidos por Caldera & Robles (2017), en Nicaragua y por Moreno et al. (2013) en el hospital Universitario “Dr. Ángel Larralde” en Carabobo, así como los encontrados por Gastelo en el 2015 en el hospital Regional Lambayeque (Gastelo et al., 2016). Los genes de carbapenemasas al encontrarse usualmente en elementos genéticos móviles permiten su fácil dispersión incluso hasta a especies de Enterobacterias tales como K. pneumoniae, S. marcescens, E. aerogenes, E. cloacae, E. coli, etc. (Faccio & Cuba, 2019), tal como se ha encontrado también, aunque en poca frecuencia en los resultados de este estudio. Deben realizarse otros estudios de búsqueda de carbapenemasas en cultivos sensibles a carbapenémicos ya que podrían existir cepas productoras de carbapenemasas que muestren incluso un fenotipo susceptible a los carbapenémicos (Nordmann et al., 2011).
Durante el año de estudio P. aeruginosa fue la más frecuentemente aislada como resistente a carbapenémicos confirmando lo dicho por Hong et al. (2015), quienes manifiestan que en Brasil, Perú, Costa Rica, Rusia, Grecia, Polonia, Irán y Arabia Saudita están los valores más altos de P. aeruginosa resistentes a carbapenémicos, esta bacteria presenta múltiples mecanismos de resistencia tanto constitutivos como adquiridos (Pang et al., 2019), como por ejemplo la baja permeabilidad de su membrana externa a los antibióticos (Livermore, 2001). La disminución de la concentración intracelular del antibiótico a través de la hiperexpresión de los sistemas de expulsión MexAB-OprM, y MexEF-OprN (Quale et al., 2006); estos mecanismos de resistencia se pueden combinar con la hiperproducción de una enzima cromosomal betalactamasa inducible, el Amp C, la cual al ser sintetizada en alta concentración, permite la degradación del antibiótico (Moya et al., 2009). P. aeruginosa es capaz de obtener nuevos genes de carbapenemasas, en forma de casetes situados en integrones, a su vez localizados en transposones o plásmidos que permiten su transferencia (Espinoza & Esparza, 2021).
A. baumanii fue el segundo bacilo Gram negativo resistente a carbapenémico y productor de carbapenemasas encontrado con mayor frecuencia, concordante con los últimos estudios que han demostrado que existe un incremento en la resistencia a los carbapenémicos por parte de esta bacteria (Hamidian & Nigro, 2019). Esto es debido a varios mecanismos de resistencia que presenta, como alteraciones en las proteínas porinas CarO de la membrana externa (Rodríguez et al., 2016), la síntesis de carbapenemasas de clase D, tanto cromosómicas como plasmídicas, mayormente encontrado en cultivos de A. baumannii en América latina (Rodríguez et al., 2018), la Bomba AdeABC, codificada cromosómicamente que puede expulsar una gran variedad de antibióticos entre ellos β-lactámicos (incluyendo carbapenémicos), lo cual complica su manejo (Rodríguez et al., 2016).
Otros grupos de bacilos Gram negativos no fermentadores resistentes a carbapenémicos encontrados en el presente trabajo, aunque en muy poca cantidad tenemos a S. maltophilia y B. cepacia.
Según la bibliografía, S. maltophilia presenta dos β-lactamasas, cromosómicas L1 y L2 inducibles por β-lactámicos que la hacen tener resistencia natural a la mayor parte de los antibióticos (incluidos los carbapenémicos) (Brooke, 2021); además, posee bombas de expulsión SmeABC y SmeDEF (Gulcan et al., 2004) y los mecanismos de resistencia adquirida mediante la transferencia horizontal de plásmidos, transposones, integrones, elementos de la región común de la secuencia de inserción (Brooke, 2021).
En cuanto a B. cepacia, presenta genes cromosómicos que codifican betalactamasas que la hacen ser resistente naturalmente a los β-lactácmicos; Holden et al. (2009) detectaron cuatro posibles β- lactamasas, dos pertenecían a la clase A, mientras que los otros dos restantes eran de las clases C y D según la clasificación de Ambler. Bevivino (et al. 2002) mostraron que después del uso de antibióticos las cepas hospitalarias mostraban más nivel de resistencia que las cepas ambientales, es decir que los usos de antibióticos permitían adquirir resistencia a las cepas ambientales presentes en el hospital. Otros mecanismos de resistencia reportada por la literatura en esta especie son las bombas de eflujo como mexC, mexX, mexA y mexE (Gautam et al., 2015) y las betalactamasas AmpC, sin embargo, es difícil concluir qué mecanismo es responsable de que una cepa sea resistente (Rhodes & Schweizer, 2016).
En cuanto a las especies de enterobacterias encontradas aunque en pequeña proporción E. cloacae fue el aislado de mayor frecuencia seguido de K. pneumoniae y E. coli, coincidiendo estos aislamientos con los obtenidos por Moreno et al. (2013) en el hospital Universitario “Dr. Ángel Larralde” Carabobo y con los obtenidos por Hidalgo, (2018) en el hospital General Enrique Garcés de Quito. Los bajos porcentajes de las especies de enterobacterias encontrados en este estudio puede deberse a que las enterobacterias incluso sintetizando carbapenemasas podrían mostrar en los antibiogramas un fenotipo de sensibilidad frente a los carbapenémicos (Nordmann et al., 2011), lo cual ha quedado constatado en el presente trabajo puesto que del poco número de cultivos encontrados como resistentes a carbapenémicos el porcentaje de productores de carbpenemasas encontrados en cada especie han sido superiores al 25% lo que hace pensar que en el referido hospital podrían estar circulando enterobacterias productoras de carbapenemasas, pero que no muestran resistencia a los carbapenémicos en las pruebas de tamizaje esto debido a que la detección fenotípica de resistencia en los laboratorios no es fácil ya que en muchos casos los valores de las concentraciones mínimas inhibitorias de los carbapenémicos frente a las enterobacterias productoras de carbapenemasas se encuentran en el rango de sensibilidad, por debajo de los puntos de corte clínicos (Cercenado, 2015), por otro lado existen una variedad de otras estrategias de resistencia como la síntesis de BLEE y AmpC tanto cromosómico como plasmídico que pueden ocultar la síntesis de carbapenemasa (Mancilla, 2015).
En el caso específico de K. pneumoniae y E. cloacae se han descrito en la literatura aislados clínicos resistentes a carbapenémicos por combinación de una serie de estrategias de resistencia como la falta o poca expresión de las porinas, la síntesis de β-lactamasas, además, de la producción de carbapenemasas mediadas por plásmidos (Doumith et al., 2009). El continuo uso de Betalactámicos y Fluorquinolonas están favoreciendo el desarrollo de resistencia a los carbapenémicos en estas bacterias (Rodríguez et al., 2015). E. coli fue una de las de las enterobacterias con resistencia a carbapenémicos menos aislada durante el año de estudio lo cual permite tener una idea de que la mayoría de E. coli en el hospital Belén de Trujillo aún son sensibles a carbapenémicos, sobre 90%; sin embargo, en otros hospitales ya se están reportando con mayor frecuencia la aparición de aislados de E. coli resistentes a carbapenémicos, especialmente en urocultivos de pacientes hospitalizados. La baja cantidad de cultivos de E. coli, resistentes a carbapenémicos obtenidos coinciden con los obtenidos por Acevedo et al. (2019) y Ortiz et al. (2015) ellos obtuvieron solo un total de 3 y 1 solo aislamiento respectivamente es importante resaltar el peligro que representaría un aumento en la frecuencia de aislamiento de E. coli resistente a carbapenémicos puesto que es una de las bacterias de mayor protagonismo en la microbiota intestinal.
En la tabla 4 se muestra que la mayoría de cultivos encontradas son productores de serincarbapenemasas, en la mayoría de trabajos de investigación, las serincarbapenemasas son encontradas principalmente en E. cloacae, Serratia marcescens y K. pneumoniae, además de encontrarse también en no fermentadores como P. aeruginosa, A. baumanni (Drawz & Bonomo, 2010) lo cual es concordante con lo encontrado en este trabajo.
Las especies productoras de serincarbapenemasas encontradas en este estudio con mayor probabilidad podrían estar sintetizando carbapenemasas de tipo KPC, GES, NMC-IMI esto debido a que el ácido fenil borónico usado en este estudio presenta la capacidad de inhibir de manera reversible a estas enzimas mientras que en aquellos cultivos que presentaron inhibición con EDTA indica la presencia de especies productoras de metalocarbapenemasas probablemente de tipo VIM, IMP, NDM, puesto que son las más frecuentes en el mundo y las más comunicadas en América Latina (Escandón et al., 2017). Aquellos cultivos donde no se presentó inhibición con ninguno de los inhibidores indicaría la presencia de cultivos productores de carbapenemasas de clase D (OXA-48 y derivados), todos estos hallazgos fenotípicos deberían ser confirmados con la búsqueda de genes específicos para estas enzimas por PCR (Gómez, 2011).
En el caso de metalocarbapenemasas, P. aeruginosa ha quedado en este estudio como una de las bacterias no fermentadoras que presenta un porcentaje no tan bajo, superior al 10%, de cultivos productores de estas enzimas, corroborando lo manifestado por la literatura donde se reporta que P. aeruginosa está siendo el microorganismo más frecuentemente asociado a metalobetalactamasa a nivel mundial, e incluso en Perú (Mena et al., 2012). Cabe resaltar, sin embargo, que el test con EDTA posee de un 10 a un 15% de resultados falsos positivos debido a que el EDTA puede producir un aumento en la permeabilidad de la membrana externa de especies de Pseudomonas, incrementando así la sensibilidad a varios antimicrobianos (Perozo et al., 2012).
A. baumanii ha sido una de las especies con mayor porcentaje de cultivos productores de serin carbapenemasas encontrado en el presente trabajo. El 12,5% de cultivos de A. baumanii se encontró como productores de metalo-β-lactamasas resultados similares a los 14,3% obtenidos por Molina et al. (2019) en el hospital Alemán Nicaragüense, por otro lado los 34 aislamientos restantes (51,6%) de P. aeruginosa y los 11 (45,8%) de A. baumanii, que no presentaron sinergia con ninguno de los inhibidores, sugiere otros mecanismos de resistencia como la producción de carbapenemasas tipo oxacilinasas u otro tipo de mecanismo de resistencia (Caldera & Robles, 2017; Gastelo, 2016).
En el caso de S. maltophilia en el presente trabajo se ha encontrado solo 1 cultivo productor de metalobetalactamasa probablemente de tipo L1, puesto que estas son de tipo metallo-β-lactamase tanto el imipenem como el meropenem son inductores de L1 y, por lo tanto, no son eficaces contra S. maltophilia in vitro (Nicodemo & Garcia, 2007).
En cuanto a las enterobacterias productoras de serincarbapenemasas encontradas en este estudio probablemente se traten de cultivos productores de la carbapenemasa KPC puesto que es la más frecuente en enterobacterias (Vera et al., 2017) y la más frecuentemente reportada en varias regiones del Perú (Mayta et al., 2021), sin embargo, la epidemiología en los hospitales de la ciudad de Trujillo podría variar. En el presente trabajo no se encontró ningún cultivo de E. coli y K. pneumoniae como productoras de metalocarbapenemasas coincidiendo también con Faccio & Cubas, (2019). El presente trabajo ha demostrado que en el hospital Belén la frecuencia de metalocarbapenemasas en bacilos Gram negativos sigue siendo baja, a partir del año 2015 se ha notado que cada vez aparecen un mayor número de cultivos que están sintetizando a la vez carbapenemasas y BLEE (García, 2018).
En el presente trabajo contó como principal fortaleza el hecho de que existían reportes de aislamientos bacterianos con resistencia a carbapenémicos, así como el interés y total colaboración del personal de laboratorio de microbiología por empezar una investigación que constituyera un primer reporte de la presencia de carbapenemasas en el hospital. Entre las limitaciones de esta investigación fue no incluir en la recolección a cultivos de bacilos Gram negativos que mostraron sensibilidad a los carbapenémicos, puesto que también podrían haber sido productores de carbapenemasas, lo cual hubiese permitido conocer con más exactitud la presencia y dispersión de éstas enzimas en el hospital, de igual manera otra limitación es el no haber formado parte de esta investigación, la identificación de los tipos de genes de carbapenemasas que se estarían transfiriendo entre los bacilos Gram negativos.
Los resultados encontrados permitirán tomar las medidas preventivas para evitar la diseminación de estas cepas en el ambiente hospitalario, orientar en tomar la mejor decisión en cuanto a la administración de los antibióticos y manejo adecuado de los pacientes, así como empezar a construir un perfil epidemiológico que permita ir conociendo la prevalencia y expansión de bacilos Gram negativos productores de carbapenemasas en la región.
5. Conclusiones
Se detectó la producción de carbapenemasas en casi la mitad de bacilos Gram negativos resistentes a carbapenemicos aislados de pacientes del hospital Belén de Trujillo.
Las serincarbapenemasas son el tipo de carbapenemasas mayormente encontradas en los bacilos gram negativos aislados.
Pseudomonas aeruginosa y Acinetobacter baumanii son los bacilos Gram negativos no fermentadores de glucosa mayormente aislados como productores de carbapenemasas.
Existe una baja prevalencia de enterobacterias productoras de carbapenemasas en el hospital Belén de Trujillo.
6. Agradecimiento
Al área de microbiología del Laboratorio central del hospital Belén de Trujillo por la facilidad para la obtención de las muestras.
7. Contribución de autores
CAD: Generación y planteamiento de la investigación, procesamiento, análisis e interpretación de datos, borrador del artículo, revisión crítica y aprobación definitiva de la versión que se presenta
JGC: Generación y planteamiento de la investigación, borrador del artículo, revisión crítica y aprobación definitiva de la versión que se presenta
KCD: Toma de muestra y adquisición de datos
8. Conflicto de interés
Los autores declaran que no existe conflicto de interés
9. Referencias Bibliográficas
Acevedo, G., Dávila, Z., Yixria, D., & Montenegro, R. (2019). Caracterización fenotípica y genotípica de genes de resistencia productores de enzimas carbapenemasa tipo Metalo-β-lactamasas en enterobacterias aisladas de pacientes internos en el Hospital Alemán Nicaragüense (HAN) en el período enero a diciembre 2017. [Tesis para título, Universidad Nacional Autónoma de Nicaragua, Managua].
Arias, L., & Bracamonte, A. (2019). Validación del método Blue Carba para la detección rápida de carbapenemasas tipo metalobetalactamasas en cepas de bacilos gram negativos procedentes de los diferentes hospitales pertenecientes a la Red Nicaragüence para la vigilancia de la resistencia a los antimicrobianos [Tesis para título, Universidad Nacional Autónoma de Nicaragua, Managua].
Bevivino, A., Dalmastri, C., Tabacchioni, S., Chiarini, L., Belli, M., & Piana S, (2002). Burkholderia cepacia complex Bacteria from Clinical and Environmental Sources in Italy: Genomovar Status and Distribution of Traits Related to Virulence and Transmissibility. Journal of Clinical Microbiology, 40(3), 846-851.
Brink, A. (2019) Epidemiology of carbapenem-resistant Gram-negative infections globally. Current opinion in infectious diseases, 32(6), 609-616.
Brooke, J. (2021). Avances en la Microbiología de Stenotrophomonas maltophilia. Revisiones de microbiología clínica, 34(3), e0003019.
Bueno, J. (2015). Epidemiologia Molecular de Enterobacterias productoras de carbapenemasas [Tesis de maestría, Universidad Zaragoza, España].
Caldera, F., & Robles, D. (2017). Caracterización Fenotípica de Bacilos Gram Negativos Resistentes a carbapenemes procedentes de la Red Nicaragüense para la vigilancia de la Resistencia a los antimicrobianos Nicaragua Enero del 2014- diciembre 2016 [Tesis para Título Universidad Nacional Autónoma de Nicaragua, Managua].
Cercenado, E. (2015). Detección de enterobacterias productoras de carbapenemasas en la rutina del laboratorio. Rev Esp Quimioter, 28 (1), 8-11.
Drawz, S., & Bonomo, R. (2010). Tres décadas de inhibidores de betalactamasas. Revisiones de microbiología clínica, 23 (1),160-201.
Diene, S., & Rolain, J. (2014). Carbapenemase genes and genetic platforms in Gram-negative bacilli: Enterobacteriaceae, Pseudomonas and Acinetobacter species. Clinical microbiology and infection, 20(9), 831-8.
Doumith, M., Ellington, M., Livermore, D., & Woodford, N. (2009). Molecular mechanisms disrupting porin expression in ertapenem-resistant Klebsiella and Enterobacter spp. clinical isolates from the UK. The Journal of antimicrobial chemotherapy, 63(4), 659–667.
Escandon, K., Reyes, S., Gutierrez, S., & Villegas, M., (2017). The epidemiology of carbapenemases in Latin America and the Caribbean. Expert Rev Anti Infect Ther, 15(3), 277-297.
Espinoza, D., & Esparza, G., (2021). Resistencia enzimática en Pseudomonas aeruginosa, aspectos clínicos y de laboratorio. Revista Chilena de Infectología, 38 (1), 69-80.
Faccio, K; & Cuba, M. (2019). Detección de cultivos de Escherichia coli y Klebsiella pneumoniae productores de genes blaKPC y blaoxa-48; procedentes del Laboratorio de Referencia Regional en Salud Publica- La Libertad, marzo-junio 2018. [Tesis para obtener el título de Biólogo-Microbiólogo Universidad Nacional de Trujillo].
García, S. (2018). Carbapenemasas. Mecanismos de Resistencia y Métodos fenotípicos de detección de carbapenems [Tesis para Título Unversidad de Salamanca, España].
Gastelo, R., Díaz, R., & Maguiña, C. (2016) Carbapenemasas en bacterias Gram negativas no fermentadoras aisladas en servicios críticos del Hospital Regional de Lambayeque, diciembre 2014-julio 2015. Acta Med Peru, 33(3),183-8.
Gautam, V., Shafiq, N., Singh, M., Ray, P., Singhal, L., Jaiswal, N. P., Prasad, A., Singh, S., & Agarwal, A. (2015). Clinical and in vitro evidence for the antimicrobial therapy in Burkholderia cepacia complex infections. Expert. Rev. Anti. Infect. Ther, 13(5),629–663.
Gómez, A. (2011). Presencia de carbapenemasas en enterobacterias de muestras recolectadas de nueve hospitales de la ciudad de Quito [Tesis para Título, Pontificia Universidad Católica del Ecuador, Ecuador].
Gonzales, E., Vicente, W., Champi, R., Soto, J., Flores, W., & Lovera, M. (2013). Metalobetalactamasa en aislamientos clínicos de Pseudomonas aeruginosa en Lima, Perú. Rev Peru Med Exp Salud Pública, 30(2), 241-5.
Gulcan, H., Kuzucu, C., & Durmaz, R. (2004). Nosocomial Stenotrophomonas maltophilia croos-infection: Three cases in newborns. Am J Infect Control, 32(6), 365-8.
Hamidian, M., & Nigro, S. (2019). Emergence, molecular mechanisms and global spread of carbapenem-resistant Acinetobacter baumannii. Microbial Genomics, 5(10): e000306
Hartl, R., Widhalm, S., & Kerschner, H. (2013). Temocilin and meropenem to discriminate resistance mechanisms leading to decreased carbapenem susceptibility with focus on OXA-48 in Enterobacteriaceae. Clinical microbiology and infection, 19(5), 230-2.
Hidalgo, B. (2018). Prevalencia de bacilos gram negativos resistentes a carbapenémicos de pacientes hospitalizados en el Hospital General Enrique Garcés de Quito en el año 2017 [Tesis para Titulo, Universidad Central de Ecuador, Ecuador].
Holden, M., Seth, H., Crossman, L., Sebaihia, M., Bentley, S., & Cerdeno, A. (2009). The Genome of Burkholderia cenocepacia J2315, an Epidemic Pathogen of Cystic Fibrosis Patients. J Bacteriol, 191(1), 261-77.
Hong, D., Bae, I., Jan, I., Jeong, S., Kang, H., & Lee, K. (2015). Epidemiology and Characteristics of Metallo-β-Lactamase-Producing Pseudomonas aeruginosa. Infect Chemother, 47(2),81-97.
Kelly, A., Mathema, B., & Larson, E. (2017). Carbapenem-resistant Enterobacteriaceae in the community: a scoping. Revista Internacional de Agentes Antimicrobianos, 50(2),127-134.
Livermore, D. (2001). Of Pseudomonas, porins, pumps and Carbapenems. J Antimicrob Chemother, 47, 247-250.
Maguiña, C. (2016). Infecciones nosocomiales. Acta Med Perú, 33(3),175-7
Martínez, L., & González, J. (2014). Carbapenemases in Enterobacteriaceae: Types and molecular epidemiology. Enfermedades infecciosas y microbiología clínica, 32 (4), 4-9.
Mancilla, E. (2015). Detección de enterobacterias productoras de carbapenemasas en la rutina del laboratorio. Rev Esp Quimioter, 28(1), 8-11.
Mayta, M., Ramirez, J., Pampa, L., & Yagui, M. (2021). Molecular characterization of carbapenemases in Perú during 2019. Rev Perú Med Exp Salud Pública, 38(1),113-118.
Mena, J., Minoli, M., Garutii, A., & Aiassa, M. (2012). Búsqueda de KPC y Metaloβlactamasas en Pseudomonas aeruginosa aisladas en el Hospital Córdoba. Supervisión Microbiología, Servicio de Bioquímica, Hospital Córdoba, Ministerio de Salud.
Molina, A., Garcia, F., & Centeno, B. (2019). Caracterización fenotípica y genotípica de cepas de Pseudomonas aeruginosa y Acinetobacter baumannii resistentes a los carbapenémicos, aisladas de muestras clínicas de pacientes internados en salas del Hospital Alemán Nicaragüense, enero 2017 - febrero 2018. [Tesis para Titulo Universidad Nacional Autónoma de Nicaragua, Nicaragua].
Moncada, M. (2014). Caracterización Molecular de Aislamientos de Klebsiella pneumoniae portadores del GEN bla NDM-1 Procedentes de una Unidad Neonatal en un Hospital de Bogotá [Tesis de Maestría, Universidad Nacional de Colombia, Colombia].
Moreno, J., Castillo, Y., Delgado, A., Ayala, F., Licia, A., Lima, M., De Freitas, A., Valera, A., & Castillo, Z. (2013). β-lactamasas de espectro extendido y carbapenemasas en gérmenes gramnegativos aislados de muestras clínicas en los servicios de hospitalización. Unidad de infectología. Hospital Universitario “Dr. Ángel Larralde”. Estado Carabobo, enero -septiembre 2013. Bol Venez Infectol, 26 (2), 64-76.
Moya, B., Dötsch, A., Juan, C., Blazquez, J., Zamorano, L., Haussler, S., & Oliver, A. (2009). Beta-lactam resistance response triggered by inactivation of a non-essential penicillin-binding protein. PLoS Pathog, 5(3), e1000353.
Nicolau, C., & Oliver, A. (2010). Carbapenemasas en especies del género Pseudomonas. Enferm Infecc Microbiol Clin. 28(1),19-28.
Nicodemo, A., & Garcia, J. (2007). Antimicrobial therapy for Stenotrophomonas maltophilia infections. Eur J Clin Microbiol Infect Dis, 26, 229–237.
Nordmann, P., Nass, T., & Poirel, L. (2011). Global spread of carbapenemase-producing Enterobacteriaceae. Emerg Infect Dis, 17,1791-8.
Ortiz, D., Rodríguez, M., & Urbina, J. (2015). Identificación fenotípica de Enterobacterias productoras de carbapenemasa y genes que portan β-lactamasa de Espectro Extendido (BLEE), en cepas aislada de procesos infecciosos en los pacientes internos del Hospital Antonio Lenin Fonseca en los meses de abril a julio 2014. [Tesis para Título, Universidad Nacional Autónoma de Nicaragua, Managua].
Pang, Z., Raudonis, R., Glick, B., Lin, T., Cheng, Z., (2019). Antibiotic resistance in Pseudomonas aeruginosa: mechanisms and alternative therapeutic strategies. Biotechnol 37,177-92.
Pratt, S. (2018). Recomendaciones para detección de carbapenemasas en Enterobacterias y Pseudomonas aeruginosa. Instituto de Salud Pública Ministerio de Salud Gobierno de Chile.
Pasteran, F., Albornoz, E., Faccone, D., Gomez, S., Valenzuela, C., & Morales, M. (2012). Emergence of NDM-1-producing Klebsiella pneumoniae in Guatemala. Journal of Antimicrobial Chemotherapy, 67(7),1795-7.
Perozo, A., Castellano, M., Ling, E., & Arraiz, N. (2012). Detección fenotípica de metalobetalactamasas en aislados clínicos de Pseudomonas aeruginosa. Kasmera, 40(2), 113-121.
Quale, J., Bratu, S., Gupta, J., & Landman, D. (2006). Interplay of efflux system, ampC, and oprD expression in carbapenem resistance of Pseudomonas aeruginosa clinical isolates. Antimicrob Agents Chemother, 50,1633-41.
Rada, A., Hernández, C., Restrepo, E., Villegas, M. (2019). Distribución y caracterización molecular de betalactamasas en bacterias Gram negativas en Colombia, 2001-2016. Biomédica, 39,199-220.
Rhodes, K., & Schweizer, H. (2016). Antibiotic resistance in Burkholderia species. Drug Resist. Updat, 28, 82–90.
Rodríguez, J., Cisneros, J., Cobos, N., Fresco, G., Navarro-San Francisco, C., Gudiol, C., Horcajada, J., López-Cerero, L., Martínez, J., Molina, J., Montero, M., Paño-Pardo, J., Pascual, A., Peña, C., Pintado, V., Retamar, P., Tomás, M., Borges-Sa, M., Garnacho-Montero, J., & Bou, G. (2015). Diagnosis and antimicrobial treatment of invasive infections due to multidrug-resistant Enterobacteriaceae. Guidelines of the Spanish Society of Infectious Diseases and Clinical Microbiology. Enferm Infecc Microbiol Clin, 33(5),337.
Rodríguez, E. (2014). Caracterización genética de aislamientos de Klebsiella pneumoniae, resistentes a carbapenémicos, remitidos al grupo de resistencia bacteriana de Bogotá GREBO por hospitales del distrito, en un periodo de 3 años [Tesis de maestría Universidad Nacional de Colombia].
Rodríguez, C., Nastro, M., & Famiglietti, A. (2018). Carbapenemases in Acinetobacter baumannii. Review of their dissemination in Latin América. Rev Argent Microbiol, 50(3),327-333.
Rodríguez, R., Bustillo, D., Caicedo, D., Cadena, D., & Castellanos, C. (2016). Acinetobacter baumannii: patógeno multirresistente emergente. Médicas UIS, 29 (2), 113-135.
Shoulders, B; Casapao, A; & Venugopalan, V. (2020). An Update on Existing and Emerging Data for Meropenem-Vaborbactam. Clin Ther, 42(4), 692-702.
Tehrani, K; & Martin, N. (2018). B-lactam/B-lactamase inhibitor combinations: an update. MedChemComm, 9(9), 1439-56.
Vera, A., Barría, C., Carrasco, S., Lima, C., Aguayo, A., Domínguez, M., Bello, H., & González, G. (2017). KPC: Klebsiella pneumoniae carbapenemasa, principal carbapenemasa en enterobacterias. Revista chilena de infectología, 34(5), 476-484.
Velásquez, J., Hernández, R., Pamo, O., Candiotti, M., Pinedo, Y., & Sacsaquispe, R. (2013). Primer caso de carbapenemasa tipo KPC en Perú 2013. Rev Soc Peru Med Interna. 26(4),194-6.
Villa, J. (2020). Análisis genómico de Enterobacterales productores de carbapenemasas de interés clínico en el Hospital Universitario 12 de octubre [Tesis Doctoral Universidad Autónoma de Madrid, España].
Villegas, M., Lolans, K., Correa, A., Suarez, C., Lopez, J., & Vallejo, M. (2006). First Detection of the Plasmid-Mediated Class A Carbapenemase KPC-2 in Clinical Isolates of Klebsiella pneumoniae from South America. Antimicrob Agents Chemother, 50(8), 2880-2.