EFECTO DE DOS TIEMPOS DE CRIOPRESERVACIÓN Y DOS CRIOPROTECTORES, SOBRE LA VIABILIDAD DEL SEMEN DE Colossoma macropomum “GAMITANA”
EFFECT OF TWO CRYOPRESERVATION TIMES AND TWO CRYOPROTECTANTS, ON THE VIABILITY OF Colossoma macropomum “GAMITANA” SEMEN
Ehrlich Yam Llasaca Calizaya1, Elizabeth Norka Llasaca Calizaya2
1 Universidad Nacional de Moquegua – Filial Ilo, Ciudad jardín s/n, Moquegua, Perú
2 Universidad Nacional Jorge Basadre Grohman, Av. Cuzco s/n, Ciudad Universitaria, Tacna, Perú
Ehrlich Yam Llasaca Calizaya
Elizabeth Norka Llasaca Calizaya
Artículo original
Recibido: 6 de setiembre 2022
Aceptado: 31 de diciembre 2022
Resumen
El presente trabajo de investigación se desarrolló, con el propósito de evaluar el efecto de dos tiempos de criopreservación y dos crioprotectores, sobre la viabilidad del semen de Colossoma macropomum, “gamitana”. y se desarrolló en las instalaciones del Centro de Investigaciones “Fernando Alcántara Bocanegra”, del Instituto de Investigaciones de la Amazonía Peruana-IIAP. Se utilizó una proporción sexual 1:2 (Hembra: Macho), colectando el semen en solución de 0,4 M de sacarosa. Para el proceso de criopreservación el semen, se sometió a dos tiempos de congelación (6 minutos y 9 minutos) y dos niveles de crioprotectores (Nivel 1:10% de DMSO a 0,1 M y nivel 2:43% de dextrosa a 0,3 M). Se fertilizó con 25 μL de semen descongelado, utilizando un diseño factorial de 22, los cuales fueron sometidos a un ANOVA, al 95% de confianza.
Los resultados demuestran en la evaluación del semen fresco, que el tiempo de motilidad, presentó diferencia significativa p=0,021. Sin embargo, en la evaluación del semen post descongelación, el tiempo de motilidad y porcentaje de motilidad, no presentaron diferencia significativa (p > 0,05) para cada reproductor, pero se evidenció una reducción de los tiempos promedios, en comparación al semen fresco. Para el porcentaje de fertilización, sólo el tiempo de congelación presentó diferencia significativa (p=0,000001), para el macho 1 y para el macho 2 no se encontró diferencias significativas entre los tratamientos. Para el porcentaje de eclosión, según tiempo de congelación y porcentaje de crioprotector, para el macho 1, no se encontró diferencias significativas p > 0,05 y para el macho 2, se encontró diferencias significativas (p=0,043), para el porcentaje de crioprotector. En relación al porcentaje de malformación de las larvas, el tiempo de congelación y tipo de crioprotector, no mostraron diferencias significativas (p > 0,05), para los reproductores; sin embargo, fueron superiores en relación al tratamiento con semen fresco. Por lo cual se evidencia, que habría un factor desconocido del macho, que no permitía replicar los valores obtenidos, lo cual se manifiesta en la sinergia de las variables estudiadas, para esta especie.
Palabras claves: Colossoma macropomum, criopreservación de semen, dextrosa, motilidad, tiempo de activación.
Abstract
The present research work was developed, with the purpose of evaluating the effect of two cryopreservation times and two cryoprotectants, on the viability of Colossoma macropomum semen, "gamitana". and it was developed in the facilities of the “Fernando Alcántara Bocanegra” Research Center, of the Peruvian Amazon Research Institute-IIAP. A sex ratio of 1:2 (Female: Male) was used, collecting semen in a 0.4 M solution of sucrose. For the cryopreservation process, the semen was subjected to two freezing times (6 minutes and 9 minutes) and two levels of cryoprotectants (Level 1:10% DMSO at 0.1 M and level 2:43% dextrose at 0.3 M). It was fertilized with 25 μL of thawed semen, using a factorial design of 22, which were subjected to an ANOVA, at 95% confidence.
Fresh semen evaluation shows that motility time presented a significant difference p=0.021. However, in the post-thaw semen evaluation, motility time and motility percentage did not present a significant difference (p > 0.05) for each breeder, but a reduction in the average times was evidenced, compared to fresh semen. For fertilization percentage, only freezing time presented a significant difference (p=0.000001), for male 1 and male 2 no significant differences were found between treatments. For hatching percentage, according to freezing time and percentage of cryoprotectant, for male 1, no significant differences were found p > 0.05 and for male 2, significant differences were found (p=0.043), for cryoprotectant percentage. In relation to larvae malformation percentage, freezing time and type of cryoprotectant, did not show significant differences (p > 0.05), for breeders, however, they were higher in relation to fresh semen treatment. Therefore, it is evident that there would be an unknown factor of male, which did not allow replicating the values obtained, which is manifested in the synergy of variables studied, for this species.
Keywords: Colossoma macropomum, cryopreservation of semen, dextrose, motility, activation.
* Autor para correspondencia: E. mail: ehrlich.llasaca1@gmail.com
Citar como:
Llasaca, E., Llasaca, E. 2022. Efecto de dos tiempos de criopreservación y dos crioprotectores, sobre la viabilidad del semen de Colossoma macropomum “gamitana”. REBIOL, 42(2): 126-140.
1. Introducción
Los beneficios de la criopreservación de gametos (espermatozoides) son ampliamente conocidos e incluyen desde facilitar el mejoramiento genético de las especies de interés comercial hasta permitir la conservación de especies amenazadas o las que se encuentran en peligro de extinción (Cabrita et al., 2010; Liu, 2006; Martino, 2006; Otemé et al., 1996; Munkittrick & Moccia, 1984).
Sin embargo, varios protocolos para la crio preservación de espermatozoides de peces han sido desarrollados durante los últimos 25 años a pesar del gran número de estudios e investigaciones sobre criopreservación de semen, aun no se han logrado los procesos prácticos suficientes que permitan el uso de esta técnica a escala comercial (Lichtenstein et al., 2010; Vuthiphandchai et al., 2009; Muchlisina, et al. 2004; Carolsfeld et al., 2003; Chereguini et al., 1992; Leung & Jamieson, 1991). En general, los resultados son muy variables, indicando una alta sensibilidad de los protocolos propuestos, lo cual hace necesario, en la mayoría de los casos, ajustar el procedimiento para cada especie (Mocé et al., 2010; Rideout et al., 2004; Krone & Wittbrodt, 1997; Ciereszko & Dabrowski, 1993).
Aunque se han realizado varios esfuerzos para lograr la crioconservación eficiente de semen de algunas especies amazónicas, los índices de fertilidad hasta ahora obtenidos aún son inferiores a aquellos observados utilizando semen fresco. Los bajos índices de fertilidad podrían explicarse porque la mayoría de los protocolos estudiados han sido derivados de aquellos utilizados en especies marinas, particularmente salmónidos y ciprínidos. (Murgas et al., 2001; Martino, 2006; Maria et al., 2006).
Surge entonces la necesidad de realizar trabajos que permitan perfeccionar un protocolo para la crioconservación del semen de esta especie, que garantice adecuados índices de fertilidad y que permita aprovechar las ventajas que ofrece la inseminación artificial.
Por lo acotado, esta investigación tuvo por finalidad evaluar el efecto de diferentes tiempos de criopreservación, sobre la viabilidad de semen de C. macropomum, que garantiza un adecuado índice de fertilidad. Los resultados obtenidos, en esta investigación, brinda información y nuevos aportes científicos, en la optimización de la técnica de criopreservación.
Los hallazgos de este trabajo constituyen un paso muy importante, orientado hacia la conservación de la especie. Como también promover un banco genético con semen viable, que permitirá mantener las opciones de tener semen de buena calidad, disponible en el tiempo, de acuerdo a las demandas de reproducción.
2. Materiales y Métodos
Para la evaluación del efecto de diferentes tiempos de criopreservación, sobre la viabilidad del semen de Colossoma macropomum “gamitana”, se realizó el experimento en las instalaciones del Centro de Investigaciones de “Fernando Alcántara Bocanegra” (CIFAB) del Programa de Investigación para el Uso del Agua y sus Recursos (AQUAREC) del Instituto de Investigaciones de la Amazonía Peruana (IIAP), en el distrito de San Juan Bautista, provincia de Maynas, región Loreto, durante un periodo de 210 días aproximadamente trabajando con reproductores de C. macropomum “gamitana” que recibían una alimentación a razón de 1,5% de su biomasa, considerando contenido de 30,5 % de proteína y 2800 kcal de energía; alimentado de 2 a 4 veces/día.
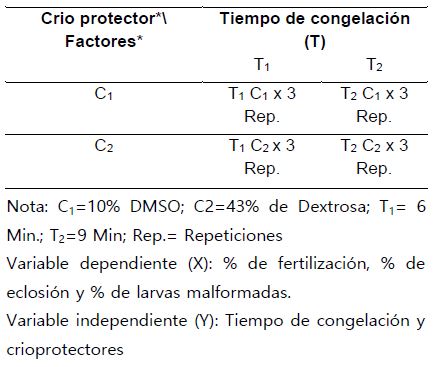
Se trabajó con un diseño de bloques al azar de arreglo factorial simétrico de 22 con 3 repeticiones (Tabla 1), para la evaluación del porcentaje de fertilización, porcentaje de eclosión y porcentaje de larvas malformadas.
Tabla 1. Factores y niveles de estímulo, aplicado a dos lotes de semen crio preservado de Colossoma macropomum “gamitana”
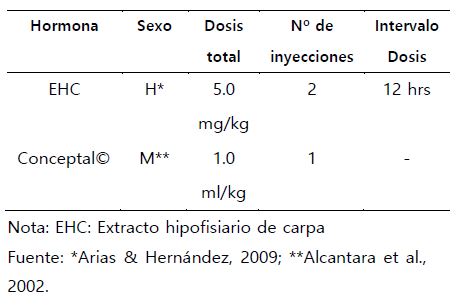
Se empleó un total de 20 reproductores machos y 9 hembras de los cuales se seleccionaron 3 reproductores: dos machos y una hembra en función a su estado de maduración gonadal, para realizar el proceso de inducción hormonal empleando diferentes dosis (Tabla 2). Así también se colectaron dos lotes de semen con solución de sacarosa 0.4 M a una proporción de 1/10 y 5,0 g., aprox. de óvulos de una misma progenie. Se trabajó con veintisiete (27) bandejas rectangulares de plástico de medio (1/2) litro colocadas en un tanque de cemento, revestido con mayólica blanca de 1,5 m. x 1,0 m x 1,0 m., de largo y con un tirante de agua de 0,7 m.
Tabla N° 02. Dosificación de EHC y Conceotal© para Colossoma macropomum “gamitana”
Procedimientos, técnicas e instrumentos de recolección de datos.
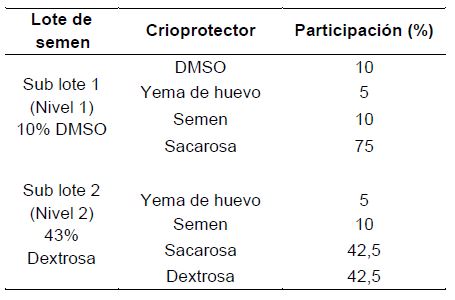
Se realizó la evaluación de concentración, volumen y motilidad de semen y para llevar a cabo la técnica de criopreservación de semen se realizó el mezclado de semen con crioprotectores a diferentes proporciones (Tabla 3), luego el sellado hermético por la presión en calor de las pajillas; posterior a ello el congelado a diferentes tiempos (6 y 9 min.) en cajas adiabáticas de 20 L empleando contenedores de nitrógeno líquido de 60 L de capacidad, dado durante 10 días de almacenamiento hasta el momento de la fertilización, previa descongelación (con agua a temperatura ambiente) para la obtención de óvulos. La fertilización de los óvulos, se realizó por el método seco, que consistió en echar semen (tanto fresco como descongelado) sobre la bandeja que contenían óvulos, según como lo recomendado por IIAP (2000).
Primeramente, se descongeló las pajillas que contenían el semen congelado en nitrógeno líquido, luego se agregó una gota de solución de Bicarbonato de Sodio (NaHCO3), a 0,1 M (para la activación de la motilidad), según lo recomendado por Vicuña (2012), para una mejor recuperación y activación de los espermatozoides congelados.
Tabla 03. Participación de crioprotectores, aplicado a los lotes de semen para criopreservación de cada reproductor macho de Colossoma macropomum “gamitana”
Se trabajó con los siguientes tratamientos:
- Tratamiento 1 (T1). - Criopreservación semi lenta (congelado en vapor de nitrógeno líquido, a unos 5 cm., de la superficie del nitrógeno, con un tiempo estimado de congelación de 6 min).
- Tratamiento 2 (T2). - Criopreservación lenta (congelado en vapor de nitrógeno líquido, a unos 10 cm., de la superficie del nitrógeno, con un tiempo estimado de congelación de 9 min).
- Tratamiento 3 (T3). - Semen fresco.
Así mismo, la incubación de los óvulos fertilizados se dio en envases de plástico descartables de 15 cm x 10 cm x 4 cm de alto, hasta su eclosión (18 horas post fertilización). Culminado el periodo de incubación se determinó la tasa de eclosión y tasa de larvas deformes.
Con los datos obtenidos, como resultado del experimento fueron procesados, para porcentajes de fertilización, para cada macho fueron descritos estadísticamente y expresados como media ± desviación estándar, valores mínimos y máximos, de acuerdo a los casos. Los factores de tiempo de congelación y los niveles de crioprotector fueron sometidas a un análisis de varianza factorial, previa normalización de los valores o resultados expresados en porcentajes, siendo transformados por el método del arco seno previo a su análisis en ANOVA siguiendo las recomendaciones de Lochmann et al. (2009) y al presentarse diferencias significativas, se realizó la prueba de comparación de medias. Los valores de P < 0,05 se consideraron como diferencia significativa.
3. Resultados
Efecto de dos tiempos de criopreservación y porcentajes de crioprotector, sobre el porcentaje de motilidad post descongelación, del semen de Colossoma macropomum, “gamitana”
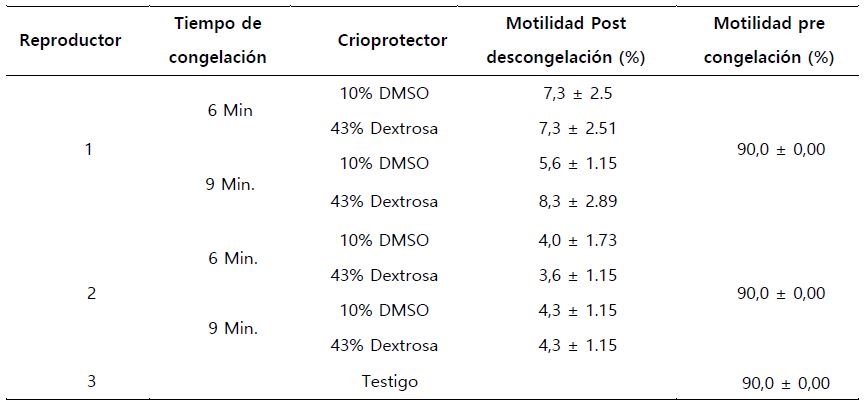
Los porcentajes de motilidad espermática post descongelación, de los tratamientos no presentaron diferencias significativas, tanto para cada variable o la interacción de las mismas, para cualquiera de los machos (p > 0,05). Obteniendo p= 0,81 y p= 0,35, para el tiempo de congelación y para el porcentaje del crioprotector respectivamente y para la interacción de ambas variables se obtuvo un p=0,35, para el macho 1 (Figura 1. a y b).
El segundo reproductor presentó un p= 0,51, p= 0,87 y p= 0,87, para el tiempo de congelación, porcentaje del crioprotector y la interacción de ambas variables, respectivamente (Figura 1.c y d). Lo que nos permite deducir, cuando comparamos la tasa de motilidad post descongelación entre los reproductores, que el tiempo de congelación y el porcentaje de crioprotector, no influyeron en el porcentaje de motilidad de semen post descongelado, siendo semejantes las tasas de motilidad para ambos machos. Sin embargo, cuando comparamos los valores medios, de la tasa de motilidad entre el semen post descongelado y el semen fresco, se evidencia la reducción del porcentaje de motilidad.
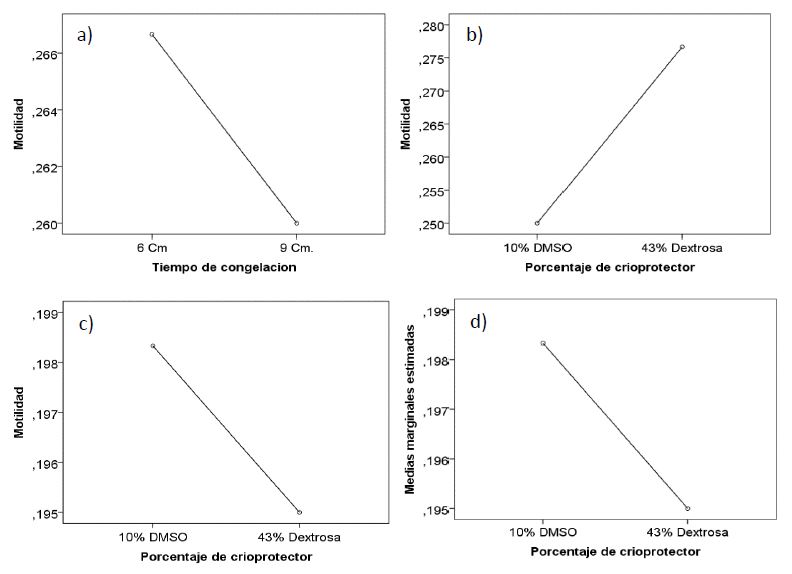
Figura 1. Motilidad de semen de “gamitana” post descongelación, según tiempo de congelación y porcentaje de crioprotector, para el macho 1 (a y b) y tiempo de congelación y porcentaje de crioprotector, para el macho 2 (c y d).
Así también, se observa que el rango del porcentaje de motilidad del espermatozoide post descongelado de los reproductores, varía de 3,6 ± 1,15 seg., hasta 8,3 ± 2,89 seg., lo cual está muy por debajo del porcentaje de motilidad del semen fresco, el cual fue de 90,00 ± 0,00 (Tabla 4).
Tabla 4. Valores promedio ±DS, de porcentaje de motilidad post descongelación, de lotes de semen criopreservado, según reproductor
Efecto de dos tiempos de criopreservación y porcentajes de crioprotector, sobre el porcentaje de fertilización de huevos de Colossoma macropomum “gamitana”
Los valores de fertilización con semen descongelado, presentó para el tiempo de congelación diferencias significativas (p=0,000001), lo que indica que el tiempo de congelación, si influyó sobre la capacidad fertilizadora de los espermatozoides. Para el porcentaje del crioprotector, no se encontró diferencia significativa (p=0,087), lo cual mostró que, no influyó del porcentaje del crioprotector sobre el espermatozoide descongelado. Sin embargo, cuando interactuaron ambos factores, si existió diferencia significativa (p=0,042), por lo cual el tiempo de congelación, influyó sobre el porcentaje del crioprotector utilizado. Obteniendo los mejores resultados cuando se criopreservó a 9 minutos y con 10% de DMSO, para el macho 1 (Tabla 5; Figura 2. a y b).
Para el macho 2, no existió diferencia significativa, para las variables de tiempo de congelación, porcentaje de crioprotector y la interacción de ambos (p=0,10, p=0,64 y p=0,54 respectivamente). Sin embargo, es de señalar que el tiempo de congelación de 9 minutos con 43% de Dextrosa, presentó el valor más alto en porcentaje de fertilización (47,97 ± 11,99). Siendo todos estos resultados, mucho menores que los logrados, cuando se fertilizó con semen fresco (65,69 ± 7,85) (Tabla 5; Figura 2. c y d).
Así también, se observa que el rango del porcentaje de fertilización de huevos, varía de 4,3% ± 2,27., hasta 47,97% ± 11,99 (Tabla 5).
Tabla 5. Valores promedio ±DS, de porcentaje de fertilización, de óvulos de Colossoma macropomum “gamitana”
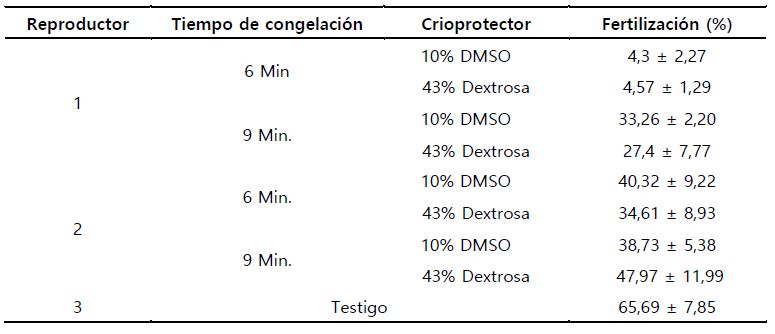
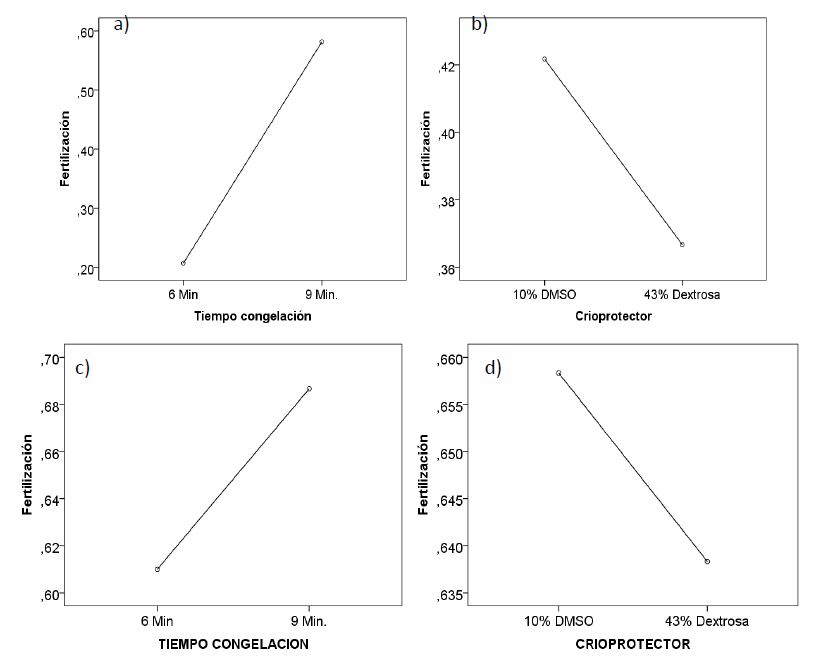
Figura 2. Valores de fertilización con semen descongelado, de “gamitana”, según tiempo de congelación y porcentaje de crioprotector, para el macho 1 (a y b) y para el macho 2 (c y d).
Efecto de dos tiempos de criopreservación y porcentajes de crioprotector, en el porcentaje de eclosión de huevos de Colossoma macropomum “gamitana”
El porcentaje de eclosión, para el primer macho, no presentó diferencias significativas (p > 0,05), para el tiempo de congelación, porcentaje de crioprotector y la interacción entre ambos factores, para todos los tratamientos, siendo p= 0,32, p= 0,45 y p= 0,73 respectivamente. Lo cual evidenciaría, que para el macho 1, el tiempo de congelación y el porcentaje de crioprotector, no influyeron sobre la tasa de eclosión (Tabla 6; Figura 3. a y b).
Para el segundo reproductor, se observó p= 0,12, p= 0,04 y p=0,512, para el tiempo de congelación, porcentaje de crioprotector y la interacción de ambas variables, evidenciando la diferencia significativa en el porcentaje de crioprotector. Lo que indicó que el porcentaje de eclosión fue influenciado por el porcentaje de crioprotector. Así mismo, el porcentaje de crioprotector influyó de manera independiente, no teniendo influencia sobre el tiempo de congelación. Por lo cual, la interacción entre ambos factores no influyó sobre la tasa de eclosión, evidenciando los mejores resultados, cuando se congeló a 9 minutos y con 10% de DMSO (94,25 ± 3,28), comparándolo aún con el testigo (semen fresco) (Tabla 6; Figura 3. c y d).
Así también, se observó que el rango del porcentaje de eclosión, varió de 79,05% ± 21,45 hasta 94,25% ± 3,28 (Tabla, 6). Lo cual está muy por debajo del porcentaje de fertilización del semen fresco el cual fue de 65,69% ± 7,85 (Tabla 5).
Tabla 6. Valores promedio ± DS, de porcentaje de eclosión, de óvulos de, Colossoma macropomum “gamitana”
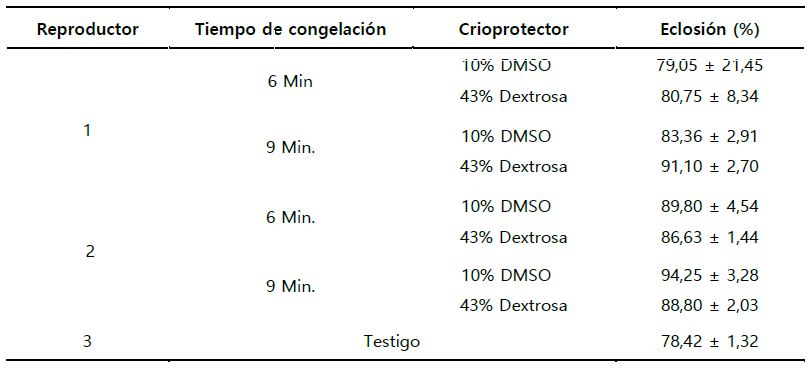
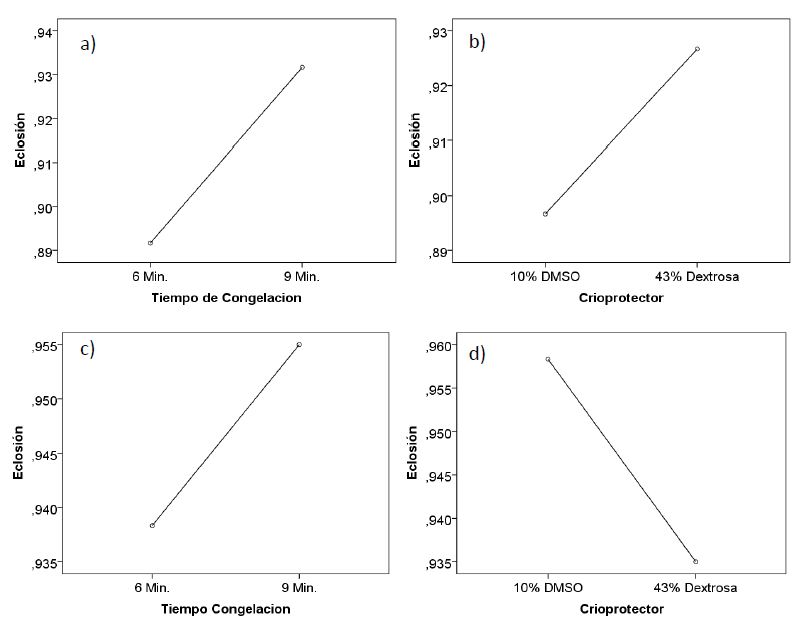
Figura 3. Valores de eclosión, con semen descongelado de “gamitana”, según tiempo de congelación y porcentaje de crioprotector, para el macho 1 (a y b) y para el macho 2 (c y d).
Efecto de dos tiempos de criopreservación y porcentajes de crioprotector, en el porcentaje de malformación de larvas, de Colossoma macropomum “gamitana”
Los porcentajes de malformaciones de larvas para el macho 1, no presentaron diferencias significativas para el tiempo de congelación, porcentaje de crioprotector y la interacción entre ambos factores, para todos los tratamientos, siendo p= 0,77, p= 0,87 y p= 0,70, respectivamente. (Tabla 7, Figura 4. a y b). Así también, para el segundo reproductor se evidenció p=0,27, p=0,92 y p= 0,23, para el tiempo de congelación, porcentaje de crioprotector y la interacción de ambos factores, respectivamente (Figura 4. c y d). Lo cual indicó que, para ambos machos, el tiempo de congelación no influyó, sobre el porcentaje de criopreservación (Tabla 7; Figura 4). Lo cual nos permite inferir, que los valores de larvas deformes obtenidas en las diferentes técnicas de criopreservación, es estadísticamente similar, para todos los tratamientos.
Así mismo, se observó los mayores valores de larvas malformadas, cuando se congeló en 9 minutos y 10% de DMSO, para el macho 1 y 2 (53,40 ± 40,48 y 52,39 ± 14,71, respectivamente). Así también, los menores valores de larvas deformes, se observó cuando se congeló en 6 minutos y con 10% de DMSO, para el macho 1 y 2 (36,11 ± 12,73 y 31,33 ± 13,05, respectivamente). Por lo cual, se podría pensar según las medias observadas, que el tiempo de congelación podría estar influyendo sobre el porcentaje del crioprotector en la malformación de larvas, observando que en 6 minutos de congelación y con 10% de DMSO, se obtuvo los valores más bajos de malformación de larvas y congelando en 9 minutos, aún en presencia de DMSO, se observó los valores medios más altos de larvas malformadas. Por lo cual, congelando a 6 minutos y con 10% de DMSO, se protege mejor la célula al daño del ADN, por el proceso de criogénesis (Tabla 7, Figura 4).
Estos valores obtenidos, nos permite inferir que el efecto tóxico del DMSO, aumentó cuando se congeló en 6 minutos, en presencia de sacarosa.
Así también, se observa que el rango del porcentaje de larvas deformes, varió de 31,33% ± 13,05 a 53,40 ± 40,48, lo cual está por encima del porcentaje de deformes del testigo, el cual fue de 18,39% ± 10,11 (Tabla 7).
Tabla 7. Valores promedio ±DS, de porcentaje de malformación de larvas, Colossoma macropomum “gamitana”.
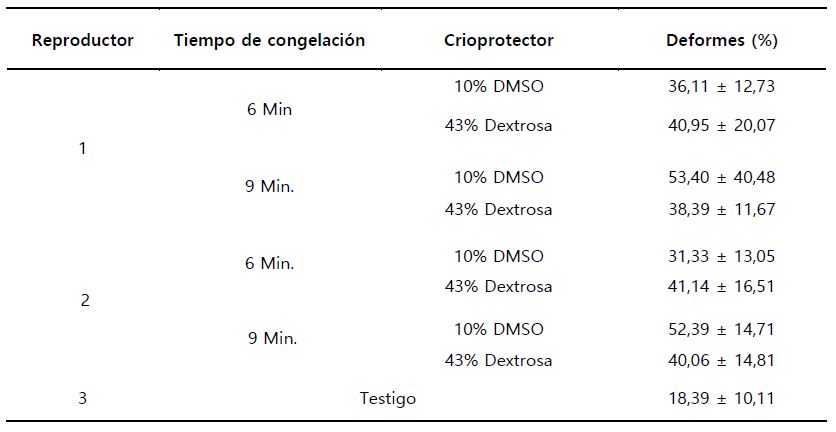
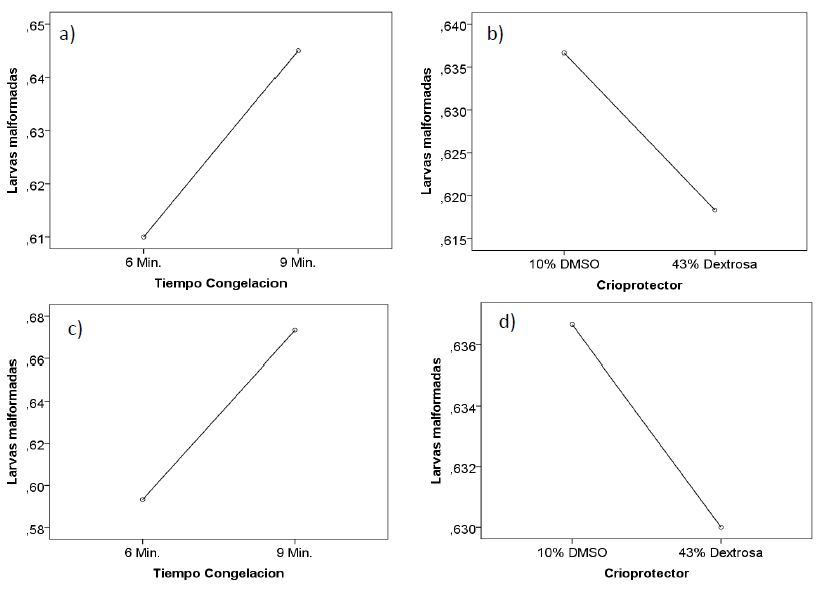
Figura 4. Valores de malformación de larvas de “gamitana”, según tiempo de congelación y porcentaje de crioprotector, para el macho 1 (a y b) y macho 2 (c y d).
4. Discusión
Efecto de dos tiempos de criopreservación y porcentajes de crioprotector, sobre el porcentaje de motilidad post descongelación, del semen de Colossoma macropomum “gamitana”
Si bien la estrategia reproductiva y el hábitat en la que se encuentre una determinada especie condiciona el tiempo de activación espermática que se pueda presentar (Osorio, 2017; López et al., 2018; Medina et al., 2020), por lo general, se considera que tanto el tiempo de vida como el tiempo de activación de los espermatozoides en peces es muy corto (Boryshpolets et al. 2018), además de ello, en procesos de criopreservación se generan daños celulares que influyen tanto en la calidad final de semen como en la fertilidad seminal, y en casos de activación de semen post descongelado se reduce más el tiempo disponible para la fertilización (Harvey & Carolsfeld, 1993; Medina et al., 2005; Medina et al., 2020), debido al estrés osmótico a nivel celular y a la deshidratación, cristalización/recristalización, toxicidad y cambios en los fosfolípidos en la membrana plasmática (Mazur, 1984; Watson, 2000; Martínez, 2010), trayendo como consecuencia la desnaturalización de las macro moléculas de la célula, produciendo el encogimiento de la célula (membrana plasmática) de forma irreversible (Medeiros et al., 2002), así mismo, una tasa de congelación entre -15°C a -60°C es la más crítica, pudiendo ocurrir la formación de cristales de hielo extracelular e intracelular (Marques, 2013). Así mismo, cuando la velocidad de congelación se da lentamente, el medio se vuelve ligeramente hiperosmótico, lo cual provoca que la tensión en la membrana plasmática aumente, ocurra deshidratación celular y la afluencia de iones (Mazur, 1984; Yang & Tiersch, 2009). Así también, diferentes estudios recomiendan el desarrollo de una descongelación rápida, debido a que se disminuye la recristalización del hielo, generando un menor daño a nivel celular (Bernardi et al., 2015 y Valera & Stive, 2021); por lo tanto, el tipo de congelamiento es importante en el proceso de criopreservación, en semen de peces, porque puede influenciar en la velocidad de congelamiento y descongelamiento (Rodina et al., 2007). En función a ello, se considera que para evitar los daños señalados se emplee diluyentes, que pueden diferir en cada especie, con propiedades crioprotectoras que protejan o disminuyan el daño producido por los efectos de la congelación (Pegg, 2014).
La inactivación temporal de la motilidad de espermatozoides es importante para conservar la calidad seminal durante el proceso de criopreservación, así mismo la célula debe mantener su integridad y funcionalidad hasta el momento de la descongelación (Maria et al., 2011; Carneiro et al., 2012), por lo cual los estudios realizados en esta especie reportan drásticas reducciones de motilidad de espermatozoide expuesto a nitrógeno líquido. Martino, (2006) reporta motilidades entre 5% a 20%, utilizando solución salina 0,9%, 10% DMSO y 10% de Yema de huevo. Lo que coincide con Varela et al. (2012) y Maria et al. (2011), en relación al porcentaje de criorprotector. Así mismo, Galo et al., (2020) reporta motilidades de 14,40 ± 9,15 % empleando DMSO.
Varela et al. (2012), reportó motilidades hasta 20% (incluyendo motilidad nula), utilizando 10% de DMSO como crioprotector, cuando aumenta la concentración de DMSO a 20%. Esto también coincide con Carolsfeld et al. (2003), que reportó motilidades de 0% a 5% activado con 25 mMol de NaCl y hasta el del 20% de motilidad con 1% de Bicarbonato de sodio, como medio de activación de la motilidad, para algunas especies de peces migradores brasileños. Así también, se reportaron, similares valores para otras especies de peces. Por todo esto, nuestros valores obtenidos guardan relación con el protocolo de criopreservación ejecutado, estando nuestros valores dentro de los reportados.
Una explicación, a la reducción del porcentaje de motilidad está referido, que, dentro del testículo, los fluidos seminales, contienen iones y azúcares, que le permite mantener la estabilidad al espermatozoide, algo que se busca lograr cuando le adicionamos sustancias crioprotectoras, que tienen como principal función deshidratar en parte a la célula, para que ingrese el crioprotector intracelular y que no permita la formación de cristales al interior de la célula. Sin embargo, el incremento del DMSO, mezclado con glucosa en combinación con 10% de DMSO, también causan daño en el espermatozoide (Martínez, 2010). Así también, Stock et al. (2018) establecieron que el DMSO es un componente muy usado en procesos de criopreservación debido a su capacidad de deshidratar células, lo cual podría evitar la formación de cristales de hielo, sin embargo, pueden ser tóxicos, lo cual guarda relación con nuestro trabajo considerando que se presentó elevados porcentajes de malformación de larvas, según los diferentes crioprotectores. Diferentes autores indican la toxicidad del DMSO frente a los espermatozoides, lo cual influye negativamente en la estabilidad del mismo, existiendo reportes que indican la toxicidad a partir del 5%, para Lates calcarifer (Leung, 1998, Gwo & Arnold, 1991) y en algunos caracidos: Prochilodus lineatus (Viveiros et al., 2009) y en B. amazonicus (Cruz-Casallas et al., 2004), cuando la concentración DMSO también llegó a 15%. En estudios para B. moorei se presentó una menor movilidad (30,6±7,9%).
Así como, movilidad nula (69,4±7,9%) con el uso de DMSO al 15 % (Atencio-García et al., 2017). Para nuestra especie, Varela et al. (2012), reporta 24% de daños producido a nivel de la integridad de la membrana, trayendo como consecuencia valores del 20% de tasa de motilidad, cuando se utilizó 10% de DMSO, llegando a motilidad nula a 20% de presencia del DMSO. Por lo cual, los daños tanto en a nivel de células espermáticas (toxicidad), se puede dar por la sola presencia del crioprotector o la ausencia en el interior celular, lo que altera los procesos de nucleación (Zachariassen & Kristiansen, 2000) y también, se podría mencionar en combinación con la glucosa (Martínez, 2010). Guardando relación con lo anteriormente reportado por otros autores, en relación a los resultados obtenidos.
Efecto de dos tiempos de criopreservación y porcentajes de crioprotector, sobre el porcentaje de fertilización de huevos de Colossoma macropomum “gamitana”
El proceso de fertilización, se da cuando el espermatozoide logra fecundar al óvulo, ocurriendo cuando el espermatozoide, se activa. Pérdidas en cuanto a la fertilización es posible cuando el espermatozoide no ha sido activado homogéneamente. Siendo el plasma seminal el que se encarga de la su inactivación (Tiersch & Green, 2011).
El proceso de criopreservación, influye sobre el funcionamiento biológico de la célula, como la alteración de la estructura física, comprometiendo la carga genética (Labbe et al., 2001; Cabrita et al., 2005), lo que podría ocasionar una reducción de la calidad seminal criopreservada (Medina et al., 2020), lo cual repercutirá en la tasa de fertilización. El proceso de descongelación rápida del semen ayuda a reducir los daños ocasionados al principio del proceso de criopreservación (Noel, 2017).
En la fertilización con semen criopreservado Freitas, (2013), reporta la utilización de 250 μL/g de óvulo de “gamitana”, obteniendo valores entre 15% a 20% de tasa de fertilización, teniendo una densidad de 9,73x105 espermatozoides/óvulo, utilizando 250 μL de semen descongelado/g de óvulo, activando los espermatozoides con agua destilada, lo cual es inferior a lo observado en este experimento, en relación a la tasa de fertilización. Valores similares, al reportado en este trabajo, coincide con lo reportados por Martino (2006), quien obtiene de 10% a 34 % de la tasa fertilización, para esta especie, aproximándose nuestros valores a los obtenidos por Marques, (2013), quien reporta tasas de fertilización de 41% a 45%, lo cual difiere con Varela et al. (2012)., quien reporta valores de fertilización de 22% hasta 74%. Por lo mencionado anteriormente, para otras especies de la misma familia (B. siebenthalae), se obtiene tasas de fertilización de 51% hasta 75%, lo cual es inferior a los valores obtenidos (77% a 85%) con semen fresco, según lo reportado por Cruz-Casallas & Velasco (2002).
Leite et al. (2013), reportó que es necesario 100 000 espermatozoides/ovocito, en procesos de fertilización artificial. Nuestros valores de relación espermatozoides/ovocito están cercanos, habiendo utilizado 75 000 espermatozoides/óvulo. Por lo cual, nuestros tasas de fertilización en general están dentro de lo reportado, considerando que fueron activados con solución de Bicarbonato de sodio (NaHCO3) a 0,1 M, como medio activador, lo que coincide con Carolsfeld et al. (2003), para P. corruscans; Cruz-Casallas et al. (2004), para B. amazonicus; Andrade-Talmelli et al. (2001), para B. insignis; Kamavoto et al. (1996), para P. lineatus; Luz et al. (2001), para S. scriptum; Vicuña (2012), para Colossoma macropomum y Marques (2013), para P. magdalenae; en relación a la capacidad como medio promotor de la activación espermática, ayudando a aumentar la fertilización.
Los resultados obtenidos, sobre el efecto del tiempo de congelación en la tasa de fertilización, corroborarían lo descrito anteriormente, con relación a la capacidad fecundante de los espermatozoides (motilidad), que son afectados por el proceso de congelación y descongelación, con relación al estado de integridad de la célula, tanto externamente como internamente. Sin embargo, podría pensarse que el volumen de semen empacado podría influenciar en la capacidad fertilizadora. Según lo reportado por Marques (2013), la capacidad de fertilización de los espermatozoides, no fue afectada por el volumen del semen congelado en criotubos. Así también, el tiempo de descongelamiento del semen, es otro factor que podría estar influenciando negativamente en relación a la calidad y capacidad fertilizadora de los espermatozoides de ésta especie, cuando fue descongelada a 60°C (Marques, 2013), Considerando que incluso cambios bruscos de temperatura podrían ser letales para los espermatozoides, por ello es importante el control tanto de tiempo como de temperatura en este proceso (Ramírez et al., 2010; Bernardi et al., 2015). Sin embargo, en otras especies como el B. amazonicus, la mayor tasa de fertilización se logró descongelando semen criopreservado a 35°C. y en Prochilodus lineatus, no se observó diferencia en la calidad y fertilización del semen criopreservado, que fue descongelado a 30°C y a 60°C (Martínez, 2010).
Efecto de dos tiempos de criopreservación y porcentajes de crioprotector, en el porcentaje de eclosión de huevos de Colossoma macropomum “gamitana”
Nuestros resultados permiten inferir, que el crioprotector tiene influencia independientemente sobre el porcentaje de eclosión y sobre el reproductor. Esto podría deberse, en las cualidades propias de cada reproductor y el rol del crioprotector. Siendo el DMSO uno de los mejores crioprotectores por su efectividad en la crioconservación, cuando se trabaja con semen de especies icticas, en su mayoría tropicales (Atencio et al., 2013; Restrepo-Betancur et al., 2017), lo cual se ve reflejado en lo reportado por Varela et al. (2012)., quien reporta una tasa de eclosión del 47,3% ±2,5, cuando utilizó 10% de DMSO, en comparación con 37,4% ± 4,5 de eclosión cuando fue con 5% de DMSO, sin embargo, la tasa de eclosión fue inversamente proporcional, a medida que aumentaba la concentración de DMSO, lo cual evidencia el nivel tóxico de este crioprotector intracelular, en mayores proporciones. Esto es un inconveniente por cuanto se requiere obtener mayores tasas de eclosión, pero sin efectos tóxicos secundarios que permitan llegar a niveles comerciales.
Sin embargo, Freitas (2013), reporta tasas de eclosión de 65% a 85% aproximadamente, utilizando 10% de DMSO y glucosa como medio de dilución. Nuestros resultados obtenidos están dentro de lo reportado anteriormente, para ambos reproductores. Sin embargo, en este experimento, nuestros resultados, pondrían en evidencia, que los parámetros zootécnicos pueden variar entre reproductores. Si consideramos lo manifestado por Varela et al. (2012), que indica que la integridad del espermatozoide probablemente produzca un impacto negativo sobre la tasa de eclosión. Lo cual se evidenciaría, por lo descrito en las discusiones anteriores, cuando comparamos con otros autores, que si bien, es posible replicar el proceso, los valores a obtener no podrían ser los mismos, considerando las sinergias entre las variables estudiadas, para lo cual habría que agregársele las condiciones del reproductor, como un factor a estudiar. Lo cual pondría en manifiesto, que habría que desarrollar una metodología más eficaz de evaluación de la integridad del espermatozoide, como medio de evaluación de calidad espermática para los procesos de criopreservación.
Al comparar nuestros resultados, con las tasas de eclosión del tratamiento testigo, evidenciamos que los mejores resultados fueron obtenidos, cuando fue incubado en envases de medio litro, sin flujo de agua. Lo cual, evidenciaría que el tipo de incubadora y/o el sistema de incubación, podría también afectar la tasa de eclosión, como por ejemplo el movimiento de los embriones durante el tiempo de incubación, está influenciado por el caudal que no puede ser constante y que los embriones no estén en suspensión durante todo el tiempo de incubación o se golpeen entre ellos.
Efecto de dos tiempos de criopreservación y porcentajes de crioprotector, en el porcentaje de malformación de larvas, de Colossoma macropomum “gamitana”
La presencia de larvas deformes, en trabajos de investigación, no es considerada, puesto que es algo común en sistemas de producción de peces, considerando que la presencia no sólo se puede dar cuando se usa semen criopreservado, sino también con semen fresco, según lo reportado por Miskolczi et al. (2005), para el Clarias gariepinus. Lo que coincide con lo manifestado por Martínez (2010), quien reportó la presencia de larvas malformadas para P. magdalenae, usando semen fresco y criopreservado, así también indicó que es posible encontrar grandes cantidades de larvas malformadas, inclusive superiores al tratamiento control de manera significativa. Por lo cual, es posible inferir que el daño del crioprotector hacia la integridad celular, también esta mediado por la presencia de glucosa, la cual aumentaría el daño a nivel del ADN. Por lo cual, a medida que aumenta el crioprotector aumentaba el daño o la malformación larval. Lo cual coincide con lo reportado por Proaño (2013) en la especie Rhinella marina, donde a una concentración de 15% de DMSO se presentó una mayor tasa de malformación que al emplear un 5 o 10 % de DMSO. En estudios realizados por Miskolczi et al. (2005), para P. magdalenae, reportó tasas de malformación larval, sin embargo, no encontró diferencia significativa con el grupo control. Para nuestro estudio, coincide con lo reportado, en relación los valores encontrados, de malformación de larvas entre los tratamientos, no siendo así cuando comparamos con el grupo control, que si bien, hay presencia de larvas deformes, éstas son en tasas inferiores, lo cual coincide con Horváth & Urbanyi (2000) y Varela et al. (2012), manifiesta que la integridad del espermatozoide probablemente produzca un impacto negativo sobre en la alteración del desarrollo embrionario. Así entonces, la temperatura de congelamiento y la presencia de azúcares, aumenta la capacidad tóxica del DMSO, por lo cual se evidencia, el efecto del proceso de congelación y crioprotector, sobre la calidad de larvas a obtener.
Kopeika et al. (2004), reporta la existencia de sistemas de reparación de ADN en ovocitos en peces, los cuales pueden reparar el daño de la fragmentación de los ácidos nucleicos en el espermatozoide, que hayan sido afectados por algún agente tóxico, siendo esta capacidad de forma limitada, según el tipo de daño. Así también, lo confirma Martínez (2010), para el P. magdalenae, en la cual no encontró la existencia de una correlación entre la fragmentación del ADN y la malformación de larvas, demostrando la existencia de ese mecanismo de reparación celular. Así mismo, May et al. (1988), indicaron que las larvas con un solo “n” cromosomal (haploides), sea del padre (androgenéticas) o la madre (ginogenéticas), exhiben tipos de malformación. En nuestro trabajo, la mayoría de las larvas malformadas, presentaban curvatura de la espina o columna vertebral, lo que coincide con Martínez, (2010), quien reportó los mismos daños y ausencia de saco vitelino, cabeza y cola, presentes en el tratamiento de 10% de DMSO y 6,5% de Glucosa. De modo que, para nuestro caso, habría la posibilidad de dicho efecto reparador, que podrían vislumbrarse, con estudios más específicos de la existencia de este mecanismo, que podría ser una adaptación evolutiva de reparación intracelular.
5. Conclusiones
Las técnicas de criopreservación, reducen drásticamente, el porcentaje de motilidad de los espermatozoides de Colossoma macropomum, pudiéndose obtener mayores tasas de fertilización, congelando espermatozoides a una velocidad de enfriamiento relativamente lenta, independientemente del tipo de crioprotector y obtener tasas de eclosión semejantes, independientemente del tiempo de congelación o tipo de crioprotector; observando la afectación del proceso criogénico sobre las tasas de larvas malformadas, influyendo el factor macho sobre estos parámetros zootécnicos reproductivos
6. Agradecimientos
Se agradece a la Universidad Nacional de Moquegua, por las contribuciones realizadas al presente estudio.
7. Contribución de los autores
Ehrlich Yam Llasaca Calizaya: Elaboración del proyecto, ejecución del proyecto, análisis e interpretación de datos, levantamiento de observaciones.
Elizabeth Norka Llasaca Calizaya: Redacción, orientación en la ejecución del proyecto, análisis e interpretación de resultados, levantamiento de observaciones.
8. Conflicto de intereses
Los autores expresan que no hay conflicto de intereses al redactar el manuscrito
9. Referencias Bibliográficas
Alcántara, F.; Rodriguez, M., Kholer, C., Kholer, S., Camargo, W. (2002). Reproducción Inducida de Paco y Gamitana. Instituto de Investigaciones de la Amazonía Peruana. Southern Illinois University at Carbondale, USA. 1-7.
Andrade-Talmelli, E., Kavamoto, E., Fenerich-Verani, N. (2001). Características seminais da piabanha, Brycon insignis (Steindachner, 1876), após estimulação hormonal.B. Inst Pesca 27:149-154.
Arias, J. & Hernández, J. (2009). Efectos del extracto hipofisiario de carpa común y el análogo de GnRH sobre la maduración final del oocito y el desove de la cachama negra (Colossoma macropomun). J. FCV-LUZ / Vol. XIX, Nº 5: 486-494.
Atencio, V., Perez, E., Espinosa, J., & Pardo, S. (2013). Evaluación de dimetilacetamida como crioprotector para la crioconservación de semen de bocachico Prochilodus magdalenae. Archivos de Medicina Veterinaria, 45(2), 151–158.
Atencio-García, J., Dorado, M., Montes, C., Prieto-Guevara, M, & Espinosa-Araujo, J. (2017). Crioconservación de semen de dorada Brycon moorei con dimetilsulfóxido. Revista Colombiana de Biotecnología, 19(2), 81-88.
Bernardi, S., Di Prinzio, M., Maglione, D., Rinaudo, A., & Marini, P. R. (2015). Efecto del protocolo de descongelación de semen sobre el porcentaje de preñez en bovinos lecheros. Revista Veterinaria, 26(1, 27-32).
Boryshpolets, S., Kholodnyy, V., Cosson, J., & Dzyuba, B. (2018). Fish sperm motility analysis: The central role of the flagellum. In Reproduction, Fertility and Development, 30(6), 833–841.
Cabrita, E., Sarasquete, S. Martínez-Páramo, V. Robles, J. Beirao, S. Pérez-Cerezales y M. Herraéz. (2010). Cryopreservation of fish sperm: applications and perspectives. J. Appl. Ichthyol. (26) 623–635.
Cabrita, E.; Robles, V., Rebordinos, L., Sarasquete, C., & Herráez, M. (2005). Evaluation of DNA damage in rainbow trout (Oncorhynchus mykiss) and gilthead sea bream (Sparus aurata) cryopreserved sperm. Cryobiology (50) 144-153.
Carneiro, P., Azevedo, H., Santos, J. & María, A. (2012). Criopreservación de semen de tambaqui (Colosoma macropomum): diluyentes, crioprotectores, relaciones de dilución y métodos de congelación. Cryo-Letters, 33 (5), 385-393.
Carolsfeld, J., Godinho, H., Zaniboni, E. & Harvey, B. (2003). Cryopreservation of sperm in Brazilian migratory fish conservation. J. Fish Biol.; (63) 472-89.
Ciereszko, A.; L. Ramseyer y K. Dabrowski. (1993). Cryopreservation of perch semen. The Prog. Fish. Cult. (55) 261-264.
Ciereszko, A. & Dabrowski, K. (1993). Estimation of sperm concentration of rainbow trout, whitefish and yellow perch using a spectrophotometric technique. Aquaculture (109) 367-73.
Chereguini, O., Fernández, P., & Rasines, I. (1992). Adaptación de la técnica de críopreservación de esperma para el Rodaballo (Scohthalmus maximus) y Besugo (Pagellus bogaraveo). Instituto español de Oceanografía. (117) 1-11.
Cruz-Casallas, P., Pardo-Carrasco, S., Arias-Castellanos, J., Lombo-Rodríguez, D., Pardo-Mariño, J. (2004). Cryopreservation of Yamú Brycon siebenthalae Milt. J. World Aquac. Soc, 35, 529-535.
Cruz-Casallas, P. & Velasco, Y. (2002). Criopreservación de semen de yamú (Brycon siebenthalae): Calidad seminal; dosis inseminante y sistemas de empaque. Instituto de Acuicultura de la Universidad de los Llanos. Villavicencio. Universidad de los Llanos-Colciencias.
Freitas, R. (2013). Criopreservação seminal do tambaqui Colossoma macropomum. [Tesis de maestria, Universidad Federal do Rio Grande do Sul, Brasil].
Galo, J., Streit, D., Corcini, C., Varela, A., Jardim, R., & Ribeiro, R. (2020). Protein profile as a quality indicator of cryopreserved semen from tambaqui Colossoma macropomum (Cuvier, 1818). Brazilian Journal of Biology, 80(4), 752–762.
Gwo, J. & Arnold, C. (1991). Cryopreservation of Atlantic croaker spermatozoa: evaluation of morphological changes. Journal Experiment Zoology, 264, 444-453.
Harvey, B. & Carolsfeld, J. (1993). Induced Breeding in tropical Fish Culture, Otawa: International Development Research Centre.
Horváth, A. & Urbányi, B. (2000). The effect of cryoprotectants on the motility and fertilizing capacity of cryopreserved African catfish Clarias gariepinus (Burchell 1822) sperm. Aquaculture Research, (31), 317-324.
Instituto de Investigaciones de la Amazonía Peruana (IIAP). (2000). Cultivo y procesamiento de peces nativos: una propuesta productiva para la Amazonía peruana. 14-22.
Kavamoto, E., Narahara, M., Mainardes-Pinto, C., Andrade-Talmelli, E., Romagosa, E., & Ferraz, E. (1996). Efeito do hCG na produção de sêmen do curimbata (Prochilodus scrofa Steindachner, 1881). Rev Ceres 43,76–85.
Kopeika, J., Kopeika, E., Zhang, T., Rawson, D., & Holt, W. (2004). Effect of DNA repair inhibitor (3-aminobenzamide) on genetic stability of loach (Misgurnus fossilis) embryos derived from cryopreserved sperm.Theriogenology, 61(9), 1661-1673.
Krone, A. & Wittbrodt, J. (1997). A simple and reliable protocol for cryopreservation of Medaka (Oryzias latipes) spermatozoa. J. The Fish Biology Medaka. (9) 4-48.
Labbe, C.; Martoriati, A., Devaux, A., &. Maisse, G. (2001). Effect of sperm cryopreservation on sperm DNA stability and progeny development in rainbow trout. Mol Reprod Dev, 60(3),397-04.
Leite, L, Melo, M., Oliveira, J., Pinheiro, J., Campello, C., Nunes, J., & Salmito-Vanderley, C. (2013). Determinação da dose inseminante e embriogênese na fertilização artificial de tambaqui (Colossoma macropomum). Arq. Bras. Med. Vet. Zootec, 65 (2), 421 – 429.
Leung, K. & Jamieson, B. (1991). Live preservation of fish gametes. En: Jamiesson BGM, editor. Fish evolution and systematics: Evidence from spermatozoa. Cambridge: University Press: 245-69.
Lichtenstein, G., Mariano, E., & Miranda, L. (2010). Development of sperm cryopreservation techniques in pejerrey Odontesthes bonariensis. Aquaculture (306), 357–361.
Liu, Q., Li, L., Zhang, S., Ding, F., Xu, X., Xiao, Z., & Xu, S. (2006). An Efficient Methodology for Cryopreservation of Spermatozoa of Red Seabream, Pagrus major, with 2-mL Cryovials. Journal of the World Aquaculture Society, 37 (3) 289 – 297.
Lochmann, R., Chen, R., Chu, F., Camargo, W., Kohler, C., & Kasper, C. (2009). Effects of carbohydrate-rich alternative feddstuffs on grow survival, body composition, hematology, and nonspecific immune response of Black pacu, Colossoma macropomum, and Red pacu, Piaractus brachypomus. Journal of the World Aquaculture Society, 40 (1), 33- 44.
López-Hernández, J., Osorio Pérez, A., Jiménez-Félix, S., Páramo-Delgadillo, S., Márquez-Couturier, G., Yasui, G. S., & Arias-Rodríguez, L. (2018). La calidad espermática en peces y los métodos de evaluación. Revista Ciencias Marinas y Costeras, 10(1), 67.
Luz, R., Ferreira A., Reynalte-Tataje D., & Zaniboni, F. (2001). Avaliação qualitativa e quantitativa do semen de suruvi, Steindachneridion scripta (Pimelodidae). Boletim do Instituto de Pesca, 27(1), 39-42.
Maria, A., Azevedo, H., & Carneiro, P. (2011). Protocolo para criopreservação do sêmen de tambaqui (Colossoma macropomum). Comunicado técnico. EMBRAPA, 1678-1937.
Maria, A., Viveiros, A., Freitas, R., & Oliveira, A. (2006). Extenders and cryoprotectants for cooling and freezing of piracanjuba (Brycon orbignyanus) semen, an endangered Brazilian teleost fish. Aquaculture, 260 (1-4), 298-306.
Martino, G. (2006). Primeros ensayos sobre críopreservación de semen de Cachama Colossoma macropomun y Morocoto Piaractus brachypomus. IV Congreso Iberoamericano Virtual de Acuicultura, 152-158.
Martinez, J. (2010). Efecto de la concentración de DMSO y Glucosa sobre la calidad espermáticca y el material genético en semen crioconservado de bocachico Prochilodus magdalenae. [Tesis de maestría, Universidad Nacional de Colombia, Colombia].
Marques de Carbalho, A. (2013). Criopreservação de sêmen de tambaqui Colossoma macropomum em criotubo. [Tesis de maestria, Universidade Federal de Sergipe, Brasil].
May, B., Henley, K., Krueger, C., & Gloss, S. (1988). Androgenesis as a mechanism for chromosome set manipulation in brook trout (Salvelinus fontinalis). Aquaculture,75 (1-2), 57-70.
Mazur, P. (1984). Freezing of living cells: mechanisms and implications- American Journal of Physiology, 247(3),125-142.
Medina, V., Velasco, Y., & Cruz, P. (2005). Aspectos generales de la criopreservación espermática en peces teleósteos. Rev. Col. Cienc. Pec, 18(1), 34-48.
Medina-Robles, V., Duarte-Trujillo, A. & Cruz-Casallas, P. (2020). Crioconservación seminal en peces de agua dulce: aspectos biotecnológicos, celulares y bioquímicos. Orinoquia, 24(2), 51-78.
Medeiros, C., Forell, F., Oliveira, T., & Rodriguez, J. (2002). Current status of sperm cryopreservation: why isn´t it better? Theriogenology. 57(1), 327-344.
Miskolczi, E., Mihalffy, S., Pata, V., Urbanyi, B., & Horváth, A. (2005). Examination of larval malformation in african catfish (Clarias gariepinus) following fertilization with cryoconserved sperm. Aquaculture, 247(1-4), 119-125.
Mocé, E., Blanch, E., Tomás, C., & Graham, J. (2010). Use of Cholesterol in Sperm Cryopreservation: Present Moment and Perspectives to Future. J. Reprod. Dom. Anim, 45 (2), 57-66.
Muchlisina, Z., Hashimb, R., & Chong, A. (2004). Preliminary study on the cryopreservation of tropical bagrid catfish (Mystus nemurus) spermatozoa; the effect of extender and cryoprotectant on the motility after short-term storage. Theriogenology, 62(1-2), 25-34.
Munkittrick, K., & Moccia, R. (1984). Advances in the cryopreservation of salmonid semen and suitability for a production - scale artificial fertilization program. Theriogenol, 21(4), 645-59.
Murgas, L., Gualhanone, A., Silva, M., Mello, C., Freitas, R., & Zangeronimo, M. (2001). Calidad seminal del pez piracanjuba (Brycon orbignyanus) post-descongelación. An. Vet. Murcia (17), 3-10.
Noel, A. (2017). Dilución y congelación de semen de macho cabrio con el uso de dos dilutores Tris y Triladyl. [Tesis título, Universidad Nacional Agraria La Molina, Perú].
Osorio, A. (2017). Fisiología y microestructura espermática del pejelagarto tropical Atractosteus tropicus. [Tesis de Licenciatura. Universidad Juárez Autónoma de Tabasco, México].
Otemé, J., Nuñez, J., Kouassi, C., Agnese, J., & Hem, S. (1996). Testicular structure and sperm cryopreservation of the african catfish Heterobranchus longifilis (Valenciennes, 1840). Aquaculture Research, 27(11), 805-813.
Pegg, D. (2014). Principles of cryopreservation. Methods in Molecular Biology, 3-19.
Proaño, B. (2013). Fertilización in-vitro con espermatozoides criopreservados de la especie Rhinella marina e identificación de malformaciones en los embriones obtenidos (Bachelor's thesis, PUCE).
Restrepo-Betancur, G., Montoya, J., & Arboleda, L. (2017). Evaluación de Dos Crioprotectores y Tres Curvas de Congelación Programable en la Criopreservación de Semen de Brycon henni (Pisces: Characidae). Revista de Investigaciones Veterinarias Del Perú, 28(3), 597.
Rodina, M., Gela, D., & Kocour, M. (2007). Cryopreservation of tench, Tinca tinca, sperm – Sperm motility and hatching success of embryos. Treriogenolog, 67(5), 931-940.
Rideout, R., Trippel, E., & Litvak, M. (2004). The development of haddock and Atlantic cod sperm cryopreservation techniques and the effect of sperm age on cryopreservation success. J. of Fish Biology, 65(2), 299-311.
Stock, W., Pinseel, E., De Decker, S., Sefbom, J., Blommaert, L., Chepurnova, O., Vyverman, W. (2018). Ampliación de la caja de herramientas para la crioconservación de diatomeas marinas y de agua dulce. Informes científicos, 8 (1).
Tiersch, T., & Green, C. (2011). Cryopreservation in aquatic species. World Aquaculture Society. 2da. Edition.
Varela, J., Corcini, C., Streit, D., Rizzoto, G., Dessesards, R., Lucia J., & Chim, M. (2012). Efeito crioprotetor de diferentes concentraçôes do Dimetilsulfóxido no congelamento de sêmen de tambaqui Colossoma macropomum. Atlántica, 34 (2) 129-137.
Varela, E., & Stive, J. (2021). Revisión Bibliográfica, Sobre La Influencia De La Curva De Descongelación Y Volúmenes De Empaque, En Protocolos De Crioconservación De Semen En Especies Ícticas Nativas De Colombia.
Vicuña, M. (2012). Informe de prácticas pre profesionales. Universidad Nacional Agraria de la Selva. Facultad de Zootecnia.
Viveiros, T., Orfão, L., Maria, A., & Allamam, I. (2009). A simple, inexpensive and successful freezing method for curimba Prochilodus lineatus (Characiformes) semen. Animal Reproduction Science, 112(3-4), 293-300.
Vuthiphandchai, V., Chomphuthawach, S., & Nimrat, S. (2009). Cryopreservation of red snapper (Lutjanus argentimaculatus) sperm: Effect of cryoprotectants and cooling rates on sperm motility, sperm viability, and fertilization capacity. Theriogenology, 72(1), 129-138.
Watson, P. 2000. The causes of reduce fertility with cryopreserved semen. Animal reproduction Science, 60, 481-492.
Yang, H., & Tiersch, T. (2009). Current status of sperm cryopreservation in biomedical research fish models: Zebrafish, medaka, and Xiphophorus. Comparative biochemistry and Physiology, 149(2), 224-232.
Zachariassen, K., &. Kristiansen, E. (2000). Ice nucleation and antinucleation in nature. Cryobiology, 41(4), 257-279.