DIETA DE Phalacrocorax bougainvillii “GUANAY” EN ISLA CHINCHA NORTE, PISCO-PERÚ. MARZO-SETIEMBRE 2019
DIET OF Phalacrocorax bougainvillii “GUANAY” IN NORTH CHINCHA ISLAND, PISCO-PERU. MARCH-SEPTEMBER 2019
Rayza Isabella Calle Apolo1 *, Ronald Wilmer Marcial Ramos1
1 Escuela de Ciencias Biológicas, Universidad Nacional de Piura, Urb. Miraflores s/n - Castilla, Piura, Perú.
Artículo original
Recibido: 22 de noviembre 2022
Aceptado: 19 de enero 2022
Resumen
Con el objetivo de determinar las especies que conforman la dieta de Phalacrocorax bougainvillii, “guanay” en isla Chincha Norte de marzo a setiembre de 2019, se colectaron y analizaron 55 bolos residuales mensuales, abarcando etapas de aposentamiento y reproducción. Se registraron 17 especies presa, (15 peces, 1 cefalópodo y 1 crustáceo). Engraulis ringens “anchoveta” fue la presa con mayor abundancia en ambas etapas, con 95,91% de los otolitos (n=27 020), de los cuales 68,19% corresponden a adultos y 31,81% a juveniles. Mediante el índice de Levins se determinó que P. bougainvillii es un depredador especialista. Además, se encontró elementos no propios de la dieta en los bolos residuales, como isópodos 10,65%, piojos 2,08%, garrapatas 0,52% y microplásticos 7,01%.
Palabras clave: anchoveta, bolos residuales, depredador especialista, Engraulis ringens, especies presa, microplásticos
Abstract
In order to determine the species that make up the diet of Phalacrocorax bougainvillii, "guanay" on Chincha Norte Island from March to September 2019, 55 monthly residual boluses were collected and analyzed, covering settlement and reproduction stages. 17 prey species were recorded (15 fish, 1 cephalopod and 1 crustacean). Engraulis ringens “anchoveta” was the most abundant prey in both stages, with 95.91% of the otoliths (n=27 020), of which 68.19% correspond to adults and 31.81% to juveniles. The Levins index shows that P. bougainvillii is a specialist predator. In addition, elements not typical of the diet were found in the residual boluses, such as isopods 10.65%, lice 2.08%, ticks 0.52% and microplastics 7.01%.
Keywords: anchovy, residual boulders, Engraulis ringens, microplastics, prey species, specialist predator
* Autor para correspondencia: E. mail: rayza.calle.apolo@gmail.com
Citar como:
Calle, R., & Marcial, R. 2022. Dieta de Phalacrocorax bougainvillii “guanay” en isla Chincha Norte, Pisco-Perú. marzo-setiembre 2019. REBIOL, 42(2): 91-103.
1. Introducción
A lo largo de la costa peruana, desde Piura hasta la frontera con Tacna, existen un conjunto de 22 islas, islotes y grupos de islas y 11 puntas, las cuales están protegidas por la Reserva Nacional Sistema de Islas, Islotes y Puntas Guaneras desde el 31 de diciembre de 2009, mediante Decreto Supremo Nº 024-2009-MINAM (Servicio Nacional de Áreas Naturales Protegidas por el Estado [SERNANP], 2010).
Estas islas albergan a las 3 especies de aves guaneras de alta importancia económica para el país, (guanay, piquero y pelícano) ya que su excremento “guano de las islas”, por su composición rica en nitrógeno, es esencial para la agricultura, y ha sido reconocido como el mejor fertilizante orgánico, desde mediados del siglo XIX (Coker, 1919).
Phalacrocorax bougainvillii, “guanay”, alcanza una longitud total de 74 a 76 cm. Tiene una coloración de color negro con brillo violeta en la cabeza y cuello, al igual que los flancos y parte externa del muslo. El plumaje nupcial tiene un moño y hay plumas filamentosas blancas debajo del ojo y en el cuello. La garganta, la base del cuello, el abdomen y subcaudales son de color blanco. Largo pico córneo. Piel desnuda en la cara, roja con un anillo verde alrededor del ojo. Patas rosadas. El plumaje no reproductivo es de coloración más apagada (Couve et al., 2016, Goodall et al., 1951).
En los antiguos tiempos, y en los actuales, el guanay ocupa una posición incomparable, históricamente, ha sido la especie más abundante de las tres aves guaneras. Forma colonias sumamente extensas y su densidad poblacional puede llegar a los 20 individuos por metro cuadrado según observaciones de los guardaislas. Se alimenta principalmente de anchoveta y algunos estudios señalan que el descenso poblacional del guanay ha sido ocasionado por la pesca industrial de este recurso, desde finales de los años 60 hasta la actualidad (Agro Rural, 2021).
En la actualidad el “guanay” P. bougainvillii se encuentra en la categoría de casi amenazado (NT) según la Lista Roja de la IUCN (The International Union for Conservation of Nature’s) y el Decreto Supremo N° 004-2014-MINAGRI (BirdLife International, 2018).
El principal alimento de las aves guaneras es la anchoveta Engraulis ringens, es por ello que su población y la producción del guano, están asociadas a la variación de la biomasa de anchoveta (Apaza y Santamaría, 2001).
Según Zuta (2015), las aves guaneras que se alimentan principalmente de anchoveta, son gravemente afectadas ante la ausencia de esta especie. La población de aves guaneras fue de 27,8 millones de individuos en el año 1955, esta población sufrió un descenso de 15,5 millones en 1957 y de 12,7 millones en 1965, como resultado de las mortandades y migraciones motivadas por El Niño en esos años. Hasta 1972, la población estaba alrededor de 6 millones, y es posible que actualmente sea de varios millones menos.
Los estudios sobre dieta de aves guaneras, despertaron interés, ante la potencial competencia entre estas aves y la industria pesquera por los recursos, desde entonces se realizaron una serie de trabajos que mostraron la importancia de la anchoveta Engraulis ringens en la dieta de estas aves (Jahncke y Zileri, 1998).
Algunas especies de aves regurgitan materiales de desecho luego de la digestión, es así el caso del guanay, expulsa los restos duros de peces y otros alimentos ingeridos envueltos en una capa seudomembranosa formando lo que se conoce como “bolo residual”, en estos se puede encontrar restos de huesos, escamas, otolitos, picos de cefalópodos y restos de crustáceos y moluscos (Jordán, 1959).
Los bolos residuales han sido utilizados por distintos investigadores en el estudio de su dieta, con la finalidad de conocer las especies presa que consume y determinar la cantidad de alimento ingerido a diario por esta ave en condiciones naturales, considerándolas como grandes depredadoras de recursos pelágicos en el mar peruano (Rivas, 2000).
El objetivo principal fue determinar la dieta de Phalacrocorax bougainvillii “guanay” en la etapa de aposentamiento y reproductiva mediante el análisis de bolos residuales en isla Chincha Norte, marzo - setiembre 2019.
2. Materiales y Métodos
Área de estudio
La investigación se realizó en Isla Chincha Norte, provincia de Pisco, departamento de Ica con coordenadas 13°37´ S y 76°23´ O. (Figura 1).
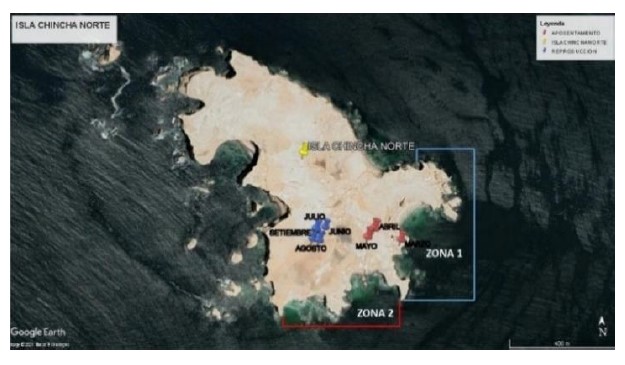
Figura 1. Isla Chincha Norte, Pisco, Perú Fuente: Google (2019)
Se realizó una salida mensual a Isla Chincha Norte de marzo a setiembre de 2019. Se colectaron 55 bolos residuales por mes (n=385) en horas de la mañana, inmediatamente después de que las aves abandonaron sus colonias para alimentarse, y así evitar que sean picados por las gaviotas (Larus belcheri y Larus dominicanus). Se tuvo en cuenta que los bolos colectados estén frescos, es decir recién expulsados por los guanayes, estos contenían los restos no digeribles de las presas consumidas el día anterior (Jordán, 1959; Cabrera, 1979). Fueron colectados en 2 zonas durante todo el muestreo, en la etapa de aposentamiento (marzo-mayo) en la zona 1 (n=165) y en la etapa de reproducción (junio- setiembre) en la zona 2 (n=220). En la etapa de reproducción, se utilizó una caseta móvil, para colectar las muestras, para no causar disturbios y evitar que el ave abandone su nido.
Procesamiento de las muestras
Se realizó el análisis correspondiente de cada bolo residual, con ayuda de un estilete y una pinza, muy cuidadosamente se separó los elementos duros (cristalinos, otolitos, picos de cefalópodos y huesos). En algunos casos fue necesario colocarlos en agua para facilitar la separación ya que estaban envueltos por una capa mucosa.
Análisis de los restos duros en los bolos residuales
Los restos duros encontrados en los bolos residuales de guanay, se visualizaron con ayuda de un estereoscopio Motic SMZ-171, y con un microscopio digital marca Nobrand Modelo 1600X.
Para identificar los otolitos se utilizó la guía “Patrones morfológicos del otolito sagitta de algunos peces óseos del mar peruano” de García (2001) y Catálogo fotográfico de otolitos de peces marinos y dulceacuícolas del Perú (Oré, 2017).
Los otolitos de las anchovetas adultas fueron separados de los de las anchovetas juveniles o peladillas (cuyos otolitos miden menos de 2 mm, que corresponden a tallas menores o iguales a 9 cm).
Los picos de cefalópodos se identificaron con ayuda de la guía “Cephalopod beak guide for the southern ocean” de Xavier y Cherel (2009).
Se contabilizó los restos duros encontrados en los bolos residuales, y se calculó la abundancia por cada especie presa.
Análisis de datos
Con la información que se obtuvo, se realizó los siguientes análisis:
- Abundancia Numérica (AN%) (Hyslop, 1980)
Se calculó la abundancia numérica total y de cada especie presa. La abundancia numérica o relativa es la relación porcentual del número de otolitos de la especie identificada con respecto al total de otolitos de todas las especies presa.

- Test de chi- cuadrado
Mediante el test de proporciones se analizó la abundancia y frecuencia de la anchoveta en la dieta de P. bougainvillii “guanay” en las etapas de aposentamiento y reproducción.
- Índice de Levins (Bi) (Krebs, 1999)
Se calculó la amplitud de la dieta utilizando el índice estandarizado de Levins, empleando la técnica propuesta por Labropoulou & Eleftheriou (1997):
Los valores de este índice fluctúan de 0 a 1, por debajo de 0,6 indican una dieta dominada por pocas presas, y valores mayores a 0,6 revelan dietas de depredadores generalistas (Krebs 1989)

- Programas estadísticos utilizados
3. Resultados
Se registró un total de 17 especies presa en la dieta de guanay entre peces (15), cefalópodos (1) y crustáceos (1).
Tabla 1. Listado de especies presa registradas en los bolos residuales de Phlacacrocorax bougainvillii “guanay” de marzo a setiembre 2019 en isla Chincha Norte, Pisco, Perú.
Tabla 2. Composición de la dieta Phlacacrocorax bougainvillii “guanay” en la etapa de aposentamiento y reproductiva de marzo a setiembre 2019 (N° de otolitos) en isla Chincha Norte, Pisco, Perú.
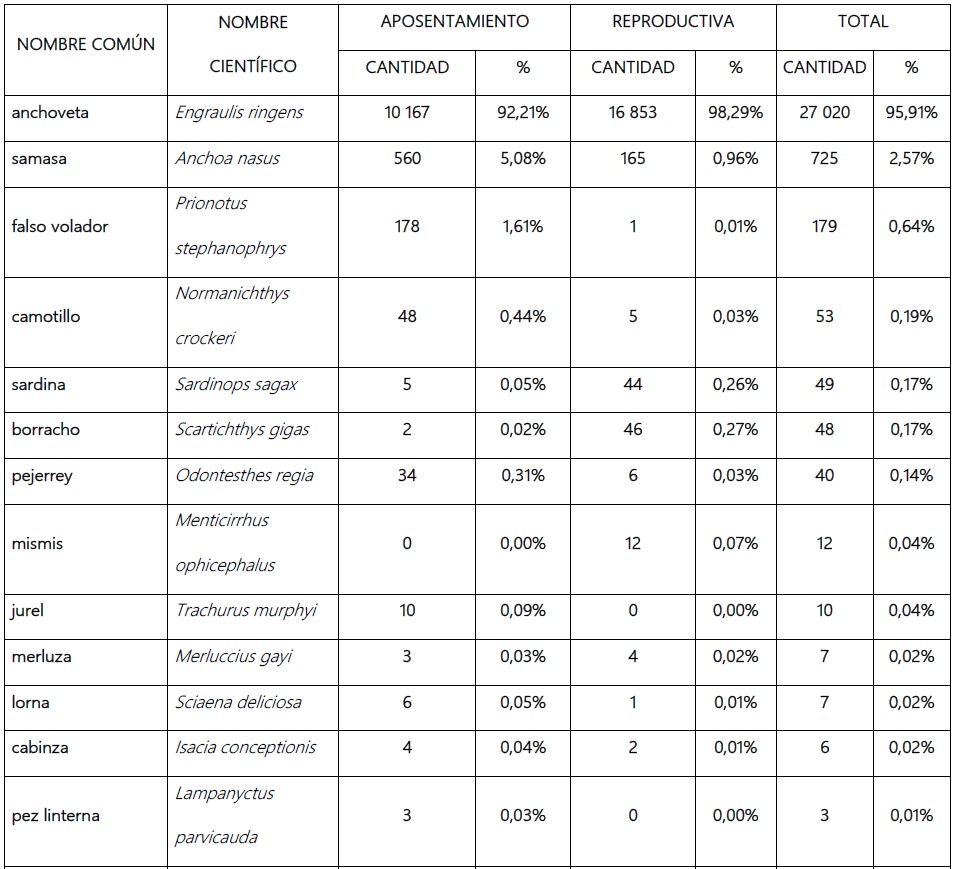
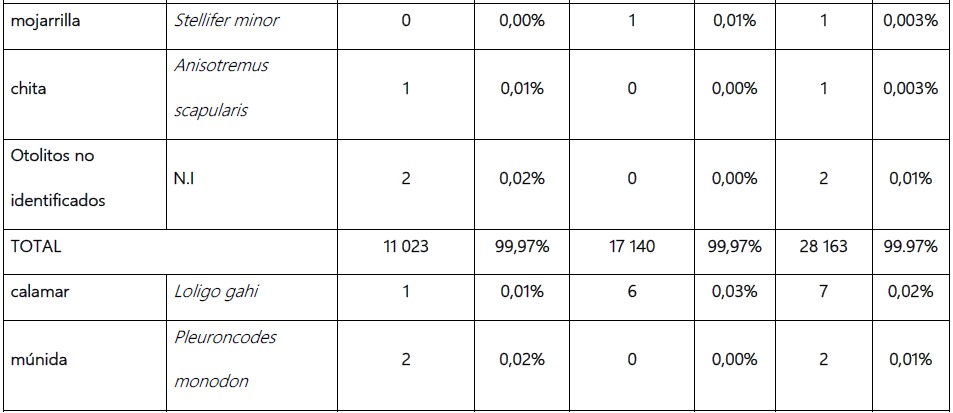
Engraulis ringens “anchoveta” fue la especie presa más abundante en la dieta de guanay de marzo a setiembre de 2019 en isla Chincha Norte, con 27 020 otolitos (95,91%), Anchoa nasus “samasa” ocupó el segundo lugar, con 725 otolitos (2,57%), y en tercer lugar Prionotus stephanophrys “falso volador” con 179 otolitos (0,64%).
No se logró identificar 2 otolitos (N.I), debido a su desgaste.
En la etapa de aposentamiento, E. ringens “anchoveta” fue la especie presa con mayor abundancia, en segundo lugar, A. nasus “samasa” y P. stephanophrys “falso volador” en tercero. En la etapa reproductiva, E. ringens “anchoveta” también ocupa el primer lugar, el segundo A. nasus “samasa” y Scartichthys gigas “borracho” el tercero.
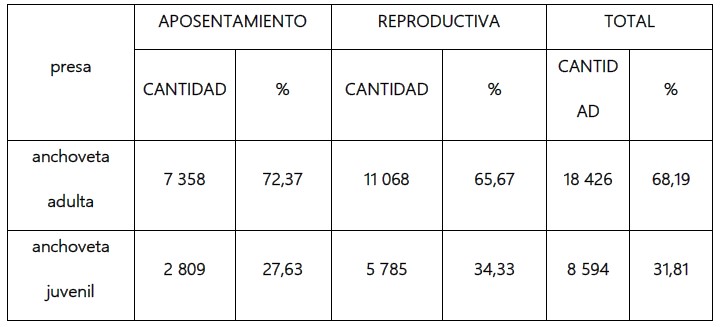
Respecto al consumo de E. ringens “anchoveta” en la dieta de P. bougainvillii “guanay”, se observa que en las 2 etapas (aposentamiento y reproductiva), la anchoveta adulta fue la presa más abundante, con un 68,19% (18 426 otolitos) la anchoveta juvenil tuvo una abundancia de 31,81% (8 594 otolitos) (Tabla 3).
Tabla 3. Engraulis ringens “anchoveta” adulta y juvenil en la dieta de Phlacacrocorax bougainvillii “guanay” en la etapa de aposentamiento y reproductiva.
Índice de Levins
Se calculó el índice de Levins, obteniendo un valor de 0,2755843; (menor a 0,6), por lo tanto, se concluye que la dieta está dominada por pocas presas, tratándose de un depredador especialista.
Temperatura superficial del mar
Se tienen los resultados del promedio mensual de la temperatura superficial del mar, de marzo a setiembre de 2019, facilitados por Agro Rural ( 2021).
Se observa temperaturas elevadas en marzo y abril, a partir de mayo, la temperatura descendió, lo que coincidió con la disminución de la población de guanayes. sin embargo, en junio empezó la etapa reproductiva, por lo que la población aumentó significativamente. En los meses siguientes el promedio de la temperatura descendió 1°C mensual, la población de guanayes tuvo pequeñas variaciones, en setiembre la temperatura aumenta.
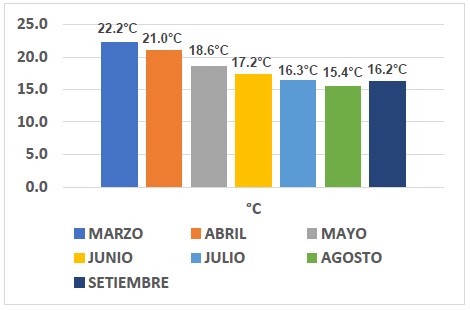
Figura 2. Temperatura superficial del mar (TSM) de marzo a setiembre de 2019 en Isla Chincha Norte, Pisco, Perú. Fuente: Agro Rural (2021).
Potencial de hidrógeno (pH)
Se evaluó también el pH para medir la acidez y alcalinidad del agua de mar, los datos variaron de 6,82 a 7,63, en abril se registró el valor más bajo y en setiembre el más alto (Figura 3).
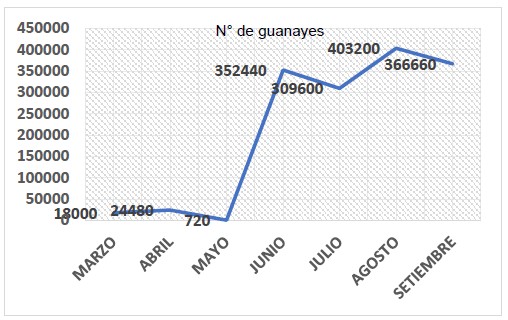
Figura 3. Potencial de hidrógeno (pH) de marzo a setiembre de 2019 en Isla Chincha Norte, Pisco, Perú.
Población de Phalacrocorax bougainvillii “guanay”
Agro rural nos brindó también los datos de la población de guanay durante los meses de muestreo (marzo-setiembre 2019), mayo fue el mes con la menor cantidad de aves (720 individuos) y agosto mes con mayor cantidad de polluelos y adultos (403 200 individuos)
Fuente: Agro Rural, 2019
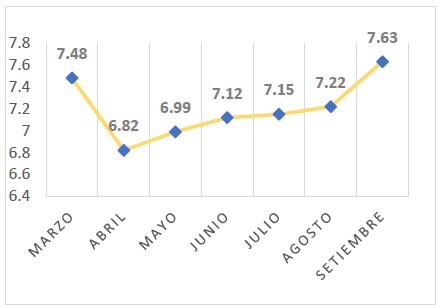
Figura 4. Población de Phalacrocorax bougainvillii “guanay” de marzo a setiembre de 2019 en Isla Chincha Norte, Pisco, Perú.
Otros elementos encontrados
Se describieron también los elementos encontrados en los bolos residuales que no pertenecen a la dieta de Phalacrocorax bougainvillii “guanay”, entre ellos tenemos Ceratothoa gaudichaudii “isópodo” que estuvo presente en 41 bolos (10,65%), Piagetiella sp. “piojo” en 8 bolos (2,08%), Ornithodoros amblus “garrapata” en 2 bolos (0,52%) y microplásticos en 27 bolos residuales (7,01%).
(Tabla 4).
Tabla 4. Otros elementos registrados en los bolos residuales de Phalacrocorax bougainvillii “guanay”, marzo- setiembre del 2019 en isla Chincha Norte, Pisco, Perú.
4. Discusión
Se analizó la dieta de guanay en algunas islas de la costa del Perú, incluyendo Isla Chincha, se colectaron durante 4 días 142 bolos residuales, obteniendo 5 589 otolitos pertenecientes a 10 especies de peces. Siendo las principales Odontesthes regia “pejerrey”, con una abundancia de 74,84%, Engraulis ringens “anchoveta” adulta 15,68% y Anchoa nasus “samasa” 5,18%, la anchoveta juvenil tuvo un porcentaje del 0,44% (Jahncke et al., 1997). Realizando una comparación con el presente estudio, la diferencia es notoria en el número de especies presa registradas (17 especies entre peces, cefalópodos y decápodos) y en la selección de la presa principal, presentando a Engraulis ringens “anchoveta”, como principal alimento consumido, con una abundancia de 95,91%, (adulta 65,43% y juvenil 30,52%) seguido por la Anchoa nasus “samasa” 2,57% y en tercer lugar Prionotus stephanophrys “falso volador” 0,64% (Tabla 2). La cantidad de especies presa registradas entre uno y otro estudio se debe al tiempo de duración de cada uno y al número de muestras colectadas.
Quispe (2015) analizó la dieta del guanay mediante bolos residuales en Punta San Juan de Marcona-Ica, de agosto a noviembre (etapa pre-reproductiva) del 2013 y de marzo a mayo (etapa post-reproductiva) del 2014, siendo el ítem alimenticio más representativo los peces. La anchoveta, se presentó como alimento predominante en las dos etapas, encontró también restos de moluscos y crustáceos en menos cantidad. La anchoveta presentó mayor cantidad de otolitos en septiembre. En el estudio realizado, la anchoveta también fue la principal especie presa, con una evidente preferencia de consumo en junio, mes en el que empezaba la etapa reproductiva (Tabla 3).
Pisconte (2015) sobre la composición de la dieta de guanay en Islas Ballestas, analiza 385 bolos residuales, de junio a diciembre del 2013, recuperando 1 735 otolitos, y reporta 9 especies presa. Analizamos 385 bolos residuales de marzo a setiembre del 2019, se recuperó 28 163 otolitos, pertenecientes a 15 especies de peces, en ambos estudios E. ringens “anchoveta” fue la especie con mayor abundancia, sin embargo, podemos notar la variación en el número de otolitos recuperados y de las especies presa determinadas, esto puede deberse a la disponibilidad de alimento para el guanay en los meses que se realizó la investigación y las variaciones anuales propias de los cambios debido a la dinámica del mar peruano.
Las aves se reproducen cuando las condiciones alimenticias alcanzan un nivel que garantice su supervivencia y la viabilidad de sus polluelos (Lack, 1954).
El guanay es una especie que muestra una evidente preferencia por la anchoveta, de esta manera, la estacionalidad y el éxito reproductivo está estrechamente ligado a la disponibilidad de este recurso. La anchoveta fue la especie presa más abundante, con una evidente alza en la etapa reproductiva (98,29%), comparada con la etapa de aposentamiento (92,21%), así mismo, el mes con mayor consumo de anchoveta fue junio 99,26% que fue el inicio de etapa reproductiva (Tabla 2), los guanayes empezaban a armar sus nidos y parte de la población ya anidaba, sin embargo, el consumo de anchoveta respecto a otras presas fue disminuyendo ligeramente a lo largo de los meses, en setiembre presentó una abundancia de 97,42%. Analizando los resultados, se ratifica lo mencionado por el autor, los guanayes iniciaron su etapa reproductiva cuando la disponibilidad de alimento (anchoveta) era la adecuada, para la incubación de los huevos y posteriormente alimentación de los polluelos, asegurando de esta manera el éxito reproductivo en la colonia.
Según el reporte de la actividad pesquera del IMARPE en el año 2019, el desembarque de E. ringens “anchoveta” en el puerto de Pisco fue casi nulo, entre mayo y junio. A inicios de julio, aumentó considerablemente. La población de P. bougainvillii “guanay” en mayo disminuyó drásticamente (720 individuos), junto con el consumo de anchoveta, si bien es cierto, fue la presa con mayor abundancia ese mes, el número de otolitos fue menor comparada con otros meses. A mediados de junio, la población aumentó (352 440 individuos) siendo el inicio de la etapa reproductiva (Figura 4), los guanayes empezaban a armar sus nidos, preparándose para la incubación de sus huevos.
Se distinguen dos tipos de depredadores, generalistas, que tienen un amplio nicho trófico y depredadores especialistas, con un nicho trófico reducido. Debido a su reducida amplitud trófica, los depredadores especialistas presentan cambios en el tamaño poblacional asociados a la densidad de su presa principal, esto les permite un desarrollo óptimo en condiciones ambientales estables y homogéneas, sin embargo, les limita considerablemente su capacidad de respuesta ante cambios ambientales (Begon et al., 1996).
Se calculó el índice de Levins, y se obtuvo un valor de 0,275 (menor a 0,6), lo que nos indica que P. bougainvullii “guanay” es un depredador especialista, puesto que se alimenta mayormente de pocas especies presa, siendo E. ringens “anchoveta” la especie de mayor abundancia (95,91%), y en segundo lugar A. nasus “samasa” (2,57%), ambas especies epipelágicas y formadoras de cardúmenes.
P. bougainvillii “guanay, se alimentó durante el periodo evaluado de 15 especies de peces, sin embargo, cuando se evalúa la abundancia de las presas, consumen principalmente E. ringens “anchoveta”, especie dominante en la dinámica del mar peruano y además con mayor biomasa, por ello su proporción en los regúrgitos de esta ave. Estacionalmente, los guanayes presentan ligeras tendencias en el consumo de anchoveta, observándose mayor consumo en invierno y primavera, época cuando consumirían un mayor número de ejemplares de menor tamaño (Jahncke y Goya, 1998).
(Morón et al., 2017) analizaron los aspectos físicos y químicos, como la temperatura y el potencial de hidrógeno (pH) en el ecosistema marino del área natural de Islas Ballestas y Chincha entre el 15 y 25 de marzo del 2015. La temperatura varió de 20 a 26 °C, mezclándose con aguas relativamente frías en el área oceánica. Agro Rural brindó datos de la temperatura superficial del mar de Isla Chincha Norte desde marzo hasta setiembre, siendo la temperatura mínima 15,4°C en agosto y máxima 22,2°C en marzo (Figura 2). El agua de mar es moderadamente alcalina, variando el pH de 7,6 a 8,4; hallándose la mayor alcalinidad en la superficie del agua (Jacinto, 2006). Según la información estadística del IMARPE (2009), el valor mínimo del pH a nivel superficial en la bahía de Pisco en el 2004 fue 7,62 y el máximo 7,67.
Se midió el potencial de hidrógeno (pH) del agua de mar de isla Chincha Norte, esté varió desde 6,82 en abril hasta 7,63 en Setiembre (Figura 3), observando que en los meses de invierno los valores aumentan, teniendo una relación inversa con la temperatura superficial del mar y directa con la disponibilidad de anchoveta.
Las aves guaneras al vivir en densidades muy altas, favorecen la propagación de ectoparásitos como garrapatas, piojos, son seriamente afectadas, pueden alcanzar altos niveles de infestación y forzar a las aves a abandonar sus nidos e incluso a sus pichones (Duffy y Laurenson, 1983). Como parte del contenido de los bolos residuales, se encontró 2 individuos de Ornithodoros amblus “garrapata” y 8 individuos de Piagetiella sp. “piojos”, la existencia de estos en los bolos residuales se debe que los guanayes se desparasitan por sí mismos con el pico, y en el caso de los piojos, estos se sitúan muy cerca de la garganta del ave, lo que hace que se los trague con facilidad.
Ceratothoa gaudichaudii “isópodo” ha sido reportado infectando a nueve especies de peces en Perú (Brusca, 1981), entre ellos a Scartichthys gigas “borracho” (Iannacone et al., 2012), Trachurus murphyi “jurel” (Quiroz, 2017). En los bolos analizados se contabilizaron un total de 41 individuos del isópodo C. gaudichaudii, su presencia se debe a que parasitan especies que componen la dieta del guanay.
Los microplásticos afectan a una gran diversidad de organismos marinos (Guzzetti et al., 2018) se considera microplástico cuando los fragmentos de plástico alcanzan un tamaño inferior a 5 mm de diámetro (Browne et al., 2013), estos pueden estar ampliamente biodisponibles en los distintos niveles tróficos (Wright, 2013, Law y Thompson, 2014). La presencia de estos residuos se ha constatado en fauna marina, por ejemplo, en crustáceos (Devriese et al., 2015, Jamieson et al., 2019), peces (Ory et al., 2018, Herrera et al., 2019). Se encontró microplásticos en 27 bolos residuales, es decir, en el 7,01% de las muestras totales (Tabla 4). Su presencia puede deberse a que estos se encuentren suspendidos en el agua y son tragados por los individuos de P. bougainvilli “guanay” al momento de alimentarse, o de lo contrario son consumidos por las especies presa de esta ave. El mes con mayor incidencia de microplásticos fue junio, que coincide con el mayor consumo de anchoveta (99,26%).
5. Conclusiones
Se registraron 17 especies presa en la dieta de guanay, clasificados en 3 taxas, 8 órdenes y 14 familias.
Engraulis ringens “anchoveta” fue la especie presa más abundante y frecuente en la dieta de guanay, tanto en la etapa de aposentamiento como reproductiva. Los adultos con una abundancia del 68,19% y juveniles con 31,81%.
Se determinó mediante el Índice de Levins, que Phalacrocorax bougainvillii “guanay” es un depredador especialista, lo que nos indica que su dieta está dominada por pocas especies presa.
En 27 bolos se encontró microplásticos, que corresponde al 7,01% de bolos analizados, siendo junio el mes con más alto registro. Además, se encontraron 3 tipos de parásitos, Ceratothoa gaudichaudii “isópodo”, Piagetiella sp. “piojo”, y Ornithodoros amblus “garrapata”, que corresponden a ingesta incidental, no formando parte de la dieta Phalacrocorax bougainvillii “guanay”.
6. Agradecimientos
Agradecemos al Departamento Académico de Ciencias Biológicas de la Universidad Nacional de Piura por las facilidades para utilizar materiales y equipos de laboratorio para realizar las determinaciones. Asimismo, queremos expresar nuestro agradecimiento al equipo de la Reserva Nacional Sistema de Islas Islotes y Puntas Guaneras, SERNANP por las facilidades brindadas para realizar la investigación.
7. Contribución de los autores
R.C. (1) concepción y diseño de estudio, registro de datos, elaboración de los mapas, redacción del borrador del artículo y la revisión crítica del contenido y la aprobación final.
R.M. (2) concepción y diseño de estudio, redacción del borrador del artículo y la revisión crítica del contenido y la aprobación final.
8. Conflicto de interes
Los autores declaran que no existe conflicto de intereses.
9. Referencias Bibliográficas
Agro Rural. (2021). Reporte mensual de conservación en islas y puntas guaneras - junio 2021. Programa de Desarrollo Productivo Agrario Rural. Ministerio de Desarrollo Agrario y Riego.
Apaza, M. & Santamaría, M. (2001). Anchoveta. En: Identificación de las prioridades de conservación de acuerdo a una base ecológica, económica y social, Casos de Estudio. Comité peruano de la Unión Mundial para la Conservación de la Naturaleza UICN y Asociación peruana para la Conservación de la Naturaleza APECO. Págs. 100-112.
Begon, M., Haper, J. & Towsend, C. (1996). Ecology: individuals, populations and communities. Blackwell Science, Oxford.
BirdLife International. (2018). Species factsheet: Phalacrocorax bougainvilliorum. http://www.birdlife.org.
Browne, M., Niven, S., Galloway, T., Rowland, S. & Thompson, R. (2013). Microplastic moves pollutants and additives to worms, reducing functions linked to health and biodiversity. Current Biology, 23,2388-2392.
Brusca, R. (1981). A monograph on the Isopoda Cymothoidae (Crustacea) of the Eastern Pacific, Zoological Journal of the Linnean Society 73(2):117 - 199
Cabrera, D. (1979). Bases para el manejo del recurso aves guaneras del Perú. [Tesis doctoral, Universidad Nacional de Trujillo, Trujillo - Perú].
Coker, R. (1919). Habits and economic relations of the guano birds of Peru. Proceedings of the. United States National Museum, 56 (2298), 449-511.
Couve, E., Vidal, C. & Ruiz, J. (2016) Aves de Chile, sus islas oceánicas y Península Antártica. FS Editorial. Punta Arenas, Chile.
Devriese, L., Van Der Meulen, D., Maes, T., Bekaert, K., Paul-Pont, I., Frere, L., Robbens, J. & Vethaak, A. (2015). Microplastic contamination in brown shrimp (Crangon crangon, Linnaeus 1758) from coastal waters of the Southern North Sea and Channel area. Marine Pollution Bulletin, 98 (1-2), 179-187.
Duffy, D. & Laurenson, L. (1983) Pellets of Cape Cormorants as Indicators of Diet. Condor, 85, 305-307.
Goodall, J., Johnson, A. y Philippi, R. (1951). Las Aves de Chile, su conocimiento y sus costumbres. Tomos 1 (1946) y 2 (1951), Platt Establecimientos Gráficos - Buenos Aires.
Google (s.f). [Mapa de isla Chincha Norte, Pisco, Perú]. Recuperado el 25 de junio de 2020, de https://earth.google.com/web/@-13.62783752.
Guzzetti, E., Sureda, A., Tejada, S. & Faggio, C. (2018). Microplastic in marine organism: Environmental and toxicological effects. Environmental Toxicology Pharmacology, 64, 164-171.
Herrera, A., Stindlová, A., Martínez, I., Rapp, J., Romero, V., Samper, M., Montoto, T., Aguiar, B., Packard, T. & Gómez, M. (2019). Microplastic ingestion by Atlantic chub mackerel (Scomber colias) in the Canary Islands coast. Marine Pollution Bulletin, 139, 127-135.
Hyslop, E. (1980). Stomach contents analysis. A review of methods and their applications. Journal of Fish Biology.
Iannacone, J., Sánchez, V., Olazábal, N., Salvador, C., Alvariño, L. y Molano, J. (2012). Ecological indices of parasites of Scartichthys gigas (Steindachner, 1876) (Perciformes: Blenniidae) of the coasts of Lima, Perú Neotropical Helminthology, vol. 6, pp. 191-203.
Instituto del Mar del Perú [IMARPE]. (2009). Información estadística: Rango de pH a nivel superficial, según Bahía, 2003-2007. https://sinia.minam.gob.pe/documentos/rango-ph-nivel-superficial-segun-bahia-2003-2007.
Jacinto, H. (2006). Protocolo de monitoreo de efluentes marinos. [Trabajo monográfico, Ingeniero químico, Universidad Nacional Mayor de San Marcos, Lima. Perú].
Jamieson, A., Brooks, L., Reid, W., Piertney, S., Narayanaswamy, B. & Linley, t. (2019). Microplastics and synthetic particles ingested by deep-sea amphipods in six of the deepest marine ecosystems on Earth. The Royal Society Open Science, 180667.
Jahncke, J., García, I. & Goya, E. (1997) Dieta del Guanay Leucocardo bougainvilli, el piquero peruano Sula variegata y otras aves de la costa peruana, abril y mayo de 1997. Inf. Inst. Mar Perú N° 126, 75-86.
Jahncke, J., y Goya, E. (1998). Las dietas del Guanay y del piquero peruano como indicadoras de abundancia y distribución de anchoveta. Boletín del Instituto del Mar Perú, 17(1-2), 15-33.
Jahncke, J., y Zileri, D. (1998). Estudios sobre dieta en piqueros como indicadores de la estructura por tallas de los stocks de anchoveta en el mar peruano. Boletín del Instituto del Mar Perú, 17(1-2), 47-54.
Jordán, R. (1959). El fenómeno de las regurgitaciones en el guanay (Phalacrocorax bougainvillii) y un método para estimar la ingestión diaria. Boletín de la Compañía Administradora del Guano Pág. 23-40.
Krebs, C. (1999) Ecological Methodology. Segunda edición. Addison- Wesley, New York. Lack, D. (1954). The natural regulation of animal numbers. Oxford University Press, New York.
Labropoulou, M. & Eleftheriou, A., (1997). The foraging ecology of two pairs of congeneric demersal fish species: importance of morphological characteristics in prey selection. Journal of Fish Biology, 50, 324-340.
Law, K. y Thompson, R. (2014). Microplastics in the seas. Science 345 (6193), 144-145.
Morón, O., Quispe, J., Lorenzo, A., Flores, G., Sánchez, S., Aronés, K., Solís, J. & Quipuzco A. (2017). Caracterización de los procesos físicos, químicos, biológicos y sedimentológicos en las islas Ballestas y Chincha. 2013. Inf Inst Mar Perú, 44(4), 472-506.
Oré, D. (2017). Catálogo fotográfico de otolitos de peces marinos y dulceacuícolas del Perú. Boletín del Instituto del Mar Perú, 32(2), 136-213.
Ory, N., Chagnon, C., Felix, F., Fernández, C., Ferreira, J., Gallardo, C., Ordoñez, O., Henostroza, A., Laaz, E., Mizraji, R., Mojica, H., Haro, V., Medina, L., Preciado, M., Sobral, P., Urbina, M. & Thiel, M. (2018). Low prevalence of microplastic contamination in planktivorous fish species from the southeast Pacific Ocean. Marine Pollution Bulletin, 127, 211-216.
Pisconte, J. (2015). Composición de la dieta del guanay Phalacrocorax bougainvillii en Islas Ballestas (junio-diciembre 2013). [Tesis para Biólogo, Universidad Nacional San Luis Gonzaga. Ica, Perú].
Quiroz, L. (2017). Estudio de la parasitofauna en el jurel con énfasis en zoonosis parasitaria. [Tesis para Ingeniero Pesquero, Universidad Agraria la Molina. Lima, Perú].
Quispe, M. (2015). Estudio del espectro alimenticio del guanay Phalacrocorax bougainvillii (Lesson, 1837) y su variabilidad durante las etapas pre-reproductiva y Post reproductiva 2013-2014 en Punta San Juan Marcona-Ica. [Tesis para Biólogo, Universidad Nacional San Agustín de Arequipa. Perú].
Rivas, C. (2000). Utilidad de los bolos residuales de guanay en los estudios de dieta, pérdida y erosión de otolitos en estómagos de guanayes en cautiverio. [Tesis para Magister, Universidad Nacional Agraria La Molina, Lima-Perú].
Servicio Nacional de Áreas Naturales Protegidas por el Estado - SERNANP (2010). Ministerio del Ambiente. http://www.sernanp.gob.pe/sistema-de-islas-islotes-y-puntas-guaneras.
Wright, S., Thompson, R. & Galloway, T. (2013). The physical impacts of microplastics on marine organisms: A review. Environmental Pollution, 178, 483-492.
Xavier, J. & Cherel, Y. (2009) Cephalopod Beak Guide for The Southern Ocean. British Antartic Survey, Cambridge.
Zuta, S. (2015). El Fenómeno El Niño 1972-1973. IMARPE. Boletín Trimestral Oceanográfico, 1(1-4),20-24.
ANEXOS
Figura 5. Otolito sagitta de Engraulis ringens “anchoveta”

Figura 6. Otolito sagitta de Prionotus stephanophrys “falso volador”
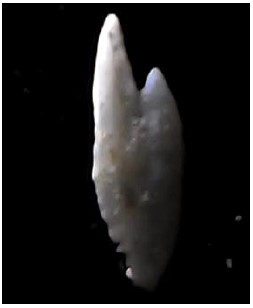
Figura 7. Otolito sagitta de Sardinops sagax “sardina”
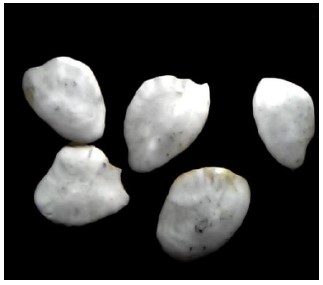
Figura 8. Otolito sagitta de Normanichthys crockeri “camotillo”
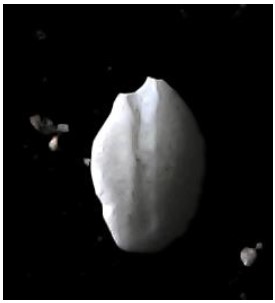
Figura 9. Otolito sagitta de Odontesthes regia “pejerrey”

Figura 10. Otolito sagitta de Anchoa nasus “samasa”
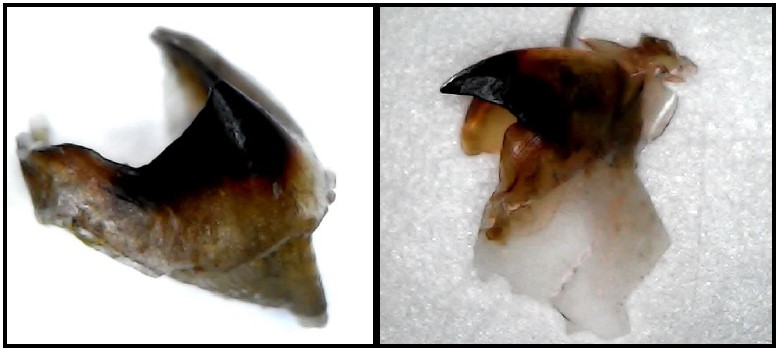
Figura 11. Pico de Loligo gahi “calamar” (a) vista frontal (b) vista lateral

Figura 12. Microplásticos presentes en los bolos residuales