DENSIDAD MINERAL ÓSEA BAJA EN VARONES JÓVENES CON INFECCIÓN ASINTOMÁTICA POR EL VIRUS DE LA INMUNODEFICIENCIA HUMANA EN TRATAMIENTO ANTIRRETROVIRAL
LOW BONE MINERAL DENSITY IN YOUNG MEN WITH ASYMPTOMATIC HUMAN IMMUNODEFICIENCY VIRUS INFECTION ON ANTIRETROVIRAL THERAPY
Sheila Lizett Rodríguez-Ulloa *
Servicio de Reumatología, Hospital de Alta Complejidad “Virgen de la Puerta”, Av. Reactivación s/n, La Esperanza, Trujillo, Perú.
Sheila Lizett Rodríguez-Ulloa
Artículo original
Recibido: 27 de julio 2022
Aceptado: 28 de octubre 2022
Resumen
El objetivo de este estudio fue determinar la frecuencia de densidad mineral ósea (DMO) baja en varones jóvenes con infección asintomática por el Virus de la Inmunodeficiencia Humana (VIH) en el tratamiento antirretroviral menor de 2 años, así como comparar la frecuencia de DMO baja y normal según esquema de tratamiento antirretroviral (TAR) y nivel de actividad física. Se incluyó a 39 varones jóvenes con infección asintomática por el VIH y TAR menor de 2 años. Se les realizó una densitometría ósea, y se evaluaron las siguientes zonas: columna lumbar, cuello femoral izquierdo y cadera total izquierda. Se encontró 12 pacientes (31%) con DMO baja y 27 pacientes (69%) con DMO normal. No se encontró diferencia significativa entre los pacientes con DMO normal y baja según tipo de TAR y nivel de actividad física. La frecuencia de DMO baja es alta en varones jóvenes con infección asintomática por el VIH en tratamiento antirretroviral menor de 2 años.
Palabras clave: Agente antirretroviral, densidad ósea, VIH.
Abstract
The aim of this study was determine the frequency of low bone mineral density (BMD) in young men with asymptomatic Human Immunodeficiency Virus (HIV) infection on antiretroviral therapy for less than 2 years, as well as to compare the frequency of low and normal BMD according to antiretroviral treatment (ART) scheme and level of physical activity. 39 young men with asymptomatic HIV infection and ART less than 2 years were included. A bone densitometry was performed, and the following areas were evaluated: lumbar spine, left femoral neck and total left hip. 12 patients (31%) with low BMD and 27 patients (69%) with normal BMD were found. No differences were found between patients with normal and low BMD according to type of ART and level of physical activity. The frequency of low BMD is high in young men with asymptomatic HIV infection under antiretroviral treatment for less than 2 years.
Keywords: Antiretroviral agent, bone density, HIV
* Autor para correspondencia: E. mail: slru21@hotmail.com
Citar como:
Rodríguez-Ulloa, S. 2022. Densidad mineral osea baja en varones jóvenes con infección asintómatica por el virus de la inmunodeficiencia humana en tratamiento retroviral. REBIOL, 42(1): 77-83.
1. Introducción
La infección por el VIH tiene una prevalencia ascendente, se estima que afecta alrededor de 37 millones de personas en todo el mundo, y presenta un crecimiento anual de alrededor de 2 millones de nuevos casos (Ahmad et al., 2017). El Perú es hogar de 68 000 personas infectadas con el VIH, hasta inicios del 2017. Es más frecuente entre los varones de 25 a 34 años, con una relación aproximada de 3:1 con el sexo femenino. Según el Centro Nacional de Epidemiología, Prevención y Control de Enfermedades del Ministerio de Salud (2017), el Departamento de La Libertad se encuentra en el quinto lugar en cuanto al número de pacientes con el VIH, después de Lima/Callao, Loreto, Ica y Arequipa.
Pero la historia natural de esta infección ha cambiado profundamente desde la introducción de la terapia antirretroviral; produciéndose un incremento dramático en la sobrevivencia de los pacientes. Esto expone a los sujetos infectados con el VIH a las morbilidades relacionadas con la edad (Biver, 2022), incluyendo enfermedad metabólica y cardiovascular, cáncer, trastornos neurocognitivos, enfermedad renal y ósea (Hileman et al., 2015).
La enfermedad ósea representa uno de los problemas más frecuentes a largo plazo de la infección por el VIH.
Según Chang et al. (2021), la prevalencia de DMO baja y el riesgo de fracturas por fragilidad son mayores en las personas con el VIH, al compararlas con la población general. Hay reportes que aproximadamente el 40% al 90% de las personas infectadas presentan DMO disminuida, y además tienen un 60% más de riesgo de fractura que las personas no infectadas (Gullón & García, 2013).
La etiología de la disminución de la DMO en la infección por el VIH es multifactorial según Perazzo et al. (2018), e incluye factores de riesgo tradicionales (consumo de tabaco y alcohol, sedentarismo, bajo peso, nutrición inadecuada, deficiencia de vitamina D) y factores asociados al VIH (TAR, inicio del TAR, recuento de CD4 al inicio de TAR).
En estudios realizados en varones con infección por el VIH en Corea, Reino Unido y Eslovenia, pero de todas las edades, se encontró disminución de la masa ósea en alrededor del 60 al 70% de los pacientes; pero no se encontró asociación con el régimen de terapia antiretroviral. (Choe et al., 2014; Short et al., 2014) y más bien se encontró que la ausencia de TAR es predictor independiente de baja masa ósea (Tomazic et al., 2007).
Pero Ozcan et al. (2022), en su estudio en varones menores de 50 años, si encontraron asociación de la pérdida ósea con el uso y la duración del tratamiento antirretroviral.
De otro lado, Paccou et al. (2017) en Francia, realizaron un estudio en 49 varones jóvenes con infección por el VIH con menos de 10 días de TAR, encontrando baja masa ósea sólo en el 24.5%.
En Sudamérica, dos estudios que incluían alrededor del 70% de su muestra a pacientes varones de todas las edades, encontraron una prevalencia entre el 23 al 27% de baja masa ósea (Da Silva et al., 2017). Sólo en uno de ellos, el uso de nevirapina y tenofovir/emtricitabina se asoció con disminución de la masa ósea (Ruiz-Henao et al., 2017). Además, Pérez & Ceballos (2014) encontraron en un estudio realizado en Chile, que el 63% de varones infectados con el VIH tenían osteopenia u osteoporosis, y todos presentaban niveles bajos de vitamina D. Pero se incluyeron sólo 16 pacientes, entre 29 y 60 años.
La terapia antirretroviral cumple con objetivos epidemiológicos, clínicos, inmunológicos y virológicos.
Cada objetivo tiene diferentes funciones como, evitar la transmisión de la infección, prevenir la aparición de enfermedades relacionadas con este virus, restablecer la función del sistema inmunitario y disminuir la carga viral; que es el objetivo primordial de la terapia antirretroviral, de conseguir la mayor supresión de la replicación del virus, lo que sucede entre las 16 y 24 semanas del inicio del tratamiento (Paz, 2017).
Los fármacos antirretrovirales disponibles actualmente actúan: inhibiendo la transcriptasa inversa, lo que bloquea la síntesis de la cadena ADN viral (efavirenz, emtricitabina, tenofovir, etc); bloqueando la enzima proteasa, lo que evita la formación de proteínas estructurales necesarias para la formación de partículas virales maduras (atazanavir, ritonavir, lopinavir, darunavir, etc); bloqueando la enzima integrasa, que el virus utiliza para integrarse al genoma de la célula que invade (raltegravir); e inhibiendo la fusión de las membranas de virus y de la célula, lo que impide la entrada del virus a la célula (Tobón & Toro, 2008).
Según la guía de tratamiento de la Sociedad Americana de Enfermedades Infecciosas, se recomienda iniciar el TAR en todos los individuos con infección por el VIH a pesar de su estadío clínico o recuento celular de CD4, con la finalidad de preservar el sistema inmune del paciente, controlar la replicación del virus, y reducir su transmisión (Panel on Antiretroviral Guidelines for Adults and Adolescents, 2018). En el hospital donde se llevó a cabo el estudio se siguen las guías de manejo de esta institución, donde el régimen de tratamiento inicial consiste en 2 inhibidores de la transcriptasa inversa análogos de nucleósidos en combinación con cualquiera de los tres medicamentos: un inhibidor de la integrasa, un inhibidor de la transcriptasa inversa no análogo de nucléosido o un inhibidor de la proteasa; siendo el esquema mayormente utilizado emtricitabina, tenofovir y efavirenz.
La pérdida de DMO es sustancial durante los primeros 2 años del TAR, disminuyendo entre 2 al 6% (Marques et al., 2020). Todos los grupos de antirretrovirales se han asociado con pérdida de masa ósea; pero los medicamentos con mayor influencia parecen ser los inhibidores de la proteasa y los inhibidores de la transcriptasa inversa análogos de nucleósidos (Gullón & García, 2013).
Según Dave et al. (2015), efavirenz reduce las concentraciones de vitamina D al inducir su metabolismo.
Además, hay informes que los regímenes que contienen tenofovir están asociados con la desmineralización ósea (Meng et al., 2021), aunque otros estudios no han podido confirmar la asociación.
Asimismo, el régimen que incluye un inhibidor de la proteasa potenciado con ritonavir (generalmente lopinavir), también se ha asociado con DMO baja y mayor riesgo de fracturas (Moran et al., 2016). De otro lado, Stellbrink et al. (2010) reportaron una mayor disminución de la DMO en sujetos tratados con tenofovir/emtricitabina que con abacavir/lamivudina.
Por otra parte, se ha descrito en varias poblaciones con VIH una alta prevalencia de hipovitaminosis D, tanto en pacientes sin TAR como luego de la exposición al mismo, particularmente en aquellos que reciben efavirenz (Abreu et al., 2022) e inhibidores de proteasa. No se conoce el mecanismo preciso que subyace a estas observaciones, pero Masyeni et al. (2013), han sugerido que puede ser una consecuencia de la disminución de la síntesis dérmica y/o como resultado de la regulación inducida por TAR del metabolismo de la 25-hidroxivitamina D (25 (OH) D).
Pero cada vez tienen más peso teorías como la planteada por Paccou et al. (2017), en la que postulan que los factores de riesgo tradicionales de la osteoporosis y la propia infección por el VIH son los que fomentan la disminución de la DMO, sin evidencia de aportación del TAR o en las que se admite que todos los antirretrovirales producen una merma de DMO similar, producto de las modificaciones en el metabolismo óseo debido al control de la replicación viral más, que al propio medicamento en sí.
Otro tema primordial es la reconstitución inmune, que se presenta de forma rápida luego del inicio del TAR, y representa la redistribución de los linfocitos T CD4 existentes aunado a la liberación de los linfocitos T de memoria de los ganglios linfáticos. La recuperación inmunológica logra su nivel máximo a las 12 semanas después del inicio de la medicación, lo que coincide con el mayor pico de disminución de DMO, durante el cual hay una liberación masiva de citoquinas, incluido el RANKL (Gullón & García, 2013). Varios autores, como Ofotokun et al. (2016), proponen que la reconstitución inmune puede ser el principal inductor de la pérdida de DMO asociada con el inicio del TAR.
Como se puede observar, la mayoría de los estudios que evalúa el tratamiento antirretroviral y la disminución de la densidad mineral ósea en pacientes con infección por el VIH incluye poblaciones heterogéneas, que incluyen hombres y mujeres de todas las edades, lo que limita la interpretación ya que de por sí el sexo femenino ya es un factor de riesgo de osteoporosis y la clasificación de la DMO según la Organización Mundial de la Salud difiere según la edad y el sexo; además hay resultados contradictorios. La prevalencia de la DMO anormal varía en diferentes poblaciones, pero se sabe poco sobre la masa ósea en pacientes VIH positivos en el Perú; además la mayoría de las personas infectadas en el Perú son varones jóvenes. Es por ello que se quiere determinar la frecuencia de densidad mineral ósea baja en varones jóvenes con infección asintomática por el VIH en tratamiento antirretroviral menor de 2 años; así como comparar la frecuencia de DMO baja y normal según esquema de tratamiento antirretroviral y nivel de actividad física.
2. Materiales y Métodos
MUESTRA:
Se incluyeron 39 pacientes con infección asintomática por el VIH del Hospital de Alta Complejidad “Virgen de la Puerta” de Trujillo atendidos en el Servicio de Infectología de octubre 2020 a abril del 2021, que cumplían con los criterios de inclusión: diagnóstico de infección por el VIH por ELISA, en tratamiento antirretroviral menor de 2 años, varones de 18 años a más, pero menores de 50 años, pacientes en fase de infección aguda o crónica por el VIH asintomático (Gullón & García, 2013). Se excluyeron a aquellos pacientes con artritis reumatoide, lupus eritematoso sistémico, esclerosis sistémica, vasculitis sistémica, miopatías inflamatorias, enfermedades tiroideas, diabetes insulinodependiente, insuficiencia renal o hepática, diarrea crónica, pacientes en tratamiento crónico con corticoides, antiepilépticos, anticoagulantes, levotiroxina, litio. También se excluyó a los pacientes en estadío SIDA (Parekh et al., 2019), con tabaquismo actual (más de 15 cigarrillos al día) (Supervía, 2002), con alcoholismo actual (más de 60gr al día de alcohol) (Supervía, 2002), con bajo peso (IMC ˂ 18.5 kg/m2) u obesidad mórbida (IMC ≥ 40 kg/m2) (WHO, 2000).
MÉTODOS Y TÉCNICAS:
Los pacientes fueron derivados del consultorio de Infectología y Consejería VIH. Previos otorgamientos del consentimiento informado fueron atendidos en el Servicio de Reumatología del Hospital de Alta Complejidad “Virgen de la Puerta” de Trujillo, los pacientes varones con infección asintomática por el VIH desde octubre 2020 hasta abril 2021, que cumplían con los criterios de inclusión y exclusión.
La información obtenida fue llenada en una ficha de recolección de datos elaborada por la investigadora. Se recolectaron los siguientes datos: edad, tiempo de enfermedad, peso, talla, comorbilidades, medicación habitual, tratamiento antirretroviral recibido, inicio de tratamiento antirretroviral, hábitos nocivos (tabaco, alcohol).
Para el cálculo de la ingesta de gramos de alcohol se utilizó la fórmula: gramos alcohol = (volumen ml x grados de alcohol x 0,8) / 100, que permite obtener la tabla de cantidad de alcohol según el tipo de bebida alcohólica (Morales, 2015).
El nivel de actividad física se determinó según la siguiente clasificación, que se basa en la actividad física realizada los últimos 7 días previos: (1) casi sedentario (realiza actividad física leve por ˂ 2 horas a la semana), (2) actividad leve (realiza actividad física leve de 2 a 4 horas por semana), (3) actividad moderada (realiza actividad física leve ˃ 4 horas por semana y actividad vigorosa de 2 a 4 horas por semana) y (4) actividad alta (realiza actividad física vigorosa ˃ 4 horas por semana o deportes competitivos varias veces a la semana). Para el propósito de este estudio se agrupó a los del grupo 1 y 2 como “grupo de actividad física baja”, y a los de los grupos 3 y 4 como “grupo de actividad física alta” (Jeppesen et al., 1998).
La característica de la dieta en cuanto a la ingesta de calcio se determinó con la aplicación del cuestionario de frecuencia de alimentos semanal (Orozco et al., 2004), calculando la ingesta total diaria: (sumatoria del número de raciones x calcio en mg/7).
De otro lado se les realizó a los pacientes, una densitometría ósea utilizando un densitómetro MEDIX DR, y se evaluó las siguientes zonas: columna lumbar, cadera total izquierda y cuello femoral izquierdo. Se utilizó los valores de Z score, según la clasificación de la Organización Mundial de la Salud para varones menores de 50 años (Z score: Normal: ˃ - 2, Baja: ≤ -2) (WHO, 1994).
Se determinó la frecuencia de DMO baja en la muestra y luego se dividió a la muestra en 2 grupos (pacientes con DMO normal y DMO baja); y se evalúo según el tipo de TAR y nivel de actividad física.
Los resultados fueron presentados en tablas de frecuencia. Además, para el análisis univariado se utilizó para las variables continuas las prueba “t” Student y U de Mann Whitney; y para las variables categóricas la prueba Z de comparación de proporciones.
Este estudio fue realizado de acuerdo a las normas éticas internacionales, preservando siempre los derechos y el bienestar de los participantes.
3. Resultados
Se incluyeron 39 pacientes varones con infección asintomática por el VIH, con una edad promedio de 32,13 ± 6,83 años, un tiempo de enfermedad promedio de 1,63 ± 0,56 años, un índice de masa corporal promedio de 24,74 ± 3,13 kg/m2 y un tiempo de tratamiento antirretroviral promedio de 1,54 ± 0,61 años.
Además, el promedio de ingesta de calcio al día de los pacientes fue de 369,86 ± 146,74 mg/d.
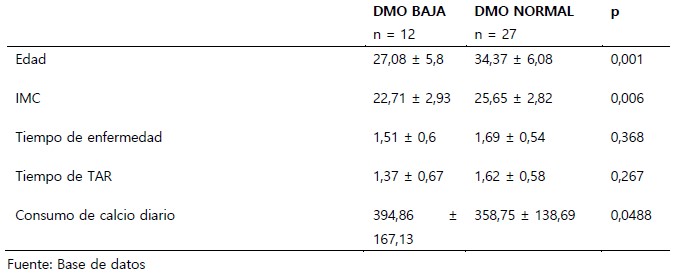
En lo que respecta a la densidad mineral ósea, según la clasificación de la OMS (Z score), se encontró 12 pacientes (31%) con DMO baja y 27 pacientes (69%) con DMO normal, como se muestra en Tabla 1. Se encontró diferencia significativa entre los pacientes con DMO baja y normal en cuanto a la edad, índice de masa corporal y consumo diario de calcio.
Tabla 1. Características demográficas y clínicas de varones jóvenes con infección asintomática por el VIH y TAR menor de 2 años, Hospital de Alta Complejidad "Virgen de la Puerta". Trujillo-2021.
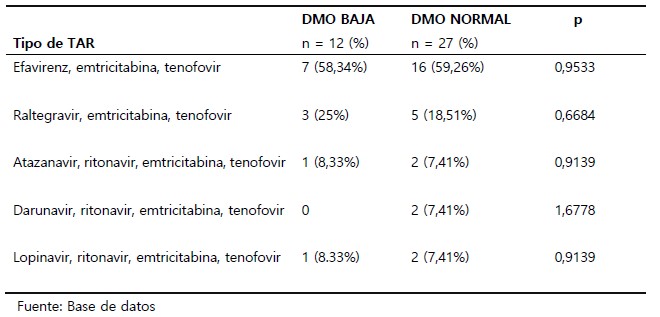
Los esquemas de tratamiento antirretroviral que recibían los pacientes fueron: efavirenz, emtricitabina y tenofovir (23 pacientes, 58,97%); raltegravir, emtricitabina y tenofovir (8 pacientes, 20,51%); atazanavir, ritonavir, emtricitabina y tenofovir (3 pacientes, 7,69%); lopinavir, ritonavir, emtricitabina y tenofovir (3 pacientes, 7,69%); darunavir, ritonavir, emtricitabina y tenofovir (2 pacientes, 5,13%). En el grupo con DMO baja el esquema más frecuentemente utilizado fue el de efavirenz, emtricitabina y tenofovir (7 pacientes). No se encontró diferencia significativa entre los pacientes con DMO normal y baja según esquema de TAR. (Tabla 2).
Tabla 2. Densidad mineral ósea de varones jóvenes con infección asintomática por el VIH y TAR menor de 2 años, Hospital de Alta Complejidad "Virgen de la Puerta", según tipo de TAR
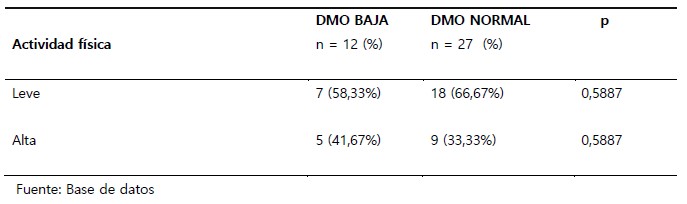
En cuanto al nivel de actividad física, 25 pacientes (64%) presentaron actividad física leve y 14 pacientes (36%) con actividad física alta. No se encontró diferencia significativa entre los pacientes con DMO normal y baja según el nivel de actividad física (Tabla 3).
Tabla 2. Densidad mineral ósea de varones jóvenes con infección asintomática por VIH y TAR menor de 2 años, Hospital de Alta Complejidad "Virgen de la Puerta", según nivel de actividad física
4. Discusión
En este estudio se encontró una frecuencia del 31% de densidad mineral ósea baja en varones jóvenes con infección asintomática por el VIH y en TAR durante al menos 2 años. Esto es un hallazgo similar al reportado por Paccou et al. (2017) en Francia, que encontró baja masa ósea en el 24,5% en 49 varones jóvenes con infección por el VIH y menos de 10 días de TAR. No se han realizado estudios similares en otros países.
Se encontró diferencia significativa en cuando a la edad entre aquellos pacientes con densidad mineral ósea baja y normal, siendo menor en el grupo de densidad mineral ósea baja. Esto es diferente a lo que reporta la literatura, que menciona que a partir de los 40 años disminuye la masa ósea; incluso a mayor edad es mayor el riesgo de fractura (Aspray & Hill, 2019); quizás esto se deba al pequeño número de la muestra del estudio. Además, el nivel máximo de masa ósea se alcanza entre los 20 a 30 años, y los principales determinantes de su adquisición son los factores genéticos, los factores ambientales (como la actividad física y la dieta) y los factores hormonales; siendo el factor genético el que aporta en gran parte en su adquisición (Rozenberga et al., 2020).
Asimismo, se encontró diferencia significativa en cuando al índice de masa corporal entre aquellos pacientes con densidad mineral ósea baja y normal, siendo menor en el grupo de densidad mineral ósea baja. Esto está de acuerdo en lo reportado por la literatura, que menciona que a menor IMC, hay menor densidad mineral ósea. Por ello dentro de las medidas de estilo de vida para la prevención de fracturas incluye mantener un peso corporal saludable (índice masa corporal >20 kg/m2) (Ensrud & Crandall, 2017).
Es importante mencionar que el promedio diario de ingesta de calcio en toda la muestra fue inferior al recomendado por las organizaciones internacionales, que recomiendan una ingesta diaria de 1000mg/día (Institute of Medicine, 2011). De otro lado, también se encontró diferencia significativa en cuando al promedio diario de ingesta de calcio entre aquellos pacientes con densidad mineral ósea baja y normal, siendo mayor en el grupo de densidad mineral ósea baja. Quizás esto se deba al tratamiento antirretroviral, ya que se ha reportado que altera el metabolismo fosfo-cálcico a través de la inactivación de la vitamina D (Gullón & García, 2013).
Según el tipo de tratamiento antirretroviral, no se encontró diferencias entre los diferentes esquemas. Esto puede deberse a la pequeña muestra que se obtuvo para cada uno de los tipos de TAR. El esquema que presentó un mayor porcentaje de pacientes con densidad mineral ósea baja fue el de efavirenz + emtricitabina + tenofovir, con un 58,4%. Similar a lo reportado por Stellbrink et al. (2010) que encontró una mayor disminución de la DMO en sujetos tratados con tenofovir/emtricitabina. Además, hay reportes que el efavirenz disminuye la concentración de vitamina D al inducir su metabolismo (Dave et al., 2015), lo que impactaría en la densidad mineral ósea.
En lo que respecta al nivel de actividad física, no se encontró diferencias entre los pacientes con actividad física leve y alta. Esto difiere de lo que reporta la literatura que menciona que la actividad física de alto impacto mejora la salud ósea, pero también se sugiere que un mayor volumen de actividad física de bajo impacto puede ser importante. (Rowlands et al., 2020) Y de otro lado, el sedentarismo incrementa el riesgo de osteoporosis. (Perazzo et al., 2018)
Es importante monitorizar la densidad mineral ósea en varones jóvenes con infección asintomática por el VIH y que se encuentren en tratamiento antirretroviral, para la detección temprana y tratamiento oportuno de cualquier alteración.
5. Conclusiones
Se encontró densidad mineral ósea baja en el 31% de varones jóvenes con infección asintomática por el VIH en tratamiento antirretroviral menor de 2 años. No se encontró diferencia significativa entre los grupos de densidad mineral ósea normal y baja, en cuanto al tipo de TAR. Tampoco se encontró diferencia significativa entre ambos grupos, en cuanto al nivel de actividad física.
6. Agradecimientos
Al Servicio de Infectología y Consultorio de Consejería VIH del Hospital de Alta Complejidad “Virgen de la Puerta”, EsSalud de Trujillo; por las facilidades brindadas.
7. Contribución de los autores
S. R.: concepción y diseño del estudio, adquisición de datos, análisis e interpretación de los datos, aprobación definitiva de la versión final.
8. Conflicto de intereses
La autora declara que no existe conflicto de interés.
9. Referencias Bibliográficas
Abreu, J., Nogueira, A., Villela, M., Módolo, D., Panaro, T., Setubal, S., Velarde, L., Lima, G., Da Cruz, R. & Soares, D. (2022). Low bone mass and vitamin D in Brazilian people living with HIV under antiretroviral therapy. Arch Osteoporos.,17(1), 40.
Ahmad, A., Ahmad, S. & Ahmad, N. (2017). HIV Infection and Bone Abnormalities. The Open Orthopaedics Journal, 11, 777-784.
Aspray, T. & Hill, T. (2019). Osteoporosis and the ageing skeleton. Subcell Biochem., 91, 453-76.
Biver, E. (2022). Osteoporosis and HIV Infection. Calcified Tissue International, 110, 624-640.
Chang, C., Chan, Y., Pramukti, I., Ko, N. & Tai, T. (2021). People with HIV infection had lower bone mineral density and increased fracture risk: a meta-analysis. Arch Osteoporos, 16, 47.
Choe, P., Choi, H., Kim, N-H., Park, W., Song, K-H., Bang, J., Kim, E., Park, S., Kim, H., Oh, M. & Kim, N. (2014). High prevalence of low bone mass and associated factors in Korean HIV-positive male patients undergoing antiretroviral therapy. Journal of the International AIDS Society, 17,18773.
Da Silva, D., Soares, L., Pereira, R., Rutherford, G., Assone, T. & Takayama L. (2017) Low bone mineral density among HIV-infected patients in Brazil. Rev Inst Med Trop São Paulo, 59 (e89), 1-5.
Dave, J., Cohen, K., Micklesfield, L., Maartens, G. & Levitt, N. (2015). Antiretroviral Therapy, Especially Efavirenz, Is Associated with Low Bone Mineral Density in HIV-Infected South Africans. PloS ONE., 10 (12), 1-9.
Ensrud, K. & Crandall, C. (2017). Osteoporosis. Ann Intern Med., 167(3), ITC17- ITC32.
Gullón, A. & García, J. (2013). Osteoporosis en los pacientes infectados por el virus de la inmunodeficiencia humana. Semin Fund Esp Reumatol., 14(1), 18-23.
Hileman, C., Eckard, A. & McComsey, G. (2015). Bone loss in HIV - a contemporary review. Curr Opin Endocrinol Diabetes Obes., 22(6), 446-451.
Institute of Medicine. (2011). Dietary reference intakes for calcium and vitamin D. Washington, DC: National Academies Press.
Jeppesen, J., Hein, H., Suadicani, P. & Gyntelberg, F. (1998). Triglyceride concentration and ischemic heart disease: an eight year followup in the Copenhagen male study. Circulation, 97: 1029-1036.
Marques, B., Menezes, C., Pinto, C. & Machado, G. (2020). Osteopenia and osteoporosis among treatment-experienced people living with HIV. Braz J Infect Dis., 24(4), 288–295.
Masyeni, S., Utama, S., Somia, A., Widiana, R. & Merati, T. (2013). Factors Influencing Bone Mineral Density in ARV-Naïve Patients at Sanglah Hospital, Bali. Acta Med Indones-Indones J Intern Med, 45 (3), 175-179.
Meng, W., Chen, M., Song, Y., Zhang, H., Xie, R. & Zhang, F. (2021). Prevalence and Risk Factors of Low Bone Mineral Density in HIV/AIDS Patients: A Chinese Cross-Sectional Study. J Acquir Immune Defic Syndr., 90(3), 360-368.
Ministerio de Salud (MINSA) Centro Nacional de Epidemiología, Prevención y Control de Enfermedades (2017). Situación epidemiológica del VIH - Sida en el Perú. Boletín VIH/SIDA. http://www.dge.gob.pe/portal/index.php?option=com_content&view=article&id=362&Itemid=362.
Morales, A. (2015). ¿Cuánto alcohol consumimos cuando decimos que bebemos “lo normal”? Determinación de la tasa de alcoholemia. EducaFarma 3.0. https://gredos.usal.es/jspui/bitstream/10366/.../13%20%20Consumo%20Alcohol.pdf.
Moran, C., Weitzmann, M. & Ofotokun, I. (2016). The Protease Inhibitors and HIV Associated Bone Loss. Curr Opin HIV AIDS, 11(3), 333-342.
Ofotokun, I., Titanji, K., Vunnava, A., Roser-Page, S., Vikulina, T., Villinger, F., Rogers, K., Sheth, A., Lahiri, C., Lennox, J. & Weitzmann, N. (2016). Antiretroviral therapy induces a rapid increase in bone resorption that is positively associated with the magnitude of immune reconstitution in HIV infection. AIDS, 30, 405-414
Orozco, P., Vilert, E. & Zwart, M. (2004). Evaluación de la ingesta de calcio en la población adulta de España. Estudio INDICAD. REEMO, 13(6):117-21.
Ozcan, S., Sevgi, D., Oncul, A., Gunduz, A., Pehlivan, O., Terlemez, R., Kuran, B. & Dokmetas, I. (2022). The Prevalence and Associated Factors of Reduced Bone Mineral Density (BMD) Among Men with Suppressed Viral Load Taking Antiretroviral Therapy. Curr HIV Res., 20(1), 74-81.
Paccou, J., Viget, N., Drumez, E., Cortet, B. & Robineauc, O. (2017). Prevalence and risk factors for low bone mineral density in antiretroviraltherapy-naive HIV-infected young men. Med Mal Infect, https://doi.org/10.1016/j.medmal.2018.02.009.
Panel on Antiretroviral Guidelines for Adults and Adolescents. (2018). Guidelines for the Use of Antiretroviral Agents in Adults and Adolescents living with HIV. Department of Health and Human Services. http://www.aidsinfo.nih.gov/ContentFiles/AdultandAdolescentGL.pdf.
Parekh, B., Ou, C-Y., Fonjungo, P., Kalou, M., Rottinghaus, E., Puren, A., Alexander, H., Cox, M. &. Nkengasong, J. (2019). Diagnosis of human immunodeficiency virus infection. Clin Microbiol Rev, 32 (1), 1-55.
Paz, C. (2017). Efectividad del tratamiento con antirretrovirales en la transmisión vertical del VIH en embarazadas que asistieron al Hospital Martin Icaza en el año 2014. [Tesis doctoral, Universidad Nacional Mayor de San Marcos, Lima, Perú].
Perazzo, J., Webel, A., Alam, S., Sattar, A. & McComsey. G. (2018). Relationships Between Physical Activity and Bone Density in People Living with HIV: Results from the SATURN-HIV Study. J Assoc Nurses AIDS Care, 29(4), 528-537.
Pérez, C. & Ceballos, M. (2014) Alta frecuencia de hipovitaminosis D y baja densidad mineral ósea en un grupo de hombres con infección por VIH en Chile. Rev Chilena Infectol, 31 (1), 44-46.
Rowlands, A., Edwardson, C., Dawkins, N., Maylor, B., Metcalf, K. & Janz, K. (2020). Physical Activity for Bone Health: How Much and/or How Hard? Med Sci Sports Exerc., 52(11), 2331-2341.
Rozenberga, S., Bruyèreb, O., Bergmannc, P., Cavalierd, E., Gielene, E., Goemaeref, S., Kaufmang, J., Lapauwh, B., Laurenti, M., De Schepperj, J. & Body, J. (2020). How to manage osteoporosis before the age of 50. Maturitas, 138, 14-25.
Ruiz-Henao, G., Arenas-Quintero, H., Estrada-Álvarez, J. & Villegas-Muñoz, Y. (2017). Trastornos de la densidad mineral ósea en personas con VIH en tratamiento antirretroviral Pereira- Risaralda-Colombia. Infectio, 21(4), 208-213.
Short, C-E., Shaw, S., Fisher, M., Walker-Bone, K. & Gilleece, Y. (2014). Prevalence of and Risk Factors for Osteoporosis and Fracture among a Male HIV-Infected Population in the UK. Int J STD AIDS, 25(2), 113–121.
Stellbrink, H., Orkin, C., Arribas, J., Compston, J., Gerstoft, J., Van Wijngaerden, E., Lazzarin, A., Rizzardini, G., Sprenger, H., Lambert, J., Sture, G., Leather, D., Hughes, S., Zucchi, P. & Pearce, H. (2010). ASSERT Study Group. Comparison of changes in bone density and turnover with abacavir-lamivudine versus tenofovir-emtricitabine in HIV-infected adults: 48-week results from the ASSERT study. Clin Infect Dis, 51, 963-972.
Supervía, A. (2002). Efectos del hábito tabáquico sobre la masa ósea, remodelado óseo, hormonas sexuales y otras hormonas y eje parathormona-vitamnia D y análisis de los efectos de la suspensión del tabaquismo. [Tesis doctoral, Universitat Autónoma de Barcelona, España].
Tomazic, J., Ul, K., Volcanšek G., Gorenšek, S., Pfeifer, M., Karner, P., Prezelj, J., Vidmar, G. & Vidmar. L. (2007). Prevalence and risk factors for osteopenia/osteoporosis in an hiv-infected male population. Wien Klin Wochenschr, 119 (21), 639–646.
Tobón J. & Toro A. (2008). Estudio del paciente con infección por VIH. Medicina & Laboratorio, 14 (1), 11- 42.
World Health Organization. (1994). Assessment of fracture risk and its application to screening for postmenopausal osteoporosis. WHO technical report series 843, 1-136.
World Health Organization. (2000). Obesity: preventing and managing the global epidemic. World Health Organ Tech Rep Ser 2000; 894: 1-253.