EFECTO IN VITRO DEL ACEITE ESENCIAL DE Cymbopogon citratus SOBRE LA EMBRIOGENESIS Y VIABILIDAD DE LOS HUEVOS DE Trichuris ovis
IN VITRO EFFECT OF Cymbopogon citratus ESENTIAL OIL ON EMBRIOGENESIS AND VIAVILITY OF Trichuris ovis eggs
Lorenzo Ibáñez-Lujan 1; Cristopher Sánchez-Rojas 1; César Jara-Campos 1 *
1 Departamento de Microbiología y Parasitología. Universidad Nacional de Trujillo. Trujillo-Perú.
Cristopher Sánchez-Rojas:
Artículo original
Recibido: 29 de abril 2022
Aceptado: 21 de junio 2022
Resumen
El aumento de la prevalencia de nematodos gastrointestinales resistentes a antihelmínticos, la presencia de residuos de éstos en productos animales comerciales y su alto costo, ha motivado el interés de investigar otras fuentes de antihelmínticos. Cymbopogon citratus (DC.) Stapf. es usada en la medicina tradicional por sus propiedades antimicrobianas y antiparasitarias. El objetivo de esta investigación fue evaluar la actividad del aceite esencial (AE) de las hojas de C. citratus cultivada en Poroto (Trujillo, Perú), en concentraciones de 0,31 mg/mL (AE-0,31), 0,62 mg/mL (AE-0,62) y 1,25 mg/mL (AE-1,25), sobre la embriogénesis y viabilidad de los huevos de Trichuris ovis (Abidgaard, 1795). Para ello, se determinó el porcentaje de huevos larvados a los 21 días del ensayo. El AE se obtuvo por hidrodestilación y se disolvió en Tween 80 al 3%. Se utilizaron huevos ovipuestos por hembras recolectadas de ovinos infectados naturalmente e inmediatamente incubados en medio RPMI (Merck) a 37°C. La evaluación se hizo en una placa de poliestireno (Falcon) de 24 pocillos (4 x 6), en tres pocillos de cada fila se incubaron aproximadamente 100 huevos con: AE-0,31 (fila 1), AE-0,62 (fila 2) y AE-1,25 (fila 3). La fila 4 se usó como control (sin AE). La placa se mantuvo a 30±0,5°C y se determinó el porcentaje promedio de huevos sin larva en el día 21 de prueba. Se encontró que el 1,3% de huevos del grupo control, el 3,3% con AE-0,31, el 14,3% con AE-06,2 y el 90,6% del grupo con AE-1,25 no presentaron larvas. En conclusión, este ensayo sugiere que el AE de las hojas de C. citratus (Poaceae) de Poroto, Trujillo (Perú) tiene actividad ovicida in vitro contra Trichuris ovis.
Palabras clave: Aceite esencial, antihelmínticos, desarrollo larvario, Cymbopogon citratus, técnicas in vitro, Trichuris ovis.
Abstract
The increase in prevalence of anthelmintic-resistant of gastrointestinal nematodes, the presence of their residues in commercial animal products, and their high cost have aroused the interest in investigating other sources of anthelmintics. Cymbopogon citratus (DC.) Stapf. is used in traditional medicine for its antimicrobial and antiparasitic properties. The objective of this research was to eva luate the activity of the essential oil (EO) of the leaves of C. citratus cultivated in Poroto (Trujillo, Peru), in concentrations of 0.31 mg/mL (EO-0.31), 0.62 mg/mL (EO -0.62) and 1.25 mg/mL (EO-1.25), on the embryogenesis and viability of Trichuris ovis eggs (Abidgaard, 1795). For this, the percentage of eggs hatched at 21 days of the trial was determined. The essential oil was obtained by hydrodistillation and dissolved in 3% Tween 80. Eggs laid by females that were collected from naturally infected sheep and immediately incubated in RPMI medium (Merck) at 37°C were used. The evaluation was done in a polystyrene plate (Falcon) with 24 wells (4 x 6), in three wells of each row approximately 100 eggs were incubated with: EO-0.31 (row 1), EO-0.62 (row 2) and EO-1.25 (row 3). Row 4 was used as a control (no EO). The plate was kept at 30±0.5°C and the average percentage of eggs without larvae on day 21 of the test was determined. It was found that 1.3% of eggs from the control group, 3.3% with EO-0.31, 14.3% with EO-06.2 and 90.6% of the group with EO-1.25 did not present larvae. In conclusion, this trial suggests that EO from the leaves of C. citratus (Poaceae) from Poroto, Trujillo (Peru) has in vitro ovicidal activity against Trichuris ovis.
Keywords: Essential oil, anthelmintics, larval development, Cymbopogon citratus, in vitro techniques, Trichuris ovis.
* Autor para correspondencia: E. mail: cjara@unitru.edu.pe
Citar como:
Ibañez-Lujan, L., Sánchez-Rojas, C., & Caja-Campos, C. 2022. Efecto in vitro del aceite esencial de Cymbopogon citratus sobre la embriogénesis y viabilidad de los huevos de Trichuris ovis. REBIOL, 42(1): 20-28.
1. Introducción
Trichuris ovis (Abildgaard, 1795) es uno de los nematodos gastrointestinales (NGI) frecuentes de ovinos, caprinos, vacunos y camélidos en distintas partes del mundo y en el Perú (Sarmiento et al., 1999; Gul & Tak, 2016; Puicón et al., 2018; Yeustafieva et al., 2018). Los huevos de Trichuris, típicamente en forma de barril con dos opérculos en forma de enchufe polares y con capas externa gruesa trilaminada e interna delgada (vitelogena), son excretados al ambiente con las heces de sus hospedadores insegmentados y aun no infectivos, condición que adquieren en, aproximadamente, tres semanas en climas tropicales y subtropicales (Yeustafieva et al., 2018). T. ovis es un parásito patógeno debido a que se alimenta exclusivamente de sangre y puede ocasionar anemia, hipoalbuminemia, ulceraciones de la mucosa del intestino, diarrea, pérdida de peso y debilidad (Gul & Tak, 2016).
Debido a que las infecciones por NGI constituyen una gran amenaza y principal limitación de la producción ovina que pone en peligro el bienestar animal a nivel mundial, se ha optado desde hace décadas por el uso de drogas comerciales, tales como el Albendazol, Tetramisol y la Ivermectina para minimizar este efecto (Molento et al., 2011; Mavrot et al., 2015); sin embargo, su uso inapropiado ha provocado la resistencia a dichos antihelmínticos y otros efectos adversos tales como, su acumulación en los productos pecuarios como la leche, efectos secundarios como diarreas y acumulación de sus residuos en el medio ambiente; la resistencia antihelmíntica ha sido observada en varias especies de NGI, entre ellos: Haemonchus contortus, Teladorsagia circumcincta, Trichostrongylus spp., Oesophagostomum columbianum y T. ovis, de varios países (Da Silva et al., 2018; Ploeger et al, 2018).
Cymbopogon citratus (DC.) Stapf, conocida como “hierba luisa”, originaria del Perú, pertenece a la Familia Poaceae. Se caracteriza por un olor fuerte, de 20 a 50 cm de longitud, que crece de modo silvestre en zonas subtropicales y es apreciada por su uso en medicina tradicional; en efecto, es usada por sus propiedades diuréticas, antiasmáticas, antidepresivos, antioxidantes, astringentes y antisépticos (Bussman, 2014; Cabanillas Martínez & Gonzáles Sarmiento, 2018; Sánchez Hinostrosa, 2020). Estudios fitoquímicos han mostrado que esta hierba presenta constituyentes bioactivos conformadas por sustancias no volátiles, tales como flavonoides, ácido cafeico y volátiles, principalmente citral y geraniol (Avosev, et al., 2015) y estudios in vivo e in vitro han demostrado que el aceite esencial y extractos de naturaleza diversa tienen diferentes actividades como antibacteriana contra bacterias Gram positivas y Gram negativas (Oliveira et al., 2017; Bermúdez Vásquez, et al., 2019; Braga da Silva et al., 2019; Piasecki et al., 2021), anti fúngica contra Candida (De Paiva, et al., 2022; Sawadogo et al., 2022), anti protozoaria contra Trypanosoma (Emiru et al., 2020), nematicida (Echeverrigaray et al., 2015) e insecticida contra Aedes y Boophilus (Pinto et al., 2015; Serra Rosa et al., 2021; Castillo-Morales et al., 2021).
Extractos y aceites esenciales de diferentes especies de plantas han sido probadas contra huevos y Larvas L3 de NGI, principalmente de Haemoncus contortus, nematodo gastrointestinal debido a que se alimenta exclusivamente de sangre en el abomaso y genera una patología grave en el ovino (Ali et al., 2021). Los aceites esenciales son metabolitos secundarios de plantas aromáticas compuestos por sustancias diversas con diferentes concentraciones y de ellos, los que han probado tener actividad antiparasitaria contra H. contortus han sido obtenidos de: Eucalyptus globulus (Macedo et al., 2009), Alpinia zerumbet, Coriandrum sativum y Tagetes minuta (Macedo et al., 2013), Piper aduncum (Oliveira et al., 2014), Zanthoxylum simulans (Qi et al., 2015), Thymus vulgaris (Ferreira et al., 2016), Hesperozygis myrtoides (Castilho et al., 2017), Citrus aurantifolia, Anthemis nobile y Lavandula officinalis (Ferreira et al., 2018), Arthemisia vulgaris (Malik et al., 2019), Anethum graveolens (Castro et al., 2021), y también Cymbopogon citratus (Macedo et al., 2015).
Desde el punto de vista de la relación parásito-huésped T. ovis es similar a H. contortus, porque ambos se alimentan solamente de sangre y causan efectos adversos semejantes (Gul & Tak, 2016); sin embargo, las investigaciones respecto de la actividad de aceites esenciales naturales, dentro de ellas la obtenida de C. citratus, contra H. contortus es amplia (Macedo et al., 2009; Olivera et al., 2014; Qi et al., 2015; Ferreira et al., 2019; Castillo et al., 2019; Castro et al., 2021; Ali et al., 2021), mientras que para T. trichiura es incompleta, a pesar de que se ha verificado que esta planta tiene capacidad antihelmíntica (Macedo et al., 2015; Freitas et al,, 2019). Esta hierba puede conseguirse con relativa facilidad debido a que presenta una amplia distribución geográfica en zonas tropicales y subtropicales como la nuestra. Teniendo en cuenta estas consideraciones, la presente investigación tuvo como objetivo determinar si el aceite esencial de las hojas de C. citratus cultivada en Poroto-Trujillo Perú, inhibe el desarrollo de la larva dentro del huevo (embriogénesis) de T. ovis in vitro. Debido a la presencia de flavonoides en tal aceite esencial, que son sustancias que han mostrado actividad ovicida contra NGI especie vegetal, se propuso que inhiba el desarrollo larvario dentro del huevo en proporción directa a la concentración: a mayor concentración del aceite, mayor porcentaje de inhibición del desarrollo larvario dentro del huevo.
2. Materiales y Métodos
Diseño de investigación
Es un ensayo in vitro, estudio cuasi-experimental con grupo de control y sin aleatorización), con el siguiente diseño:
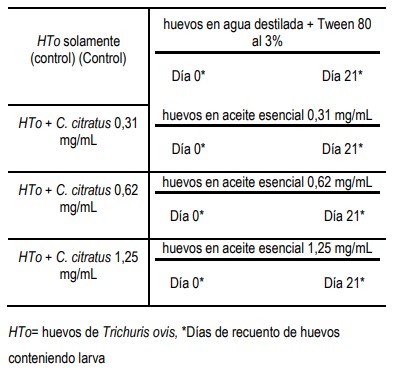
Preparación del aceite esencial (AE) de Cymbopogon citratus
Hojas de C. citratus se recolectaron en el verano del 2021 en el distrito de Poroto, Trujillo, Perú (8 ° 01' 02''S, 78° 45' 59''O) a una altura de 716 m.s.n.m. (Fig. 1). El manejo de las muestras se realizó de acuerdo al protocolo propuesto por Cabrera y Silva (2021), con los siguientes criterios de inclusión: sin roturas, sin signos producto de infecciones por microorganismos, tales como marchitamiento y clorosis, ni lesiones por agentes físicos. La identificación taxonómica se hizo en el Herbarium Truxillense (HUT) de la Universidad Nacional de Trujillo (Trujillo, Perú), para ello se siguió los requisitos señalados por dicha Institución.
Tres kg de hojas fueron sometidos a hidrodestilación durante 3 h, el destilado se deshidrató con sulfato de sodio anhidro y se almacenó en un frasco de vidrio color ámbar con tapa de 500 mL. De este modo se conservó en refrigeración a 4ºC hasta su utilización (Manconi et al., 2018; Castro et al., 2021). A partir del AE puro (densidad inicial 0,87252 g/mL) se prepararon las emulsiones de 2,50; 1,25; 0,62 mg/mL mediante diluciones subsecuentes. De este modo, para lograr la emulsión, el AE se integró en una mezcla de ADE y Tween 80 al 3% (Macedo et al., 2015; Ferreira et al., 2018).

Figura 1. Cymbopogon citratus (DC.) Stafp (Poaceae) de Poroto, La Libertad, Perú del cual se obtuvo el aceite esencial para probar su actividad ovicida contra Trichuris ovis (flecha).
Obtención de huevos de Trichuris ovis
Nematodos con características compatibles con las del género Trichuris (aproximadamente 3 cm, una porción corta y gruesa y la otra fina y muy alargada) fueron recolectados vivos del ciego de ovinos, Ovis aries, infectados naturalmente y sacrificados en el Camal Municipal El Porvenir (Trujillo, Perú). Los especímenes se recolectaron con pinceles en placas de Petri convencionales conteniendo PBS donde fueron lavadas por agitación manual; de inmediato, se seleccionaron a ejemplares hembras (cola no enrollada) que fueron depositadas en tubos con PBS para ser trasladas al laboratorio en un termo con agua tibia (Sing & Lal, 2011).
En el laboratorio, con ayuda de un estéreo-microscopio, se seleccionaron a las hembras correspondientes a T. ovis de acuerdo a los criterios propuestos por Oliveiros y Cutillas (2003) y Gul & Talk (2016) las cuales fueron colocadas en microviales de 1,5 que contenían 1 mL de medio RPMI-1640 suplementado con penicilina 500 UI/mL, estreptomicina 500 μg/mL y fluconazol 64 μg/mL e incubados a 37 °C durante 24 h, con el propósito de que las hembras depositen sus huevos espontáneamente y que fueron apreciados a modo de botón en el fondo del vial (Sing & Lal, 2011). La calidad de los huevos (huevos con cascara intacta, mamelones polares, con dos zonas claras similares a núcleos) se determinó con la ayuda de un microscopio invertido. A continuación, los huevos se transfirieron a un tubo de 15 mL para su posterior lavado.
El lavado se realizó con agua destilada estéril (ADE) haciendo uso de una centrífuga programada a 3500 RPM por 5 minutos, este último paso se repitió 3 veces. Luego del lavado, los huevos se colocaron en un solo tubo con ADE para obtener una suspensión madre, la cual se conservó a 4°C (Oliveira et al., 2014).
Preparación de la suspensión de huevos
La concentración inicial de huevos, en el tubo con suspensión madre, se estimó con la ayuda de un microscopio a 100 aumentos, por lo tanto, se determinó el número de huevos/volumen (µL) de solución madre. De esta manera, se contó sobre un portaobjeto los huevos contenidos en un volumen de 20 µL de ADE, y para obtener un valor más confiable se realizaron 12 repeticiones de estos conteos, en tal sentido, para disminuir los errores se homogenizó la suspensión en cada repetición, además, se eliminó el conteo más alto y el más bajo, para finalmente promediar los 10 conteos restantes y conocer el número promedio de huevos en 20 μL de ADE. Aplicando una regla de tres se calculó la cantidad de huevos por mL de ADE (Macedo et al., 2015).
Determinación del efecto antihelmíntico del aceite
Para determinar el efecto del AE se utilizó una placa de poliestireno (Falcon) de 24 pocillos (4 filas de 6). En pocillos de cada fila (tres repeticiones) se colocaron aproximadamente 100 huevos o su equivalente en volumen (250 μL de la suspensión de huevos en ADE) más 250 μL de emulsión del AE. Para lograr la concentración deseada, en cada pocillo se agregó el doble de la concentración de aceite, de esta manera el volumen de ADE procedente de la suspensión de huevos ajusta la concentración final a la que se evaluó el ensayo. En el bioensayo se usó el AE a las concentraciones 1,25; 0,62 y 0,31 mg/mL (grupos experimentales) y Tween 80 al 3% en ADE (control) en cada fila de la placa (seis pocillos por tratamiento). El sistema se tapó con una lámina de vidrio y se incubó durante 21 días a 30±0,5°C a fin de inducir la embrionación, con movimientos rotatorios sobre la mesa diarios para evitar que los huevos se adhieran unos con otros. Transcurrido el periodo de incubación, se contó el número de huevos con larvas en el interior con ayuda de un microscopio invertido (Fig. 2), para ello, se transfirió el contenido de cada pocillo a placas de Petri pequeñas estériles con ayuda de una pipeta Pasteur estéril con chupón (Macedo et al., 2015; Ferreira et al., 2018; Castro et al., 2021).
Análisis estadísticos
La actividad ovicida aceite del esencial de las hojas de C. citratus a 30±0,5°C a los 21 días de incubación se expresaron como el porcentaje de inhibición del desarrollo larvario dentro de los huevos (huevos sin larva) de T. ovis al. Para calcular este porcentaje se utilizó la fórmula [(A)/ (A + B)] x 100, donde A = número de huevos no larvados (promedio de los seis pocillos) y B = número de huevos con larva (promedio de los seis pocillos. Para comparar los porcentajes a diferentes concentraciones del aceite esencial se utilizó el Test de ANOVA seguida del Test de Turkey (p < 0,05) (Ferreira et al., 2018; Castro et al., 2021) utilizando el Programa SPSS v. 22 para Windows.
Consideraciones éticas
El proyecto fue aprobado por el Comité de Ética de la Facultad de Ciencias Biológicas de la Universidad Nacional de Trujillo (Trujillo-Perú), como parte del procedimiento requerido para su aprobación y posterior ejecución. La segregación de residuos sólidos se hizo en concordancia con lo dispuesto para ello en directivas de la Facultad de Ciencias Biológicas y la obtención y manejo de la planta se hizo siguiendo las recomendaciones proporcionadas por Cabrera y Silva (2021).
3. Resultados
Los resultados mostraron que el aceite esencial de las hojas de C. citratus inhibe el desarrollo larvario dentro del huevo de T. ovis, es decir tiene actividad ovicida (Fig. 2), en una proporción directa a la concentración. Así, en el grupo de huevos sin el aceite esencial (Grupo .00, control negativo) sólo el 1,4% de huevos no presentaron larvas; en cambio, en el grupo con aceite esencial a la concentración de 03 mg/mL (Grupo .03), el 3,0% presentaron esa condición, en el grupo con aceite esencial al 0,6 mg/mL (Grupo .06), el 14,0% y en el grupo con aceite a la concentración de 1,25 mg/mL (Grupo 1,25), el 90,8%. El efecto de la concentración 1,25 mg/mL mostró significancia estadística (p < 0.05) en comparación a las otras concentraciones que, entre ellas, no mostraron diferencia estadísticamente significativa (Tabla 1).
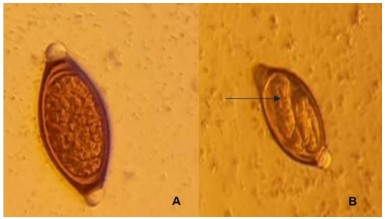
Figura 2. Observación microscópica (40X) del huevo de Trichuris ovis: A. sin larva (correspondiente al grupo experimental incubado en aceite esencial de las hojas de Cymbopogon citratus a la concentración de 1,25 mg/mL. B. con larva, producto de la embrionación, (flecha) del grupo control incubado en Tween 80 al 3%+agua destilada estéril, sin aceite esencial.
Tabla 1. Efecto in vitro de tres diferentes concentraciones del aceite esencial de Cymbopogon citratus (DC.) Stafp (Poaceae) de Poroto, La Libertad, Perú sobre la viabilidad de huevos de Trichuris ovis no embrionados (HTo) a los 21 días de incubación

4. Discusión
Basados en el rol patológico que tiene T. ovis sobre la salud de ovinos y el efecto negativo del control con antihelmínticos comerciales sintéticos que generan resistencia y se acumulan en productos derivados de la explotación ovina y el medio ambiente (Da Silva et al., 2018; Ali et al., 2021), en este ensayo in vitro se determinó la actividad del aceite esencial de C. citratus sobre la embriogénesis y viabilidad de los huevos de C. citratus, que mostró un significante efecto dosis dependiente sobre la viabilidad de los huevos de T. ovis. El mejor efecto se observó cuando se empleó la dosis más alta (1.25 mg/mL) donde la actividad inhibitoria alcanzó el 90,6 %; este efecto podría deberse a la difusión de los componentes del AE a través del cascarón del huevo e impedir la embrionación por destrucción de las células por los flavonoides, geraniol y citral presentes en las hojas de C. citratus (Braga da Silva et al., 2018; Castillo-Morales et al., 2021; Ferreira et al., 2018).
Este hallazgo podría constituir el inicio de investigaciones de otra índole, tales como de ensayos clínicos que corroboren su actividad in vivo y con ello contar con una alternativa de control saludable y sostenible debido a que es una hierba de fácil consecución y el AE podría agregarse a vegetales de consumo habitual a fin de que actúen como preservante tal como se hizo para combatir bacterias (Sales de Lima et al., 2019); es decir, podría actuar contra los huevos presentes en estos vegetales, teniendo como la base el hecho que T. ovis accede al huésped en forma de huevo presente en los alimentos, o en el intestino grueso de huéspedes ovinos infectados que es donde la hembra coloca los huevos antes de ser expulsados al exterior (Kumsa & Hagos, 2020).
La elección de C. citratus para su evaluación contra T. ovis se hizo en base a los antecedentes; en efecto, se ha probado que sustancias presentes en el AE y en extractos tienen actividad contra virus (Chiamenti et al., 2019); bacterias Gram positivas y Gram negativas (Oliveira et al., 2017; Bermudez-Vasquez et al., 2019; Sales de Lima et al., 2019; Braga da Silva et al., 2019; Mukarram et al., 2022); hongos patógenos de humanos como Candida (De Paiva et al., 2021) y de vegetales explotados agro-industrialmente (Pérez-Cordero et al., 2017); protozoarios tales como Trypanosoma (Emiru et al., 2021) y Plasmodium (Oladeji et al., 2020); huevos y larvas L2 de nematodos parásitos de animales de importancia económica como H. contortus (Macedo et al., 2015; Kumsa et al., 2020) y vegetales tales como Meloidogyne incognita (Echeverrigaray et al., 2010); así como contra huevos y larvas de artrópodos de importancia en salud pública, como es el caso de Aedes aegypti (Castillo-Morales et al., 2021). Según Avoseh et al. (2015), Bermudez-Vasquez et al. (2019); Madi et al. (2021) y Serra Rosa et al. (2021) el AE de C. citratus es versátil para actuar contra diversos agentes patógenos debido a que presenta una serie de componentes bioactivos que han sido identificados en dos grupos: no volátiles (flavonoides y ácido cafeico) y volátiles (geraniol y citral, mireno, citronelal y limoneno). Se ha comunicado que, de ellos, los que tienen actividad contra huevos de nematodos parásitos son flavonoides y el monoterpeno citral, que se presenta como citral A (Trans-isómero) y citral B (Cis-isómero) y que actúa contra el ADN (Alam et al., 2018; Graña et al., 2020), la colinesterasa (Madi et al, 2021) y promueve la apoptosis (Xia et al., 2013). Por analogía, entonces, estas sustancias estarían actuando contra los huevos de T. trichura; sin embargo, es probable que hayan otras sustancias presentes en el AE que también estarían actuando, aspecto que falta abordar en investigaciones futuras; es decir, separar las sustancias de probable actividad y probarlo contra el nematodo aquí investigado, tal como se ha hecho en ocasiones anteriores con otras especies patógenas (Oliveira et al., 2014; Pinto et al., 2015; Manconi et al., 2018; Malik et al., 2019; BermudezVasquez et al., 2019; Serra Rosa et al., 2021)
El hecho de haber encontrado que la actividad del AE de C. citratus contra huevos de T. ovis es dosis dependiente; es decir, a mayor concentración mayor actividad ovicida podría deberse a que los aceites esenciales en general son una mezcla de sustancias químicas, como se ha señalado, cuya interacción puede resultar en compuestos que actuarían contra el metabolismo del parásito, inhibiendo o desorganizando sus funciones vitales desde sus estadíos iniciales: los huevos (Macedo et al., 2013). También se ha comunicado que los AE pueden interactuar con la membrana citoplasmática y pueden interrumpir la estructura de los polisacáridos lípidos y fiosfolítpidos promoviendo una despolarización de la membrana y en consecuencia alteración de la permeabilidad (Katiki et al., 2011; Graña et al., 2020; Gioffre et al., 2020). En definitiva, cuando el AE está más concentrado tendría mayor cantidad y variedad de componentes químicos bioactivos, en particular el citral que tiene actividad citotóxica (Chiamenti et al., 2019) y, en consecuencia, se ejercería mayor actividad contra los huevos reflejada en el menor porcentaje de huevos con larvas: más del 90% con la dosis más alta empleada (1,25 mg/mL). Resultados similares han sido observados en estudios previos, cuando se probó la actividad de aceites esenciales de diversas especies vegetales contra H. contortus, un nematodo patógeno del grupo de los NGI (nematodos gastrointestinales) de rumiantes, entre ellos ovinos, tal como T. ovis (Macedo et al., 2009; Katiki et al., 2011; Oliveira et al., 2014; Ferreira et al., 2018; Castro et al., 2021). Al mismo tiempo, los resultados de la presente investigación respecto del porcentaje de efectividad (90,6%) es concordante con el 99,5% obtenido cuando se probó el AE de C. citratus a la concentración de 1,25 mg/mL contra huevos del nombrado H. contortus (Macedo et al., 2015). Debe señalarse que el huevo de este nematodo tiene un cascarón más delgado que el de T. ovis, hecho que explicaría una mayor eficacia ovicida de AE (99,5 vs. 90,6).
En esta investigación, luego de separar a hembras de machos de T. ovis (los machos, a diferencia de las hembras poseen la cola enrollada) se tuvo hizo la determinación a nivel de especie; como se sabe, además de T. ovis los ovinos pueden estar parasitados al mismo tiempo con T. skrjabini (Baskakov, 1924) que es otra especie cosmopolita y también patógena; sin embargo, el extremo anterior de la hembra de T. ovis, a diferencia de la otra especie, presenta expansiones a modo de aletas a cada lado y la vulva es evertida (Gul & Talk, 2016; Yevstafieva et al., 2018) características que pueden ser observadas utilizando un estereomicroscopio. Al mismo tiempo, hay varias maneras de obtener los huevos a partir de las hembras para hacer los bioensayos orientados a determinar el efecto de AEs o extractos de vegetales; así, por ejemplo, se puede disecar las hembras y recolectar los huevos directamente del útero, sin embargo, esta metodología no permite obtener huevos solamente, sino que el acto de disección arrastra una serie de detritus que resultan en impurezas. La otra manera, que fue usada en esta investigación, es incubar a las hembras, a 37°C, en soluciones que les permitan sobrevivir por tiempos suficientes como para que ovipongan numerosos huevos (Sing & Lal, 2011); de esta manera, se obtienen huevos completamente formados y en suficiente cantidad para diversas pruebas in vitro. También, se ha probado varias soluciones para incubar los huevos y procurar la embriogénesis y formación larvaria al interior de ellos y utilizarlos como controles; se ha usado, por ejemplo, solución salina mezclada con antibióticos, formol al 2% y una mezcla de Tween 80 al 3% con agua destilada estéril.
De todas ellas, la última solución ha permitido obtener mejores resultados (Macedo et al., 2009; Katiki et al., 2011; Oliveira et al., 2014; Ferreira et al., 2018; Castro et al., 2021), esta es la razón por la que utilizó también en la presente investigación; aun así, siempre hay una pequeña cantidad de huevos que no embrionan, como se apreció en esta investigación (1,3%).
Una característica común de las plantas aromáticas es su naturaleza hidrofóbica y por ello, Macedo et al. (2015) sostienen que el primer blanco de la actividad contra los helmintos parásitos es la membrana celular y que luego de ingresar interfieren con el metabolismo, no sólo de huevos sino de larvas L3. Investigaciones hechas en aceites esenciales a partir de plantas de C. martinii y C. schoenanthus sugieren que los responsables de la capacidad antihelmintica del aceite se debe a la sinergia de múltiples terpenoides; sin embargo, no descartan la intervención del neral y el geranial (Ali et al., 2021). En ese sentido, trabajos relacionados con aceites esenciales de C. citratus han registrado que uno de los principios activos que están presentes en mayor concentración de este aceite es el citral, considerada una mezcla de neral y geranial (Xia et al., 2013; Sheikh et al., 2017). Esta sustancia bioactiva también inhibe la colinesterasa, disminuye el potencial de la membrana mitocondrial causando apoptosis y evita la proliferación de los microtúbulos (Kumsa & Hagos, 2020; Graña et al., 2020; Piasecki et al., 2021; Mukarram et al., 2022). Estos hallazgos permiten considerar que la inhibición del desarrollo larvario y, por lo tanto, la muerte de los huevos podría atribuirse a este principio activo, debido a su alta concentración en el aceite esencial del vegetal en estudio, como ha sido registrada en diferentes lugares (Avosech et al., 2015; Bermudez-Vasquez et al., 2019; Castillo-Morales et al., 2021).
C. citratus ya ha sido registrado como una planta con capacidad, por lo tanto, los resultados de la presente investigación sugieren que el aceite esencial de C. citratus tiene un potencial significativo como agente terapéutico y también como fuente de principios activos con actividad antihelmintica. Sin embargo, deben llevarse a cabo nuevas investigaciones in vitro con dosis diferentes e in vivo contra las formas larvarias y adulta para confirmar su capacidad antihelmíntica contra nematodos gastrointestinales.
5. Conclusiones
El aceite esencial de las hojas de Cymbopogon citratus (Poaceae) de Poroto, Trujillo (Perú) y sus componentes químicos al ensayo in vitro tienen efecto ovicida contra Trichuris ovis
6. Contribución de los autores
L.I.L., C.S.R. y C.J.C. concepción y diseño de la investigación, revisión crítica del artículo y aprobación de la versión final
L.I.L. y C.S.R. bioensayos y recolección de datos en el laboratorio.
7. Conflicto de intereses
Los autores declaran no tener conflicto de intereses
8. Referencias Bibliográficas
Alam, M.F., Varshney, S., Khan, M.A., Laskar, A.A. & Younus, H. (2018). In vitro DNA binding studies of therapeutic and prophylactic drug citral. International Journal of Biology Macromolecules, 113, 300-8.
Ali, R., Rooman, M., Mussarat, M., Norin, S., Ali, S., Adnan, M. & Khan, S.N. (2021). A Systematic Review on Comparative Analysis, Toxicology, and Pharmacology of Medicinal Plants Against Haemonchus contortus. Frontiers in Pharmacology, 12, 644027.
Avoseh, O., Oyedeji, O., Rungqu, P., Nkeh-Chungag, B. & Oyedeji, A. (2015). Cymbopogon species; ethnopharmacology, phytochemistry and the pharmacological importance. Molecules, 20(5), 7438-53.
Bermudez-Vásquez, M.J., Granados-Chinchilla, F. & Molina, A. (2019). Composición química y actividad antimicrobiana del aceite esencial de Psidum guajava y Cymbopogon citratus. Agronomía Mesoamericana, 30(1), 147-163.
Braga da Silva, N., Rangel, M.L., Dias de Castro, R., Muniz de Lima, J., Cancado Castellano, L.R., Valenca, A.M.G. & Cavalcanti A.L. (2019). Anti-Biofilm and Hemolytic effect of Cymbopogon citratus (Dc) Stapf Essential Oil. Pesquisa Brasileira em Odontopedriatia e Clínica Integrada, 19, e5911.
Bussman, R.W. (2014). The Globalization of Traditional Medicine in Northern Peru: From Shamanism to Molecules. Evidence-Based Complementary and Alternative Medicine, Article ID 291903.
Cabanillas Martínez, E., Gonzáles Sarmiento, C. (2018). Enfermedades más frecuentes tratadas con plantas medicinales en el distrito de Trujillo, La Libertad, Perú. [Tesis para título. Universidad Nacional de Trujillo].
Cabrera Meléndez, J.L., Silva Alarcón, J.T. (2021). Guía técnica para la colecta de plantas medicinales. Instituto Nacional de Salud. Ministerio de Salud. Lima Perú.
Castilho, C.V.V., Fantatto, R.R., Gaínza, Y.A., Bizzo, H.R., Barbi, N.S., Leitao, S.G. & Chagas, A.C. (2017). In vitro activity of essential oil from Hesperozygis myrtoides on Rhipicephalus (Boophilus) microplus and Haemonchus contortus. Revista Brasileira de Farmacognosia, 27, 70- 76.
Castillo-Morales, R.M., Serrano, S.O., Villamizar, A.R.L., Méndez-Sánchez, S.C. & Duque, J.E. (2021). Impact of Cymbopogon flexuosus (Poaceae) essential oil and primary components on the eclosion and larval development of Aedes aegypti. Scientific Reports, 11, 24291.
Castro, L.M., Pinto, N.B., Moura, M.Q., Villela, M.M., Capella, G.A., Freitag, R.A. & Berne, M.E. (2021). Antihelminthic action of the Anethum graveolens essential oil on Haemonchus contortus eggs and larvae. Braz J Biol., 81(1):183-188.
Chiamenti, L., Pereira da Silva, F., Schallenberger, K, Demoliner, F., Rigotto, C. & Fleck, J.D. (2019). Citoxity and antiviral activity evaluation of Cymbopogon spp hydroethanolic extracts. Brazilian Jouirnal of Pharmaceutical Scienses, 55, e18063.
Da Silva, F., Bezerra, H. F., Feitosa, T.F. & Vilela, V.L. (2018). Nematode resistance to five anthelmintic classes in naturally infected sheep herds in Northeastern Brazil. Revista Brasileira de Parasitologia Veterinaria, 27(4), 423-429.
De Paiva, L.F., Teixeira-Loyola, A.B., Schnaider, T.B., De Souza, A.C., Lima, L.M.Z. & Dias, D.R. (2021). Associación of esential oil of Cymbopogon citratus (DC) Stapf with nystatin against oral cavity yeast. Anais da Academia Brasileira de Ciencias, 94(1); e20200681.
Echeverrigaray, S., Zacaria, J. & Beltrão, R. (2010). Nematicidal activity of monoterpenoids against the root-knot nematode Meloidogyne incognita. Phytopathology, 100(2), 199-203.
Emiru, A.Y., Makkonen, E., Regassa, F., Regassa F. & Tufa, T.B. (2021). Antitrypanosomal activity of hydromethanol extract of leaves of Cymbopogon citratus and seeds of Lepidium sativum: in-vivo mice model. BCM Complementary Medicine and Therapies, 21, 290.
Ferreira, L.E., Benincasa, B.I., Fachin, A.L., França, S.C., Contini, S.S. & Chagas, A.C.S. (2016). Thymus vulgaris L. essential oil and its main component thymol: Anthelmintic effects against Haemonchus contortus from sheep. Veterinary Parasitology, 228, 70-76.
Ferreira, L.E., Benincasa, B.I., Fachin, A.L., Contini, S.H., França, S.C, Chagas, A.C.S. & Beleboni, R.O. (2018). Essential oils of Citrus aurantifolia, Anthemis nobile and Lavandula officinalis: in vitro anthelmintic activities against Haemonchus contortus. Parasites & Vectors, 11(1), 269.
Freitas, I.T., Beserra, L.M., Pinheiro, W.P., De Araujio, J.V., Leite, J.M., Macedo, F.C., Correia, W.L., Camurca-Vasconcelos, A.L., Falcao, E., Beserra, F.C. & Leal-Bevilaqua, C.M. (2019). Antihelminthic effect of Cymbopogon citratus essential oil and its nanoemulsion on sheep gastrointestinal nematodos. Brazilian Journal of Veterinary Parasitology, 28(3), 522- 527.
Gioffrè, G., Ursino, D., Labate, M.L.C. & Giuffrè, A.M. (2020). The peel essential oil composition of bergamot fruit (Citrus bergamia, Risso) of Reggio Calabria (Italy): A review. Emirates Journal of Food & Agriculture, 32, 835-845.
Graña, E., Díaz-Tielas, C., Sánchez-Moreiras, A.M., Reigosa, M.J., Celeiro, M. & Abagyan, R. (2020). Transcriptome and binding data indicate that citral inhibits single strand DNA-binding proteins. Physiologia Plantarum, 169(1):99-109.
Gul, N. & Tak, H. (2016). Prevalence of Trichuris spp. in small ruminants slaughtered in Srinagar District (J&K). Journal of Parasitology Diseases, 40(3), 741-4.
Katiki, L.M., Chagas, A.C., Bizzo, H.R., Ferreira, J.F. & Amarante, A.F. (2011). Anthelmintic activity of Cymbopogon martinii, Cymbopogon schoenanthus and Mentha piperita essential oils evaluated in four different in vitro tests. Veterinary Parasitology, 183(1-2), 103-8.
Kumsa, B., Hagos, Y. (2020). Antihelmintic medicinal plants used for animals in Ethiopia: A review. The Journal of Phytopharmacology, 9(4), 274- 280.
Macedo I.T.F., Beserra, L.M., Ribeiro, W.L., Leite, J.M., Silva, K., De Araújo, J.V., Camurca-Vasconcelos, A.L.F. & Leal Bevilaqua, C.M. (2015). Anthelmintic activity of Cymbopogon citratus against Haemonchus contortus. Revista Brasileira de Parasitología Veterinária, 24(3), 268- 75.
Macedo, I.T., Bevilaqua, C.M., De Oliveira, L.M., Camurça-Vasconcelos, A.L., Vieira, L., Oliveira, F.R., Queiroz-Junior, E.M., Portela, B.G., Barros, R.S. & Chagas, A.C. (2009). Atividade ovicida e larvicida in vitro do óleo essencial de Eucalyptus globulus sobre Haemonchus contortus. Revista Brasileira de Parasitologia Veterinaria, 18(3), 62-6.
Macedo, I.T., de Oliveira, L.M., Camurça-Vasconcelos, A.L., Ribeiro, W.L., dos Santos, J.M., de Morais, S.M., Beserra de Paula, H.C. & Bevilaquia, C.M.L. (2013). In vitro effects of Coriandrum sativum, Tagetes minuta, Alpinia zerumbet and Lantana camara essential oils on Haemonchus contortus. Revista Brasileira de Parasitologia Veterinaria, 22(4), 463- 9.
Madi, Y.F., Choucry, M.A., Meselhy, M.R. & El-Kashoury, E.A. (2021). Essential oil of Cymbopogon citratus cultivated in Egypt: seasonal variation in chemical composition and anticholinesterase activity. Natural Products Research, 35(21), 4063-4067.
Malik, S., Silva de Mesquita, L.S., Rocha Silva, C., Carvalho de Mesquita, J.W., Rocha, de S., Bose, J., Abiri, R., Silva Figueiredo P.S. & Costa-Junior, L.M. (2019). Chemical Profile and Biological Activity of Esential Oil of Artemisia vulgaris L. Cultivated in Brazil. Pharmaceuticals, 12, 49.
Manconi, M., Petretto, G., D'hallewin, G., Escribano, E., Milia, E., Pinna, R., Palmieri, A., Firoznezhad, M., Peris, J.E., Usach, I., Fadda, A.M., Caddeo, C. & Manca, M.L. (2018). Thymus essential oil extraction, characterization and incorporation in phospholipid vesicles for the antioxidant/antibacterial treatment of oral cavity diseases. Colloids Surf & Biointerfaces, 171, 115-122.
Mavrot, F., Hertzberg, H. & Torgerson, P. (2015). Effect of gatro-intestinal nematode infection on sheep performance: a systematic review and meta-analysis. Parasites & Vectors, 8, 557.
Molento, M.B., Fortes, F.S., Pondelek, D.A., Borges, F.A., Chagas, A.C. & Torres-Acosta, J.F. (2011). Challenges of nematode control in ruminants: Focus on Latin America. Veterinary Parasitology, 180(1-2), 126-132.
Mukarram, M., Choudhary, R., Khan, M.A., Poltronieri, P., Khan, M.M.A., Kurjak, D. & Shahid, M. (2022). Lemongrass Essential Oil Components with Antimicrobial and Anti-Cancer Activities. Antioxidants, 11, 20.
Oladeji, O.S., Oluyori, A.P., Bankole, T.P. & Afolabi, T.Y. (2020). Natural Products as Sources of Antimalarial Drugs: Ethnobotanical and Ethnopharmacological Study. Scientifica, Article ID 7076139.
Oliveira, G.L., Vieira, T.M., Nunes, V.F., de Oliveria, M.R., Duarte, E.R., de Lima Moreira, D.M., Coelho Kaplan, M.M. & Martins, E.R. (2014). Chemical composition and efficacy in the egg-hatching inhibition of essential oil of Piper aduncum against Haemonchus contortus from sheep. Revista Brasileira de Farmacognosia, 24, 288-292.
Oliveira, M.A.C., Borges, A.C., Brighenti, F.L., Salvador, M.J., Gontijo, A.V.L. & Koga-Ito, C.Y. (2017). Cymbopogon citratus essential oil: effect on polymicrobial caries-related biofilm with low cytotoxicity. Brazilian Oral Research, 31, 89.
Oliveros, R. & Cutillas, C. (2003). Redescripción de Trichuris ovis (Nematoda) (Abildgaard, 1795) parásito de Ovis aries (Linné, 1758) y Capra hircus (Linné, 1758). Revista Ibérica de Parasitología, 63(3-4), 77-80.
Pérez-Cordero, A., Chamorro-Anaya, L., Vitola-Romero, D. & HernándezGomez, J. (2017). Actividad Antifúngica de Cymbopogon citratus contra Colletothrichum gloesporoides. Agronomia Mesoamericana, 28(2), 465-475.
Piasecki, B., Biernasiuk, A., Skiba, A., Skalicka-Wosniak, K. & Ludwiczuk, A. (2021). Composition, Anti-MRSA Activity and Toxicity of Essential Oil of Cymbopogon Species. Molecules, 26, 7542.
Pinto, Z.T., Sánchez, F.F., dos Santos, A.R., Amaral, A.C., Ferreira, J.L., Escalona-Arranz, J.C. & Queiroz, M.M. (2015). Chemical composition and insecticidal activity of Cymbopogon citratus essential oil from Cuba and Brazil against housefly. Revista Brasileira de Parasitología Veterinária, 24(1), 36-44.
Ploeger, H.W. & Everts, R.R. (2018). Alarming levels of anthelmintic resistance against gastrointestinal nematodes in sheep in the Netherlands. Veterinary Parasitology, 262, 11-15.
Puicón, V., Chávez, J., Gutiérrez, G., Sánchez, D., More, M. & Zárate, D. (2018). Prevalencia de nematodos gastrointestinales en alpacas y ovinos de dos cooperativas comunales de la Región Pasco, Perú. Rev Inv Vet Peru, 29(4), 1440-1448.
Qi, H., Wang, W.X., Dai, J, L. & Zhu, L. (2015). In vitro anthelmintic acivity of Zanthoxylum simulans essential oil against Haemonchus contortus. Veterinary Parasitology, 211, 223-227.
Sales de Lima, A.B., Nunes Queiroga, I.M.B., de Sousa Silva, G.M., Silva da Costa, J., de Sousa Guedes, J.P., Dantas, C, V. & Cavalcanti, M.T. (2019). Characterization and application of Lipia alba (Mill) and Cymbopogon citratus D.C. Stapf essential oils as natural sanitizers in coriandrum. Food Sci. Technol., Campinas, 39(4), 993-998.
Sánchez Hinostrosa, E.M. (2020). Uso tradicional de plantas medicinales en el distrito de Santiago-Ica. [Tesis para título. Universidad Nacional San Luis Gonzaga. Ica. Perú].
Sarmiento, L., Tantaleán, M. & Huiza, A. (1999). Nematodos parásitos del hombre y de los animales en el Perú. Rev. Peruana Parasit., 14(1-2), 9-65.
Sawadogo, I., Paré, A., Kaboré, D., Montet, D., Durand, N., Bouajila, J., Zida, E.P., Sawadogo-Lingani, H., Nikiéma, P.A., Nebié, R.H.C. & Bassolé, I.H.N. (2022). Antifungal and Antiaflatoxinogenic Effects of Cymbopogon citrates, Cymbopogon nardus and Cymbopogon schoenanthus Essential Oil Alone and in Combination. J. Fungi, 8, 117.
Serra, P.V., Santos, P.S., Pereira, I.T., Santos, I., dos Santos Farias, W.K., Dos Santos, L., Fonseca, D., Neto, A.P. & Everton G.O. (2021). Chemical constituents, lavicidal activity and mollusquicidal from fresh leaves of Alpinia zerumbet (Pers.) and Cymbopogon citrates (DC.) Stapf. Rev. Colomb. Ciencia Química Farmacéutica. 50(2), 571-589.
Sheikh, B.Y., Sarker, M.M., Kamarudin, M.N., & Mohan, G. (2017). Antiproliferative and apoptosis inducing effects of citral via p53 and ROS-induced mitochondrial-mediated apoptosis in human colorectal HCT116 and HT29 cell lines. Biomedicine Pharmacotherapy, 96, 834- 46.
Sing, T. & Lal, S.S. (2011). A study on a in vitro culture of Trichuris ovis in different physiological solutions a constant temperature, 37°C. Journal of Parasitic Diseases, 35(1), 57-60.
Xia, H., Liang, W., Song, Q., Chen, X., Chen, X., Hong, J. (2013). The in vitro study of apoptosis in NB4 cell induced by citral. Cytotechnology, 65(1), 49-57.
Yevstafieva, V. A., Yuskiv, I. D., Melnychuk, V. V., Yasnolob, I. O., Kovalenko, V. A., & Horb, K. O. (2018). Nematodes of the genus Trichuris (Nematoda, Trichuridae) parasitizing sheep in central and southeastern regions of Ukraine. Vestnik Zoologii, 52(3), 553-556.