MACROBENTOS EN SUSTRATO ARTIFICIAL EN EL ESTUARIO DEL RIO CHIRA, PAITA - PIURA
MACROBENTHOS IN ARTIFICIAL SUBSTRATE IN THE ESTUARY OF THE CHIRA RIVER, PAITA - PIURA
Sady Santur Rivera 1 *; Ronald Wilmer Marcial Ramos 1
1 Escuela de Ciencias Biológicas, Universidad Nacional de Piura, Urb. Miraflores s/n, Castilla- Piura. Apartado Postal 295.
Artículo original
Recibido: 04 de marzo 2022
Aceptado: 3 de junio 2022
Resumen
Se determinaron las especies de macrobentos en el estuario del río Chira entre octubre 2018 y mayo 2019. Se instalaron 8 losetas de cerámica de 36 x 36 cm de color ladrillo cada 5 metros, en las zonas de baja profundidad del estuario, las mismas que fueron aseguradas con cuatro estacas de madera, se dejaron sumergidas a una profundidad de 20 cm en marea baja durante todo el periodo de investigación y se retiró una mensualmente. Se determinaron 10 especies de macrobentos, distribuidos entre los Phylum Athropoda y Annelida, siendo el género Balanus el predominante y el que tuvo la mayor abundancia relativa de las especies encontradas. La variación de la salinidad se debió a las precipitaciones estacionales, que es la principal causa de los cambios observados en la comunidad macrobentónica.
Palabras clave: Annelida, Crustácea, gradiente de salinidad, sésil.
Abstract
Macrobenthos species were determined in the Chira river estuary between October 2018 and May 2019. Eight ceramic tiles of 36 x 36 cm of brick color every 5 meters were installed in the shallow areas of the estuary, the same ones that were secured with four wooden stakes, they were submerged to a depth of 20 cm at low tide during the entire research period and one was removed monthly. Ten species of macrobenthos were determined, distributed between the Phylum Athropoda and Annelida, being the genus Balanus the predominant, likewise it was the one that had the highest relative abundance of the found species. The variation in salinity was due to seasonal rainfall, which is the main reason of observed changes in the macrobenthic community.
Keywords: Annelida, Crustacean, salinity gradient, sessile.
* Autor para correspondencia: E. mail: sadysantur08@gmail.com
Citar como:
Santur, S., & Marcial-Ramos, R. 2022.Macrobentos en sustrato artificial en el estuario del rio Chira, Paita – Piura. REBIOL, 42(1): 11-19.
1. Introducción
La fauna bentónica se ve marcada por las diferentes categorías de zoobentos que la componen; dentro de la macrofauna bentónica existen tres grupos representativos debido a sus elevadas densidades: moluscos, crustáceos y poliquetos (McLachlan & Brown, 2006 en Luque, 2016). Los organismos de la macrofauna bentónica se cuantifican para indicar el estado en que se encuentran los ambientes marinos, debido a que en su mayoría son sedentarios, poseen ciclos vitales largos y son tolerantes a diferentes condiciones ambientales, principalmente a los cambios climáticos, por lo que pueden ser consideradas como indicadoras de zonas intervenidas o contaminadas por materia orgánica o por su posición con relación al sustrato existente, en especial el grupo de los poliquetos (Tena et al., 1993 en Luque, 2016).
La macrofauna intermareal que habita las playas utiliza diferentes estrategias para protegerse de la desecación y depredación durante los periodos de bajamar, tales como migración siguiendo la marea, enterramiento en el sustrato, protección con exoesqueletos, mecanismos de orientación y plasticidad comportamental. Estas estrategias varían según las capacidades de las especies habitantes de la playa, las cuales no siempre son las mismas debido a los procesos de adaptación y evolución, lo que da como resultado especies de playa que no se encuentran en otros ambientes y una estructura comunitaria única para cada playa (McLachlan & Brown, 2006 en Romero, 2014).
Los fondos sedimentarios son el sustrato predominante sobre la plataforma continental, donde la infauna y epifauna asociadas se caracterizan por presentar adaptaciones morfológicas y fisiológicas que les permiten asentarse en ellos. Dada la relación existente entre los organismos y el sustrato, se debe analizar la distribución de los tipos de sedimento, su contenido de materia orgánica y carbonato de calcio y las condiciones oceanográficas, con el propósito de determinar su influencia sobre los patrones de distribución de las asociaciones de organismos (Wiens et al., 1986 en Ruiz, 2001).
Las comunidades bentónicas de la plataforma continental se caracterizan por ser fuertemente reguladas por la disponibilidad de oxígeno disuelto sobre el fondo, cuyo régimen obedece en gran medida a la dinámica de la extensión sur de la Corriente de Cromwell en la zona centro norte. Resultados del programa de monitoreo de estaciones fijas costeras frente a Paita y San José revelan que la variabilidad de la concentración de oxígeno en la capa subsuperficial presenta un componente estacional, además de la componente extra-estacional asociada a la propagación de ondas Kelvin a lo largo de la costa (Gutiérrez et al., 2011).
Los organismos asociados a los fondos marinos se definen como bentos. El bentos está constituido por todas aquellas especies que viven en relación íntima con el fondo, ya sea para fijarse, excavarlo, marchar sobre su superficie o nadar en sus vecindades sin alejarse de él. El bentos, como gran comunidad ecológica se extiende en el mar desde la zona litoral hasta las grandes profundidades y está representado por casi todos los Phyla del reino animal, los cuales muestran una amplia diversidad en tamaños, formas de vida, alimentación y comportamiento. La mayoría de los organismos bénticos poseen movilidad escasa, debido a esto, responden rápidamente a las perturbaciones (Guzmán et al., 2001 en Guarneros, 2014).
El sistema bentónico presenta multitud de biotopos, a cada uno de los cuales se adaptan los seres que en ellos viven tanto por su morfología y coloración, como por sus hábitos y biología (Abanto, 1992).
El bentos constituye un eslabón importante al interior de la red trófica de los ecosistemas acuáticos. Su papel funcional reside en la transferencia de energía entre los productores primarios y los consumidores terciarios. Debido a sus hábitos alimenticios (por ejemplo, predadores o carroñeros) y a su poca o nula movilidad (sésiles), algunos componentes del bentos, por ejemplo, poliquetos, son empleados como especies indicadoras de cambios ambientales. Otros organismos, como holotúridos (pepino de mar), decápodos (langosta, jaiba o camarón) o gasterópodos (caracol rosado) presentan un interés comercial (Pech & Ardisson, 2009).
El objetivo fue determinar las especies de macrobentos en sustrato artificial en el estuario del río Chira. Distrito de Vichayal, Paita - Piura.
2. Materiales y Métodos
Área de Estudio
El estudio se realizó en el estuario del río Chira, distrito de Vichayal, Paita - Piura. Ubicado en la región noroeste del Perú, entre los paralelos 4° 87’ 84” S y 81° 16’ 00” W (figura 1).
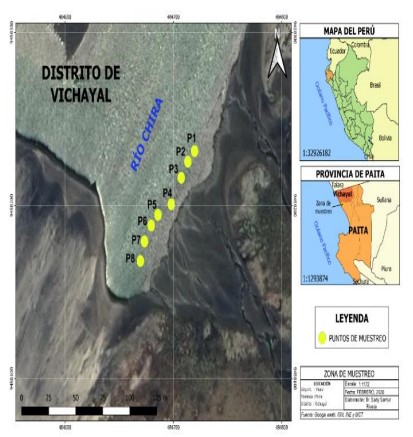
Figura 1. Ubicación de zona de estudio y puntos de muestreo en el estuario del río Chira.
Se realizó un muestreo mensual entre octubre del 2018 y mayo del 2019. Las muestras fueron obtenidas en la zona intermareal del estuario del río Chira, teniendo en cuenta los periodos de mareas “Pleamar” (mareas altas) y “Bajamar” (mareas bajas), Las fechas y horas de la toma de muestra fueron en base a la tabla de mareas del IMARPE de cada mes (IMARPE, 2018), (IMARPE, 2019).
I) Las muestras de macrobentos se obtuvieron de acuerdo a la capacidad de fijación de los organismos, utilizando el sustrato artificial, el cual consistió en sumergir las piezas de cerámica de 36 x 36 cm, en 8 puntos específicos del estuario del río Chira. Las mismas que fueron aseguradas por cuatro estacas de madera, se instalaron en total 8 piezas de cerámica, espaciadas cada 5 metros.
II) Se registró temperatura y salinidad del agua, para ello se utilizó un termómetro digital LCD con sensibilidad 0,1 °C, y un refractómetro óptico KOMPASS de sensibilidad 1%o.
III) Se recogió mensualmente una cerámica, la cual fue puesta en una bolsa de plástico transparente (de 70 x 90 x 3 micras), se agregó agua potable con formalina al 10% para su conservación, y posterior traslado al laboratorio de Zoología de Invertebrados de la Escuela Profesional de Ciencias Biológicas de la Universidad Nacional de Piura.
IV) En el laboratorio el macrobentos encontrado fue retirado de las losetas utilizando un pincel y espátula, puestos en frascos de plástico con tapa hermética, previamente rotulados y abastecidos con formalina al 10%.
V) Las especies obtenidas fueron analizadas, para ello se utilizó un estereoscopio (Labomed), lupa de mano (marca Galileo), un estuche de disección para manipular los organismos, placas Petri, estiletes y gotero.
Se determinaron las especies usando claves taxonómicas y bibliografía especializada: “Clave Dicotómica para la Identificación de Macroinvertebrados de la Cuenca del Ebro” (Oscoz et al., 2011). “Guía para la Identificación de Invertebrados Acuáticos” (Palma, 2013). “Guía para el estudio de macroinvertebrados II. Introducción a la metodología de muestreo y análisis de datos” (Maroñas et al., 2010). “Zoología de los Invertebrados. 6ta Edición” (Rupper & Barnes, 1996). “Poliquetos Bentónicos del Golfo de Guayaquil (Villamar, 1983). “Identificación de Familias de Poliquetos en las zonas circundantes al área de protección especial de Punta de Manabique” (Flamenco, 2014).
3. Resultados
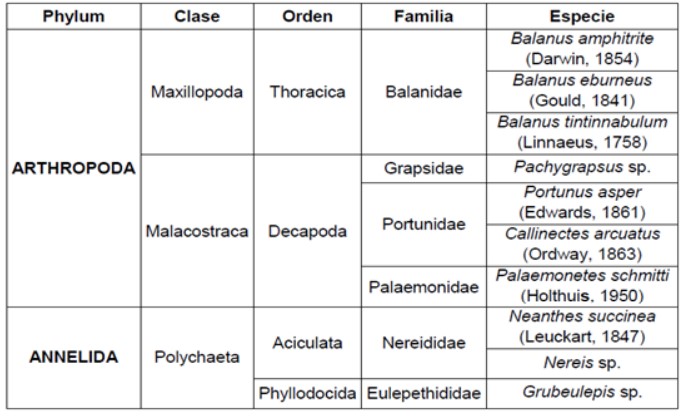
Tabla 1. Especies bentónicas de los Phyllum Arthropoda y Annelida determinadas en el estuario del río Chira, de octubre 2018 a mayo 2019.
De las especies obtenidas del sustrato artificial, el Phylum Arthropoda, fue el más abundante con 54 individuos (84%); el Phylum Annelida presento 10 individuos (16 %) (Figura 2).
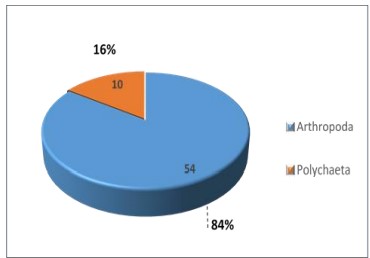
Figura 2. Distribución porcentual de especies de macrobentos según Phyllum presentes en el sustrato artificial, instalado en el estuario del río Chira de octubre 2018 a mayo 2019.
En abundancia relativa las especies de la familia Balanidae: Balanus amphitrite y Balanus eburneus, fueron las más abundantes con 29,6% y 23%, respectivamente. Mientras que: Nereis sp. de la Clase Polychaeta tuvo una abundancia relativa de 3,1%; la familia Palaemonidae, correspondiente a la clase artrópoda con 1,5% presento la menor abundancia relativa (Figura 3).
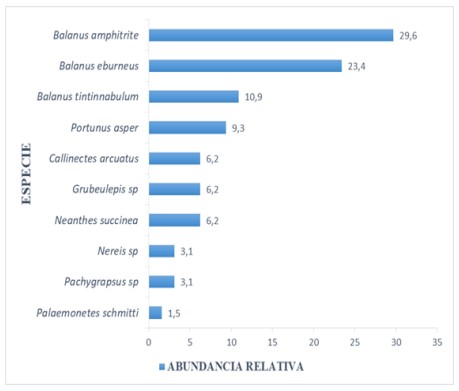
Figura 3. Abundancia Relativa (%) por especie del macrobentos presente en el sustrato artificial, en el estuario del río Chira de octubre 2018 a mayo 2019.
Densidad: Las especies con mayor densidad fueron Balanus amphitrite y Balanus eburneus, con 19 y 15 ind/m2 respectivamente, mientras que en Balanus tintinnabulum fue de 7 ind/m2; Portunus asper 6 ind/m2, Callinectes arcuatus, Grubeulepis sp. y Neanthes succinea con 4 ind/m2; Nereis sp. y Pachygrapsus sp. con 2 ind/m2; además Palaemonetes schmitti con 1 ind/ m2 (figura 4).
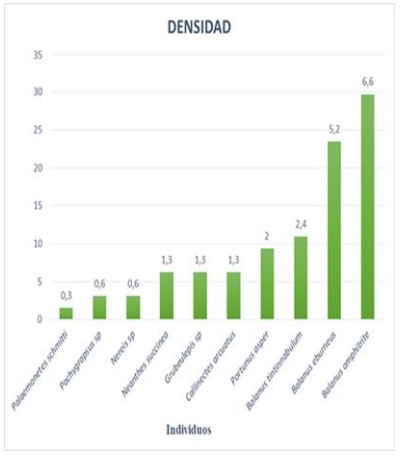
Figura 4. Densidad (ind/m2), por especie del macrobentos en el estuario del río Chira de octubre 2018 a mayo 2019.
En cuanto a los factores abióticos, se observó que la temperatura presentó valores de 20,5°C en noviembre del 2018 y de 29,1°C mayo del 2019; con respecto a salinidad se registró valores máximos en octubre de 20‰ y mínimos en mayo de 3‰. La salinidad y temperatura del estuario presentaron una correlación inversamente proporcional (r= -0,929) (figura 5).
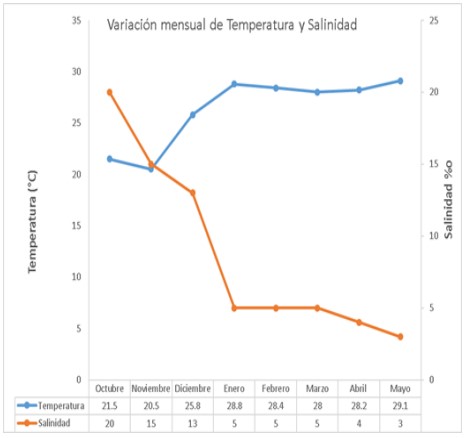
Figura 5. Variación mensual de temperatura y salinidad de octubre 2018 a mayo 2019, en el estuario del río Chira.
4. Discusión
El macrobentos de las playas de sustrato blando está constituido principalmente por artrópodos (crustáceos), moluscos (bivalvos) y poliquetos, aunque también se encuentran, con menor frecuencia, equinodermos, sipuncúlidos y otros grupos. La biota que se desarrolla en estos ambientes presenta adaptaciones y características especiales relacionadas con la gran variabilidad de las condiciones físicas (Luque, 2016).
El Phylum Arthropoda fue el más representativo de la comunidad macrobentónica determinada en el estuario del río Chira, que se caracteriza por poseer un fondo fango arenoso.
De acuerdo a los resultados obtenidos los organismos que predominaron fueron los crustáceos específicamente del género Balanus, siendo constante en todos los muestreos.
Lancellotti & Vásquez (2000) registran 1601 especies de macroinvertebrados bentónicos conformado por Mollusca (611), Anthozoa (31), Polychaeta (403), Crustacea (370), Echinodermata (70), Ascidiacea (40) y Demospongiae (76), corresponden a los grupos mejor representados a lo largo de la costa chilena.
En el estuario del río Chira se registraron 10 especies de macrobentos, pertenecientes al phylum Arthropoda (07) y Annelida (3), en general la riqueza específica de la comunidad macrobentónica fue baja. Según Barnes (1989) en un estuario la riqueza de especies disminuye al pasar de la zona con mayor salinidad hacia las zonas de menor salinidad.
De acuerdo a Barnes (1989), las especies que habitan los estuarios son en su inmensa mayoría especies marinas con escasa capacidad de competencia interespecífica, pero muy tolerantes, lo que les permite aprovechar hábitats marginales al marino, como es el caso de la zona de aguas salobres de los estuarios. El carácter fluctuante del ambiente de estuario, causante de que la fauna que lo habita esté sometida a bruscos cambios ambientales, es considerado como una de las principales razones de su bajo número de especies en comparación con las áreas marinas limítrofes: sólo las especies eurihalinas son capaces de sobrevivir en el mismo (Junoy, 1996).
La familia Balanidae mostró una constante predominancia, encontrándose adheridos en todas las muestras obtenidas, dentro de la familia Balanidae la especie más común fue Balanus amphytrite; mientras que especies de la clase polychaeta estuvieron presentes solo en tres muestras.
Los cirrípedos que aparecieron como dominantes en el estuario del río Chira fueron Balanus amphytrite, Balanus eburneus y Balanus tintinnabulum; estas especies estuvieron presentes en todas las losetas instaladas, Calcagno (1995) encontró a lo largo de la costa de la provincia de Buenos Aires a Balanus amphitríte, Balanus glandula, Balanus improvisus, Balanus trigonus, y Balanus venustus niveus
Así mismo Darwin (1854) cito a Balanus amphitrite como un componente común de la fauna fijada al casco de los buques y en objetos flotantes, y junto con Balanus trigonus presentan una tendencia a poblar con preferencia la zona intermareal en áreas portuarias y contaminadas en general (Spivak y L’Hoste, 1976 en Calcagno 1995).
Dentro del grupo de los crustáceos también se encontró Portunus asper, Pachygrapsus sp. y Callinectes arcuatus; Además, se registró la especie Palaemonetes schmitti un tipo de camarón perteneciente a la familia Palaemonidae; coincidiendo con Fischer et al. (1995) quien describe a Palaemonetes schmitti como una especie que habita en los estuarios, en zonas fango arenosa.
El segundo grupo en importancia para el estuario fue el phylum Annelida, del cual se determinó dos especies de la familia Nereididae como Neanthes succinea, Nereis sp. y la especie Grubeulepis sp. perteneciente a la familia Eulepethidae.
Bocanegra et al. (1986) reporta 12 especies para las playas arenosas de Trujillo, encontrando que la especie predominante fue Nepthys ulticerrata para Salaverry y Las Delicias (Paredes, 2017). Villamar (1983) registro en el golfo de Guayaquiil, 37 especies entre ellas Neanthes succinea y Grubeulepis guayanensis como nuevo y único registro para la zona. La familia Eulepethidae, según Pettibone (1969), se localizan en aguas tropicales y subtropicales desde áreas intermareales hasta profundidades moderadas.
En Perú la especie Grubeulepis sp. ha sido reportada en bahía Samanco en Chimbote por IMARPE (2009), Así mismo Paredes (2017) reporto para Junco Marino en Trujillo la especie Grubeulepis sp. como nuevo y único registro para la zona, de igual forma Carrillo (2018) registro esta especie para punta Chérrepe.
Grubeulepis sp. también se reporta para el estuario del río Chira, es posible que esta especie sea tolerante a niveles bajos de salinidad y al sedimento fango arenoso con presencia de materia orgánica.
5. Conclusiones
Se determinaron 10 especies de macrobentos distribuidos en 2 Phyllum, 3 Clases, 4 Órdenes y 6 Familias, siendo el Phylum Arthropoda el más abundante con la especie Balanus amphytrite. Las especies del género Balanus, estuvieron presentes en todos los sustratos instalados en el estuario, mientras que las especies de poliquetos estuvieron solo en tres muestreos. La variación de la salinidad se debió a las precipitaciones estacionales, lo que parece ser la principal causa de los cambios observados en la comunidad macrobentónica. La temperatura y la salinidad del estuario presentaron una correlación inversamente proporcional (r = -0,929).
6. Agradecimientos
Agradecemos al Laboratorio de Zoología de Invertebrados de la Escuela Profesional de Ciencias Biológicas de la Universidad Nacional de Piura por habernos dado las facilidades para utilizar materiales y equipos para realizar este trabajo.
7. Contribución de los autores
S.S. (1) la concepción y el diseño de estudio, registro de datos, elaboración de los mapas, redacción del borrador del artículo y la revisión crítica del contenido y la aprobación final.
R.M. (2) la concepción y el diseño de estudio, redacción del borrador del artículo y la revisión crítica del contenido y la aprobación final
8. Conflicto de intereses
Los autores declaran que no existe conflicto de interés.
9. Referencias Bibliográficas
Abanto, N. (1992). Composición, densidad y distribución del macrozoobentos en relación a la granulometría y contenido de materia orgánica del sedimento de la marisma de Cerro Guañape-La Libertad de octubre 1991 a marzo 1992. [Tesis para bachiller, Universidad Nacional de Trujillo. Perú].
Bastida, J. (2003). El Mar y Los Poliquetos. Colegio de la Frontera Sur, Unidad Chetumal.
Barnes, R. (1989). The coastal lagoons of Britain: An overview and conservation appraisal. Biol. Conserv. 49: 295-313.
Bocanegra, C., Oliva, J. y Carbajal, W. (1986). Estructura de la comunidad de macroinvertebrado bentónico en las playas arenosas de Trujillo. En: A. Tresierra (ed). Anales I congreso Nacional de Biología Pesquera. Trujillo, Perú.
Cáceres, S. (2016). Biodiversidad estacional de macrobentos mesolitoral de fondos blandos en la playa de Salaverry, La Libertad- Perú. [Tesis para título, Universidad Nacional de Trujillo].
Calcagno, J. (1995). Dinámica poblacional del cirripedio Balanus amphitrite Darwin en un área afectada por contaminación cloacal. [Tesis para doctor, Universidad de Buenos Aires].
Carrasco, F. (2004). Organismos del bentos marino sublitoral: algunos aspectos sobre abundancia y distribución. Biología Marina y Oceanografía: Conceptos y Procesos, 1(15): 315- 348.
Carrillo, D. (2018). Diversidad Bentónica en la Playa el brujo y Chérrepe, La Libertad de Julio a diciembre del 2017. [Tesis para Título, Universidad Nacional de Trujillo].
Darwin, C. (1854). A monograph of the sub-class Cirripedia. Ray Society, London 684 pp.
Flamenco, M. (2014). Identificación de Familias de Poliquetos en las zonas circundantes al área de protección especial de Punta de Manabique (APEPM) en la costa del mar caribe de Guatemala. [Tesis de grado, Universidad Rafael Landívar].
FIscher, W., Krupp, F., Schneider, W., Sommer, C., Carpenter, K., & Niem, V. (1995). Guía FAO para la identificación de especies para los fines de la pesca. Pacífico centro-oriental. Volumen I. Organización de las Naciones Unidas para la Agricultura y la Alimentación.
Guarneros, P. (2014). Variabilidad de la riqueza biológica, densidad y biomasa en la macrofauna bentónica de la planicie abisal del Golfo de México. [Tesis para título, Universidad Nacional Autónoma de México].
Gutiérrez, D., Quipúzcoa L., Enríquez, E., & Marquina, R. (2011). El Macrobentos y las Condiciones Ambientales en otoño 2003: ¿Hay Evidencias de Variación Interanual Significativa Desde el 2000? Laboratorio de Bentos Marino. Dirección de Investigaciones en Hidrografía. IMARPE. Vol. 38.
IMARPE. (2009). Estudio de línea base en el ámbito marino de bahía de Samanco 13-24 diciembre 2008.
IMARPE. (2018). Tabla de mareas. Dirección de Hidrografía y Navegación de la Marina. Biblioteca Imarpe.
IMARPE. (2019). Tabla de mareas. Dirección de Hidrografía y Navegación de la Marina. Biblioteca Imarpe.
IMARPE. (2019). Guía Ilustrada Para Reconocimiento de Especies de Cangrejos Braquiuros y Anomuros con Valor Comercial del Perú. Programa Presupuestal “Fortalecimiento de la Pesca Artesanal” del Ministerio de la Producción (PRODUCE). Callao, Perú.
Junoy, J. (1996). La Ría de Foz, comunidades bentónicas. Servicio de Publicaciones de la Diputación de Lugo. Lugo, España:
Lancellotti, D. & Vasquez. J. 2000. Zoogeografía de macroinvertebrados bentónicos de la costa de Chile: contribución para la conservación marina. Revista Chilena de Historia Natural. Universidad Católica de casilla. SantiagoChile.
Luque, C. (2016). Macrofauna bentónica del Intermareal arenoso de las playas próximas al estuario del Rio Tambo, Islay - Arequipa (octubre 2014 - junio 2015). [Tesis para Título, Universidad Nacional de San Agustín de Arequipa].
Maroñas, M., G. Marzoratti, A., Vilches., Legarralde, T., & Darrigran, G. (2010). Guía para el estudio de macroinvertebrados II. Introducción a la metodología de muestreo y análisis de datos. Facultad de Ciencias Naturales y Museo (FCNyM), Universidad Nacional de La Plata (UNLP).
Oscoz, J., Galicia, D., & Miranda, R. (2011). Clave Dicotómica para la Identificación de Macroinvertebrados de la Cuenca del Ebro. Universidad de Navarra. Zaragoza.
Palma, A. (2013). Guía para la Identificación de Invertebrados Acuáticos. 1era Edición.
Paredes, K. (2017). Biodiversidad de Macrobentos en las zonas de Cerro Negro y Junco Marino, La Libertad. [Tesis para Título. Universidad Nacional de Trujillo].
Pech, D. & Ardisson, P. (2009). Comunidades Acuáticas, Diversidad en el bentos marino-costero. Biodiversidad y desarrollo humano en Yucatán. Ecosistemas y Comunidades.
Pettibone, M. (1969). Revision of the Aphroditoid Polychates of the Family Eulepethidae Chamberling (Eulepidinae Darboux;=Pareulepidae Hartman). Smithsonian Research Online.
Rocha, C. (2009). Zonación vertical del macrobentos de sustratos sólidos del estuario del río Massangana, Bahía de Suape, Pernambuco, Brasil. Biota Neotrop., vol. 9.
Romero, A. (2014). Caracterización ecológica del macrobentos de la zona intermareal de dos playas arenosas en la bahía de la paz, Baja California Sur, México. [Tesis para Título, Universidad Autonoma de Baja California Sur].
Ruiz, J. (2001). Caracterización de la Macroinfauna Bentónica Asociada a Fondos Blandos del PNN Gorgona (Pacifico colombiano) y su Variación Espacio Temporal entre enero y junio de 1999. Tesis para optar al título de Biólogo Marino. Santa Fe de Bogotá- Colombia.
Rupper, E. & Barnes, R. (1996). Zoología de los Invertebrados. 6ta Edición. Mc GRAW - Hill Interamericana Editores, S.A. de C.V. México.
Tarazona, J., Paredes, C. & Agreda, M. (1986). Estructura del macrobentos en las playas arenosas de la zona de lima, Perú. Revista de Ciencias U.N.M.S.M. 74(1): 103-116.
Tena, J., Capaccione, R., Torres, F. & Porras, R. (1993). Anélidos poliquetos del antepuerto de Valencia: distribución y Categorías tróficas. Publ. Espec. Inst. Esp. Oceanogr. Valencia. España.
Vegas, M. (1971). Introducción a la Ecología del Bentos Marino. Departamento de Pesquería. Universidad Nacional Agraria La Molina, Perú.
Villamar, F. (1983). Poliquetos Bentónicos del Golfo de Guayaquil. Acta Oceanográfica del Pacifico, 2(2): 659-733.
ANEXOS


Figura 1. (A) Vista dorsal de Balanus amphitrite; (B) Vista dorsal de Balanus eburneus

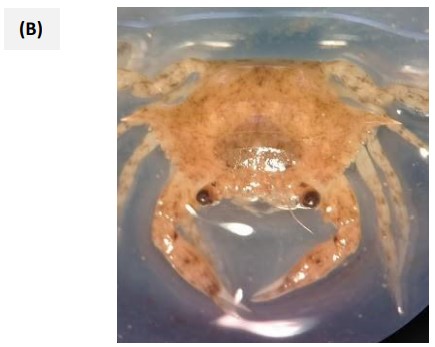
Figura 2. (A) Vista dorsal de Balanus tintinnabulum; (B) Vista dorsal de Portunus asper


Figura 3. (A) Vista dorsal de Callinectes arcuatus; (B) Vista dorsal de Pachygrapsus sp.


Figura 4. (A) Vista dorsal de Neanthes succinea; (B) Vista dorsal de Grubeulepis sp.

Figura 5. (A) Rostro de Palaemonetes schmitti