PLOMO, MERCURIO Y COBRE EN HÍGADO Y MÚSCULO DE Orestias ispi Y Orestias agassii DEL LAGO TITICACA (PERÚ) 2018
LEAD, MERCURY AND COPPER IN LIVER AND MUSCLE OF Orestias ispi AND Orestias agassii OF LAKE TITICACA (PERU) 2018
Yvette Arbulu-Vercauteren 1 *; Guadalupe Sánchez 1
1 Facultad de Biología Marina/Ingeniería Acuícola, Universidad Científica del Sur, Km.19 Panamericana Sur, Lima.
Yvette Arbulu-Vercauteren:
Artículo original
Recibido: 03 de enero 2022
Aceptado: 25 de marzo 2022
Resumen
La contaminación por relaves mineros está presente en el lago Titicaca, esto ocasiona daños y degradación de los recursos hidrobiológicos, como las especies de peces nativos Orestias ispi y Orestias agassii, que habitan en este ecosistema léntico, y que son de consumo humano directo de la población de Puno, Perú. Estos organismos se consideran buenos bioindicadores de la contaminación por metales pesados, aunque están presentes en varios niveles tróficos y tienen el potencial de bioacumular y biomagnificar metales. El objetivo de este estudio fue determinar la presencia y concentración de plomo (Pb), mercurio (Hg) y cobre (Cu) en el agua, hígado y músculo de O. ispi y O. agassii del lago Titicaca, Puno-Perú; estos elementos se determinaron mediante el método de espectrometría de masas de plasma acoplado inductivo (ICP-MS). El área de estudio se ubicó al norte del lago Mayor (Chucuito) del lago Titicaca con tres estaciones, donde se tomaron las muestras de agua y se capturaron ejemplares de O. ispi y O. agassii, de estos peces se extrajeron el hígado y el músculo. Los resultados analíticos mostraron los valores de Cu para ambas especies, encontrándose diferencias significativas entre las dos, aunque, no excedieron el límite permisible (LP). Los análisis de Pb y Hg estuvieron por debajo del límite de detección del equipo de 0,02 mg/kg y 0,01 mg/kg, respectivamente.
Palabras clave: bioacumulación, contaminación, ecosistema léntico, metales pesados, peces.
Abstract
Pollution due to mining tailings are present in Titicaca Lake, this causes damage and degradation of water resources, as nati ve fishes like Orestias ispi and Orestias agassii, that inhabit in this lentic ecosystem and are of direct human consumption of the population of Puno, Peru. These organisms are considered, as good bioindicators of heavy metal pollution although they are present in several trophic levels and having the potential of bioaccumulate and biomagnify metals. The objective of this research was to determinate the presence and concentration of lead (Pb), mercury (Hg) and copper (Cu) in liver and muscle of O. ispi and O. agassii of Titicaca Lake, Puno-Peru; these elements were determined by Inductive coupled plasma mass spectrometry method (ICP- MS). The study area was in the northern part of Mayor Lake (Chucuito) of Titicaca Lake with three sampled stations, where water samples and samples of O. ispi and O. agassii were taken, the liver and muscle of these species were extracted. Analytical results showed the values of Cu for both species, finding significant differences between the two, although, these values did not exceed the permissible limit (L P) of FAO. Analysis of Pb and Hg were below the equipment detection limit of 0.02 mg/kg and 0.01 mg/kg, respectively.
Keywords: bioaccumulation, pollution, lentic ecosystem, heavy metals, fishes.
* Autor para correspondencia: E. mail: yvette_nicole_95@hotmail.com
Citar como:
Arbulu-Vercauteren, Y., & Sánchez, G. 2022. Plomo, mercurio y cobre en hígado y músculo de Orestias ispi y Orestias agassii del lago Titicaca (Perú) 2018. REBIOL, 42(1): 3-10.
1. Introducción
El lago Titicaca, generalmente tiene una temperatura promedio de 14,74 ºC; un pH de 8,38 y un oxígeno disuelto de 6,32 mg/L (Hallasi, 2018). Presenta diversos problemas ambientales tales como: la eutrofización, debido principalmente a los vertimientos orgánicos provenientes de los desechos domésticos, que incrementa la presencia de nutrientes como fosfatos y nitratos, causando floraciones de macrófitas entre estas la “lenteja de agua” Lemna gibba (Linaeus 1753) (Aguirre & Vento, 2015); produciéndose una depleción de oxígeno.
Asimismo, existen otras amenazas como el uso de agentes contaminantes como los plaguicidas y fertilizantes utilizados en la agricultura, que, al discurrir por los afluentes que descargan finalmente al lago (Monroy et al., 2014); así como, la presencia de los contaminantes químicos inorgánicos procedentes de los relaves mineros (Aguirre et al., 2009).
La pesca artesanal en el lago Titicaca, es de gran importancia económica y social (Chura-Cruz & Mollocondo, 2016), basado en peces nativos, donde destaca las especies como “ispi” Orestias ispi (Lauzanne, 1991) y el “carachi gris” Orestias agassii (Valenciennes, 1846), destinados al consumo humano directo (Treviño et al., 1991). O. agassii, está considerada en la categoría vulnerable (VU), especialmente impactada por diferentes fuentes de contaminación antrópica, pero principalmente por la actividad minera. Mientras que O. ispi, está catalogada de menor riesgo, considerándose como especie casi amenazada (NT) del Libro Rojo, sin embargo, no es menor el impacto que le proporciona la minería (Aguirre et al., 2009).
Es importante señalar, que los peces son considerados como buenos bioindicadores de contaminación por metales pesados; al estar presentes en varios niveles tróficos, tienen la capacidad de bioacumular y biomagnificar los metales pesados como Hg, Pb y Cu (Authman et al., 2015; Bosch et al., 2016); algunos muy tóxicos como el Hg y Pb, es por ello que el monitoreo de la calidad del ambiente acuático tiene mucha importancia, con la finalidad de conocer su presencia y niveles en el medio acuático (Alí et al., 2019). Estas características motivaron la selección de estas especies que viven en este cuerpo de agua, donde descargan los relaves del proceso de extracción del oro, como el río Ramis, que está ubicado en la zona norte del lago, los cuales llegan al área de la distribución de estas especies, causando un impacto negativo para la vida de los organismos acuáticos (Gammons et al., 2006).
El objetivo del presente estudio fue determinar la presencia y concentración de los metales pesados en trazas de Hg (Hg total), Pb y Cu en músculo e hígado de las especies O. ispi y O. agassii que son recursos de la pesca artesanal e importantes productos para la alimentación de la población del altiplano.
2. Materiales y Métodos
Área de Estudio
El estudio se realizó en la zona noreste del lago Mayor (Chucuito) del lago Titicaca, a 3 812 msnm, es un cuerpo léntico compartido por Perú y Bolivia (Chui et al., 2021) (Figura 1).
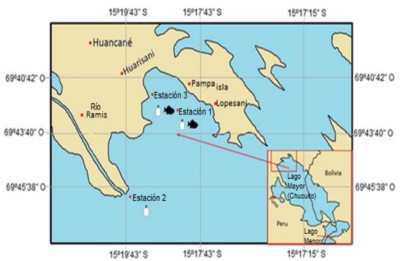
Figura 1. Zona de estudio en el lago Mayor (Chucuito) del lago Titicaca, con las tres estaciones de recolecta de agua y dos estaciones de captura de peces del género Orestias, en noviembre de 2018.
Trabajo de Campo
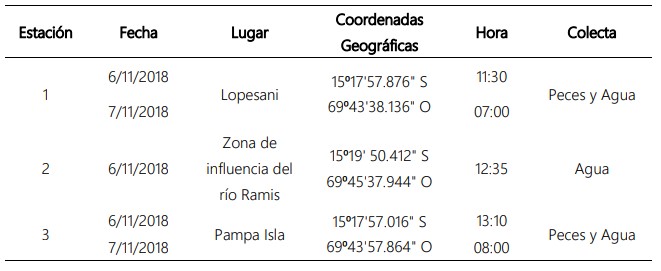
El estudio se realizó al final de la estación de estiaje, mes de noviembre del 2018. En las estaciones 1 y 3 se recolectaron ejemplares de los peces del género Orestias; el agua en las tres estaciones (Tabla 1), para determinar las variables fisicoquímicas y las concentraciones de los metales pesados: Pb, Hg y Cu. Los ejemplares de los peces fueron capturados con red de enmalle por pescadores artesanales y los ejemplares de ambas especies se colocaron en bolsas de plástico rotuladas con el número de la estación, fecha y hora.
Tabla 1. Estaciones de muestreo de parámetros físicoquímicos y colectas de muestras de agua y peces del género Orestias, en el lago Mayor (Chucuito) del lago Titicaca, en noviembre de 2018.
El muestreo de las variables fisicoquímicas del agua superficial del lago como temperatura (°C), oxígeno disuelto (mg/L), conductividad (μS/cm) y pH, se realizó mediante el uso de un Multiparámetro marca Toledo con 2 sensores: Sevengo Duo pH/ion/Do, pH, inlab expert GoIsm, O2 inlab optiox sensor, un conductímetro Hanna H198192 y un GPS Garmin etrex con previa calibración siguiendo el protocolo de la ISO (2016).
Trabajo en el Laboratorio
Las muestras de peces y agua se llevaron al laboratorio, como primer paso se realizó el análisis biométrico, registrando datos de longitud total (cm) y peso total (g). Se utilizó un número de 39 ejemplares de O. agassii para la determinación de metales pesados, los cuales procedieron de la estación 1 y 583 ejemplares de O. ispi de la estación 3.
Los análisis de metales pesados de Pb, Hg y Cu para el agua (mg/L) en tejido blando, músculo e hígado de los peces (mg/kg), siguió el Protocolo descrito por Greenfield et al. (1964) donde aplica el método analítico de Espectrometría de Masa con Plasma de Acoplamiento Inductivo (ICP-MS). En cuanto a la técnica analítica para agua, se usó la de ICP-MS ISO 17294-2 2016 (ISO, 2016) y para los tejidos blandos de peces el ICP-MS US EPA 6020 (US EPA, 2014).
Cabe señalar que, por requerimiento de la técnica analítica de metales pesados en tejidos blandos, el peso mínimo de muestra fue de 100 g, de tal manera que para O. agassii, se analizó 5 muestras utilizando 8 ejemplares en cada análisis. En el caso de O. ispi se analizó 9 muestras, utilizando 583 individuos, alcanzando el peso exigido.
Análisis estadístico
Se aplicó el programa R studios y la prueba U de MannWhitney con la finalidad de establecer las diferencias significativas, entre los resultados de Cu obtenido de ambas especies sobre la bioacumulación de este elemento.
3. Resultados
Durante el muestreo se registraron variables fisicoquímicas bastante estables que se presentan en la Tabla 2. Sin embargo, se puede destacar que el oxígeno disuelto en la estación 3 en los dos días de muestreo presentaron valores ligeramente más altos que en las dos primeras y está en relación a bajas temperaturas del agua con un pH estable. La conductividad en la estación 2 mostró un valor menor en un 50% que en las estaciones 1 y 3, así como la temperatura ligeramente más alta, debido a la influencia de la descarga del río Ramis, que vierte sus aguas en el extremo norte del lago Mayor (Chucuito) (Tabla 2).
La biometría de la especie O. ispi presentó una talla promedio de 6,5 cm y un peso de 2,1 g; mientras que para O. agassii fue de 13,1 cm y 38,7 g, para talla y peso respectivamente. Los valores obtenidos de metales pesados en agua de Pb, Hg y Cu, estuvieron por debajo del límite de detección del equipo de análisis en las tres estaciones de muestreo (Tabla 3).
En el músculo e hígado de las dos especies, el Pb y Hg (mg/kg) estuvieron por debajo del límite de detección del equipo; sin embargo, el Cu presentó valores en un rango de 0,7 a 0,9 mg/kg, con un promedio de 0,80 mg/kg para O. ispi y de 1,53 a 1,88 mg/kg, con un valor promedio de 1,64 mg/kg para O. agassii (Tabla 4).
En cuanto a la prueba estadística de U de Mann-Whitney para Cu, se comprobó la diferencia significativa entre ambas especies (p= 0,0023) (Figura 2), la cual está basada en las características de los organismos acuáticos de bioacumular los metales pesados, en este caso Cu presentó mayores valores en O. agassii (Tabla 4); aunque, esto no constituye un peligro para la vida del organismo, ya que es un microelemento requerido en el metabolismo de peces y otros organismos acuáticos. Sin embargo, se puede biomagnificar dentro de la cadena trófica, llegando al hombre como el nivel tope de este proceso.
Los valores de Cu no superaron los Límites Permisibles de ingesta de pescado para consumo humano de 10 mg/L para peso seco (FAO,1983). Cabe resaltar que no se utilizó valores de SANIPES, debido a que no existe limite permisible de Cu para peces.
Tabla 2. Valores de temperatura, oxígeno disuelto, pH y conductividad de las aguas de las 3 estaciones de muestreo del lago Titicaca, en noviembre del 2018.
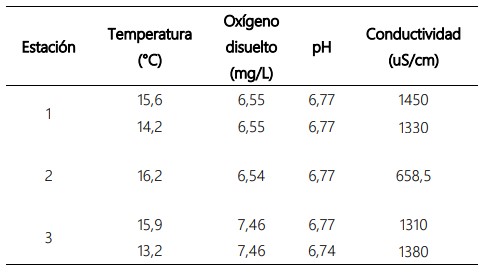
Tabla 3. Análisis de Pb, Hg y Cu en mg/L en agua de la zona de estudio en el lago Mayor (Chucuito) del lago Titicaca, en noviembre de 2018.
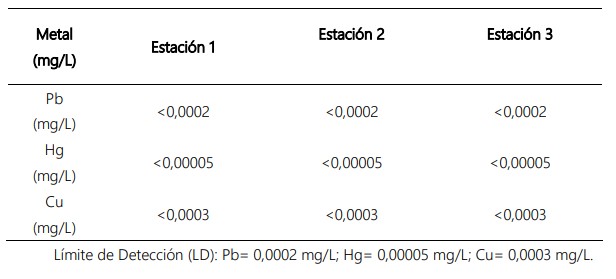
Tabla 4. Concentración de Pb, Cu y Hg en mg/kg de músculo e hígado de O. ispi y O. agassii del lago Mayor (Chucuito) del lago Titicaca, en noviembre de 2018
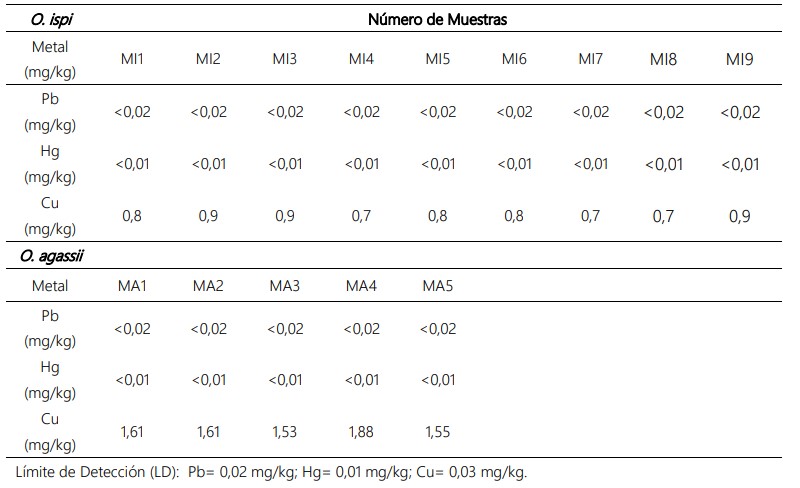
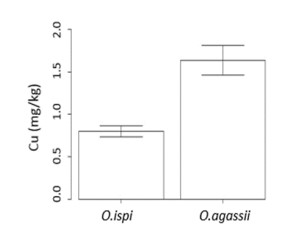
Figura 2. Concentraciones de Cu donde existe mayor bioacumulación en O. agassii, con respecto a O. ispi en ejemplares capturados en el lago Mayor (Chucuito), del Lago Titicaca en noviembre de 2018.
4. Discusión
Argota et al. (2020), realizaron un trabajo en la bahía de Puno, en el lago Titicaca, cerca de una laguna de oxidación, hallando datos de pH de 6,2. Monroy et al. (2014), registraron parámetros fisicoquímicos cerca a la desembocadura del rio Ramis, obteniendo datos de temperatura de 15 °C, oxígeno de 5,3 mg/L y pH de 8. Para ambos trabajos, los datos mencionados anteriormente, son similares a los encontrados en el presente trabajo con temperatura de 13,2 a 16,2 °C, oxígeno de 6,54 a 7,56 mg/L y pH de 6,74 a 6,77. Estos valores están dentro de los Estándares de Calidad Ambiental (ECA) para Agua, de la categoría 2: Extracción, cultivo y otras actividades marino costeras y continentales, Subcategoría C4: Extracción y cultivo de especies hidrobiológicas en lagos y lagunas, donde la temperatura es de Δ 3 °C, el valor mínimo oxígeno disuelto es ≥ 5 mg/L y el pH: 6,5 a 9,0 (MINAM, 2017).
Sin embargo, en la bahía de Puno, Argota et al. (2020), encontraron el oxígeno disuelto de 3,7 mg/L, estando muy por debajo del ECA de agua, esto es consecuencia de la descarga de materia orgánica de la laguna de oxidación, lo que origina el proceso de degradación por microorganismos, con alto consumo de oxígeno. También, se presentó sólidos totales que alcanzó los 2,967 mg/L, que superó ampliamente el valor de ≤ 25 mg/L del ECA (MINAM, 2017). Por lo que, se presentan episodios de fuerte depleción de oxígeno, como el caso reportado por Sierralta et al. (2020), quienes determinaron que la anoxia e hipoxia, ocurrida por la eutrofización del agua presente en la bahía de Puno causó la mortalidad de ejemplares del género Orestias. Los niveles de oxígeno disuelto que fueron registrados en el área fueron de 0,0 a 1,3 mg/L; a diferencia del presente trabajo, donde el oxígeno estuvo en el rango de 6,5 a 7,6 mg/L, óptimo para el desarrollo de estas especies.
Por otro lado, Monroy et al. (2014), hallaron en las aguas del lago, alta conductividad de 1 754 uS/cm, valor que está por encima del estándar de calidad de 1 000 uS/cm del ECA de agua (MINAM, 2017). Cabe resaltar, que Olías et al. (2005), catalogaron como baja conductividad las aguas con valores < 750 uS/cm, similar a lo registrado en la Estación 2 (río Ramis) con una conductividad de 658,5 uS/cm. Las estaciones 1 y 3, presentaron valores de 1 450 y 1 330 uS/cm y de 1 310 y 1 380 uS/cm, respectivamente, que están dentro de la categoría de conductividad media, que van de 700 a 1 500 uS/cm (Tabla 2). Al obtener un valor bajo de conductividad en la estación 2, hay menor presencia del transporte de metales pesados al lago (Hg: 0,00005, Pb: 0,0002 y Cu: 0,0003) (Ramos-Gómez et al., 2012) (Tabla 3); sin embargo, Monroy et al. (2014), señalan que la conductividad alta si favoreció la movilización de los metales, obteniendo concentraciones mayores en el agua (Cu: 16,84 mg/L y Pb: 32,39 mg/L) superando los límites permisibles del ECA de agua (Cu: 0,1 mg/L y Pb: 0,0025 mg/L) (MINAM, 2017).
Los análisis en agua en todas las estaciones dieron como resultado, bajas concentraciones de metales pesados (Hg= < 0,00005 mg/L, Pb: 0,0002 mg/L y Cu: 0,0003 mg/L), a comparación con el trabajo de Argota et al., (2020), que presenta altos niveles de metales pesados, hallándose valores para Cu 3,88 mg/L y Pb: 0,012 mg/L que superan los límites permisibles del ECA (MINAM, 2017), que posiblemente se deba a la presencia de agroquímicos.
Por lo general, los metales pesados en el agua suelen presentar concentraciones más bajas que en los sedimentos o en la biota acuática, esto puede ocasionar bajas concentraciones de metales pesados en la columna de agua (Mancera-Rodríguez & Álvarez-León, 2006), como ha sido el caso de Hg, Pb y Cu. Sin embargo, esto no sería motivo para que los peces no puedan concentrar metales pesados en sus tejidos blandos al bioacumular y especialmente biomagnificar, alcanzando valores bajos de metales pesados con respecto al agua.
Es importante señalar que los trabajos sobre la presencia de metales pesados en las especies ícticas del altiplano son escasas, en especial del área seleccionada del estudio. Gammons et al., (2006), trabajaron con ejemplares del género Orestias, capturadas cerca de la cabecera del río Ramis, en las proximidades de las mineras auríferas, que son la principal fuente de contaminación de la zona, donde un 75% de especímenes tuvieron altos niveles de Hg, superando el límite permisible de 0,30 mg/kg que da la Agencia de Protección Ambiental de Norteamérica (US EPA, 2001). Estos resultados, difieren a los del presente trabajo, considerando que estos ejemplares fueron capturados en la desembocadura del rio Ramis, aproximadamente 110 km, del área mencionada, encontrándose valores de Hg < 0,01 mg/kg, por debajo de la norma ambiental de Estados Unidos.
Monroy et al., (2014), en su trabajo realizado con ejemplares del “carachi amarillo” Orestias luteus (Valenciennes, 1846), provenientes de otras áreas del lago Titicaca, determinó una alta concentración de Cu (108,84 ± 85,75 mg/kg) en hígado y tejido muscular, valor que superó ampliamente el límite permisible de 10 mg/kg de peso seco (FAO, 1983).
En cuanto las concentraciones de Cu entre las dos especies, este fue menor en O. ispi que en O. agassii, esta diferenciación está relacionada a la cadena trófica; O. ispi tiene un solo nivel trófico, mientras que O. agassii es omnívora, lo que permite la biomagnificación (Lauzanne, 1991), aunque no sobrepasó el LMP para Cu de 0,5 mg/kg de peso seco (FAO, 1983); asumiendo que la baja conductividad ha influenciado en la baja concentración de metales en los tejidos blandos de los ejemplares.
Martínez (2018), realizó un estudio con peces del río Madre de Dios, Perú en el cual halló una correlación positiva entre el nivel trófico y la concentración de Hg, lo que sugiere que el nivel trófico está en relación con la bioacumulación de los metales pesados en el tejido blando de los peces.
Es importante señalar que en el ecosistema de O. ispi se encuentra la macrófitas “totora” Schoenoplectus californicus (Cronquis, 1981) que tiene la propiedad de bioacumular metales pesados en el rizoma de la planta, entre ellos el Cu, controlando la contaminación del ecosistema del lago (Cuadrado et al., 2019) actuando como fitorremediadora (Bedoya, 2014; Quintana, 2019; Llana, 2019; Ayala et al., 2019).
5. Conclusiones
El agua en el extremo norte del lago Mayor (Chucuito) del lago Titicaca no presentó niveles de contaminación por metales pesados de Pb, Hg y Cu, estando por debajo de los límites de detección analítica y dentro de los LMP dado en ml/L.
Los metales de Hg y Pb en los tejidos de las especies O. agassii y O. ispi no fueron detectados analíticamente, dando valores muy por debajo de la norma dada por la FAO en mg/kg de peso seco. Por lo tanto, estas especies no presentaron contaminación por los metales pesados al final de la época de estiaje.
Se obtuvo valores de Cu en músculo e hígado de las especies O. agassii y O. ispi, presentando diferencias significativamente entre ambas especies, siendo mayor en O. agassii.
6. Agradecimientos
A los biólogos César Gamarra, Hilda Ninaraqui y Lucy Hilasaca. Asimismo, al pescador Raymundo Pampa. A la Universidad Científica del Sur, por brindar financiamiento, para la ejecución del trabajo.
7. Contribución de los autores
YAV: Concepción, adquisición de datos, análisis e interpretación de datos, borrador del artículo, revisión crítica y aprobación definitiva de la versión que se presenta.
GSR: Diseño del estudio, análisis e interpretación de datos, borrador del artículo, revisión crítica y aprobación definitiva de la versión que se presenta.
8. Conflicto de interes
Los autores declaran que no existe conflicto de interés.
9. Referencias Bibliográficas
Agencia de Protección Ambiental de Estados Unidos (US EPA). (2001). Water quality criteria for the protection of human health: methylmercury. United States Environmental Protection Agency. 308.
Agencia de Protección Ambiental de Estados Unidos (US EPA). (2014). Method 6020B: Inductively Coupled Plasma - Mass Spectrometry, part of Test Methods for Evaluating Solid Waste, Physical/Chemical Methods. 2
Aguirre, L., Aguayo, R., Balderrama, J., Cortez, C., Tarifa, T., & Rocha, O. (2009). Libro rojo de la fauna silvestre de vertebrados de Bolivia (1era ed.). Ministerio de Medio Ambiente y Agua.
Aguirre, C., & Vento, J. (2015). Calibración del Modelo Numérico Semi Implícito Tridimensional, SI3D, de Transporte y Flujo Hidrodinámico, para el estudio del lago Titicaca. Theorēma, 2 (3), 45-55.
Ali, H., Khan, E., & Ilahi, I. (2019). Environmental chemistry and ecotoxicology of hazardous heavy metals: environmental persistence, toxicity, and bioaccumulation. Journal of chemistrty, 2019, 14.
Argota, G., Escobar, F., & Moreno, E. (2020). Calidad estacionaria del agua ante el costo ambiental sostenible relativo con agregación de biomarcadores: Bahía de Puno, lago Titicaca, Perú. Revista de Investigaciones Altoandinas, 22 (2), 146-154.
Authman, M., Zaki, M., Khallaf, E., & Abbas, H. (2015). Use of fish as bioindicator of the effects of heavy metals pollution. Journal of Aquaculture, 6, 13.
Ayala, S., Flores, R., Rodríguez, M., & Roldan, D. (2019). Cuantificación de los factores de bioconcentración en Schoenoplectus californicus ubicada en el Lago San Pablo, Imbabura-Ecuador (año, 2017). Ciencia, 20 (2), 160-176.
Bedoya, B. (2014). Evaluación de la actividad fitorremediadora del Schoenoplectus californicus “junco” en agua contaminada con arsénico. Tacna 2013. [Tesis para Titulo, Universidad Jorge Basadre Grohmann].
Bosch, A., O’Neill, B., Sigge, G., Kerwath, S., & Hoffman, C. (2016). Heavy metals in marine fish meat and consumer health: a review. J Sci Food Agric, 96, 32-48.
Chui, H., Roque, B., Huaquisto, E., Sardón, D., Belizario, G., & Calatayud, A. (2021). Metales pesados en truchas arcoíris (Oncorhynchus mykiss) de crianza intensiva de la zona noroeste del lago Titicaca. Revista de Investigaciones Veterinarias del Perú, 32 (3), 10.
Chura-Cruz, R., & Mollocondo, H. (2016). Desarrollo de la acuicultura en el Lago Titicaca (Perú). Revista AquaTIC, (31), 6-19.
Cuadrado, W., Custodio, M., Espinoza, C., Vicuña, C., & Uribe, M. (2019). Capacity of absorption and removal of heavy metals from Scirpus californicus and its potential use in the remediation of polluted aquatic environment. Open Journal of Marine Science, 09 (2), 74.
Gammons, H., Slotton, G., Gerbrandt, B., Weight, W., Young, C., Mc Nearny, L., Cámac, E., Calderón, R., & Tapia, H. (2006). Mercury concentrations of fish, river water, and sediment in the Río Ramis-Lake Titicaca watershed, Peru. Science of the Total Environment, 368 (2006), 637-648.
Greenfield, S., Jones, I., & Berry, C. (1964). High pressure plasmas as spectroscopic emission sources. Analyst. 89 (1064), 713-720.
Hallasi, G. (2018). Determinación de los parámetros microbiológicos y físicoquímicos de las aguas de consumo humano en las islas flotantes uros del Lago Titicaca. [Tesis para Titulo, Universidad Nacional del Altiplano].
Lauzanne, L. (1991). Especies nativas: Las Orestias. ORSTOM Fonds Documentaire, (36638), 409-423.
Llana, T. (2019). Análisis comparativo de la absorción del plomo total presente en la especie Schoenoplectus californicus del contorno del lago Chinchaycocha. [Tesis para Titulo, Universidad Nacional Daniel Arcides Carrion]
Mancera-Rodríguez, N., & Álvarez-León, R. (2006). Estado del conocimiento de las concentraciones de mercurio y otros metales pesados en peces dulceacuícolas de Colombia. Acta Biológica Colombiana, 11(1), 3-23.
Martínez, G. (2018). Assessment of Mercury Contamination in Riverine Fish and Sediment Associated with Artisanal and Small-Scale Gold Mining in Madre de Dios, Peru. [Tesis de Maestria, University of California Davis].
Ministerio del Ambiente (MINAM). (2017). Decreto Supremo N° 004-2017- MINAM. Aprueban Estándares de Calidad Ambiental (ECA) para Agua y establecen Disposiciones Complementarias. Ministerio del Ambiente. El peruano. 7 de junio de 2017.
Monroy, M., Maceda-Veiga, A., & de Sostoa, A. (2014). Metal concentration in water, sediment and four fish species from Lake Titicaca reveals a large-scale environmental concern. Science of The Total Environment, 487, 233-244.
Olías, M., Cerón, J., & Fernández, I. (2005). Sobre la utilización de la clasificación de las aguas de riego del U.S. Laboratory Salinity (USLS), Geogaceta 37, 111-113.
Organización de las Naciones Unidas para la Agricultura y la Alimentación (FAO). (1983). Compilation of legal limits for hazardous substances in fish and fishery products. FAO Fisheries Circular, (764), 102.
Organización Internacional de Normalización (ISO). (2016). ISO 17294- 2:2016, Water quality. Application of inductively coupled plasma mass spectrometry (ICP-MS). Part 2: Determination of selected elements including uranium isotopes. International Organization for Standardization, 2, 31.
Quintana, I. (2019). Actividad fitorremediadora de la totora (Schoenoplectus californicus) en agua contaminada por arsénico en los pozos del caserío Tranca Fanupe-Mórrope [Tesis para Titulo, Universidad Cesar Vallejo].
Ramos-Gómez, M., Avelar J., Medel-Reyes A., Yamamoto L., Godinez L., Ramirez M., Guerra, R., & Rodríguez, F. (2012). Movilidad de metales en jales procedentes del distrito minero de Guanajuato, México. Revista Internacional de Contaminación Ambiental, 28 (1), 49-59.
Sierralta, V., Quinto, I., Gamarra, Peralta, C., Chura, R., & Treviño, H. (2020). Efecto de la contaminación en peces del género Orestias en la bahía interior de Puno, Lago Titicaca. Boletín Imarpe, 35(2), 294-303.
Treviño, H., Torres, J., & Roncal, M. (1991). El potencial ictiológico. ORSTUM Fonds Documentaire, (36650), 549-559.