Artículo de Revisión
NOCIONES SOBRE LA ESTRUCTURA Y EVOLUCIÓN DEL SISTEMA NERVIOSO DE ALGUNOS INVERTEBRADOS
ELEMENTARY CONCEPTS ABOUT THE STRUCTURE AND EVOLUTION OF THE NERVOUS SYSTEM OF SOME INVERTEBRATES
Sergio Pablo Urquiza 1 *
1 Departamento de Diversidad Biológica y Ecología-Escuela de Biología - Facultad de Ciencias Exactas, Físicas y Naturales-Universidad Nacional de Córdoba-Avda. Vélez Sarsfield 299-5000-Córdoba-Argentina.
* Autor responsable: sergio.pablo.urquiza@unc.edu.ar
Recibido: 29 de setiembre 2021 / Aceptado: 24 de noviembre 2021
RESUMEN
Se describe la estructura general del sistema nervioso (SN) de algunos invertebrados, así como su conformación particular en algunos filos basales. Se estudia la estructura general de los mismos, comparándolas cuando es posible, y en algunos casos se aborda la anatomía e histología de órganos puntuales. Estos son de suma importancia para trazar la evolución del SN ya sea dentro de cada filo o entre los mismos. La anatomía e histología del SN de los invertebrados es muy dispar. Existen redes neurales difusas, ganglionadas o sistemas nerviosos centrales. Entre los últimos se presenta generalmente un cerebro anterior y dorsal, unido a una o más cuerdas nerviosas ventrales, macizas. Histológicamente poseen los cuerpos neuronales en la periferia de las masas nerviosas. A pesar de las diferencias entre ellos y con los vertebrados, y a través del análisis de estas estructuras y de los patrones de desarrollo se concluye que es probable que el origen de las neuronas, de la centralización y de la cefalización del SN hayan sido eventos únicos, aunque se admite que aún falta mucho para estudiar en este campo y no es posible aseverar nada en forma definitiva.
Palabras claves: Evolución morfológica, relaciones entre vertebrados e invertebrados, sistema nervioso.
ABSTRACT
The general structure of the nervous system (SN) of complex invertebrates is described, as well as its particular conformation in some basal phyla. Their general conformation is studied, comparing them when possible, and in some cases the anatomy and histology of specific organs is addressed. These are of utmost importance to trace the evolution of the SN either within each phylum or between them. The anatomy and histology of the SN of invertebrates is very uneven among them. There are diffuse neural networks, ganglionic or central nervous systems. Among the latter there is generally a fore and dorsal brain, attached to one or more massive ventral nerve cords. Histologically, they have neuronal bodies on the periphery of nerve masses. Despite the differences between them and with vertebrates, and through the analysis of these structures and development patterns it is concluded that it is likely that the origin of neurons, centralization and cephalization of the SN have been unique events although it is admitted that there is still a long way to go to study in this field and it is not possible to affirm anything definitively.
Keywords: Invertebrates and vertebrates relationships, morphological evolution, nervous system.
DOI: http://dx.doi.org/10.17268/rebiol.2021.41.02.11
1. INTRODUCCIÓN
Una notable característica de los animales es la posesión del sistema nervioso (SN), exclusivo de ellos, aunque unos pocos grupos como las esponjas (poríferos) y los placozoos no lo poseen. Este sistema se encarga de captar y procesar información relevante, así como de inducir ciertos cambios en el cuerpo para asegurar la funcionalidad del mismo. Está constituido por neuronas, que son su unidad fisiológica y morfológica, y por una multitud de células acompañantes que les sirven de apoyo nutricional y metabólico, las células neurogliales. Las neuronas y la glia en verdad forman una asociación indisoluble, y las últimas parecen hallarse en todos los animales investigados hasta la fecha, salvo quizás los cnidarios y ctenóforos (Urquiza & Carezzano, 2018). En los platelmintos, por ejemplo, hasta hace poco tiempo aún había dudas acerca de si poseían o no este tipo celular (Biserova et al., 2010). Las neuronas, aparte de conducir la información, pueden especializarse como receptores sensoriales, por lo que los órganos de los sentidos no son más que conjuntos de neuronas altamente especializadas. Como todos los sistemas pueden clasificarse en diversos tipos y subdividirse en distintas regiones constituyentes, divisiones que no siempre son contrapuestas y que pueden experimentar cambios según el concepto que se sustente, enfoque que se adopte o animal que se considere. En este artículo serán abordados someramente la estructura y relaciones evolutivas de los SN de algunos invertebrados como los cnidarios, anélidos, insectos y cefalópodos, a través de una discusión sobre las neuronas, las redes nerviosas y el cerebro, así como de la histología encontrada en los mismos. Este último es un tema que suele quedar fuera de los manuales de grados universitarios, lo que es un claro sesgo antropocéntrico, ya que por ejemplo, la inmensa mayoría de los filos son “invertebrados”, y la mayoría de estos, a su vez, presentan la histología de sus masas nerviosas muy diferente a la de los vertebrados. En estos los somas forman la sustancia gris, normalmente ubicada en la profundidad, como en la médula. En los invertebrados, en tanto, los ganglios y el cerebro poseen los somas asentados en la periferia de los mismos. Asimismo, como se verá luego, las prolongaciones del estilo de los axones y dendritas, así como las sinapsis, también siguen un patrón de distribución espacial diferente. En este sentido, y para ilustrar la visión antropocéntrica citada, vale la pena mencionar también que un tipo de músculo, el estriado oblicuo, que ni siquiera es nombrado en la clasificación tradicional de los libros de histología, es el más frecuente en dichos filos, que conforman el 95 % de los animales (Urquiza & Carezzano, 2018). Probablemente debido a que en muchos planes de estudio no existe como materia histología de los invertebrados, el alumnado suele formarse asumiendo que no existen diferencias notables entre los tejidos de estos animales y los vertebrados. Porque es frecuente que se profundice en histología humana y no se tracen paralelos con lo que ocurre en otros animales, sobre todo los mencionados. Y, teniendo en cuenta la relevancia desde el punto de vista teórico y práctico de estos animales, es una situación que en opinión del autor sería bueno corregir.
Las subdivisiones del sistema nervioso
Como a todos los sistemas de órganos, al SN se lo puede subdividir en varias clases. Tradicionalmente se reconocen dos, SN difusos (SND) y SN centralizados (SNC). En el primer grupo se hallan animales con sus neuronas dispersas en el cuerpo conformando redes y sin formar grupos discretos, y en el segundo se encuentran los que sus neuronas se disponen en acúmulos discretos y formando masas como ganglios o cerebros. Animales con SND serían Xenoturbella, los Cnidarios y los Ctenophoros. Y, con SNC serían los anélidos, artrópodos, cefalópodos y vertebrados, entre otros. Es así que en una visión clásica se adscribió al tipo de redes difusas a los SN de los cnidarios (hidras de agua dulce, corales y medusas), sin hacer mucha distinción entre redes difusas o ganglionadas, y al tipo de los SNC, a los SN de casi todos los demás animales, los bilaterales. Empero, diversos autores no aceptan que los cnidarios presenten redes difusas, sino, en todo caso redes ganglionadas, o incluso un equivalente a un sistema nervioso central (SNC), dado que sus neuronas forman claros agregados que conforman incluso diferentes subredes (Koizumi et al., 2015; Satterlie, 2011).
Por esto, en opinión del autor quizás convendría dividir a los SN en tres clases. Las mismas serían: 1- redes difusas, que serían aquellas que presentan sus neuronas dispersas, solitarias y aisladas, formando redes dispersas, y sin conformar grupos; 2- redes ganglionadas, en los que las neuronas también forman redes nerviosas, pero no de neuronas aisladas sino de ganglios, conjuntos discretos de neuronas; y 3- sistemas nerviosos centralizados, con un cerebro o su equivalente y una o más cuerdas nerviosas, y donde estos órganos no se presentan como redes. La primera distinción se refiere a que las redes nerviosas pueden poseer sus neuronas separadas unas de otras y distribuidas en el cuerpo de forma homogénea, sin formar grupos definidos, los que son llamados ganglios. Este sistema de neuronas dispersas es sumamente difícil de hallar en algún animal actual en concreto, salvo quizás en Xenoturbella. La segunda clase es algo más frecuente y ocurre cuando las neuronas se hallan agrupadas en ganglios, esto es, dichas células forman conjuntos discretos y separados de otros. El tercer tipo es el atribuido al conjunto de los bilaterales y no precisa mayor detalle. Se hallan muy bien diferenciados en animales como los anélidos, artrópodos, los moluscos y los vertebrados, alcanzando en algunos de los dos últimos taxones un gran desarrollo, lo que les permite ejecutar conductas sumamente elaboradas, como se puede observar en los pulpos, en las aves y en los mamíferos. En todos los casos, el SN siempre consta del SNC y del sistema nervioso periférico (SNP).
En este contexto será útil definir una serie de términos evolutivos. Grupo, taxón o estado basal o ancestral hace referencia a los animales que se encuentran en la base de un árbol evolutivo particular, así como a los órganos presentes en ellos, que se asume que representan, hasta cierto punto, la situación inicial. En cambio, divergentes se aplica a los animales u órganos que se suponen se originaron de los basales y a las estructuras que de aquellos derivan. Si bien a menudo estos conceptos se asocian a los términos simples y complejos, o primitivos y evolucionados (sobre todo en la literatura más antigua) no es lo mejor. Porque muchas estructuras se simplifican en forma secundaria como consecuencia de las imposiciones ambientales, así como, en forma concomitante, diversos organismos pierden sus órganos. El mejor ejemplo es el de los parásitos, que derivan de animales de vida libre, que podrían haber tenido extremidades, ojos y sistema digestivo muy desarrollados, pero que los perdieron. En pocas palabras, no es lo mismo decir simple que simplificado. Finalmente es bueno aclarar el término filo, que se refiere a los grupos (llamados taxones o clados) de animales que antes se clasificaban por debajo de la
categoría de reino animal, como el filo moluscos o artrópodos. Los vertebrados, por ejemplo, pertenecen al filo de los cordados. El término “invertebrados” no tiene existencia real en la taxonomía, y es tan sólo una referencia útil para resumir los nombres de unos 30 filos, donde no se ubica al subfilo de los humanos, los vertebrados. Más allá de un claro sesgo antropocéntrico, existen algunas notables diferencias estructurales entre los “invertebrados” y los vertebrados. Al menos en sus SN y en buena parte de su histología (La Douceur, 2021; Urquiza & Carezzano 2018, 2019).
Para ilustrar la división del SN en SNC y SNP se tomará como punto de referencia a los vertebrados, más familiares, si bien este es un artículo sobre invertebrados. El SNC es la parte contenida en el cráneo y la columna vertebral, conocidas como encéfalo y médula, respectivamente. Y el SNP es el conjunto de nervios que emergen de las anteriores. En las dos divisiones se encuentran al sistema nervioso somático (SNS) y al autónomo (SNA), encargándose el primero de las acciones voluntarias y el segundo de las vegetativas, como el funcionamiento de las vísceras (Gabela, 2001) las que son aquellos órganos contenidos en las cavidades corporales. El SNA se clasifica a su vez en las porciones simpática (SNASi), parasimpática (SNAPa) y sistema nervioso entérico (SNAEn) (Butler & Hodos, 2005). Estas regiones, u otras más o menos equivalentes, también existen en los filos invertebrados, denominadas a veces como región autonómica, entérica o estomatogástrica (Hartenstein, 2017), aunque no siempre están claramente identificadas o definidas. Algo similar ocurre con el sistema endócrino, estrechamente relacionado al SN, y que, salvo en insectos y otras excepciones, en numerosos filos invertebrados no forma glándulas diferenciadas. De hecho, las glándulas pluricelulares no son muy frecuentes salvo en los vertebrados (Urquiza & Carezzano, 2018). En general, el SNC se halla formado principalmente por interneuronas, mientras el periférico por prolongaciones de motoneuronas o de neuronas sensoriales. Los SNC de los anélidos, moluscos y artrópodos, siempre poseerán un cerebro (llamado muchas veces ganglio) y una o más cuerdas nerviosas ventrales. Desde estas masas nerviosas emergen los nervios que constituyen el SNP y que inervan la totalidad del animal.
Tipos morfológicos de sistema nervioso
Desde el punto de vista histológico el SN puede clasificarse en tres tipos: basiepidérmico, subepidérmico, e invaginado. El primero también es denominado intraepidérmico o basiepitelial y se supone que es más antiguo y corresponde a aquellos SN cuyas neuronas se asientan y discurren entre las células epiteliales del tegumento, por encima de la membrana basal que separa a dicho tejido del conectivo subyacente. El tipo subepidérmico es aquél en el que el tejido nervioso se ubica por debajo de la membrana basal epitelial, y por tanto se encuentra inmerso en el tejido conectivo. Es el encontrado en la mayoría de los filos invertebrados. Y el tercero, exclusivo de los vertebrados, se caracteriza por formarse mediante el hundimiento del tejido nervioso, que forma un tubo, el tubo neural (Giribet & Edgecombe, 2020; Hejnol & Rentzsch, 2015).
Desde un punto de vista anatómíco, los SN podrían clasificarse al menos en 5 clases morfológicas, lo que no implica una propuesta de hipótesis filogenética. Las mismas serán explicadas luego y son, en orden creciente de complejidad estructural: 1- las redes nerviosas basiepidérmicas de hemicordados, xenoturbéllidos y acoelos; 2- la cuerda ventral ganglionar de platelmintos, artrópodos y anélidos; 3- el tetraneuralia de moluscos; 4- el anillo nervioso de equinodermos: 5- el tubo dorsal y hueco de los cordados.
Como podrá inferirse de lo expuesto hasta ahora, existen al menos tres eventos cruciales en la evolución del SN: 1- la aparición de las neuronas; 2- su reunión en conjuntos formando SN basiepidérmicos, probablemente simples y 3- la formación de SN centralizados y cefalizados. Los tres, o quizás algunos solamente, pueden haberse dado en forma independiente en dos o más filos, o como fenómenos únicos, lo que implicaría, en este último caso, la homología entre todos los SN. Esto es, todos derivarían del mismo SN originado en su último antepasado común. Este es un punto de activa discusión actual, ya que numerosos análisis genómicos o de desarrollo del SN apoyan, al menos en parte, la hipótesis de un origen común, aunque posiciones diferentes pueden verse en Moroz (2021) para el origen independiente de las neuronas, o en Martín-Durán et al. (2018), para la centralización del SN, por ejemplo. De todas formas, siempre es posible que al menos en algunos casos, ciertas coincidencias estructurales, moleculares o funcionales se deban a la acción de la homología profunda. Este fenómeno da origen a varias innovaciones evolutivas y se basa en la herencia compartida de redes génicas regulatorias, no en genes específicos para la generación de estructuras particulares (Shubin et al., 2009). Las innovaciones o novedades evolutivas, a menudo utilizadas como sinónimos, se refieren a la aparición en un taxón particular de una estructura inexistente en sus ancestros inmediatos. Sin embargo, debería diferenciarse entre novedad evolutiva, que es una estructura nueva, aunque podría ser construida sobre mecanismos moleculares ancestrales, e innovación evolutiva, que es una estructura modificada de una que ya existía en los ancestros inmediatos (Almudí & Pascual-Anaya, 2019).
A pesar que se ha avanzado mucho en este campo en estos años, sobretodo como consecuencia de estudios genómicos, los que han echado alguna luz sobre los eventos iniciales de la evolución de los animales y de sus SN (León, 2019), muchas preguntas básicas, del estilo de como fue el primer SN o cuál fue la principal innovación evolutiva implicada en su historia inicial, aún quedan sin respuesta. De todas maneras, es necesario reconocer que numerosas capacidades como cierto tipo de memoria, o la discriminación entre lo dañino o no, ya existían antes de su origen (Arendt, 2021), como puede inferirse de las conductas vistas en protistas o incluso, bacterias. Esto es, antes del origen de las neuronas.
La esencia del sistema nervioso: las neuronas
Una neurona es una de varios tipos celulares. Y aunque pudiera parecer algo simple de definir, el concepto de “tipo celular” no es fácil de demarcar y establecer (Slater, 2013), por lo que también lo es el de neurona, por lo se apelará a un concepto intuitivo del lector. Las neuronas quizás sean el tipo celular más polimórfico, y aunque a nivel molecular son difíciles de definir, la característica unificadora a todas estas células es que presentan un tipo de unión celular específica, la sinapsis, que les permite pasar información a otras equivalentes, o incluso a otros tipos celulares. Sin embargo, varias moléculas presentes en la sinapsis también son encontradas en animales como las esponjas, o incluso en protistas, que en ningún caso presentan un SN. Más aún, ciertas características que hacen a la centralidad de la neurona, como los canales activados por voltaje, también existen en las bacterias. Asimismo, también se han detectado potenciales de acción en ciertos protistas. Entre estos, alguno de los más estudiados e interesantes para esta discusión son los coanoflagelados, grupo ancestral a los metazoos. En dichos organismos se han hallado genes de canales operados por voltaje y diversas moléculas como algunas intervinientes en la exocitosis o proteínas constituyentes de las vesículas sinápticas o que actúan en las vías de señalización celular (Burkhardt & Sprecher 2017).
Es así, y en la misma dirección de este análisis, que se han hallado una gran cantidad de moléculas y proteínas de gran importancia para la sinapsis en otros protistas, placozoos, poríferos (de los cuales ninguno posee neuronas) y ctenóforos. Vale aclarar que de estos últimos animales aún se discuten dos puntos muy importantes y relacionados entre sí: su estatus filogenético (Giribet & Edgecombe 2020), y si sus neuronas son o no homólogas con las de los demás animales, como fuera ya mencionado (Moroz, 2008). Sin embargo, en estos organismos, así como en los eumetazoos con SN, estas moléculas pueden tener otros roles, aunque quizás vinculados, en los tejidos no neurales. Por ejemplo, los placozoos poseen células glandulares que expresan ciertas proteínas sinápticas, al igual que las células globulares del mesohilo de las esponjas. Un probable escenario para el surgimiento de esta situación sería que el ancestro a estos animales y a los eumetazoos presentaba una célula secretoria o sensorial que luego derivó en las neuronas en estos últimos (Burkhardt & Sprecher, 2017). Sin embargo, hay otras explicaciones posibles. En este sentido, es necesario destacar que el epitelio, con sus uniones celulares concomitantes, habría sido el primer tejido en aparecer (Urquiza & Carezzano, 2013), a la vez que es muy probable que las neuronas hubieran derivado de un epitelio de origen ectodérmico, tal como ocurre en todos los animales, salvo en algunos cnidarios, en los que también se originan del epitelio endodérmico. Es necesario mencionar que en estos animales también existen células del tipo de los epitelios musculares, que poseen capacidades sensoriales a la vez que efectoras porque son contráctiles (Kristan, 2016). Debido a estas características tan particulares, se ha propuesto la hipótesis, aunque no se ha presentado sustento experimental en su apoyo, con que estas podrían haberse especializado como neuronas (Arendt, 2008; Brunet & Arendt, 2016). Sin embargo, si bien es probable que estas células se hayan originado una sola vez, no puede descartarse su posible origen convergente.
De todas maneras, los datos moleculares por sí solos, al menos hasta ahora, no bastan para decidir qué tipo celular fue el ancestral a las neuronas y donde apareció, ya que la distribución de numerosas moléculas esenciales para su función sigue un patrón poco claro. Además, el registro fósil no ha dejado marcas de dicha evolución molecular, ni de las primeras prolongaciones que podrían calificar como neuritas. Más allá de esto, un escenario posible es que, al aumentar el tamaño de los animales, la comunicación del epitelio por sí mismo (como ocurre en Trichoplax, quizás el animal actual más simple) era ineficiente para cubrir las demandas de integración, por lo que algunas de estas se habrían especializado en forma de una red difusa de conducción eléctrica, probablemente con funciones mecanosensitivas en sus orígenes. Luego habrían derivado las sinapsis químicas, probablemente en la forma de una unión neuromuscular, y más específicamente inervando miocitos lisos, que serían anteriores a los estriados (Kristan, 2016). De todas maneras, según algunos autores los miocitos, tanto lisos como estriados, habrían estado presentes en el Urbilateria, el ancestro de los bilaterales (Brunet et al., 2016), y habría sido la primera célula mesodérmica en aparecer (Rieger & Ladurner, 2003), lo que de alguna forma avala la idea de su primitiva conexión con las protoneuronas ya que es difícil imaginar un animal con músculos más o menos bien desarrollados y diversificados y sin un SN algo avanzado. Vale aclarar que los Cnidarios y Ctenophoros también presentan músculos, o al menos células epitelio musculares, y que habrían surgido antes de los bilaterados. Sin embargo, no está claro si tales células son homólogas a los miocitos de estos últimos, toda vez que aquellos son diblásticos, mientras los bilaterales triploblásticos, en los que el músculo deriva del mesodermo (Cole et al., 2020).
El aumento de tamaño también implicó, necesariamente, el paso del movimiento ciliar al muscular. Porque el primero es efectivo sólo en animales pequeños, por lo que al aumentar el tamaño de los mismos habría sido necesaria la aparición del músculo, y con este la de las neuronas. Las diversas innovaciones morfológicas relacionadas podrían haber surgido en forma un tanto repentina en esta transición evolutiva, la que fue llamada ASMO (Animal
Sensorimotor Organization) por Keijzer & Arnellos (2017) y Arnellos & Keijzer (2019). Empero, otros autores proponen que entre 550 a 540 millones de años atrás, habrían aparecido neuronas en forma independiente en tres linajes basales, ctenóforos, cnidarios y bilaterales, a partir de células secretoras (Moroz & Romanova, 2021). Moroz (2009) también postula que la centralización se produjo en forma independiente en varias ocasiones diferentes, quizás entre cinco a siete veces, en los nemátodos, artrópodos, anélidos, moluscos y cordados.
Quizás el aumento de tamaño, el paso a la locomoción ciliar y la coordinación neuronal hayan sentado las bases para la explosión Cámbrica subsecuente al origen de los primeros animales.
Una unión especial: La sinapsis
Las sinapsis son uniones celulares implicadas particularmente en la comunicación intercelular. Son básicamente bastante parecidas en los diferentes animales (Luo, 2016) aunque existen varios ejemplos particulares de sinapsis muy especializadas, como las fibras musgosas del cerebelo, entre otras (Lüscher & Petersen, 2013). Ahora bien, ¿cómo se originaron? Como fuera comentado, de los dos tipos de sinapsis, las eléctricas y las químicas, las primeras serían las más antiguas.
Sin embargo, vale aclarar que la comunicación intercelular puede prescindir de las sinapsis. En Trichoplax, por ejemplo, las células fibrosas ejecutan multitud de tareas, entre otras, probablemente conducción de la información, a pesar que no poseen dichas uniones (Moroz & Romanova, 2021). Así, está claro de lo expuesto que antes que las neuronas hicieran su aparición, se originaron los potenciales de membrana, y que probablemente el mecanismo de comunicación ancestral fue de tipo electrotónico, tal como ocurre mayoritariamente en los cnidarios modernos, aunque también existe esta comunicación entre las neuronas de los vertebrados. Con el tiempo, sin embargo, las sinapsis químicas, surgidas bastante atrás en el tiempo, fueron desplazando a las eléctricas. Con todo, los neurotransmisores, actores imprescindibles en las sinapsis químicas, no sólo existen en las neuronas sino también en las células neuroendocrinas. Pero como en estos tejidos las cantidades liberadas de mensajeros son mucho mayores, las neuronas suponen un adelanto, ya que son más eficientes. Por lo mismo, los sistemas neuroendocrinos fueron perdiendo importancia, ya que las neuronas conducen la información más rápidamente, y muchas de sus funciones primigenias quedaron a cargo del sistema endócrino (Pannese, 2015). Probablemente los tejidos neuroendócrinos hayan surgido incluso antes de la evolución de los bilaterales (Shigeno et al., 2018), lo que parece bastante lógico, si se piensa en tales sistemas como conjuntos celulares que secretan mensajeros químicos. Así, la aparición de las sinapsis tendría que haber otorgado algunas ventajas, como un ahorro de recursos, al localizar la liberación de transmisores a puntos circunscritos; evitar su consumo como nutrientes, ya que muchos son aminoácidos y, finalmente, tendrían que haber permitido una mayor velocidad de conducción, así como una acción más precisa y localizada. Estructuralmente, la evolución de la sinapsis química se basaría en tres fenómenos: La modularidad de las moléculas implicadas; la reorganización de diversas moléculas intracelulares y extracelulares de células secretorias y por último, la selección diferencial de neurotransmisores para pasar de una secreción y comunicación parácrina a una sináptica (Moroz & Romanova, 2021).
¿Ganglio o cerebro?
Antes de avanzar con una discusión más detallada, es necesario aclarar ciertos términos. El concepto de cerebro que normalmente prevalece entre muchas personas con cierta formación científica, incluso biólogos, es que el mismo es el centro de información de los vertebrados y que los invertebrados en verdad tienen un “ganglio”. En opinión del autor esta es una visión que debería cambiarse, y en lo que sigue se repasarán brevemente estas ideas.
Aparentemente fue entre los antiguos egipcios, en una serie de papiros, que habrían aparecido las primeras referencias escritas al cerebro, concepto que luego en Aristóteles se circunscribiría particularmente a los vertebrados. Pero con el tiempo comenzó a adoptarse una definición más funcional, y se definió al cerebro como el centro de control nervioso de los animales cefalizados. Lo que implicaba que se considerasen sólo estos, o el centro en el que tenían lugar eventos como la memoria o la conciencia, esta última aún más esquiva de definir que el cerebro. De esta manera, al menos en los estadios iniciales de la neurociencia, este órgano fue analizado según tres visiones: estructural, “vertebrado-céntrica” y una que quizás podría denominarse “evolutiva”, ya que intentaba incluir una perspectiva filogenética, pero siempre dentro de los vertebrados (Pagán, 2019). De todas maneras, hay que reconocer que no siempre es fácil definir las estructuras, como podrá verse más adelante con los cordones nerviosos de los pulpos, considerados a veces parte del SNC y a veces del SNP (Shigeno et al., 2018).
Ampliando la concepción de lo que es un cerebro, incluso se ha llegado a hablar de una especie de SN en plantas, y hasta de cerebros, en el sentido de un sistema integrador de información, en bacterias o mohos sociales (Pagán, 2019). De esta forma, aunque un cerebro, más que una estructura física quizás pueda ser conceptualizado como un estado de interacción informativa entre entidades con propiedades emergentes que podría ser caracterizado como conducta, en el presente trabajo se hará referencia al mismo bajo un punto de vista exclusivamente anatómico y se ceñirá a los animales. Un punto importante es que los cerebros, al igual que todas las estructuras, debido a constricciones de diseño y ontogenéticas, así como funcionales, no puede poseer cualquier estructura posible, lo que restringe las posibilidades y podría llevar a convergencias evolutivas (Shigeno et al., 2018), lo que puede obstaculizar la discusión sobre el origen y evolución de los SNC. Por ejemplo, según Satterlie (2017), los Cnidarios presentan una maquinaria celular que permitiría la centralización del SN, que podría haberse originado en el ancestro común con los bilaterales, sin embargo, debido a que poseen simetría radial, los mismos no habrían podido desarrollar una marcada centralización y cefalización.
Así es que el cerebro, definido como una masa de neuronas concentradas en la región cefálica, es, básicamente, un ganglio que ha experimentado un notable desarrollo, y que además puede resultar de la fusión de varios de estos, y, a pesar de que aún es materia de discusión, probablemente se haya originado antes de la divergencia entre protostomados y deuterostomados. Quizás se pueda fijar su aparición cerca de la separación de radiales y bilaterales, aún más anterior (Riebli & Reichert, 2016), entendiendo por radiales a los Cnidarios, y por bilaterales a todos los demás animales salvo las esponjas y placozoos. De todas maneras, se ha llegado a sugerir el incluir entre los bilaterados a los Cnidarios. Otro grupo problemático es el de los Ctenophoros, del cual aún no hay certeza sobre su posición filogenética (Giribet & Edgecombe, 2020).
En este contexto es bueno mencionar que una de las razones esgrimidas a favor del origen independiente de los SNC complejos y cerebros es que los mismos se hallan en los taxones terminales de animales como anélidos, artrópodos o cordados, pero no en sus representantes más basales, o sea, en los taxones que surgieron primero (Shigeno et al., 2018). Por ejemplo, entre los anélidos, en los grupos que primero habrían aparecido y serían hermanos a los demás, como los owénidos, se encuentra un anillo nervioso intraepitelial a modo de cerebro, con apenas un tipo neuronal y sin formaciones ganglionares, mientras en otros grupos, el cerebro se agranda por el desarrollo de ganglios y la aparición de otros tipos neuronales (Beckers et al., 2019), como en los errantes, que poseen cerebros con cuerpos pedunculados (Heuer et al., 2010). En cuanto a los artrópodos, se considera que su estado ancestral sería el de un cerebro ganglionado, el que también existiría en los panartrópodos (artrópodos, onicóforos y tardígrados), el que en los artrópodos en sentido estricto se compone de tres neurómeros (que se comentarán más adelante) pero que en los tardígrados solo comprende uno de ellos, posiblemente el protocerebro mientras en los onicóforos existe también el deuterocerebro (Giribet & Edgecombe, 2020). La explicación alternativa sería que, en cada uno de estos linajes, los grupos basales perdieron en forma secundaria dichas estructuras (Shigeno et al., 2018). Sin embargo, esta situación también podría explicarse por la acción de la homología profunda.
Más allá de su origen y evolución, posiblemente sea más cómodo y parsimonioso llamar cerebro no sólo al órgano nervioso cefálico típico de los vertebrados, sino también a los grupos de neuronas integradoras, dorsales y anteriores de los invertebrados. Estas neuronas poseen funciones integradoras, son el centro de “decisión” del organismo y el punto de llegada de todas o de la mayoría de las aferencias sensoriales. Al igual que ocurre con el cerebro de los vertebrados. Por otro lado, probablemente sería mejor reservar el término “ganglio” para los grupos neuronales que funcionan como estaciones periféricas de relevo e integración local. Esto aplicaría tanto para los ganglios periféricos de los mamíferos, como para los ganglios de las cuerdas nerviosas de los invertebrados. Una discusión aparte merece la situación de los acúmulos neuronales de los cnidarios.
Generalidades del sistema nervioso de los invertebrados
Desde un punto de vista estructural, anatómicamente los sistemas nerviosos de los invertebrados con un SNC bien definido presentan una masa cefálica anterior, el cerebro, del que emergen una o más cuerdas nerviosas que corren a lo largo del animal, siempre ubicadas ventralmente. Estas cuerdas siempre son macizas y generalmente consisten de una serie de ganglios conectados por fibras nerviosas longitudinales. En muchos taxones estas cuerdas pueden ser dos o más, y en estos casos, los ganglios de ambos flancos se comunican con su par opuesto mediante fibras transversales, las comisuras.
Desde el punto de vista histológico el SN de los invertebrados presenta varias características comunes entre sí, y diferentes a los vertebrados. Una es que casi no presentan fibras mielinizadas, y en caso de existir, no parecen ser homólogas con las de los vertebrados. Por esta razón, si llegaran a precisar un sistema de conducción veloz, disponen de las conocidas fibras gigantes, como las halladas en los calamares o lombrices, porque a mayor calibre del axón, mayor será la velocidad de conducción. Otra es, como fuera adelantado, que sus masas nerviosas, ya sean el cerebro o los ganglios ventrales, poseen sus somas dispuestos en forma periférica, mientras las neuritas (ya sean axones o dendritas) se dirigen hacia el centro del órgano, conformando una masa enredada de fibras, el neurópilo. En los vertebrados, en general, los somas se disponen más profundamente en el órgano, desde donde emergen las neuritas, bien diferenciadas entre sí. También existen diferencias en la disposición de las sinapsis, ya que mientras en los invertebrados las mismas se localizan siempre en las neuritas, y por lo tanto en el neurópilo, en los vertebrados lo hacen también en el soma. Por esta razón, en los invertebrados las inferencias y eferencias informativas no se hallan separadas espacialmente (Meinertzhagen, 2010). Esto ocurre porque en estos animales las neuronas son, al menos en gran parte, unipolares, y las neuritas, o sea las prolongaciones neuronales, nacen como un único tronco que a poco se divide en una rama aferente y otra eferente, aunque ambos ramos poseen tanto sinapsis receptoras como emisoras de neurotransmisores, por lo que las diferencias entre axones y dendritas no siempre es tan clara. Además, en los cnidarios la misma sinapsis presenta vesículas capaces de liberar neurotransmisores a ambos lados de la hendidura sináptica, por lo que se dice que son bidireccionales (Garm et al., 2007; Matheson, 2002). Es necesario, empero, mencionar que, en los platelmintos, así como en otros grupos como nematodos o rotíferos, los músculos envían prolongaciones hacia las neuronas, estableciendo así las sinapsis. Como puede verse, es una situación del todo diferente a la observada en los vertebrados, artrópodos o anélidos, por ejemplo (Hartenstein, 2017). Al menos en los nematodos, sus miocitos consisten de tres porciones, el sarcómero contráctil, una región no contráctil donde se asienta el núcleo, y un brazo sináptico, que se dirige al cordón nervioso donde se establece la unión neuromuscular (Decraemer et al., 2013).
De la exposición anterior puede inferirse que el SN se habría desarrollado por primera vez en los cnidarios y/o ctenóforos. Los primeros son las medusas y las hidras, mientras los segundos abarcan a las nueces de mar, menos familiares. Ambos grupos son exclusivamente acuáticos, y si bien los primeros presentan formas marinas y dulceacuícolas, los segundos sólo son hallados en el mar. No está muy claro cuál fue el primer grupo en aparecer, y algunos datos sugieren que los ctenóforos habrían derivado incluso antes que las esponjas, lo que significaría que estas tuvieron un SN y lo perdieron, o que en los ctenóforos apareció un SN en forma independiente de los demás animales (Hejnol & Rentzsch, 2015). Este punto es de crucial importancia, porque estos animales han sido considerados bastante avanzados y de aparición posterior a las esponjas. Los ctenóforos son animales excepcionales, porque a pesar de ser bastante grandes (hasta dos metros) se pueden mover tanto por corrientes ciliares como por músculos. Su plan corporal es claramente más complejo que el de los poríferos, incluyendo su SN. No obstante, esto, los ctenóforos poseen pocos genes para dirigir la formación de su SN, que incluye órganos de los sentidos, mientras los poríferos y placozoos, ambos carentes de un SN, poseen mayor número de genes relacionados al SN, aunque, es bueno insistir, no lo presentan. De ahí lo crucial de esta discusión (Giribet & Edgecombe, 2020). Es bueno recordar que las esponjas pueden reaccionar al ambiente, cerrando o abriendo sus poros en forma coordinada ante cambios ambientales agresivos (Matheson, 2002) y que incluso sus larvas son móviles hasta que se asientan para originar al adulto, además de que pueden percibir la luz, entre otros estímulos (Leys et al., 2019).
Tipos De Sistemas Nerviosos
Cnidarios
Los cnidarios poseen neuronas de varias formas, unipolares, bipolares o multipolares que se comunican mediante sinapsis químicas o eléctricas, aunque su SN es difícil de observar con las técnicas usuales de microscopía óptica (Berzins et al., 2021). Las formas más complejas poseen mayormente neuronas bipolares, las que suelen formar redes nerviosas de conducción rápida. También puede existir un sistema de conducción lenta, formado por neuronas multipolares. Quizás la característica más exclusiva de este SN sea que sus sinapsis son bidireccionales, esto es, conducen el impulso en ambos sentidos, muy diferente de las sinapsis unidireccionales del resto de los animales, con la clásica imagen de la sinapsis conduciendo el mensaje desde el axón a la dendrita (Genzano et al., 2014). Sin embargo, también poseen sinapsis típicas, unidireccionales. En cualquier caso, las neuronas se disponen ya sea entre las células de la epidermis externa o la gastrodermis, al igual que las células sensoriales, lo que puede observarse en la figura 1. Las neuronas pueden establecer sinapsis entre ellas o con las células mioepiteliales, y pueden agruparse en zonas formando masas neuronales que según algunos autores habrían originado los órganos centralizados de los bilaterales (Hartenstein, 2017). El lector debe recordar que estos son animales diblásticos, y no poseerían músculos sino más bien células epitelio musculares, aunque este tópico, así como su origen es un punto de activa discusión (Seipel & Schmid, 2005; Steinmetz et al., 2012). Asimismo, si bien la clasificación en sistemas basiepiteliales, subepiteliales e invaginados es aplicado a los SNC (Hartenstein, 2017) de ser utilizado este criterio en estos animales probablemente el mismo sería un SN de tipo intraepitelial, en el que como fuera descripto antes, las neuronas se asientan por encima de la membrana basal (Hejnol & Rentzsch, 2015).
Por otro lado, los cnidarios poseen numerosos neuropéptidos que influyen en una multitud de fenómenos vitales, así como especializaciones sorprendentes como los nematocistos (cnidocitos urticantes), que son mecanorreceptores altamente diferenciados (Takahashi, 2020). Estas células disparan sus dardos a velocidades tan altas que están entre las más elevadas de todos los fenómenos biológicos, por lo que son energéticamente dispendiosos y deben ser bien regulados, lo que se logra gracias a la detección de señales no sólo mecánicas sino también químicas, para dar la respuesta más apropiada (Weir et al., 2020).
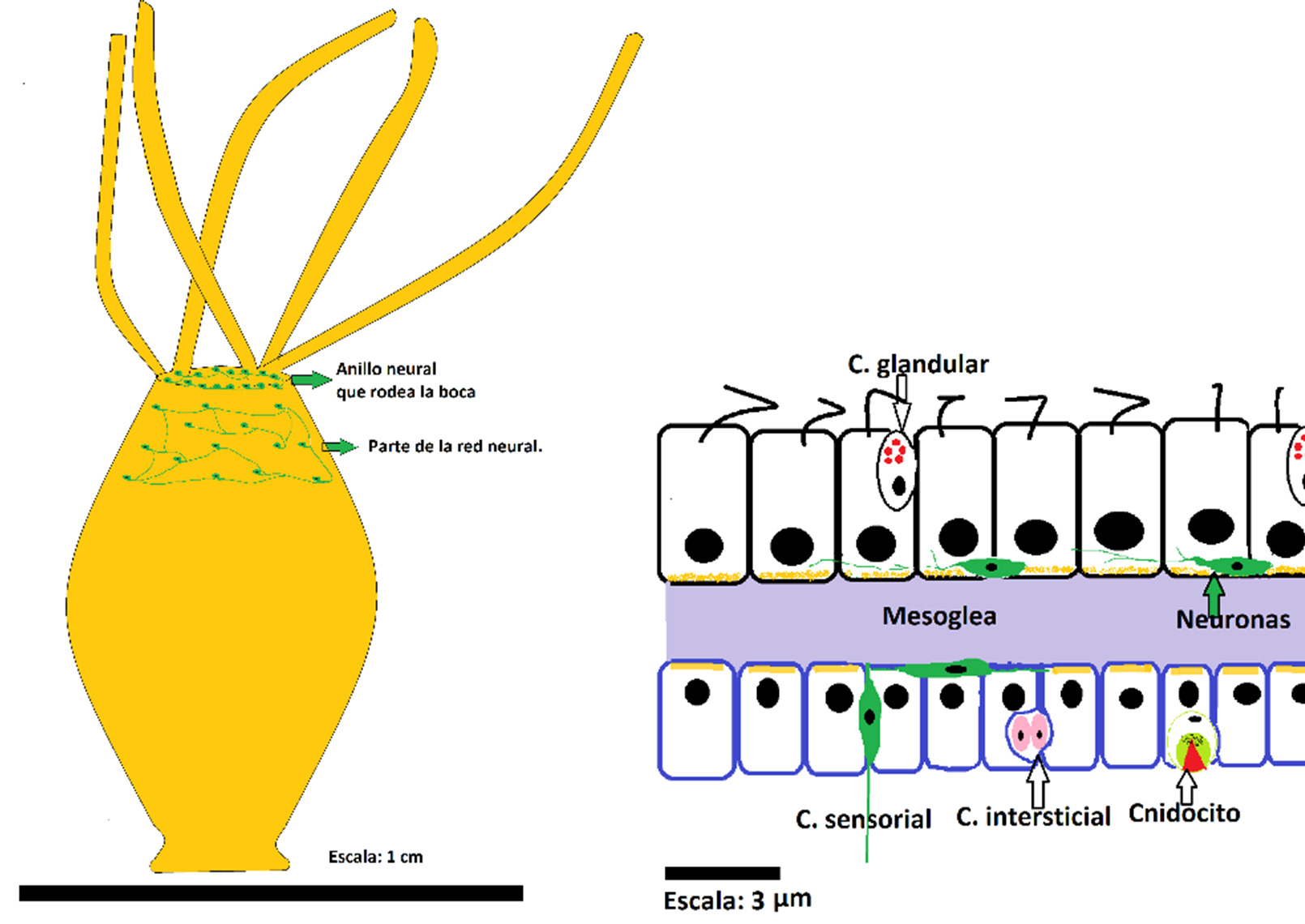
Figura 1: Se aprecia una hidra de agua dulce, con su sistema nervioso en red. En los cnidarios pueden hallarse concentraciones de neuronas, como las que rodean la boca, en la zona superior, y redes dispersas con neuronas no agregadas en ganglios, señalada en el dibujo como “red neural”. En el detalle, corte de la pared corporal donde se observan las neuronas y las células sensoriales entremezcladas entre los dos epitelios que conforman el cuerpo de este animal diblástico. En el detalle, el estrato celular superior es el endodermo que recubre el sistema digestivo, mientras el inferior es el ectodermo que limita con el exterior. Ambos esquemas no están en la misma escala. Y las neuronas del primero quizás estén algo exageradas para poderlas visualizar. Los colores no son realistas y fueron elegidos para destacar las estructuras. Ilustración: Sergio Urquiza (Inspirado en varias fuentes y observaciones in vivo).
Platelmintos
Estos animales engloban a las planarias marinas, de agua dulce y terrestres. Probablemente los primeros pasos hacia la centralización y cefalización fueron dados por los miembros de este grupo, cuyo SNC presenta numerosas similitudes morfológicas, ontogénicas y farmacológicas con el de los vertebrados. Por si fuera poco, pueden regenerar su sistema nervioso, incluso su cerebro en algunos casos, lo que impulsa el estudio de estos animales para poder entender y tratar varias dolencias humanas (Pagán, 2014). En ciertas especies el cerebro es muy complejo a pesar de lo cual se cree que podría ser similar al estado basal de los animales bilaterales, poseyendo hasta cinco agrupamientos ganglionares cefálicos. Es de destacar la gran cantidad de estructuras sensoriales que presentan, como ocelos, estatocistos, quimiorreceptores y mecanorreceptores (Roth, 2013) siendo uno de los animales bilaterales morfológicamente más simples, al menos en cuanto a la cantidad y desarrollo de los órganos y vísceras, salvo quizás los reproductivos.
En estos organismos existe un SNC con su cerebro anterior, del que emergen un conjunto de cuerdas nerviosas ventrales, pareadas y conectadas entre sí. Este agregado semeja un ortógono, denominación con la que se conoce al SN de los platelmintos. Las cuerdas nerviosas, que frecuentemente son más de dos (Schmidt-Rhaesa, 2007), pueden ser dorsales, laterales y ventrales, si bien las ventrales suelen ser las más conspicuas (Giribet & Edgecombe, 2020). Las neuronas acostumbran a entremezclarse con los músculos, una característica inusual, mientras que en la faringe parece residir un conjunto neuronal bastante independiente del resto, algo similar a lo visto en el SNAEn (sistema nervioso autónomo entérico) de los mamíferos (Pagán, 2014).
Las neuronas cerebrales poseen un conjunto de neurotransmisores muy variado, lo que prueba la complejidad de este SN (Pagán, 2014). Este filo anteriormente incluía a los nemertodermátidos y acelos, vermes acuáticos extremadamente simples y que actualmente se los considera en la base de la evolución de los bilaterales. Otro animal afín a estos últimos es Xenoturbella, el que, igual que los dos grupos nombrados anteriormente, posee un sistema nervioso basiepitelial, incluyendo un cerebro. En algunos de estos, como ciertos acelomorfos, no existe una típica membrana basal separando al epitelio del músculo subyacente (Giribet & Edgedombe, 2020). Los tres taxones suelen incluirse en el filo Xenacoelomorpha, presentan un sistema nervioso muy variable y aunque sus relaciones filogenéticas son inestables y muy discutidas suelen ubicarse en la base de la evolución de los bilaterales (Martínez & Hartenstein, 2017) por lo que son de sumo interés en el estudio de la evolución inicial del SN.
Anélidos
Los anélidos son animales con una gran disparidad morfológica, aunque a simple vista pueden parecer muy similares. Los hay marinos (la mayoría), y dulceacuícolas y terrestres (Brusca et al., 2018). En la mayor parte del filo los SN son subepidérmicos, aunque la condición basiepidérmica, que sería el bauplan basal (Purschke, 2016) es hallada en algunos grupos como en los magelónidos y los owénidos (Beckers et al., 2019). El SNC consta de un cerebro anterior, un anillo subesofágico y la cuerda ventral de ganglios pareados vinculados por conectores transversales y por ramos longitudinales entre los ganglios anteriores y posteriores (Molnár et al., 2021). Este modelo, clásicamente conocido como “collar de perlas” y atribuido a este y otros filos en los manuales no parece ser exactamente el más representativo y hace unos años ha comenzado a ser revisado, ya que sólo es hallado en los hirudíneos (sanguijuelas), un grupo muy derivado, y es muy difícil utilizarlo como modelo del cual se habrían originado los demás SNC de los otros miembros del filo (Purschke, 2016). El SN, en principio en la mayoría de los animales, es un sistema de órganos bastante conservado y ha sido analizado, al menos en el antiguo taxón de los “poliquetos” (vermes marinos) para esclarecer ciertas relaciones filogenéticas a nivel de familias. Justamente por ser dicho taxón el que contendría a los “oligoquetos” (lombrices de tierra) es lógico esperar que presentara los casos más basales. Es así que entre ellos se presentan los citados ejemplos de SN basiepidérmicos, que sería incluso una plesiomorfía de los bilaterados. Vale aclarar que las cuerdas nerviosas, si bien pueden ser ganglionadas, esto es, con los somas reunidos en grupos discretos, también pueden ser meduladas, que sería la condición ancestral y ocurre cuando los somas se disponen en forma continua a lo largo del cordón nervioso (Orrhage & Müller, 2005). Los conocidos axones gigantes, envueltos en las reacciones de huida, son hallados en buena parte del filo. El cerebro, en tanto, generalmente se halla en el prostomio, la región más anterior de la cabeza, aunque en los clitelados (lombrices de tierra, por ejemplo), puede encontrarse hasta en el tercer segmento. El cerebro de los anélidos basales no parece estar regionalizado, aunque en los Errantia, que incluye a buena parte de los que antes se conocían como poliquetos, el mismo se halla formado por tres zonas, anterior, media y posterior (Giribet & Edgecombe, 2020). De todas maneras, la regionalización del cerebro no parece reflejar una condición segmentaria, sino más bien una especialización morfofuncional y los Errantia, nuevamente, parecen exhibir una mayor organización de su neurópilo y somas neuronales. En estos últimos puede existir también un sistema estomatogástrico que inerva al sistema digestivo. El mismo se origina en diferentes puntos del cerebro o del conectivo circumesofágico, según el grupo, y se encuentra particularmente bien desarrollado en la faringe, donde cuenta con numerosos elementos sensitivos y motores. El número de nervios es, como su origen, muy variable, y generalmente son pares, pudiendo formar una comisura bucal (Purschke, 2016).
Generalmente es pasado por alto que los SN diferentes al de los vertebrados, también poseen neuroglias y capas de tejido conectivo, a veces muy desarrolladas. En estos animales el sistema nervioso se halla rodeado por tres capas protectoras: una interna epitelial, que corresponde al límite celómico; una media, conformada por miocitos; y una interna, compuesta por fibras, que puede penetrar incluso en el neurópilo (Molnár et al., 2021). El cerebro puede ser basiepidérmico o subepidérmico y en general no hay indicios de segmentación, salvo en los hirudíneos, muy derivados, y en los que no habría vestigios del equivalente al cerebro, aunque si existe un ganglio que es el resultado de la fusión de varios ganglios segmentarios. En los anélidos en general el cerebro puede presentar agrupaciones superficiales y diferenciadas de somas, o los mismos pueden disponerse periféricamente formando una capa, que casi nunca es continua, alrededor del neurópilo. Estos grupos a veces han sido llamados ganglios, término desaconsejado porque en verdad sólo son grupos discretos de neuronas, aunque en ocasiones incluso tienen una envoltura glial diferenciada de su contorno. En muchos casos el cerebro se ha simplificado por la pérdida de estructuras sensoriales cefálicas como el órgano nucal, como se observa en los clitelados. Asimismo, puede ser bastante simple en taxones basales, así como en los Sedentaria, donde puede verse incluso cierta constitución en forma de anillo nervioso. Al contrario, en los anfinómidos y Errantia el ganglio cerebral puede ser bastante complejo al punto de poder ser subdividido, como fuera dicho antes, en cerebro anterior, medio y posterior. Aunque no siempre es fácil decidir si es simple originalmente o simplificado secundariamente. Más allá de esto, en varios taxones, como los nereididos, los grupos neuronales discretos pueden ser bastante numerosos, con hasta 26 conjuntos, la mayoría de ellos pareados, aunque existen unos cuantos impares y únicos. Empero, aún faltan análisis estructurales más detallados para determinar la homología de estos conjuntos neuronales, uno de cuyos ejemplos más conspicuos son los cuerpos pedunculados (Purschke, 2016), aunque su distribución taxonómica no parece seguir un patrón muy claro (Giribet & Edgecombe, 2020).
Artrópodos e insectos
Los artrópodos son un taxón hiperdiverso que exhiben una clara segmentación no sólo en su cuerpo sino también en su SN, donde el cordón nervioso ventral suele ser único y ganglionado. Con todo, estos ganglios pueden fusionarse en una o unas pocas masas neuronales ventrales y torácicas, por ejemplo, en los dípteros. Los somas se asientan principalmente en la superficie ventral de los ganglios, dando origen a las neuritas primarias, que a su vez generan las dendritas y los axones conformando el neurópilo al interior ganglionar. En este, y en forma análoga a lo que ocurre en los vertebrados, existe cierta regionalización, ya que las prolongaciones sensitivas son ventrales y las motoras dorsales (situación opuesta a los vertebrados). Asimismo, las neuritas sensitivas se agrupan según la modalidad sensorial asociada a ellas (Loesel et al., 2013).
Los insectos, particularmente, pueden presentar las áreas presinápticas y postsinápticas distribuidas en distintos puntos, aunque también pueden asentarse en la misma neurita. Existe una capa neuroglial de diferente magnitud, así como estratos de tejido conectivo, e incluso una barrera neuro hemolinfática, todo lo cual atestigua el nivel de complejidad estructural que han desarrollado. El cerebro de los insectos consiste en la reunión de varios ganglios y consta de tres porciones, el protocerebro, el deutocerebro y el tritocerebro, formados principalmente por neuronas de asociación vinculadas a los órganos de los sentidos, sean cefálicos o corporales. Sin embargo, existen unas pocas neuronas motoras destinadas a las antenas. Ubicado ventralmente y unido por ambos flancos al cerebro se halla el ganglio subesofágico, al que continúa el cordón nervioso
ventral. El protocerebro posee tres importantes centros nerviosos: los lóbulos ópticos; el complejo central y los cuerpos pedunculados, destinados al procesamiento visual y a la regulación del patrón motor. El deutocerebro se vincula a las antenas, que son los órganos de la olfacción, a quienes destinan un neurópilo especializado, el glomérulo. Finalmente se encuentra el tritocerebro, que inerva diversas zonas de la boca y al sistema estomatogástrico, implicado en la regulación del sistema digestivo (Rogers, 2013; Nation, 2016). En la página siguiente puede apreciarse en la figura 2 un esquema que ilustra a grandes rasgos el SNC de un insecto.
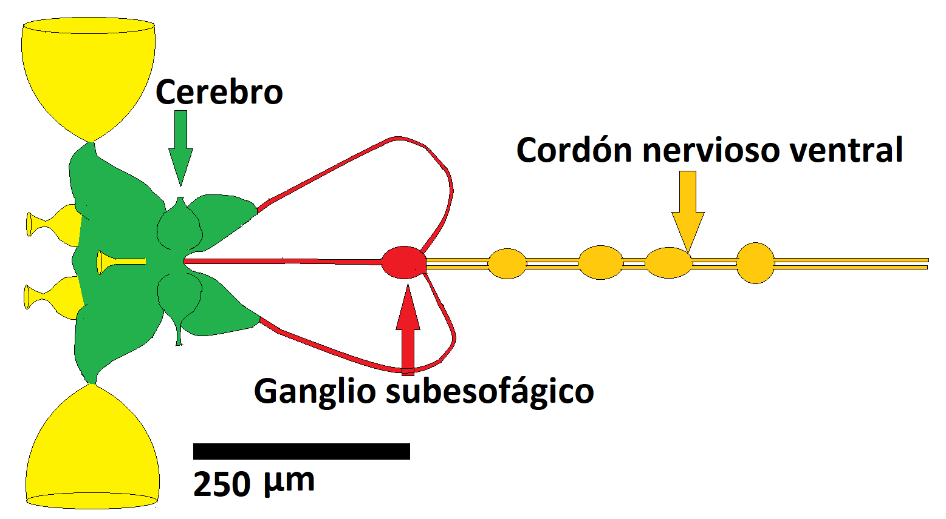
Figura. 2. Esquema general del SNC de un insecto. Puede apreciarse como grandes masas amarillas los ganglios ópticos asociados a los ojos. Hacia posterior (a la derecha del lector) se observan en color naranja la cuerda nerviosa ventral, con espesamientos periódicos que son los ganglios. Se muestran apenas tres por una cuestión de simplicidad. En rojo, y uniendo al cerebro y a la cuerda ventral, se halla el ganglio subesofágico. En drosófila, una pequeña mosca, cada hemisferio mide unas 250 μm. En las figuras 2, 3 y 4 las dimensiones son similares.
A pesar de la amplia disparidad que este sistema pueda exhibir a simple vista entre los artrópodos y los vertebrados, ya en el siglo XIX se había propuesto que los SNC de ambos taxones eran equivalentes, aunque invertidos en sentido dorso ventral, o sea, que la cuerda nerviosa ventral de un insecto sería equivalente a la médula espinal de los vertebrados. Aunque desechada en su momento, últimamente esta propuesta ha recibido mucho apoyo experimental ya que ambos grupos poseen la expresión de los genes que determinan la formación del tejido nervioso embrionario invertido uno respecto del otro, razón que explica la disposición espacial contrapuesta de sus SNC. Incluso, sorprendentemente, insectos como Drosófila y los mamíferos comparten una regionalización somatosensorial en sus SNC (Tsubouchi et al., 2017). Por otro lado, según algunos estudios, el desarrollo de la cuerda ventral como una cadena ganglionar se habría dado por la condensación de las neuronas en conjuntos ganglionares discretos en forma gradual en el linaje de los artrópodos, o quizás entre los ancestros de los tardígrados y los artrópodos, ya que los onicóforos no la presentan (Martin et al., 2017). Sin embargo, no puede descartarse que el cordón nervioso haya sido primitivamente ganglionado, y se haya simplificado secundariamente en los onicóforos (Mayer, 2016). Por otro lado, el que los artrópodos poseen un cerebro muy avanzado queda evidenciado porque les permite migrar distancias considerables, desarrollar la eusocialidad, reconocer a individuos conespecíficos y recordar si sus encuentros fueron positivos o negativos, entre un largo etc. Sin embargo, hay que decir que para hacer esto el cerebro parece que no debe ser necesariamente muy grande. Así, en algunos casos ciertos circuitos neurales relativamente pequeños bastan para que el animal pueda exhibir varias conductas muy interesantes relacionadas a la alimentación o a la interacción con el ambiente, como se observa en las larvas actuales o en los colémbolos. Esto también se apoya en ciertas inferencias del registro fósil, donde pueden detectarse ciertas conductas bastante elaboradas, ya desde la misma base evolutiva de los artrópodos, lo que podría haberse logrado con centros cerebrales superiores relativamente pequeños. En este sentido, se considera que cada uno de los clados que conforman a este filo presenta un patrón estructural del SN bastante conservado y característico de los mismos, a pesar de la limitada cantidad de elementos que los conforman. Por otro lado, y a pesar que la fosilización de estos restos es muy improbable y lo que se ha hallado es muy discutido, todo parece indicar que ya hace 518 millones de años, en el cámbrico inferior, el SNC de los artrópodos se hallaba diferenciado en un cerebro y una cuerda ventral. En la actualidad, se considera que los panartrópodos (artrópodos más onicóforos y tardígrados) poseen al menos dos neurópilos en común: el complejo central y los cuerpos pedunculados. Incluso se ha propuesto la correspondencia entre el cerebro de los cuatro clados actuales de artrópodos con diversos grupos fósiles cámbricos, como megacheira y otros taxones (Strausfeld, 2018).
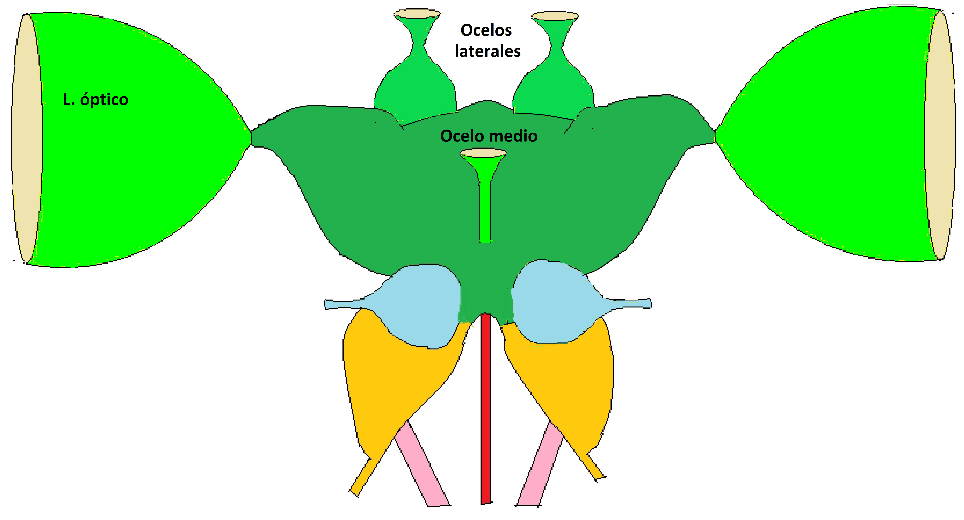
Figura. 3. Esquema del cerebro de un insecto en el que se aprecian las regiones principales. En tonos verdes el protocerebro, en celeste el deutocerebro, y en naranja el tritocerebro. Los cordones rosados y rojos son cordones nerviosos. Los lóbulos ópticos se vinculan en sus extremos externos con los ojos compuestos laterales, que se representan en un color beige. En el protocerebro se hallan los neurópilos cerebrales superiores, cuyo detalle se observan en la figura 3.
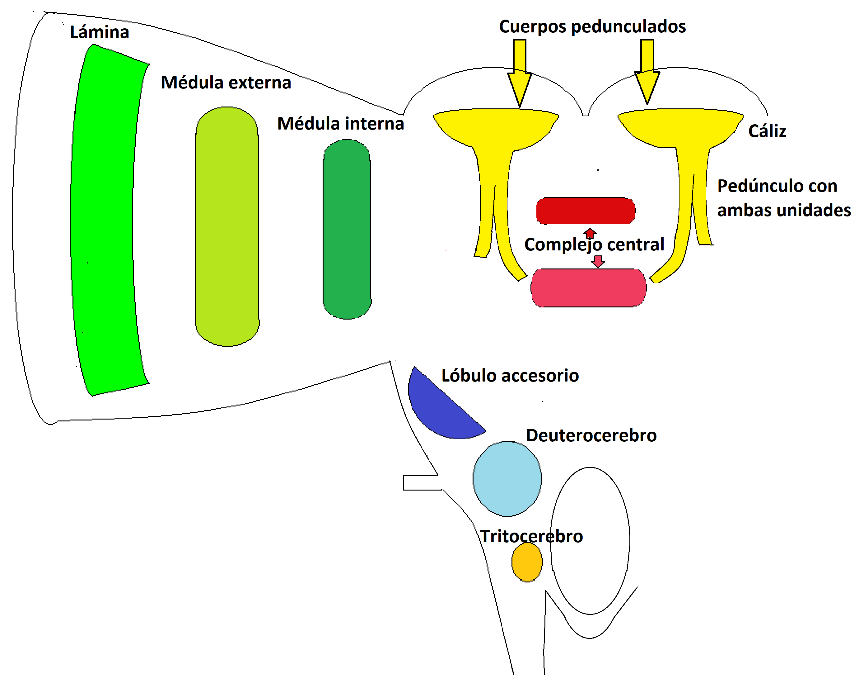
Figura. 4. Corte esquemático del cerebro de un insecto mostrando diversos neurópilos. Aproximadamente como si se hubiera seccionado la figura anterior en forma frontal. En tonos verdes, marrones, y amarillos los pertenecientes al protocerebro. Estos son, el lóbulo óptico, en tonos verdes; los cuerpos pedunculados, en amarillo, y el complejo central, en dos tonos de rojo. Se muestran los de ambos lados a fin de apreciar las relaciones topográficas. Abajo, pequeño y celeste se aprecia al deuterocerebro y en naranja el tritocerebro. El lóbulo accesorio se coloreó en azul.
El complejo central es un neurópilo ubicado en la línea media que consta de cuatro grupos neuronales. Uno, el cuerpo central, se ubica ventral y anteriormente en el protocerebro, y consiste de dos porciones, una superior y una inferior. Otra porción es el puente protocerebral, ubicado dorsal y posteriormente al anterior. Salvo en los apterigotas, existen aún otras porciones, los nódulos, que se vinculan desde la zona ventral al cuerpo central. También se pueden encontrar zonas equivalentes al complejo central en otros artrópodos, aunque sus relaciones evolutivas son muy discutidas. El puente se compone de unas ocho hileras de neuronas en cada hemisferio, las que pueden estar más o menos fusionadas en la línea media. Adopta una forma de barra alargada y algo arqueada. El cuerpo central también consiste de hileras de neuronas, generalmente cuatro a cada lado. Las neuronas de los nódulos, empero, no siguen esta disposición columnar (Pfeiffer & Homberg, 2014). Se cree que el complejo central sería homólogo en los panartrópodos, aunque en los crustáceos ha derivado mucho respecto del plan basal. Además, si bien ha alcanzado un notable desarrollo en los estomatópodos (mantis marinas) y en los hexápodos y su base sería heredada del plan básico ancestral, la complejidad de cada uno se habría alcanzado en forma independiente (Strausfeld, 2018). Por otro lado, probablemente el complejo central y los ganglios basales de los vertebrados representen un caso de homología profunda, y signifique que en la base misma de la evolución de los bilaterales ya existían complejos cerebrales que les permitían efectuar varias conductas complejas (Strausfeld & Hirth, 2013).
Los cuerpos pedunculados, otro importante centro de asociación, son hallados en todos los hexápodos, salvo los arqueognatos, grupo hermano a todos los insectos, carencia que ha llevado a creer que estos neurópilos serían exclusivos de los insectos, y que su parecido a estructuras similares encontradas en otros taxones de artrópodos sería una convergencia (Strausfeld, 2018). Así es que entre dichos grupos se hallan cuerpos pedunculados en los onicóforos (Mayer 2016), quelicerados (Sinakevitch et al., 2020) y crustáceos (Harzsch & Krieger, 2021; Maza et al., 2021). Hay que resaltar, sin embargo, que se ha discutido su presencia en las arañas (Foelix, 2011) y en los crustáceos, siendo en estos últimos que el cuerpo hemielipsoide, largamente sospechado como su homólogo en los crustáceos, correspondería a dicho elemento (Harzsch & Krieger, 2021). Respecto a los miriápodos, de acuerdo a Sombke & Rosemberg (2016) existen cuerpos pedunculados tanto en los quilópodos como en los diplópodos, aunque en Sombke et al. (2011) se afirma que no hay certeza acerca de si los neurópilos que reciben dicho nombre en los quilópodos serían homólogos al de los hexápodos. Más allá de los desacuerdos entre los científicos y de las profundas divergencias en la estructura de estos neurópilos, para ciertos autores, los cuerpos pedunculados de todos los artrópodos serían homólogos, así como también lo serían con los de otros filos (Wolf & Strausfeld, 2015). Estas regiones cerebrales son las estructuras nerviosas más estudiadas de los insectos (Strausfeld, 2018) y se trata de dos núcleos nerviosos muy desarrollados, pero de tamaño muy dispar según el taxón, ya que en drosófila sólo lo forman el 4 % del total de las neuronas, en tanto este porcentaje trepa hasta un 40% en Apis mellifera (Groh & Rössler, 2020). Son considerados el centro nervioso superior de integración, y al menos funcionalmente, equivalentes a la corteza de los mamíferos (Lefebvre et al., 2007). Incluso, aunque en diferentes momentos, se ha postulado que existiría homología entre estos neurópilos con al menos tres estructuras de los vertebrados: el cerebelo, el hipocampo o la corteza piriforme, según diferentes autores (Campbell & Turner, 2010). Asimismo, se discute intensamente su existencia y homología en otros artrópodos e invertebrados como los anélidos (Heuer & Loesel 2009) aunque no parecen existir en los moluscos (Faller et al., 2012). En los insectos los cuerpos pedunculados se hallan formados por neuronas intrínsecas muy pequeñas, llamadas células de Kenyon que exhiben un alto nivel de organización. Estas células emiten sus dendritas formando una lámina ordenada dispuesta horizontalmente y que en conjunto componen una gran estructura: el cáliz. Los axones, en tanto, forman un ramillete también muy ordenado que forma el pedúnculo, el que puede hallarse dividido en diferentes lóbulos. Las dendritas son el centro de recepción de aferencias sensoriales originadas en otras zonas del cerebro, y los axones, a su vez, envían su flujo informativo hacia neuronas eferentes ubicadas en el protocerebro (Strausfeld et al., 1998). Aunque la fuente principal de información proviene de los lóbulos antenales y por tanto son aferencias olfatorias, esta no es su única función (Loesel et al., 2013).
Moluscos
Este filo presenta una amplia disparidad anatómica y ecológica, como puede inferirse al comparar una almeja y un pulpo. Hay animales con un arreglo estructural muy basal y similar al de los platelmintos, como los aplacóforos y poliplacóforos, que presentarían incluso una red nerviosa periférica de tipo difuso y no parecen poseer sentidos muy avanzados, y otros animales con un patrón divergente (Hartenstein, 2017), como los pulpos. Los últimos son considerados los animales invertebrados más inteligentes, equivalentes a ciertos vertebrados, aunque su cerebro es, relativamente, más simple (Gutnick et al., 2017), si bien presentan un patrón de órganos sensoriales exquisito, cuya información es procesada periféricamente, por lo que las respuestas son muy veloces.
En los moluscos el SN más simple siempre se creyó que podría encontrarse en los poliplacóforos, un grupo basal, y en el cual no se ha identificado por mucho tiempo agrupaciones neuronales, por lo que no poseerían ni ganglios ni cerebro. En un reciente estudio, sin embargo, esta visión ha sido discutida (Sumner‐Rooney & Sigwart, 2018). Más allá de esto, en general el SNC de la mayoría de los miembros del filo está conformado por una serie de ganglios pareados y dispuestos a lo largo del cuerpo, de alguna manera, podría decirse, dispersos en el mismo: el par cerebral, el pedal, el pleural y el bucal. A veces puede hallarse un par visceral. En ciertos casos los ganglios se unen formando un anillo circumbucal o circumesofágico. La contraparte periférica está formada por nervios destinados a la musculatura voluntaria, así como de una sección autonómica. Vinculan a las regiones corporales anteriores con las posteriores uno o dos pares de cordones nerviosos amielínicos y muy variables según el taxón. El cerebro de los cefalópodos, por su parte, consiste de varias masas nerviosas, divididas en una serie de lóbulos, los que resultan de la fusión de un numeroso grupo de neuronas reunidas en ganglios. Es así que puede dividirse en las mencionadas porciones supraesofágica y subesofágica, ambas vinculadas por los lados por ciertos lóbulos. En Octopus, unas de las más conspicuas de las citadas masas es la zona central del cerebro, en la que reside el lóbulo vertical (Fig. 6). De todas maneras, el SN es algo variable entre los diferentes cefalópodos (Ponder et al., 2019). En cuanto al origen de este sorprendente órgano nervioso, según Mather& Kuba (2013), y citando a Young (1971), las masas nerviosas de los pulpos y calamares no se habrían generado por el aumento de tamaño de los ganglios primitivos, sino por el agrandamiento y posterior fusión de una cuerda nerviosa entérica similar a la hallada en los anfineuros, moluscos basales del tipo de los poliplacóforos, mencionados más arriba. Estos serían cordones nerviosos medulados, no ganglionados y el secreto del aumento del tamaño del cerebro de los pulpos podría residir en una neurogénesis aumentada, similar a la vista en la corteza de los mamíferos (Deryckere & Seuntjens, 2018). De todas formas, el SN de los cefalópodos como grupo no es tan homogéneo. Por ejemplo, los calamares, al nadar activamente y ser pelágicos disponen del sistema del axón gigante para reaccionar rápidamente, mientras los pulpos, casi siempre bentónicos no lo poseen (Budelmann, 1995). Este tipo de respuestas de huida, explosivas, también pueden verse en los vertebrados, en los que se halla mediada por las células de Mauthner (Shigeno et al., 2018). Asimismo, recuerde el lector que también los anélidos poseen axones gigantes a los flancos de los cordones nerviosos, que podrían ser comparados con los sistemas mencionados. A continuación, en la figura 5 puede verse la disposición general del SNC de un pulpo, y luego un detalle de su cerebro, en el que sobresalen los lóbulos ópticos.<
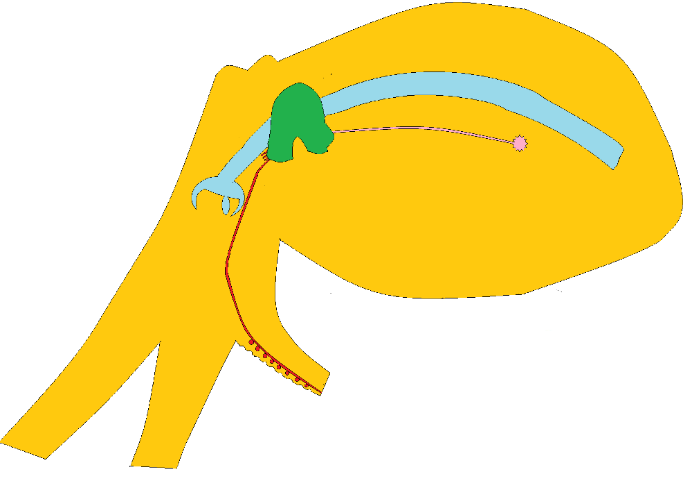
Figura 5. Imagen esquemática de un pulpo exhibiendo el arreglo corporal general. En verde: cerebro; celeste: tubo digestivo; rosado: nervio y ganglio estrellado; rojo: nervios braquiales. Conectado a uno de estos, en uno de los brazos, se pueden ver esferas rojas representando a los ganglios de las ventosas. El tamaño de los pulpos varía bastante de acuerdo a la especie, pero en principio este esquema representaría una tercera parte de un Octopus minor.
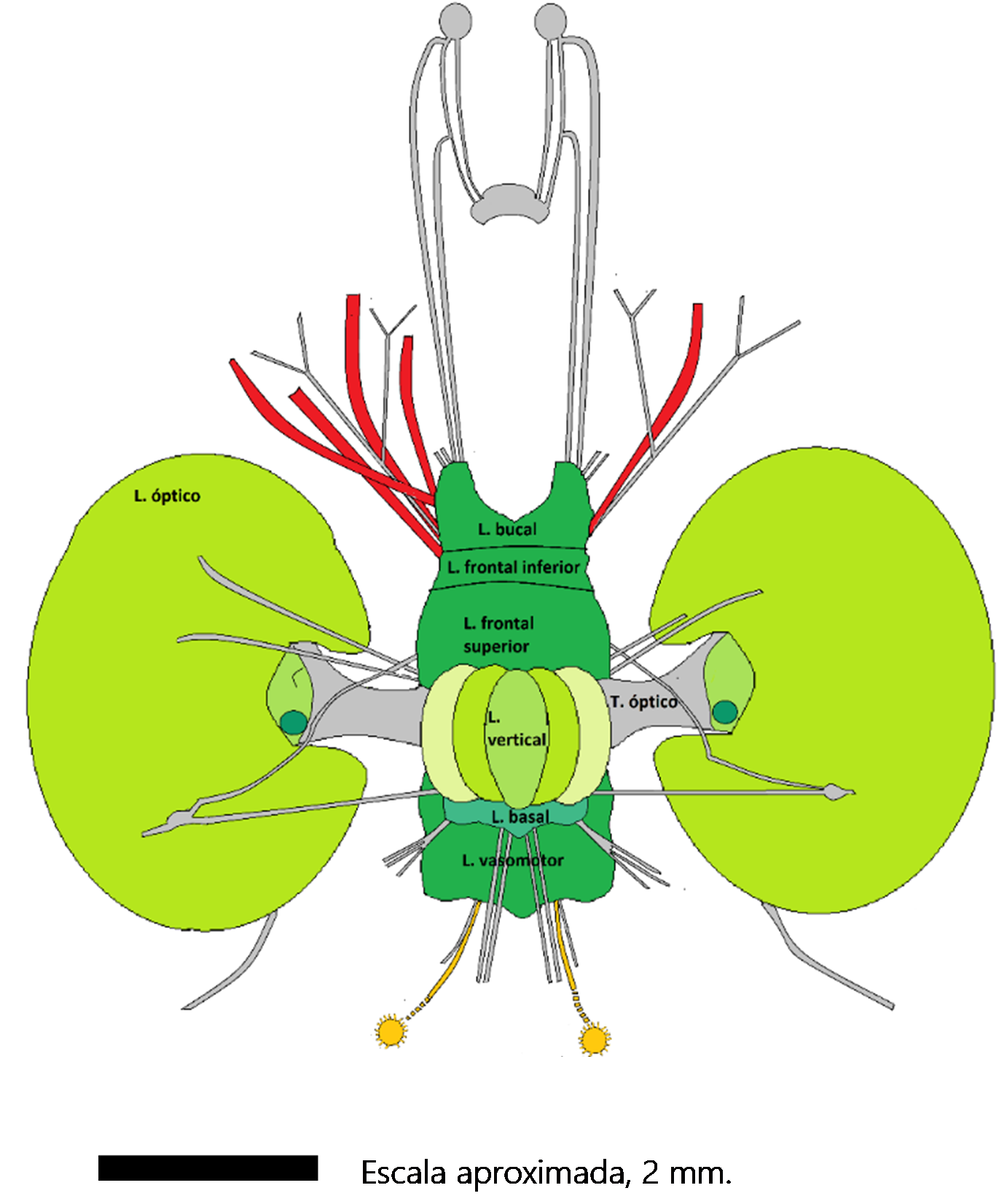
Figura 6. Esquema del cerebro de un pulpo. Vista dorsal. De la parte superior del dibujo emergen los nervios braquiales, en rojo, cuatro de cada lado, aunque no se muestran todos. Se dirigen hacia anterior. Los cordones grises son otros nervios. Las masas de tonos verdes son los diversos lóbulos cerebrales. En naranja, en la zona inferior, se aprecian los ganglios estrellados, ubicados en la región posterior del cuerpo. La región media del cerebro se asienta en una caja cartilaginosa, por fuera de la que se hallan los lóbulos ópticos. Abreviaturas. L: lóbulo; T. tracto. Aunque el esquema se basa en Octopus vulgaris, la escala se basa en Octopus minor, una especie de la que hace poco se hizo un atlas de su cerebro.
Las neuronas de los cefalópodos son unipolares, como en la mayoría de los demás invertebrados, y tanto las destinadas al área sensorial como a la motora se dispondrían en diferentes niveles jerárquicos. Así, en la masa supraesofágica se hallarían los centros motores de mayor jerarquía mientras en la subesofágica se encontrarían los centros motores de nivel inferior, o sea, aquellos que contienen a las motoneuronas que inervan a los músculos. Estos animales poseen dos sistemas de aprendizaje y memoria diferentes, el visual y el quimiotáctil. El primero se asienta en la zona más dorsal del cerebro en el lóbulo vertical y en el frontal superior, y se vincula a la memoria a largo plazo, y están formados por tres tipos de neuronas, todas unipolares. Existe, además una estrecha coincidencia funcional y estructural entre estas regiones y el hipocampo de los mamíferos. El segundo sistema, el quimiotáctil, está conformado principalmente por el lóbulo frontal mediano inferior y por el subfrontal, y guarda estrecha similitud con los anteriores (Gutnick et al., 2017).
A diferencia de lo que ocurre con los insectos y los vertebrados, los cefalópodos no parecen presentar una configuración somatotópica en su SNC, aunque hay algunos datos que hacen creer que su anillo subesofágico podría tenerla. En la masa subesofágica existe cierta organización dorso ventral, por lo que la zona dorsal del cerebro se relaciona con la cavidad paleal mientras la ventral con los brazos, aunque no ha podido efectuarse una clara correspondencia con la segregación entre las astas dorsales sensoriales y ventrales motoras como puede observarse en los vertebrados (Shigeno et al., 2018). La razón de esta carencia probablemente sea debida a que este tipo de control no sería eficiente en un animal sin una estructura corporal fija respecto al ambiente, salvo la cabeza, y quizás las aferencias de los brazos sirvan para configurar algún tipo de representación espacial (Hochner, 2013). De hecho, la corporeidad en un animal de cuerpo blando y extremadamente flexible se alcanza de diferente manera a la que puede observarse en los insectos o vertebrados, con sus esqueletos rígidos (Nesher et al., 2020). Es más, ha existido bastante discusión en torno a si el SN de cada brazo es parte del SNC (equivalente a la médula de los vertebrados) o del SNP (equivalente a los nervios periféricos) (Shigeno et al., 2018). Otro punto de sumo interés es la presencia de tejidos y órganos neurosecretores. Se han encontrado varios tejidos que podrían cumplir este rol, equivalentes al hipotálamo de los vertebrados, aunque se desconoce su filogenia entre los moluscos. Estos son la glándula óptica y el lóbulo sub pedunculado, ambos asociados al cerebro y vinculados a la reproducción (Shigeno et al., 2018).
Estos últimos autores han propuesto dos lóbulos, el dorsal basal y el sub vertical como equivalentes al tálamo de los vertebrados, ya que reciben aferencias de multitud de centros nerviosos del cuerpo, y actuarían como una estación de relevo intermedia hacia los centros nerviosos de los lóbulos frontal y vertical. Para finalizar, y aunque no es posible aún hablar de homología, se cree que también existe al menos cierta correspondencia entre los ganglios basales de los vertebrados y el lóbulo basal de los cefalópodos, el complejo central de los insectos y el neurópilo central de los anélidos, entre otros animales (Shigeno et al., 2018).
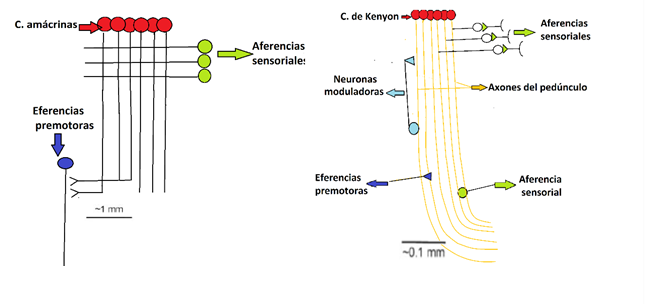
Figura 7. En esta imagen pueden observarse ciertas coincidencias estructurales en la conformación del lóbulo vertical de los pulpos (izquierda) y el cuerpo pedunculado de los insectos (derecha). Los CP exhiben una estructura básica que consiste de numerosas interneuronas intrínsecas que exhiben prolongaciones paralelas y rectilíneas conformando un ortógono, que se vinculan a neuronas aferentes sensoriales. Presentan también circuitos de retroalimentación, así como vínculos moduladores y finalmente emiten sus prolongaciones eferentes. En los pulpos también existen estos elementos. Las estructuras equivalentes se han coloreado de forma similar (El circuito del LV. redibujado de Hochner (2010); el circuito del CP. redibujado desde Wollf & Srausfeld (2015)).
2. CONCLUSIONES
¿Cuándo y en que animal surgió el primer SN? Aún no puede responderse a este interrogante. Existe cierta evidencia de que las esponjas podrían haber tenido un SN que luego perdieron, (Ryan & Chiodin, 2015) lo que de ser cierto significaría, entre otras cosas, que el mismo podría haber sido muy complejo casi desde los inicios. Esto lleva a discutir cómo podría haber sido la apariencia del primer animal, bautizado como Urmetazoo, del que habrían derivado las esponjas, e incluso los ctenóforos. ¿Podría haber tenido algún tipo de sistema nervioso, o de integración, al menos muy básico? Es muy aventurado afirmar tal cosa, aunque si las esponjas contaron con un SN, y, como fuera discutido, los cnidarios y ctenóforos poseen uno bastante complejo, aunque son animales divergentes, parece probable que el Urbilateria, el putativo antecesor de todos los animales bilaterales, surgido luego de los anteriores, podría haber contado con un equipo sensorial y neural bastante desarrollado. De aquí que es tentador creer que los SNC de los bilaterados serían antiguos y homólogos. A pesar de lo dicho, como muchos de los grupos actuales son muy derivados y cuentan con un cuerpo muy complejo, como algunos taxones particulares de anélidos, artrópodos y moluscos, el SNC debe poseer necesariamente estructuras neurales muy desarrolladas para regular, por ejemplo, los movimientos. Esto es una condición que podría conducir a la aparición independiente de los SN, al menos en parte. Por esto, si estos son o no homólogos aún no es posible aseverarlo, porque podría ser el caso de que al menos se den ciertos casos de homología profunda, en parte desde la misma base de la evolución animal, y en parte de la época en que se produjo la dicotomía entre protostomados y deuterostomados.
3. CONFLICTO DE INTERESES
Ninguno.
4. AGRADECIMIENTO
El autor desea agradecer el inestimable aporte del Biólogo y doctorando Nicolás Ramírez, que se encuentra efectuando una adscripción a la cátedra, por la lectura del manuscrito original, así como por la ayuda en las ilustraciones del presente artículo.
5. REFERENCIAS BIBLIOGRÁFICAS
Almudí, I., & Pascual-Anaya, J. (2019). How do morphological novelties evolve? Novel approaches to define novel morphologies. Old Questions and Young Approaches to Animal Evolution, 107-132.
Arendt D. (2021). Elementary nervous systems. Philosopical Transactions of Royal Society B, 376: 20200347.
Arendt, D. (2008). The evolution of cell types in animals: emerging principles from molecular studies. Nature Reviews Genetics, 9 (11), 868-882.
Arnellos, A., & Keijzer, F. (2019). Bodily complexity: Integrated multicellular organizations for contraction-based motility. Frontiers in physiology, (10), 1-17.
Beckers, P., Helm, C., & Bartolomaeus, T. (2019). The anatomy and development of the nervous system in Magelonidae (Annelida)–insights into the evolution of the annelid brain. BMC evolutionary biology, 19(1), 1-21.
Berzins, I. K., Yanong, R. P., LaDouceur, E. E., & Peters, E. C. (2021). Cnidaria. En: LaDouceur E.B. (Ed.) Invertebrate Histology, 55-86. John Wiley & Sons, Inc.
Biserova, N. M., Gordeev, I. I., Korneva, J. V., & Salnikova, M. M. (2010). Structure of the glial cells in the nervous system of parasitic and free-living flatworms. Biology Bulletin, 37(3), 277-287.
Brunet, T. & Arendt, D. (2016). From damage response to action potentials: early evolution of neural and contractile modules in stem eukaryotes. Philosophical Transactions of the Royal Society B, 371 (1685),1-14.
Brunet, T.; Fischer, A. H.; Steinmetz, P. R.; Lauri, A.; Bertucci, P. & Arendt, D. 2016. The evolutionary origin of bilaterian smooth and striated myocytes. Elife, 5: e19607. DOI: 10.7554/eLife.19607
Brusca, R., Moore, W., Shuster, S. (2018). Invertebrados. 3a edição. Editora Guanabara-Koogan, Rio de Janeiro. 1010pp.
Budelmann, B. U. (1995). The cephalopod nervous system: what evolution has made of the molluscan design. En: Breidbach, O. & Kutsch, W. The nervous systems of invertebrates: An evolutionary and comparative approach, 115-138. Birkhäuser Basel.
Burkhardt, P., & Sprecher, S. G. (2017). Evolutionary origin of synapses and neurons–Bridging the gap. Bioessays, 39 (10),1700024.
Butler, A. B., & Hodos, W. (2005). Comparative vertebrate neuroanatomy: evolution and adaptation. John Wiley & Sons.
Campbell, R. A., & Turner, G. C. (2010). The mushroom body. Current Biology, 20(1),11-12.
Cole, A. G., Kaul, S., Jahnel, S. M., Steger, J., Zimmerman, B., Reischl, Richards, G., Rentzsch, F., Steimetz, P., & Technau, U. (2020). Muscle cell type diversification facilitated by extensive gene duplications. bioRxiv.
Decraemer, W., Coomans, A., & Baldwin, J. (2013). Morphology of Nematoda. En; Schmidt-Rhaesa, A. (Ed.) Nematoda (V.2), 1-60. De Gruyter.
Deryckere, A., & Seuntjens, E. (2018). The cephalopod large brain enigma: are conserved mechanisms of stem cell expansion the key? Frontiers in physiology, 9, 1160.
Faller, S., Rothe, B. H., Todt, C., Schmidt-Rhaesa, A., & Loesel, R. (2012). Comparative neuroanatomy of Caudofoveata, Solenogastres, Polyplacophora, and Scaphopoda (Mollusca) and its phylogenetic implications. Zoomorphology, 131(2), 149-170.
Foelix, R. F. (2011). Biology of spiders. Oxford University Press, New York.
Gabella G: Autonomic Nervous System (2001) Encyclopedia of life sciences, Macmillan Publishers Ltd, Nature Publishing Group.
Garm, A., Poussart, Y., Parkefelt, L., Ekström, P., & Nilsson, D. E. (2007). The ring nerve of the box jellyfish Tripedalia cystophora. Cell and tissue research, 329(1), 147-157.
Genzano, G. N., Schiariti, A., & Mianzan, H. W. (2014). Cnidaria. Los Invertebrados Marinos. Fundación Félix de Azara, Buenos Aires, 67-85.
Giribet, G., & Edgecombe, G. D. (2020). The invertebrate tree of life. Princeton University Press.
Groh, C., & Rössler, W. (2020). Analysis of synaptic microcircuits in the mushroom bodies of the honeybee. Insects, 11(1), 43.
Gutnick, T., Shomrat, T., Mather, J. A., & Kuba, M. J. (2017). The cephalopod brain: Motion control, learning, and cognition. En: Saleuddin, S., & Mukai, S. (Eds.). Physiology of Molluscs 137-177. Apple Academic.
Hartenstein, V. (2017). The central nervous system of invertebrates. En: Sheperd, S (Ed.) The Wiley Handbook of Evolutionary Neuroscience. 173-235.
Harzsch, S., & Krieger, J. (2021). Genealogical relationships of mushroom bodies, hemiellipsoid bodies, and their afferent pathways in the brains of Pancrustacea: Recent progress and open questions. Arthropod Structure & Development, 65, 101100.
Hejnol, A., & Rentzsch, F. (2015). Neural nets. Current Biology, 25(18), R782-R786.
Heuer, C. M., & Loesel, R. (2009). Three-dimensional reconstruction of mushroom body neuropils in the polychaete species Nereis diversicolor and Harmothoe areolata (Phyllodocida, Annelida). Zoomorphology, 128(3), 219-226.
Heuer, C. M., Müller, C. H., Todt, C., & Loesel, R. (2010). Comparative neuroanatomy suggests repeated reduction of neuroarchitectural complexity in Annelida. Frontiers in zoology, 7(1), 1-21.
Hochner, B. (2010). Functional and comparative assessments of the octopus learning and memory system. Front. Biosci., (2), 764-771.
Hochner, B. (2013). How nervous systems evolve in relation to their embodiment: what we can learn from octopuses and other molluscs. Brain Behav. Evol., (82),19–30. doi: 10.1159/000353419.
Keijzer, F., & Arnellos, A. (2017). The animal sensorimotor organization: a challenge for the environmental complexity thesis. Biology & philosophy, 32(3), 421-441.
Koizumi, O., Hamada, S., Minobe, S., Hamaguchi-Hamada, K., Kurumata-Shigeto, M., Nakamura, M., & Namikawa, H. (2015). The nerve ring in cnidarians: its presence and structure in hydrozoan medusae. Zoology, 118(2), 79-88.
Kristan Jr, W. B. (2016). Early evolution of neurons. Current Biology, 26(20), 949-954.
LaDouceur, E. (2021). Invertebrate Histology. John Wiley & Sons, Inc.
Lefebvre, L., Reader, S. M., & Boire, D. (2007). The evolution of encephalization. En: Kaas JH (ed): Evolution of Nervous Systems. New York, Academic Press, (1),121–141
Leon, A. (2019). ¿Cuándo apareció el sistema nervioso? Enfoque evolutivo en metazoos no vertebrados. REBIOL, 39(1), 50-55.
Loesel, R.; Wolf, H.; Kenning, M.; Harzsch, S. & Sombke, A. (2013). Architectural principles and evolution of the arthropod central nervous system. En: Minelli, A.; Boxshall, G. y Fusco, G. (eds.). Arthropod biology and evolution: molecules, development, morphology. Springer Science & Business Media.
Luo, L. (2016). Principles of neurobiology. Garland Science. United States of American.
Lüscher, C., & Petersen, C. (2013). The synapse. En: (Galizia C. G. y Lledo, P. M. Eds.). Neurosciences-From Molecule to Behavior: a university textbook. Springer Spektrum, Berlin, Heidelberg.
Martin, C., Gross, V., Hering, L., Tepper, B., Jahn, H., de Sena Oliveira, I., Stevenson, P. & Mayer, G. (2017). The nervous and visual systems of onychophorans and tardigrades: learning about arthropod evolution from their closest relatives. Journal of Comparative Physiology A, 203(8), 565-590.
Martín-Durán, J. M., Pang, K., Børve, A., Lê, H. S., Furu, A., Cannon, J. T., Jondelius, U. & Hejnol, A. (2018). Convergent evolution of bilaterian nerve cords. Nature, 553(7686), 45-50.
Martínez, P., Hartenstein, V., & Sprecher, S. G. (2017). Xenacoelomorpha nervous systems. En: Sherman, M. (Ed.) Oxford Research Encyclopedia of Neuroscience. Oxford University Press, USA.
Mather, J. A., & Kuba, M. J. (2013). The cephalopod specialties: complex nervous system, learning, and cognition. Canadian Journal of Zoology, 91(6), 431-449.
Matheson, T. (2002). Invertebrate nervous systems. Encyclopedia of life sciences, Macmillan Publishers Ltd, Nature Publishing Group.
Mayer, G. (2016). Onycophora. Structure and Evolution of Invertebrate Nervous Systems. En: Schmidt-Rhaesa, A., Harzsch, S. y Purschke, G. (Eds.). Oxford University Press.
Maza, F. J., Sztarker, J., Cozzarin, M. E., Lepore, M. G., & Delorenzi, A. (2021). A crabs' high‐order brain center resolved as a mushroom body‐like structure. Journal of Comparative Neurology, 529(3), 501-523.
Meinertzhagen, I. A. (2010). The organisation of invertebrate brains: cells, synapses and circuits. Acta Zoologica, 91 (1), 64-71.
Molnár, K., Kriska, G., & Lőw, P. (2021). Annelida. En: E.B. La Douceur (Ed.) Invertebrate Histology, 185-219. John Wiley & Sons, Inc.
Moroz, L. L. (2009). On the independent origins of complex brains and neurons. Brain, behavior and evolution, 74(3), 177-190.
Moroz, L. L., & Romanova, D. Y. (2021). Selective Advantages of Synapses in Evolution. Front. Cell Dev. Biol. 9: 726563.
Nation, J. L. (2016). Insect physiology and biochemistry. CRC press, Boca Raton.
Nesher, N., Levy, G., Zullo, L., & Hochner, B. (2020). Octopus Motor Control. En: Sherman, M. (Ed.) Oxford Research Encyclopedia of Neuroscience. Oxford University Press, USA.
Orrhage, L., & Müller, M. C. (2005). Morphology of the nervous system of Polychaeta (Annelida). Hydrobiologia, 535(1), 79-111.
Pagán, O. R. (2019). The brain: a concept in flux. Philosophical Transactions of the Royal Society B, 374(1774), 20180383.
Pannese. E. (2015). Neurocytology. Fine Structure of Neurons, Nerve Processes, and Neuroglial Cells. Springer International Publishing Switzerland.
Pfeiffer, K., & Homberg, U. (2014). Organization and functional roles of the central complex in the insect brain. Annual review of entomology, (59), 165-184.
Ponder, W. F., Lindberg, D. R., & Ponder, J. M. (2019). Biology and Evolution of the Mollusca. CRC Press.
Purschke (2016). Annelida. Basal groups and pleistoannelida. En: Schmidt-Rhaesa, A., Harzsch, S. & Purschke, G. (Eds.) Structure and Evolution of Invertebrate Nervous Systems. Oxford University Press, 254-312.
Riebli, N., & Reichert, H. (2016). The first nervous system. The Wiley Handbook of Evolutionary Neuroscience, 125-152.
Rieger R. & Ladurner P. (2003). The Significance of Muscle Cells for the Origin of Mesoderm in Bilateria. Integrative and comparative biology, (43), 47-54.
Rogers S. Nervous system (2013). En: Simpson S.J. & Douglas A.E. (Eds.) The Insects: Structure and Function (5th edition), Cambridge University Press.
Roth, G. (2013). The long evolution of brains and minds. New York: Springer.
Ryan, J. F., & Chiodin, M. (2015). Where is my mind? How sponges and placozoans may have lost neural cell types. Philosophical Transactions of the Royal Society B: Biological Sciences, 370(1684) 20150059.
Satterlie, R. A. (2011). Do jellyfish have central nervous systems? Journal of Experimental Biology, 214(8), 1215-1223.
Schmidt-Rhaesa, A. (2007). The evolution of organ systems. Oxford University Press.
Seipel, K., & Schmid, V. (2005). Evolution of striated muscle: jellyfish and the origin of triploblasty. Developmental biology, 282(1), 14-26.
Shigeno S, Andrews P.L.R, Ponte, G. & Fiorito, G (2018). Cephalopod Brains: An overview of Current Knowledge to Facilitate Comparison With Vertebrates. Front. Physiol. 9:952. doi: 10.3389/fphys.2018.00952
Shubin, N., Tabin, C., & Carroll, S. (2009). Deep homology and the origins of evolutionary novelty. Nature, 457(7231), 818-823.
Sinakevitch, I., Long, S. M., & Gronenberg, W. (2020). The central nervous system of whip spiders (Amblypygi): large mushroom bodies receive olfactory and visual input. Journal of Comparative Neurology, 529(7), 1642-1658.
Slater, M. H. (2013). Cell types as natural kinds. Biological Theory, 7 (2), 170-179.
Sombke, A. y Rosemberg, J. (2016) Myriapoda. Structure and Evolution of Invertebrate Nervous Systems. En: Schmidt-Rhaesa, A., Harzsch, S. y Purschke, G. (Eds.) Oxford University Press 2016.
Sombke, A., Rosenberg, J. & Hilken, G. (2011) Chilopoda – the nervous system En: Minelli, A. (Ed.) The myriapoda. A Treatise on zoology – anatomy, taxonomy, biology
Steinmetz, P. R., Kraus, J. E., Larroux, C., Hammel, J. U., Amon-Hassenzahl, A., Houliston, E., Wörheide, G., Nickel, M., Degnan, B., & Technau, U. (2012). Independent evolution of striated muscles in cnidarians and bilaterians. Nature, 487(7406), 231-234.
Strausfeld, N. J. (2018). The divergent evolution of arthropod brains: Ground pattern organization and stability through geological time. En: Byrne, J. H. (Ed.) The Oxford Handbook of Invertebrate Neurobiology New York, NY: Oxford University Press. 31-68.
Strausfeld, N. J., & Hirth, F. (2013). Deep homology of arthropod central complex and vertebrate basal ganglia. Science, 340(6129), 157-161.
Strausfeld, N. J., Hansen, L., Li, Y., Gomez, R. S., & Ito, K. (1998). Evolution, discovery, and interpretations of arthropod mushroom bodies. Learning & memory, 5(1), 11-37.
Sumner‐Rooney, L., & Sigwart, J. D. (2018). Do chitons have a brain? New evidence for diversity and complexity in the polyplacophoran central nervous system. Journal of morphology, 279(7), 936-949.
Takahashi, T. (2020). Comparative aspects of structure and function of Cnidarian neuropeptides. Frontiers in endocrinology, 11, 339.
Tsubouchi, A., Yano, T., Yokoyama, T., Murtin, C., Otsuna, H. & Ito, K. (2017). Topological and modality-specific representation of somatosensory information in the fly brain. Science, 358(6363), 615–623.
Urquiza, S. P. & Carezzano, F. J. (2018). Morfología Animal. Tomo I. Editorial Sima, Córdoba. 160 pp.
Urquiza, S. P. & Carezzano, F. J. (2019). Morfología Animal. Tomo II. Editorial Sima, Córdoba. 180 pp.
Urquiza-Bardone, S. P., & Carezzano, F. J. (2013). Las uniones celulares y la emergencia de los animales. The Biologist (Lima), 11(2).
Weir, K., Dupre, C., van Giesen, L., Lee, A. S., & Bellono, N. W. (2020). A molecular filter for the cnidarian stinging response. Elife, 9, e57578.
Wolff, G. H., & Strausfeld, N. J. (2015). Genealogical correspondence of mushroom bodies across invertebrate phyla. Current Biology, 25 (1), 38-44.
Young, J.Z. (1971). The anatomy of the nervous system of Octopus vulgaris. Clarendon Press, Oxford.
Citar como:
Urquiza, S. 2021. Nociones sobre la estructura y evolución del sistema nervioso de algunos invertebrados, Perú. REBIOL, 41(2):256-276.