DEGRADACIÓN DEL ACEITE LUBRICANTE POR Pseudomonas aeruginosa
DEGRADATION OF LUBRICATING OIL BY Pseudomonas aeruginosa
Carmen Esther del Rosario Lora-Cahuas 1 *; Nélida Milly Esther Otiniano-García 2; Heber Max Robles-Castillo 1
1 Facultad de Ciencias Biológicas, Universidad Nacional de Trujillo, Av. Juan Pablo II s/n – Ciudad Universitaria, Trujillo, Perú.
2 Instituto de Investigación en Ciencia y Tecnología. Universidad César Vallejo. Av. Larco #1770. Trujillo. Perú.
Nélida M. Otiniano-García:
Heber M. Robles-Castillo:
Artículo original breve
Recibido: 29 de agosto 2021
Aceptado: 28 de noviembre 2021
Resumen
El presente trabajo tuvo como objetivo determinar la degradación del aceite lubricante por Pseudomonas aeruginosa. En primer lugar, el cultivo fue proporcionado por el Laboratorio de Biotecnología e Ingeniería Genética de la Universidad Nacional de Trujillo, se realizó la reactivación y verificación de la pureza del cultivo, luego se procedió a la evaluación cualitativa de la capacidad de degradación de la bacteria utilizando la metodología de Hanson. En segundo lugar, se utilizaron biorreactores modelo tanque aireado y agitado con lubricante SAE-20W50 al 1% y concentración del inóculo bacteriano al 15%. La degradación del aceite lubricante se evaluó de manera indirecta mediante la determinación del crecimiento de la bacteria en el Medio Mínimo de Davies (MMD) más el lubricante, mediante la técnica de recuento en placa cada 48 h por 6 días. Se calculó la velocidad de crecimiento, la DBO5 por la técnica de Winkler modificada por Alsterberg y el porcentaje de aceites y grasas por la técnica de Soxhlet. Así mismo, fue determinado la eficiencia de la biodegradación, mediante la fórmula de Calvin. En la prueba cualitativa, se observó que P. aeruginosa realizó la degradación del lubricante a partir de las 48 horas. En cuanto al crecimiento de la bacteria, se observó que alcanza la fase logarítmica a las 96 horas con una velocidad de crecimiento de 0,0619 h-1. La evaluación a las 144 h del biorreactor a temperatura ambiente (22±3 °C), se observó que la DBO5 disminuyó desde 582,42 a 62,563 mgO2/L; los aceites y grasas disminuyeron de 1 a 0,56%, siendo la eficiencia de degradación del aceite lubricante 44%. Se concluye que P. aeruginosa con inóculo al 15% presenta capacidad de degradación del aceite lubricante SAE-20W50.
Palabras clave: Aceite lubricante, degradación, inóculo, P. aeruginosa.
Abstract
The present work aimed to determine the degradation of lubricating oil by Pseudomonas aeruginosa. In the first place, the culture was provided by the Biotechnology and Genetic Engineering Laboratory of the National University of Trujillo, the reactivation and verification of the purity of the culture was carried out, then a qualitative evaluation of the degradation capacity of the b acteria was carried out. using Hanson's methodology. Secondly, aerated and agitated tank model bioreactors with 1% SAE -20W50 lubricant and 15% bacterial inoculum concentration were used. The degradation of the lubricating oil was indirectly evaluated by determinin g the growth of the bacteria in Davies' Minimum Medium (MMD) plus the lubricant, using the plate count technique every 48 h for 6 days. The growth rate, the BOD5 were calculated by the Winkler technique modified by Alsterberg and the percentage of oils and fats by the Soxhlet technique. Likewise, the efficiency of biodegradation was determined, using the Calvin formula. In the qualitative test, it was observed that P. aeruginosa carried out the degradation of the lubricant after 48 hours. Regarding the growth of the bacteria, it was observed that it reaches the logarithmic phase at 96 hours with a growth rate of 0.0619 h-1 . The 144 h evaluation of the bioreactor at room temperature (22±3 °C), it was observed that the BOD5 decreased from 582.42 to 62.563 mgO2/L; oils and greases decreased from 1 to 0.56%, the degradation efficiency of lubricating oil being 44%. It is concluded that P. aeruginosa with inoculum at 15% shows the degradation capacity of the lubricating oil SAE-20W50.
Keywords: Degradation, inoculum, lubricating oil, P. aeruginosa.
* Autor para correspondencia: clora@unitru.edu.pe
Citar como:
Lora-Cahuas, C., Otiniano-García, N., & Robles-Castillo, H. 2021. Degradación del aceite lubricante por Pseudomonas aeruginosa. REBIOL, 41(2):213-220.
1. Introducción
En la actualidad el mal manejo de los lubricantes está
ocasionando la contaminación del suelo, lo que está
originando un gran problema ambiental. Dentro de las
actividades más frecuentes se encuentra los derrames en
los talleres mecánicos automotrices los cuales generan
residuos que producen contaminación tanto del suelo
como del agua (Semarnat, 2005; Quiliche & Huayna, 2015).
A nivel mundial el uso de aceites lubricantes alcanza los 40
millones de toneladas anuales y de esos el 60%
corresponden al aceite lubricante usado. Por lo tanto, son
los residuos contaminantes más abundantes (Depuroil,
2005; Cabrera, 2018).
Los componentes básicos de un aceite lubricante son: la
base, compuestos por una mezcla de hidrocarburos
orgánicos (TPH), bifenilos policlorados, aromáticos
policíclicos y aditivos tales como metales, que ocasionan
daño en el medioambiente y en la salud de los humanos.
Por lo mencionado esta sustancia tiene efectos tóxicos,
venenosos y cancerígenos por lo que la reglamentación
establecida en el Convenio de Basilea la considera como
sustancia de difícil biodegradación catalogándolo como
residuo peligroso (Vásquez et al., 2010).
En nuestro país el Decreto Supremo Nº 037-2008-PCM
037 aprueba la reglamentación de las Actividades de
Hidrocarburos para la Protección Ambiental, en el cual
incluye al aceite automotriz usado, como residuo peligroso.
El límite máximo permisible de TPH aceites y grasas es de
20 mg/L (El Peruano, 2008). Por lo tanto, si excede a esta
concentración va a provocar daño en el ambiente y la salud
humana, originando alteraciones en donde es vertido o
derramado. Cuando este lubricante se expone a la luz solar
y al aire puede producir grandes cantidades de
compuestos tóxicos, como Pb, Zn y Cr (Daud et al., 2016).
Si se esparce en el suelo puede difundirse rápidamente, lo
que produce una formación de una película que no
permite el ingreso de oxígeno dando lugar a suelos
infértiles o pocos productivos. Si se vierte un litro de aceite
al agua se contaminarán 1 000 000 litros de la misma
(Manzanares & Ibarra-Ceceña, 2012).
Una de las tecnologías limpias para tratar ambientes
contaminados con aceites lubricantes es la
biorremediación, la cual busca resolver los problemas de
contaminación utilizando los microorganismos, como bacterias que puedan degradar con facilidad una gran
variedad de compuestos tales como el petróleo y sus
derivados (Conesa et al., 2002; Pérez et al., 2015).
P. aeruginosa es una bacteria Gram-negativa que
pertenece a las proteobacterias, su aislamiento es de aguas
contaminadas, muestras de suelo, plantas y animales; así
como, de muestras clínicas de diverso origen. Para
desarrollarse, puede utilizar una gran variedad de
compuestos orgánicos, lo que le facilita la colonización de
diversos lugares en donde otras bacterias no crecerían.
Soberón (2010) realizó estudios donde logró aislar P.
aeruginosa en sustancias tales como combustible de avión,
jabón y solución de clorhexidina.
En muchos estudios se ha demostrado que esta bacteria
tiene también la capacidad de degradar hidrocarburos y
sus derivados en parte, se debe a que, en presencia de
sustancias de naturaleza oleosa, produce biosurfactantes
conocidos como ramnolípidos, que pertenecen al grupo de
glicolípidos, importantes debido a su baja tensión
superficial, alta capacidad emulsionante, así como su gran
afinidad por moléculas orgánicas hidrófobas (Soberón,
2010; Fracchia et al., 2012; Patowary et al., 2017; Xu et al.,
2020).
Bhasheer et al. (2014), utilizando la técnica de Hanson,
evaluó la actividad degradativa por detección rápida y
sencilla para microorganismos con potencial de
degradación de petróleo crudo, esta prueba se sustenta en
la habilidad de algunos microorganismos para emplear el
lubricante como única fuente de carbono el cual indicará
cambio de color del Diclorofenolindofenol (indicador de
oxidorreducción) de color azul a incoloro).
En México, Manzanares & Ibarra-Ceceña (2012) hicieron un
estudio acerca del destino final del empleo y manejo de
residuos de aceite automotriz, concluyendo que la falta de
buenas prácticas y el empirismo que realizan en el cambio
de aceite causan daño al ecosistema.
Galindo & Llontop (2015) investigaron a Pseudomonas
obtenidas de suelo contaminado con petróleo,
determinando que eran capaces de emplear el petróleo
como fuente de carbono y energía, lo que demostró su
capacidad de descomposición de este compuesto.
Quiliche & Huayna (2015), aislaron e identificaron a
Pseudomonas aeruginosa que provenían de suelos de
talleres automotrices con gran potencial biorremediador.
En Ecuador, Cevallos & García (2018) valoraron la
degradación de suelos con hidrocarburos usando A. niger,
P. ostreatus y P. aeruginosa obteniéndose biodegradación
del 19%, 10%, y 42% respectivamente y cuando se utilizaron
los tres microorganismos se obtuvo el 44% degradación.
Chirre et al. (2019), realizaron un trabajo en Lima (Perú)
acerca de la degradación de aceite lubricante automotriz
incrustado en arcilla, con una mezcla bacteriana
compuesto por Pseudomonas montielli, Rhodococus
pyridinivorans y Bacillus sp. Se obtuvo 50% de
biodegradación del aceite lubricante usado (hidrocarburos
totales-TPH) a los 59 días, en comparación a la realizada a
los 13 días, en el que se obtuvo menos del 2% MendozaAvalos & Guerrero-Padilla (2015) evaluaron la capacidad de
biodegradación del petróleo Diesel 2 por P. aeruginosa en
agua de mar (período 5 días) encontrándose que mientras
ocurría el proceso de biodegradación de petróleo Dieseldisminuía el consumo de oxígeno con respecto a las
concentraciones de petróleo Diesel 2 y DBO5.
La presente investigación tuvo como objetivo general
determinar la degradación del lubricante por P. aeruginosa
con inóculo al 15%; así como, determinar la eficiencia de
degradación.
2. Materiales y Métodos
El estudio se hizo con un diseño tipo experimental de una
sola casilla de antes y después (problema) incluyendo un
testigo (sin estímulo). Como material biológico, se empleó
un cultivo puro de Pseudomonas aeruginosa
proporcionada por el Laboratorio de Biotecnología e
Ingeniería Genética. Facultad de CCBB. Universidad
Nacional de Trujillo.
Como material no biológico se empleó aceite lubricante
marca Shell HELIX HX5 SAE 20W50 G de origen mineral.
Reactivación de Pseudomonas aeruginosa
El cultivo de P. aeruginosa se reactivó sembrando en tubos
16x150 mm con caldo Infusión Cerebro Corazón (BHI) e
incubando a 37 oC en estufa Memmert, durante 24 h.
Luego se realizó coloración Gram y observación
microscópica para comprobar la pureza del cultivo.
Evaluación cualitativa de la degradación del aceite lubricante SAE 20W50
La microdilución se realizó utilizando la técnica de Hanson
(usado por Mendoza-Avalos & Guerrero-Padilla, 2015),
colocando: 500 uL de medio Bushnell-Haas en tubos de
13x100 mm, 50 uL de inóculo de P. aeruginosa (1,5x108
UFC/mL), 20 uL aceite lubricante al 2% y 10 uL de 2,6-
diclorofenolindofenol (DCPIP) como indicador de óxido
reducción. El set de tubos se incubó a 30°C, en la
incubadora por 24 horas (tres repeticiones). Luego, se
procedió a evaluar la capacidad degradativa a través de la
observación del cambio de color en los tubos donde la
bacteria actuó sobre el aceite lubricante. El indicador 2,6-
DCPIP demuestra la capacidad degradativa de P.
aeruginosa al emplear los hidrocarburos del lubricante
como sustrato por medio del cambio de color de forma
oxidada (azul) a forma reducida (incolora) (Afuwale & Modi,
2012; Bhasheer et al., 2014).
Diseño y acondicionamiento de biorreactores
Los biorreactores fueron construidos teniendo en cuenta
las dimensiones establecidas por Brauer (1985) y Doran
(1998). Se consideró el modelo Tanque Cilíndrico Aireado y
Agitado (TCAA) con 0,5 L volumen de trabajo (1 VVM de
aireación) y 1,0 L de volumen total. La velocidad de 480 rpm
(usando motores de 5 V) permitió un Número de Reynolds
(NRE) igual a 2,1x104
, de flujo turbulento (mezclado
homogéneo) a temperatura ambiente (22±3 °C). Los 2
biorreactores se desinfectaron con hipoclorito de sodio al
1,0%. Un biorreactor se utilizó como sistema testigo (sin
inóculo) y el otro biorreactor como sistema experimental
Problema (con inóculo al 15%).
Preparación de los materiales para determinar la capacidad de degradación por Pseudomonas aeruginosa con inóculo al 15% sobre el aceite lubricante SAE 20W50.
Se sembró el cultivo puro de P. aeruginosa en tubos con
Agar Soya Tripticase (TSA), luego de 24 h, se estandarizó el
inóculo, a partir del tubo N° 1 de Mac Farland (3x108 cel/mL)
y con diluciones seriadas se obtuvo la concentración final
de 3x106 cel/mL. A partir de esta dilución, se tomaron 75
mL (inóculo al 15%), el aceite lubricante al 1%, y fueron
agregados al biorreactor problema con un volumen final del medio Mínimo de Davis (MMD) de 0,5 L. Al biorreactor
testigo solo se agregó el aceite lubricante al 1%. Se preparó
Agar para Recuento en Placa (PCA), tubos de 16 x 150 mm
con 9,0 mL de SSF para hacer las diferentes diluciones que
se emplearon en el recuento UFC/mL, método por
incorporación (Niño-Camacho & Torres-Sáenz, 2010). Se
prepararon todos los materiales para la determinación del
DBO5 por la técnica de Winkler modificado por Alsterberg.
(Navarro, 2007; IDEAM, 2007); y para la determinación de
grasas por el método Soxhlet. (EPA, 1996; APHA, 2017).
Control y Monitoreo del proceso de degradación biológica
La biodegradación del aceite lubricante por P. aeruginosa,
al 15% fue evaluado mediante: 1) Recuento de aerobios
mesófilos viables a las 0, 48, 96 y 144 h como una medida
indirecta de la degradación del aceite lubricante. 2)
Demanda Bioquímica de Oxígeno, técnica de Winkler
Modif-Alsterberg (IDEAM, 2007; Navarro, 2007) para
determinar el consumo de oxígeno que en este caso P.
aeruginosa, necesita para degradar las sustancias en la
muestra (lubricante). Se realizo a las 0 y 144 h. 3)
Determinación de aceites y grasas por el método Soxhlet
(EPA, 1996; APHA, 2017) en el cual se va a determinar el
contenido de aceites y grasas del lubricante cuyo resultado
se encontrará al evaluar el concentración inicial y final de la
extracción a las 0 y 144 h.
El cálculo de la eficiencia de la biodegradación se realizó
con la fórmula de Calvin, utilizado por Jáuregui & Robles
(2017).

3. Resultados
Tabla 1. Evaluación cualitativa de la degradación del aceite lubricante SAE 20W50 por P. aeruginosa, según el método de Hanson utilizado por Mendoza-Avalos & Guerrero-Padilla (2015).


Figura 1. Degradación cualitativa del aceite lubricante SAE 20W50 por P. aeruginosa (A: 0 h y B: 48 h) utilizando el indicador 2,6- diclorofenolindofenol (2,6-DCPIP). Sin degradación (negativo -, azul) y con degradación (positivo +, incoloro). T = Testigo (sin inóculo) y P = Problema (con inóculo).
Tabla 2: Recuento de bacterias aerobias mesófilas viables de P. aeruginosa con inóculo al 15 % en la degradación del lubricante SAE 20W50.).
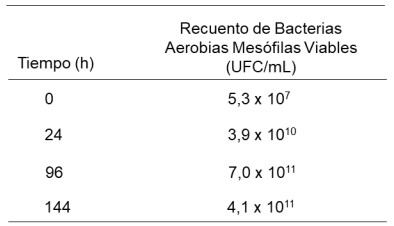
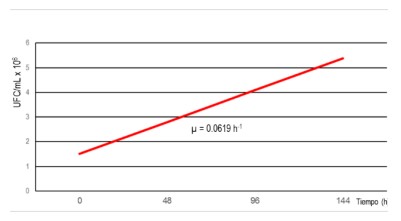
Figura 2: Tasa de crecimiento (µ) de P. aeruginosa en aceite lubricante SAE-20W50 en un biorreactor cilíndrico aireado y agitado de 0,5 L.
Tabla 3. Determinación del Oxígeno disuelto en el biorreactor usando a P. aeruginosa con inóculo al 15 % en la degradación del lubricante SAE 20W50.
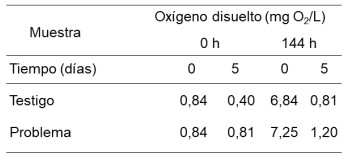
Tabla 4: Determinación del DBO5 en el biorreactor usando a P. aeruginosa al 15 % en la degradación del aceite lubricante SAE 20W50.
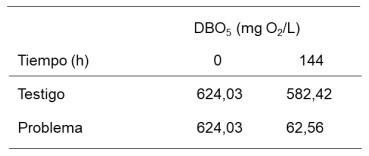

Figura 3. Biorreactor control (transparente) e inoculado (verde) con P. aeruginosa al 15 % en la degradación del lubricante SAE 20W50 a las 144 h.
Tabla 5: Degradación del aceite lubricante SAE 20W50 por P. aeruginosa a las 144 h en Medio Mínimo de Davies (determinación de aceites y grasas por el Método Soxhlet).
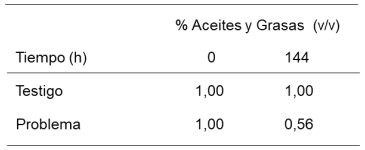
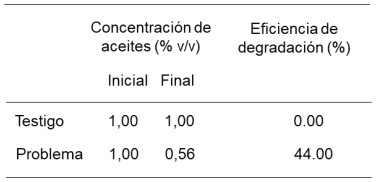
Tabla 6. Eficiencia degradación del aceite lubricante SAE 20W50 en un biorreactor con inóculo del 15% de P. aeruginosa (Problema) y en otro biorreactor sin inóculo (Testigo) a las 144 h de incubación.
4. Discusión
Los resultados mostraron que P. aeruginosa utilizó el
sustrato de hidrocarburos (lubricante) cuando se
suministraron como única fuente carbonada y energética,
que indica que pudo degradar y consumir el aceite para su
crecimiento y desarrollo, observado por la turbidez y el
cambio de color (Figura 1).
Para determinar la evaluación cualitativa degradativa se
realizó mediante la prueba desarrollada por Hanson,
utilizado por Mendoza-Avalos & Guerrero-Padilla (2015) la
cual se sustenta en la capacidad de algunos
microorganismos para emplear el lubricante (petróleo)
como única fuente de carbono el cual indicará cambio de
color del Diclorofenolindofenol (indicador de
oxidorreducción) de color azul a incoloro (Bhasheer et al.,
2014).
Durante el proceso de oxidación de hidrocarburos por los
microorganismos, el oxígeno, los nitratos y sulfato, actúan
como aceptores de electrones. Al incorporar como aceptor
de electrones el DCPIP, se puede determinar la capacidad
del microorganismo para utilizar los hidrocarburos como
sustratos observando el cambio de color de DCPIP oxidado
(azul) ha reducido (incoloro) (Mendoza-Avalos y GuerreroPadilla, 2015).
El medio empleado fue Bushnell-Haas brinda todos los
nutrimentos que necesita el microorganismo para su
crecimiento y producción de biosurfactantes, tales como el
magnesio, hierro, K2HPO4,.KH2PO4 y el NH4NO3 (utiliza los
nitratos como aceptor final de electrones) (Holmboe et al.,
2001).
En relación al crecimiento de P. aeruginosa al 15%, se
suplementó el medio de cultivo con 1% de aceite lubricante
como única fuente de carbono, en esta prueba, se puedo
corroborar que al utilizar el lubricante como fuente
carbonada esta bacteria presenta fases de desarrollo en
donde la fase log, es la más remarcada e importante, ya
que es en esta fase es donde ocurre la degradación de
compuestos.
Se observó que la fase logarítmica de crecimiento ocurre a
las 96 h con una velocidad de crecimiento de 0,0619 h-1 y a
las 144 h el número de UFC/mL empieza a ser constante
(Tabla 2 y Figura 2).
Para poder degradar el aceite, P. aeruginosa produce
sustancias surfactantes que van a ayudar en el proceso de
degradación del lubricante SAE-20W50 (Hidrocarburo).
Esto se ha demostrado en diversos estudios, que indican
que algunas bacterias de los géneros Pseudomonas,
Bacillus, Acinetobacter, Alcaligenes, Alcanivorax,
Rhodococcus, y Corynebacterium, producen
biosurfactentes que actúan de manera eficiente en la
degradación de petróleo crudo. La molécula del
biosurfactante tiende a reducir la tensión de la superficie e
interface entre sólidos, líquidos y gases. Forma micelas
alrededor del hidrocarburo, lo que produce un incremento
de la superficie del sustrato hidrocarbonado facilitando su
emulsificación y así mejora la disponibilidad a través de la
solubilización en agua (Abbasian et al., 2016; Parthipan et
al., 2017; Patowary et al., 2017). Así, en su trabajo Varjani &
Upasani (2017) plantearon que P. aeruginosa DS 10-129
produce un tipo de biosurfante ramnolípido en lugares
contaminados con gasolina y diésel. De otro lado
Kaskatepe & Yildiz (2016) encuentran en sus trabajos que
estos ramnolípidos tienen un gran potencial, para la
remediación de suelos contaminados debido a su
biodegradabilidad y baja toxicidad.
Mondragón (2011) determinó que esta bacteria empieza su
fase log a las 4 horas y termina a las 24 horas. En nuestro
trabajo, las condiciones no fueron las mismas que las
reportadas; sin embargo, nuestros hallazgos revelan que la
fase logarítmica se mantiene desde las 48 h, aumentando
de 107 a 1010 UFC/mL. De otro lado, Varjani et al. (2015), en
un estudio con P. aeruginosa donde utiliza alcanos como
fuente principal de carbono y metabólicamente demora 5
horas para poder adaptarse de las condiciones
desfavorables. En el caso nuestro evaluamos el crecimiento de P. aeruginosa utilizando como fuente de carbono el
aceite lubricante SAE 20W50, desarrollándose
favorablemente y manifestando la degradación del mismo.
Vilasó et al. (2016), determinaron que cuando esta bacteria
se encuentra a temperaturas entre 15 °C a 50 °C, su
capacidad de biodegradación del petróleo se debe la
producción de biosurfactantes ya que estos disminuyen la
tensión interfacial cuando el hidrocarburo este mezclado
con agua. De otro lado, Molano & Flórez (2016)
confirmaron que P. aeruginosa tiene un óptimo
crecimiento y excelente adaptación al sustrato comparada
con otros microrganismos, por lo tanto, es una buena
candidata para procesos de biodegradación de
hidrocarburos. En el caso nuestro también se pudo
observar la degradación de aceite lubricante SAE 20W50.
Durante el experimento se observó el crecimiento de la
bacteria de 107 hasta 1011 UFC/mL, lo que indirectamente
implica degradación del lubricante compuesto de
hidrocarburos debido a la producción de ramnolípidos, lo
que se evidenció de un color crema en la superficie del
biorreactor y en todo el líquido se observó un color
verdoso se debe a los pigmentos que P. aeruginosa
produce a partir de una fuente de carbono, en este caso,
el aceite lubricante SAE-20W50.
La Demanda Bioquímica de Oxígeno (DBO5), fue utilizado
como indicador de degradación de materia orgánica en
forma indirecta. Según los resultados obtenidos, se aprecia
una clara disminución del DBO5 en el biorreactor Problema
(62,56 mgO2/L) con respecto al biorreactor Control (582,42
mgO2/L), por lo que se puede inferir que P. aeruginosa ha
degradado al aceite lubricante (Tabla 4). Pues como se
sabe, la DBO5 viene a ser la cantidad de oxígeno disuelto
(mgO2/L) que se requieren para degradar materia orgánica
de una muestra por la acción bioquímica aeróbica de
microrganismos en condiciones determinadas por 5 días a
20°C (Navarro, 2007).
Este resultado es similar a los reportados en otras
investigaciones que emplearon la DBO5 para indicar de
manera indirecta la degradación de compuestos orgánicos,
tal es el caso de Mendoza-Avalos & Guerrero-Padilla
(2015), en el que encontraron que al degradar el petróleo
Diesel-2 hubo una disminución del DBO5 en agua de mar.
Así mismo, Jáuregui & Robles (2017) reportaron que,
utilizando otra sustancia, como la vinaza, hubo disminución
del DBO5 de 270 a 129 mgO2/L por un consorcio bacteriano, lo que significa que las sustancias
biodegradables (nitratos) contenidas en este sustrato han
sido degradadas.
La utilización del método de Soxhlet para determinar la
grasa total en los biorreactores, permitió observar la
disminución porcentual de la grasa del lubricante, lo que
indica que la bacteria ha degrado a este compuesto (Tabla
5). Por lo tanto, se puede asumir que el crecimiento
bacteriano, el DBO5 y las grasas totales, son indicadores
indirectos de la degradación del lubricante SAE-20W50
obteniéndose una eficiencia de biodegradación a los 6 días
del 44%. (Tabla 6) Comparado con González et al. (2019),
ellos encontraron un 50% de remoción de aceites en aguas
residuales de lava autos-lubricentros cuando se agregó un
consorcio bacteriano conformadas por Mycobacterium sp.
Acinetobacter sp. y Pseudomonas sp.
5. Conclusiones
Se determinó que Pseudomonas aeruginosa en inóculo al
15%, degrada el aceite lubricante SAE 20W50 a las 144
horas.
Se demostró cualitativamente la capacidad de degradación
de aceite lubricante SAE-20W50 por Pseudomonas
aeruginosa.
Pseudomonas aeruginosa desarrolla bien en medio de
cultivo con aceite lubricante al 1%, alcanzando la fase
logarítmica a las 96 horas, con una velocidad de
crecimiento de 0,0619 h-1.
La DBO5 disminuye durante el tratamiento de aceite
lubricante SAE 20W50 con Pseudomonas aeruginosa,
observándose una variación de 582,42 a 62,56 mgO2/L a
las 144 horas. Se observó disminución de aceites y grasas
por el método de Soxhlet del 1% a 0,56% en 144 horas.
La eficiencia de degradación de aceite lubricante SAE20W50 por Pseudomonas aeruginosa fue de 44%.
6. Contribución de los autores
C. E. Lora-Cahuas: Concepción de la idea,
interpretación de datos y aprobación final de informe
N. M. E Otiniano-García: Concepción de la idea,
interpretación de datos y aprobación final de informe
H. M. Robles-Castillo: Recolección y procesamiento
de datos.
7. Conflicto de intereses
Los autores declaran que no existe conflicto de interés.
8. Agradecimientos
Un agradecimiento especial al Laboratorio de
Biotecnología e Ingeniería Genética de la Universidad
Nacional de Trujillo, Perú; por el apoyo logístico y de
ambientes brindados, posibilitando de esta manera la
realización de la presente investigación.
9. Referencias bibliográficas
Abbasian, F., Lockington, R., Megharaj, M., & Naidu, R. (2016). A review
on the genetics of aliphatic and aromatic hydrocarbon
degradation. Appl. Biochem. Biotechnol, 178, 224e250.
Afuwale, C., & Modi, H. (2012). Study of bacterial diversity of crude oil
degrading bacteria isolated from crude oil contaminated sites.
Life sciences léanles, 6, 13-23.
American Public Health Association (APHA). (2017). “5520-D Aceite y
grasa”, Métodos estándar para el análisis de agua y aguas
residuales.
https://www.standardmethods.org/doi/abs/10.2105/SMWW.2882.
Bhasheer, S., Umavathi, S., Banupriya, D., Thangavel, M., & Thangam, Y.
(2014). Diversity of diesel degrading bacteria from a
hydrocarbon contaminated soil. App. Sci, 3(11), 363-369.
Brauer, H. (1985). Stirred Vessel Reactors. In: Biotechnology Vol 2.
Fundamentals of Biochemical Engineering. Edited by J. Rehm
and G. Reed. Deutsche Biblioteck cataloguing.
Cabrera, J. (2018). Elaboración de un diagnóstico de la gestión de
aceites automotrices usados generados en lubricadoras y
estaciones de servicio para el planteamiento de una propuesta
de manejo adecuado ciudad de Quevedo, provincia de los Rios2016. [Tesis de maestría, Universidad Nacional de Tumbes, Perú].
Cevallos, P., & García, D. (2018). Evaluación de la biodegradación de
suelos contaminados con hidrocarburos utilizando Aspergillus
niger, Pleorotus ostreatus y Pseudomonas aeruginosa. [Tesis
para título, Universidad Politécnica Salesiana. Quito, Ecuador].
Chirre, J., Patiño, A., & Erazo, E. (2019). Estudio de la biodegradación de
residuos de aceite lubricante retenidos en bentonita usando el
consorcio bacteriano oil eating microbes (Rodhococus,
Pseudomonas y Bacillus). Rev Soc Quím Perú, 85(2), 163-174.
Conesa, A., Punt, P., Van, D., & Hondel, C. (2002) Fungal peroxidases:
Molecular aspects and applications. J. Biotechnol, 193,143-158.
Daud, S., Najib, M., & Zahed, N. (2016). Classification of lubricant oil
odor-profile using casebased reasoning. Process and Control
(ICSPC, 207-2012).
Depuroil, S. A. (2005). Riesgos medioambientales de los aceites
industriales.
http://www.euskalnet.net/depuroilsa/Divulgacion.html
Doran, P M. (1998). Principios de Ingeniería de los Bioprocesos. Edit.
Acribia. Zaragoza. España.
El Peruano NT. 2008. Ley 28611 DS N°037-2008-PCM y DS N° 015-
2006-EM. Perú.
Fracchia, L., Cavallo, M., Martinotti. M., & Banat, I. (2012). Biosurfactants
and Bioemulsifiers Biomedical and Related Applications-Present
Status and Future Potentials.
https://www.intechopen.com/chapters/26371
Galindo, M., & Llontop, J. (2015). Eficiencia de la biorremediación de
suelos contaminados con petróleo por bacterias nativas de la
provincia de Talara, región Piura. [Tesis título, Universidad
Nacional Pedro Ruiz Gallo, Perú].
González, J., Heredia, D., & Rodríguez, R. (2019). Biorremediación de
hidrocarburos en aguas residuales con cultivo mixto de
microorganismos: caso Lubricadora Puyango. Enfoque UTE, 10,
185-196.
Holmboe, N., Kristensen, E. & Andersen, F. (2001). Anoxic
decomposition in sediments from a tropical mangrove forest
and the temperate wadden sea: implications of N and P
additions. Estuar. Cost. Shelf , 53, 125-140.
Instituto de Hidrología, Meteorología y Estudios Ambientales (IDEAM).
(2007). Determinación de Oxígeno Disuelto método
Yodométrico modificación de Azida.
http://www.ideam.gov.co/documents/14691/38155/Ox
%C3%ADgeno+Disuelto+M%C3%A9todo+Winkler.pdf/e2c956
74-b399-4f85-b19e-a3a19b801dbf
Jáuregui, S., & Robles, H. (2017). Efecto de la concentración de inóculo
de un consorcio bacteriano nativo en la degradación de los
nitratos de vinaza de una destilería de alcohol. Agroind. Sci, 7(2),
57-66.
Kaskatepe, B., & Yildiz, S. (2016). Rhamnolipid biosurfactants produced
by Pseudomonas species. Braz. Arch. Biol. Technol, 59,
e16160786.
Manzanares, L., & Ibarra-Ceceña, M. (2012). Diagnóstico del uso y
manejo de los residuos de aceite automotriz en el Municipio del
Fuerte. Univ. Autónoma Indígena de México. Sinaloa Ra Ximhai,
8(2),129-137.
Mendoza-Avalos, A., & Guerrero-Padilla, A. (2015). Biodegradación de
petróleo diesel-2 en agua de mar por Pseudomonas aeruginosa
en un biorreactor aireado y agitado. Revista SCIENDO, 18(1), 23-
37.
Molano, J., & Flórez, M. (2016). Prueba piloto para la determinación de
la tolerabilidad del carbofurano usando Pseudomonas sp.
proveniente del suelo. [Tesis para Título, Universidad La Salle.
Bogotá, Colombia].
Mondragón, L. (2011). Aislamiento y caracterización de cepas
bacterianas aerobias autóctonas de yacimientos petroleros
productoras de biosurfactantes para su aplicación en técnicas de
MEOR. [Tesis de maestría. Instituto Politécnico Nacional,
México].
Navarro, M. (2007). Demanda Bioquímica de Oxígeno 5 días,
incubación y electrometría. TP0087. IDEAM (Instituto de
Hidrología, Meteorología y Estudios Ambientales). República de
Colombia.
Niño-Camacho, L., & Torres-Sáenz, R. (2010). Implementación de
diferentes técnicas analíticas para la determinación de biomasa
bacteriana de cepas Pseudomonas putida biodegradadoras de
fenol. Revista ION, 23 (1),41-46.
Parthipan, P., Preetham, E., Machuca, L., Rahman, P., Murugan, K.,
Rajasekar, A. (2017). Biosurfactant and degradative enzymes
mediated crude oil degradation by bacterium Bacillus subtilis A1.
Front. Microbiol. 8, 193.
Patowary, K., Patowary, R., Kalita, M., & Deka, S. (2017). Characterization
of biosurfactant produced during degradation of hydrocarbons
using crude oil as sole source of carbon. Front. Microbiol, 8, 279.
Pérez, R., Silva, M., Peñuela, G., & Cardona, G. (2015). Evaluación de
biocombustibles e hidrocarburos del petróleo (gasolina y diesel)
en un suelo: proceso de transporte y biorremediación. Revista
EIA,12, 21-46
Quiliche, J., & Huayna, D. (2015). Aislamiento e identificación de
Pseudomonas aeruginosa provenientes de suelos en talleres de
automóviles con potencial en biorremediación. Infinitum, 5(2),
105-109.
Semarnat. (2005). Límites máximos permisibles de hidrocarburos en
suelos y las especificaciones para su caracterización y remediación. Secretaria de medio ambiente y recursos naturales.
Diario oficial de la federación. México. 21 p.
Soberón, C. (2010). Pseudomonas aeruginosa. UNAM. México.
http://congresos.cio.mx/3_enc_mujer/files/orales/Extensos/Pon
encia%2010.doc
United States Environmental Protection Agency (EPA). (1996). SW-846
Method 3540C Soxhlet Extraction. Manual. Government Printing
Office.https://19january2017snapshot.epa.gov/sites/production/
files/2015-12/documents/3540c.pdf
Varjani, A., & Upasani, V. (2017). Crude oil degradation by
Pseudomonas aeruginosa BCIM 5514: Influence of process
parameters. Indian Journal of Experimental Biology. 55, 493-497
Varjani, S., Rana, D., Jain, A., Bateja, S., & Upasani, V. (2015). Synergistic
ex-situ biodegradation of crude oil by halotolerant bacterial
consortium of indigenous strains isolated from on shore sites of
Gujarat, India. Int. Biodeterior. Biodegradation, 103, 116-124.
Vásquez, M., Guerrero, J., & Quintero, A. (2010). Biorremediación de
lodos contaminados con aceites lubricantes usados. Revista
Colombiana de Biotecnología, 12(1),141-157.
Vilasó, J., Rodríguez, O., & Ábalos, A. (2016). Extracción de petróleo en
suelo contaminado empleando ramnolípidos producidos por
Pseudomonas aeruginosa ORA9. Rev. Int. Contam. Ambie, 33
(3), 485-493.
Xu, A., Wang, D., Ding, Y., Zheng, Y., Wang, B., Wei, Q., Wang, S., Yang,
L. & Ma, L. (2020). Integrated comparative genomic analysis and
phenotypic profiling of Pseudomonas aeruginosa isolates from
crude oil. Front. Microbiol, 11, 519.