EFECTO DE LA ADICIÓN DE ROCA FOSFÓRICA Y ALFALFA EN EL CONTENIDO DE NITRÓGENO, FÓSFORO Y POTASIO DE TRES MUESTRAS DE BIOL
EFFECT OF THE ADDITION OF PHOSPHORIC ROCK AND ALFALFA ON THE CONTENT OF NITROGEN, PHOSPHORUS AND POTASSIUM OF THREE BIOL SAMPLES
Tany Yalú Azaña Colchado 1 *; Ana Luisa Sánchez Ramos 1; José Manuel Villanueva Carlos 1
1 Facultad de Ciencias, UniversidadNacional del Santa, Perú. Av. Universitaria s/n. Ciudad Universitaria, Urbanización Bellamar, Nuevo Chimbote, Ancash, Perú.
Artículo original:
Recibido: 24 de agosto 2021
Aceptado: 04 de noviembre 2021
Resumen
El presente trabajo evalúa el efecto de adicionar roca fosfórica y alfalfa en el proceso fermentativo de biol y su posterior contenido de nitrógeno, fósforo y potasio como nutrientes esenciales para el desarrollo y crecimiento foliar y radicular de las plantas. Para lo cual se usó un biodigestor por lote, donde se desarrolló el proceso fermentativo por un período de 90 días que fueron determinados por los valores de pH obtenidos por monitoreo constante, finalizado el proceso y obtenido el biol se procedió a realizar pruebas químicas para determinar la concentración de nitrógeno, fósforo y potasio en todas las muestras, obteniendo como resultado que el Tratamiento 3 (T3) que contenía alfalfa y roca fosfórica sobresalió en NPK con valores de 5,36% de nitrógeno, 0,63 mg/L de fósforo y 5,32 mg/L de potasio convirtiéndose en el biol óptimo para el uso en las plantas.
Palabras clave: Alfalfa, fósforo, nitrógeno, potasio, roca fosfórica.
Abstract
This work evaluates the effect of adding phosphoric rock and alfalfa in the fermentation process of biol and its subsequent c ontent of nitrogen, phosphorus and potassium as essential nutrients for the development and foliar and root growth of plants. For which a batch biodigester was used, where the fermentation process was developed for a period of 90 days that were determined by the pH values obtained by constant monitoring, after the process was finished and the biol was obtained, chemical tests were carried out to determine the concentration of nitrogen, phosphorus and potassium in all the samples, obtaining as a result that Treatment 3 (T3) containing alfalfa and phosphoric rock excelled in NPK with values of 5.36% nitrogen, 0.63 mg/L of phosphorus and 5.32 mg/L of potassium becoming the optimal biol for use in plants.
Keywords: Alfalfa, nitrogen, potassium, phosphate rock, phosphorus.
* Autor para correspondencia: tany.azana@outlook.com
Citar como:
Azaña, T., Sánchez A., & Villanueva J. 2021. Efecto de la adición de roca fosfórica y alfalfa en el contenido de nitrógeno, fósforo y potasio de tres muestras de biol. REBIOL, 41(2):187-194.
1. Introducción
La producción agrícola orgánica se ha convertido en la
principal forma de reciclar residuos sólidos de origen
vegetal y animal, por ser usados en la elaboración de
compost, humus, bioles y otros (Hermann et al.,2011). Estos
productos son obtenidos a través de procesos
fermentativos aeróbicos o anaeróbicos según el tipo de
bioabono que se requiera; puesto que, estudios previos
han indicado que la aplicación de fertilizantes orgánicos
cumplen con los requisitos de la agricultura sostenible y
presentan ventajas sobre fertilizantes químicos (Guo et al.,
2010). De estos procesos nace una alternativa de
fertilización líquida llamada biol, que se ha desarrollado
principalmente en países de América del Sur como una
solución práctica y económica a los problemas agrícolas y
ambientales (Winarso et al., 2016).
El biol, es un biofertilizante líquido obtenido por
fermentación anaeróbica que estimula en las plantas la
formación de raíces, crecimiento de flores, frutos y el
desarrollo general de las mismas, que aplicado en
pequeñas cantidades, promueve el desarrollo y
proliferación de microorganismos que optimizan la
estructura de los suelos y reduce las infecciones fúngicas
y bacterianas (Fongaro et al., 2014). El proceso de
elaboración de biol es realizado en ambientes anaeróbicos
con el objetivo de promover el crecimiento de bacterias
fermentativas que convierten los compuestos orgánicos
simples producidos durante el proceso de hidrólisis en
productos intermedios, principalmente ácidos orgánicos
volátiles que dan lugar al incremento de la acidez del
medio y por ende inhiben la presencia de
microorganismos que inducen la putrefacción (Marín,
2015).
Durante el inicio fermentativo los nutrientes presentes en
la materia orgánica serán aprovechados por las bacterias
como el sustrato que da inicio al crecimiento, desarrollo y
posterior degradación del mismo con el fin de obtener
biofertilizante rico en contenido de nutrientes como
nitrógeno, fósforo y potasio (Rojas, 2014). Esto últimos,
indispensables para el desarrollo de las plantas y del
aumento de las propiedades físico- químicas del suelo
(Ning et al., 2017). Así también la calidad del biol está
determinada por el tipo de materia orgánica usada en el
proceso fermentativo, puesto que la carga de proteínas,
carbohidratos y grasas presentes al ser transformadas en
moléculas simples serán aprovechadas por las plantas
(Feiz & Ammenberg, 2017).
Para llevar a cabo los procesos fermentativos es necesario
de contenedores herméticos conocidos como
biodigestores, que por su diseño dan las condiciones
ambientales óptimas para la biotransformación de la
materia orgánica en su interior (Ning et al., 2017). La
materia orgánica empleada juega también un papel
indispensable en este proceso puesto que determinará la
calidad del biofertilizante (Feiz & Ammenberg, 2017) por
esta razón se hace uso de excretas animales, desechos
frutales y hojas secas con la finalidad de liberar los
nutrientes que mejoren el desarrollo de las plantas.
Por lo antes mencionado y ante la posibilidad de obtener
un biofertilizante (biol) con mayor biodisponibilidad de
NPK, resulta importante realizar un estudio sobre la
evaluación de la biodisponibilidad química de nutrientes
asociada a la producción de biol enriquecido con roca
fosfórica y alfalfa. Debido a que el uso de fertilizantes para
el acondicionamiento de los suelos resulta costoso y
muchas veces perjudicial para los suelos; además, que no
todos los sustratos de origen natural se adaptan a los tipos
de suelos existentes a causa de los diferentes valores pH y
conductividad que presentan.
Por lo que la finalidad del presente trabajo fue determinar
el efecto de la adición de roca fosfórica y alfalfa en el
proceso fermentativo del biol y el contenido de nitrógeno,
fósforo y potasio en las muestras de biol en estudio a
través de análisis químicos que ayudaron a la conclusión
del estudio.
2. Materiales y Métodos
Construcción del biodigestor
Tal y como se observa en la figura 1; se diseñaron
biodigestores por lote, usando tanques de polietileno de
30 L de capacidad modificados y adaptados para el control
durante el proceso fermentativo: en la parte inferior del
tanque a 30 cm de altura de la base se efectuó un agujero
de 2 cm de diámetro en el que se acopló un tubo PVC de
½ plg de 7 cm de longitud, el mismo que fue conectado
por un extremo a una válvula de PVC de ½ plg para el
muestreo y control del pH de la fracción líquida de la
fermentación (biol). En la parte superior sobre la tapa del
tanque se acoplaron dos tubos de PVC de ½ plg, el
primero de 100 cm de longitud conectado en el centro de
la tapa del tanque e introducido hacia el interior del mismo
para agitar la mezcla de materia orgánica.

Figura 1. Biodigestores por lote, usados en el proceso fermentativo de la materia orgánica. Se observan los tratamientos en estudio, así como el control.
Preparación y adaptación de la materia orgánica
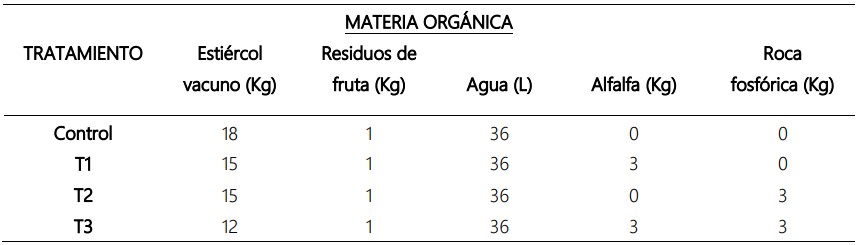
El acondicionamiento de la materia orgánica en el
biodigestor, tal y como se indica en la tabla 1, se inició con
la dilución de 18 kg de estiércol vacuno en 36 L de agua alcanzando una relación 1:3 para lograr homogeneidad en
la mezcla, de forma seguida se adicionó los restos frutales
de mango, durazno y manzana previamente seccionados
en partes de 1,5 cm de longitud aproximadamente para una degradación rápida y eficiente; posteriormente se
adicionaron roca fosfórica y alfalfa tal y como lo indica la
tabla 1.
Tabla 1. Distribución del tipo de materia orgánica en Kg, de acuerdo a cada tratamiento en estudio.
Tiempo de retención y medida de pH
El tiempo de retención de la materia orgánica en el proceso
fermentativo estuvo determinado por los valores de pH, es
decir desde un pH ácido de inicio de fermentación hasta
un pH neutro de fin de fermentación.
Determinación de la calidad química en muestras de biol
Determinación del contenido de fósforo
Las evaluaciones del contenido de fósforo se iniciaron con
la purificación de las muestras de biol, para lo cual se
tomaron 5 mL de cada muestra y por separado se
colocaron en un matraz, se adicionó 4 g de carbón
activado sobre las mismas y 100 mL de NaHCO3 al 0,5 N,
se dejó actuar por 5 min y se filtró usando papel Wattman
N° 25, este proceso fue realizado dos veces para eliminar
la mayor cantidad de impurezas presentes en las muestras
(Harris, 2007).
Se tomó 1 mL del líquido resultante y se adicionó 5 mL de
solución de molibdato de amonio y 1 mL de solución
diluida de SnCl2, se aforó a 25 mL con agua destilada y se
dejó reposar durante 10 min, para finalmente realizar la
lectura usando espectrofotómetro a una longitud de onda
de 660 nm y se determinó la concentración de fósforo de
acuerdo a la ecuación obtenida a partir de la curva de
calibración previamente realizada.
Determinación del contenido de nitrógeno total
Se usaron 5 mL de las muestras biol (por cada tratamiento)
y por separado se colocó en un matraz kjeldahl, se adicionó 3g de mezcla catalizadora más 4 mL de solución digestora,
se homogeneizó la mezcla hasta lograr el aumento de
temperatura y presenciar un viraje hacia un color verde; de
forma seguida se adicionaron 10 mL de agua destilada, 12
mL de ácido sulfúrico (H2SO4) al 4% y 2 gotas de rojo fenol,
así como 15 mL de solución concentrada de NaOH al 40%.
Finalmente se tituló con HCl 0,05 N hasta que vire de azul
a amarillo tomándose nota del volumen gastado. Para
determinar el porcentaje de nitrógeno se usó la siguiente
formula calculándose por el método volumétrico el
porcentaje de nitrógeno (Olivares et al., 2012).

Determinación del contenido de potasio
Se usó el método de espectrofotometría de tipo UV-VIS
usado por (Ramos et al., 2006), así como la determinación
de curva de calibración. Se tomó 2,5 mL de cada
tratamiento de biol y por separado, se agregó 25 mL de
acetato de amonio 1N, la mezcla fue agitada por 10 min y se dejó reposar por un período de 10 min, luego se filtraron
las muestras usando papel Wattman N° 25; el líquido
resultante constituyó el extracto de la muestra a partir del
cual se realizaron las lecturas en el espectrofotómetro a
una longitud de onda de 780 nm. La concentración de
potasio se determinó a partir de la curva de calibración
realizada para el fósforo propia del autor.
3. Resultados
En la figura 2, se muestra el comportamiento del pH desde
el inicio del proceso fermentativo de la materia orgánica
hasta la conversión a biol. Se observa que los valores de
pH al día 15 fueron ácidos y que progresivamente fueron
estabilizándose a pH neutro, registrando valores de 7 a 7,12
tanto en la muestra control como en los tratamientos en
estudio.
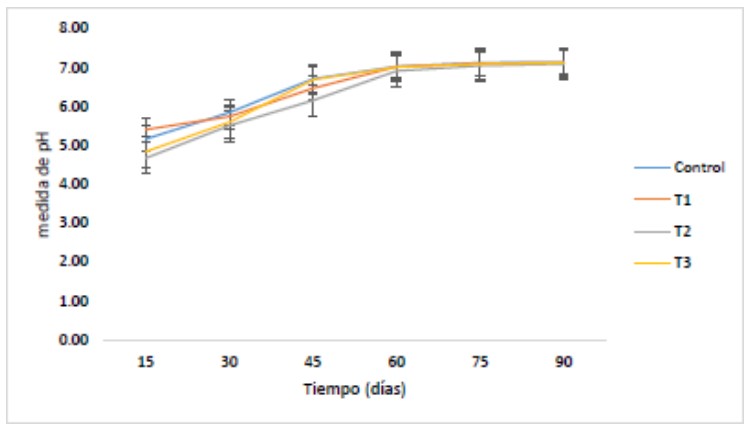
Figura 2. Monitoreo del comportamiento de pH en la muestra control y tratamientos durante los 90 días del proceso fermentativo de la materia orgánica hasta la obtención del biol. T1: tratamiento enriquecido con alfalfa, T2: tratamiento enriquecido con roca fosfórica, T3: enriquecido con alfalfa y roca fosfórica.
Por otro lado, en la figura 3, se muestran las variaciones de
temperatura durante el proceso fermentativo como parte
de parámetros ambientales bajo los cuales se llevó a cabo el proceso, observando oscilacionesde temperatura entre
los 17,1°C y los 22,8°C durante todo el tiempo de
fermentación de la materia orgánica.
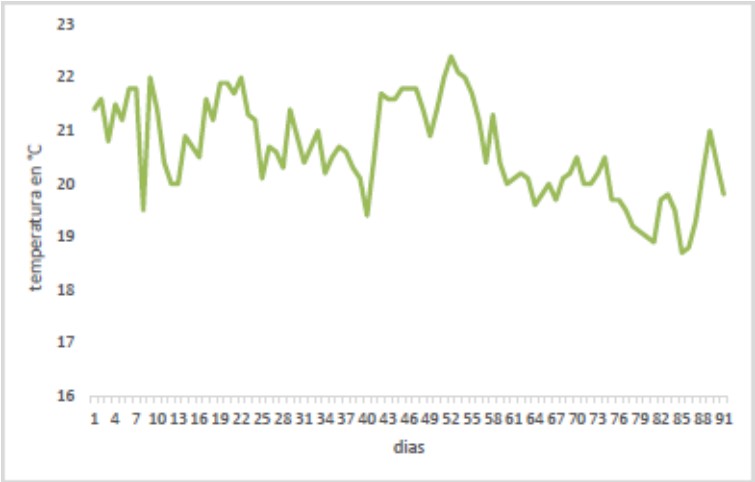
Figura 3. Variaciones de temperatura general en °C respecto a los 90 días del proceso fermentativo de la materia orgánica.
En la figura 4, los tratamientos T1 y T3 presentan mayores
porcentajes de nitrógeno con 4,44 % y 5,36%
respectivamente, la alfalfa estuvo presente en ambos tratamientos como materia orgánica en el inicio de la
fermentación, lo que indicaría los valores de nitrógeno
elevados a diferencia de los tratamientos T2 y el control.
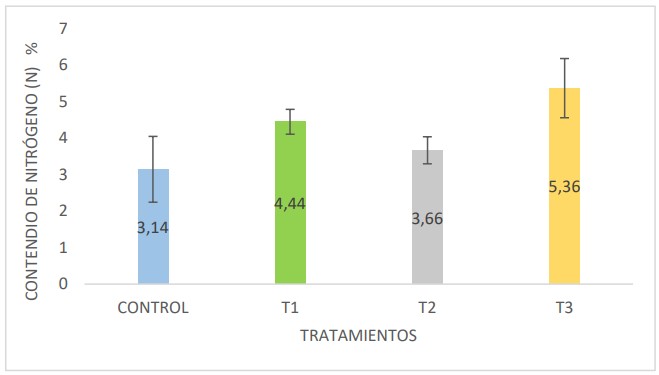
Figura 4. Contenido de nitrógeno en porcentaje (%) en las muestras de biol, provenientes del control y tratamientos 1, 2 y 3.
En la Figura 5, se observa la determinación del contenido
de fósforo en mg/L en las muestras en estudio, siendo los
tratamientos T2 y T3 con mayor contenido de nitrógeno
con 0,62 mg/L y 0,63 mg/L respectivamente a comparación del control y T1. Los tratamientos con mayor
contenido de fósforo estuvieron enriquecidos con roca
fosfórica como parte de la materia orgánica usado en el
proceso de fermentación.
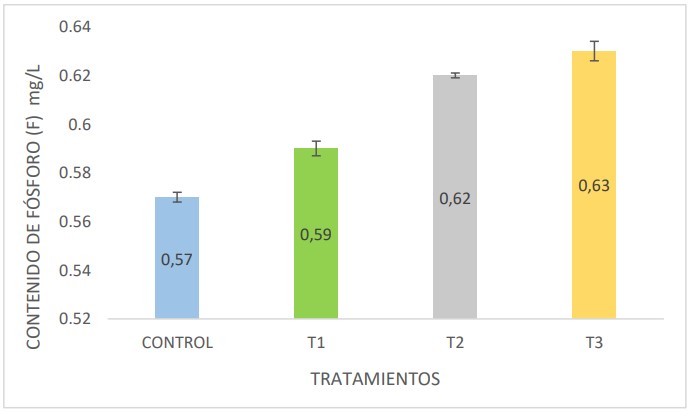
Figura 5. Contenido de fósforo en mg/L en las muestras de biol provenientes del control y tratamientos 1, 2 y 3.
Finalmente, en la figura 6, se observa el contenido de las
muestras en estudio, siendo la muestra Control y el T3 las que presentaron mayores contenidos de potasio con 4,78
mg/L y 5,37 mg/L respectivamente.
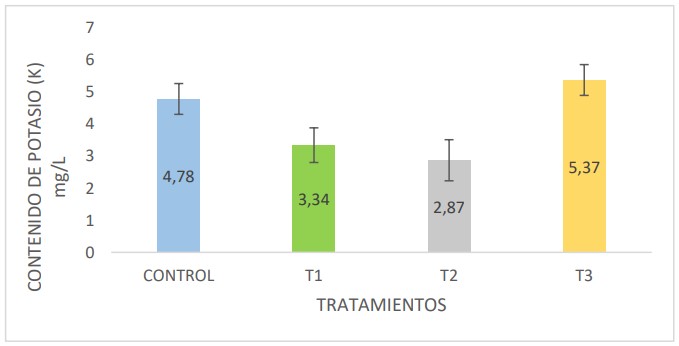
Figura 6. Contenido de Potasio en mg/L en las muestras de biol provenientes del control y tratamientos 1, 2 y 3.
Los resultados reportados mostraron diferencias
estadísticamente significativas entre las medias de un
tratamiento y otro, obteniendo un valor-P de la prueba F
menor que 0,05 con un nivel de confianza de 95%,
realizadas bajo un análisis ANOVA simple, usando el
software Statics Graphic.
4. Discusión
Los valores de pH tienen una influencia directa sobre la
producción de biol, por su acción sobre los procesos
microbianos; razón por la cual se observan pH ácidos en la
fase inicial de la fermentación tal como se indica en la figura
2, Ramos & Terry (2014), explica que este hecho se debe a
que la conversión de la materia orgánica produce la
liberación de ácidos orgánicos. De acuerdo a los resultados
obtenidos del monitoreo de pH durante el período de
fermentación en los cuatro tratamientos, se obtuvieron
valores iniciales de pH ácidos que oscilan entre 4,67 a 5,16,
siendo los tratamientos T2 y T3 los que mostraron mayor
acidez con valores de 4,67 y 4,84 respectivamente.
Sánchez-Monedero et al. (2001), mencionan que la baja de
pH más pronunciada se debe a las condiciones anaeróbicas
del biodigestor, puesto que se forman mayores cantidades
de ácidos orgánicos además que tiene una influencia
directa con el tipo y calidad de materia orgánica usada. En
la segunda fase se produce la alcalinización de la materia
orgánica, debido a la pérdida de los ácidos orgánicos y la
generación de amoniaco procedente de la descomposición
de proteínas, por lo que se obtuvieron valores de pH 6,15 y
6,45 y finalmente valores de pH de 7,01 que tienden a la neutralidad por la formación de compuesto húmicos que le
confieren la propiedad de tampón (Salamanca, 2009).
Por otra parte, la concentración NPK en el biol, depende de
la materia orgánica usada y su capacidad de solubilización
durante el proceso fermentativo (Leblanc et al., 2007), con
relación al contenido de P se obtuvieron mayores
concentraciones en los tratamientos T2 y T3 con 0,62 mg/L
y 0,63 mg/L respectivamente; ambos tratamientos fueron
enriquecidos con roca fosfórica como parte de la materia
orgánica inicial en el biodigestor. Zapata & Roy (2007)
mencionan que el pH ácido de los suelos, un alto contenido
de materia orgánica y la disponibilidad de agua son los
factores que influyen en la reactividad de la roca fosfórica
aumentando su solubilización y por ende su efectividad
agronómica; siendo el proceso fermentativo un ambiente
óptimo para lograr su solubilización en fosfatos que son
reflejados en los valores mayores de P en los tratamientos
T2 y T3 a diferencia del T1 y control. Patiño & Sánchez
(2014), han sugerido que una concentración de 0,2 mg/L de
fósforo es suficiente para un desarrollo óptimo de las
plantas.
Del mismo modo se determinó la concentración final de
nitrógeno en los tratamientos en estudio, siendo los
tratamientos T1 y T3 que presentaron mayores
concentraciones de N con 4,41 % y 5,36 % respectivamente,
ambos tratamientos fueron enriquecidos con alfalfa como
parte de la materia orgánica en el proceso fermentativo.
Duarte (2016) explica que la alfalfa contiene elevadas
concentraciones de nitrógeno en sus nódulos obtenido
mediante la relación simbiótica con el Rizhobium en el suelo
durante su crecimiento; además, provee los elementos químicos y medicinales que eliminan y controlan algunas
plagas (Restrepo, 2011). Según Rendón (2013) realizaron
enriquecimiento de biofertilizantes a base de codornaza y
alfalfa obteniendo valores de 4,40% de nitrógeno. Por otro
lado, Peralta et al. (2016), explica que el estiércol es una
fuente rica en nitrógeno pero que su degradación
dependerá de la humedad de la misma y la dieta a la que
el animal fue sometido.
Finalmente, y como se muestra en la figura 6, se
determinaron que la concentración de potasio se presentó
con mayores valores en el Control y T3 con valores de 4,78
mg/L y 5,37 mg/L respectivamente. Dichos valores se deben
al uso de estiércol vacuno como parte de la materia
orgánica en el inicio de la fermentación (Figueroa et al.,
2010). Cabos et al. (2019), elaboró biol solo usando estiércol
vacuno y obtuvo valores de 1103,8 mg/L de potasio, lo que
indica que la excreta animal es la fuente principal de potasio
en los bioabonos, este hecho explica los mayores valores de
potasio obtenidos en el control y el T3.
5. Conclusiones
Se determinó la adición de roca fosfórica y alfalfa como
parte de la materia orgánica en la producción de biol por
fermentación anaeróbica, aumenta los valores de NPK en
el producto final, es así que el tratamiento 3 (T3) presentó
los mayores valores de estos nutrientes con 5,36% de
nitrógeno, 0,63 mg/L de fósforo y 5,37 mg/L de potasio,
convirtiendo al biol enriquecido en un bioabono con
valores óptimo que pueden ser usados en las plantas para
lograr su desarrollo y crecimiento masal y radicular.
6. Contribución de los autores
T, Azaña: Redacción del artículo y desarrollo experimental.
A. Sánchez: Desarrollo experimental y datos estadísticos.
J. Villanueva: Elaboración de protocolos.
7. Conflicto de intereses
Los autores declaran que no existe conflicto de interés.
8. Referencias bibliográficas
Cabos, J., Bardales, C., León, C., & Gil, L. (2019). Evaluación de las
concentraciones de Nitrógeno, Fósforo y Potasio del biol y biosol obtenidos a partir de estiércol de ganado vacuno en un
biodigestor de geomembrana de policloruro de vinilo. Arnaldoa,
26(3), 1165-1176.
Duarte, G. (2007). Fertilización de alfalfa. Producción Animal, 1-5.
https://www.produccionanimal.com.ar/produccion_y_manejo_pasturas/pasturas_cultivadas_alfalfa/53-fertilizacion.pdf
Feiz, R., & Ammenberg, J. (2017). Assessment of feedstocks for biogas
production, part I A multicriteria approach. Resources conservation
and recycling, 122, 373-387.
Figueroa, U., Cueto-Wong, A., Delgado, J., Núñez-Hernández, G., RetaSánchez, G., Quiroga-Garza, H., Faz-Contreras, R., & MárquezRojas, J. (2010). Estiércol de bovino lechero sobre el rendimiento y
recuperación aparente de nitrógeno en maíz forrajero. Terra
Latinoamericana, 28(4),361-369.
Fongaro, G., Viancelli, A., Magri, M., Elmahdy, E., Biesus, L., Kich, J., Kunz, A.,
& Barardi, M. (2014). Utility of specific biomarkers to assess safety
of swine manure for biofertilizing purposes. Science of
The Total Environment,479-480,277-283.
Guo, J., Liu, J., Zhang, Y., Shen, L., Han, X., Zhang, W., Christie, P., Goulding,
K., Vitousek, P., & Zhang, S. (2010). Significant Acidification in Major
Chinese Croplands. Science, 327(1), 1008-1010.
Harris, D. (2007). Análisis químico cuantitativo (6ta ed.). Reverté. España.
Hermann, B., Debeer, L., De Wilde, B., Blok, K., & Patel, K. (2011). To compost
or not to compost: Carbon and energy footprints of biodegradable
materials’ waste treatment. Polymer degradation and stability,
96(6), 1159-1171.
Leblanc, H., Cerrato, M., Miranda, A., & Valle, G. (2007). Determinación de la
calidad de abonos orgánicos a través de bioensayos. Tierra
Tropical, 3(1), 97-107.
Marin, S. (2015). Biodegradabilidad anaeróbica de fracción orgánica de
residuos urbano pretratado mediante esterilización [Tesis para
título, Escuela Técnica Superior de Ingenieros de minas y energía.
España].
Ning, C., Gao, P., Wang, B., Lin, W., Jiang, N., & Cai, K. (2017). Impacts of
chemical fertilizer reduction and organic amendments
supplementation on soil nutrient, enzyme activity and heavy metal
content. Journal of Integrative Agriculture, 16(8), 1819-1831.
Olivares-Campos, M., Hernández-Rodríguez, A., Vences-Contreras, C.,
Jáquez-Balderrama, J., & Ojeda-Barrios, D. (2012).
Lombricomposta y composta de estiércol de ganado vacuno
lechero como fertilizantes y mejoradores de suelo. Universidad y
ciencia, 28(1), 27-37.
Patiño, C., & Sánchez, M. (2014). Efecto de la aplicación de roca fosfórica y
la inoculación con bacterias solubilizadoras de fosfatos sobre el
crecimiento del ají (Capsicum annum L.). Acta Agronómica. 63(2),
1-13.
Peralta, L., Juscamaita, J., & Meza, V. (2016). Obtención y caracterización de
abono orgánico líquido a través del tratamiento de excretas del
ganado vacuno de un establo lechero usando un consorcio
microbiano ácido láctico. Ecología Aplicada, 15(1), 1-10.
Ramos, A., Durango, J., Grandett, G., Díaz, B., & Barrera, J. (2006). Evaluación
de las diferentes formas de potasio en suelos de la zona platanera
de Córdoba. Agronomía Colombiana, 24(2), 334-339.
Ramos, D., & Terry, E. (2014). Generalidades de los abonos orgánicos:
importancia del bocashi como alternativa nutricional para suelos y
plantas. Cultivos tropicales, 35(4), 52-59.
Rendón, A. (2013). Elaboración de abono orgánico tipo biol a partir de
estiércol de codorniz enriquecido con alfalfa y roca fosfórica para
elevar su contenido de nitrógeno y fósforo. [Tesis para título,
Universidad técnica de Ambato. Ecuador].
Restrepo, J. (2011). Elaboración de abonos orgánicos fermentados y
biofertilizantes foliares: experiencias con agricultores en
Mesoamérica y Brasil. Instituto Interamericano de Cooperación
para la Agricultura. Costa Rica.
Rojas, H. (2014). Estudio del efecto de la aplicación de microorganismos
efectivos en la calidad de biol en un proceso de biodigestión
anaeróbica [Tesis para título, Universidad Nacional Agraria La Molina. Perú].
Salamanca, J. (2010). Diseño, construcción y puesta en marcha de un
biodigestor a escala piloto para la generación de biogás y
fertilizante orgánico [Tesis para título, Universidad San Francisco
de Quito. Ecuador].
Sánchez-Monedero, M., Roig, A., Paredes, C., & Bernal, P. (2001). Nitrogen
transformation during organic waste composting by the Rutgers
system and its effects on pH, EC and maturity of the composting
mixtures. Bioresource Technology, 78(3), 301-308.
Winarso, S., Pandutama, H., & Dwi, D. (2016). Effectivity of Humic Substance
Extracted from Palm Oil Compost as Liquid Fertilizer and Heavy
Metal Bioremediation. Agriculture and Agricultural Science
Procedia, 9, 146-157.
Zapata, F., & Roy, R. (2007). Utilización de las rocas fosfóricas para una
agricultura sostenible. Organización de las naciones unidas para la
agricultura y la alimentación. FAO.