ETIOLOGÍA DE INFECCIONES URINARIAS Y PREVALENCIA DE Escherichia coli PRODUCTORA DE BETALACTAMASAS DE ESPECTRO EXTENDIDO Y CARBAPENEMASAS
ETIOLOGY OF URINARY INFECTIONS AND PREVALENCE OF Escherichia coli, PRODUCER OF EXTENDED SPECTRUM BETALACTAMASES AND CARBAPENEMASES
Sharon Díaz-Velásquez 1, Karem Castañeda-Torres 1, Cinthya Santa Cruz - López 2 *, Fransk Carrasco - Solano 1, Mario Moreno-Mantilla 1
1 Facultad de Ciencias Biológicas, Universidad Nacional Pedro Ruiz Gallo, Calle Juan XXIII Nº 391- Ciudad Universitaria, Lambayeque, Perú.
2 Facultad de Tecnología Médica, Universidad Nacional de Jaén, Jr. Cuzco S/N - Ciudad Universitaria, Jaén, Cajamarca, Perú.
Cinthya Santa Cruz-López:
Artículo original:
Recibido: 09 de septiembre 2021
Aceptado: 17 de noviembre 2021
Resumen
Las infecciones ocasionadas por bacterias resistentes a múltiples antibióticos son de preocupación mundial. Por lo que, la investigación
determinó la etiología de infecciones urinarias y la prevalencia de Escherichia coli productora de betalactamasas de espectro extendido y
carbapenemasas en pacientes atendidos en la ciudad de Chiclayo, durante mayo a diciembre del 2018. Se trató de un estudio descriptivo,
transversal y prospectivo con diseño no experimental. La población estuvo conformada por 201 pacientes con sospecha de infección
urinaria. Se incluyeron muestras de orina de pacientes de ambos sexos atendidos en dos laboratorios clínicos privados. El aislamiento e
identificación de bacterias causantes de infecciones urinarias se realizó en Agar Mac Conkey y CLED, seguido de la identificación bioquímica
y determinación de susceptibilidad antibiótica in vitro utilizando el método de disco difusión en agar. Para la detección fenotípica de cepas
de E. coli productoras de betalactamasas de espectro extendido (BLEE) y carbapenemasas se emplearon los métodos de Jarlier y BLUE
CARB, respectivamente. El patógeno bacteriano más frecuente fue E. coli (57,71%), seguido de Staphylococcus coagulasa negativa (13,93%)
y Klebsiella sp. (8,46%). Se observó mayor resistencia a la ampicilina, amoxicilina-ácido clavulánico y norfloxacino. El 55,17% de cepas de E.
coli aisladas presentó resistencia a los antibióticos. El 68,75% de las cepas de E. coli produjeron BLEE y el 31,25% carbapenemasas. En
conclusión, la bacteria más aislada de infecciones urinarias fue E. coli, determinándose una alta prevalencia de cepas productoras de BLEE
y carbapenemasas con mayor frecuencia en mujeres entre 39 y 46 años.
Palabras clave: Betalactamasas, carbapenémicos, infección por Escherichia coli, resistencia a los antibióticos, tracto urinario.
Abstract
Infections caused by bacteria resistant to multiple antibiotics are of worldwide concern. Therefore, the research determined the
etiology of urinary tract infections and the prevalence of Escherichia coli producer of extended-spectrum beta-lactamase-producing
and carbapenemases in patients treated in the city of Chiclayo, during May to December 2018. This was a descriptive, cross -sectional,
prospective study with non-experimental design. The population consisted of 201 patients with suspected urinary tract infection. Urine
samples from patients of both sexes attended in two private clinical laboratories were included. The isolation and identification of
bacteria causing urinary tract infections was performed on Mac Conkey and CLED Agar, followed by biochemical identification a nd
determination of antibiotic susceptibility in vitro using the agar diffusion disc method. For phenotypic detection of extended-spectrum
beta-lactamase (BLEE) and carbapenemase-producing E. coli strains, the Jarlier and BLUE CARB methods were used, respectively. The
most frequent bacterial pathogen was E. coli (57.71%), followed by coagulase-negative Staphylococcus (13.93%) and Klebsiella sp.
(8,46%). Greater resistance was observed to ampicillin, amoxicillin-clavulanic acid and norfloxacin. Resistance to antibiotics was
observed in 55.17% of the isolated E. coli strains. A total of 68.75% of the E. coli strains produced BLEE and 31.25% carbapenemases.
In conclusion, E. coli was the bacterium most frequently isolated from urinary tract infections, with a high prevalence of BLEE and
carbapenemase-producing strains, with a higher frequency in women between 39 and 46 years of age.
Keywords: Antibiotic resistance, beta-lactamases, carbapenems, Escherichia coli infection, urinary tract.
* Autor para correspondencia: E. mail: cisantacruzl@gmail.com
Citar como:
Díaz-Velásquez, S., Castañeda-Torres, S., Cruz-López, C., Carrasco-Solano, F. & Moreno-Mantilla, M. 2021. Etiología de infecciones urinarias y prevalencia de Escherichia coli productora de betalactamasas de espectro extendido y carbapenemasas. REBIOL, 41(2):179-186.
1. Introducción
Las infecciones ocasionadas por bacterias multirresistentes
a los antibióticos son de preocupación mundial. El riesgo
de morbimortalidad es hasta tres veces más que con
infecciones originadas por bacterias sensibles (Saldarriaga
et al., 2015). Entre las más frecuentes se encuentran las
infecciones del tracto urinario (ITU). Anualmente se
presentan entre 2 a 3 nuevos casos de ITU por cada 100
individuos alrededor del mundo (Flores-Mireles et al.,
2015), generando un alto impacto sobre la salud humana
(Quiñones et al., 2020).
Las bacterias que ocasionan infecciones urinarias,
generalmente forman parte de la microbiota intestinal. Los
factores de virulencia que poseen les permiten adherirse,
colonizar y migrar al tracto urinario (Valdevenito &
Álvarez, 2018). Escherichia coli es la especie bacteriana
asociada a más del 90% de infecciones urinarias no
complicadas, siendo el germen más aislado en pacientes
ambulatorios (Echevarría-Zarate, 2006).
La resistencia de esta enterobacteria a múltiples
antibióticos dificulta la recuperación del paciente e
incrementa los costos sanitarios, ya que se requiere mayor
tiempo de hospitalización (Quiñones et al., 2020). E. coli
utiliza diversos mecanismos, uno de los más importantes
es la producción de betalactamasas de espectro extendido
(BLEE) (Flores-Mireles et al., 2015; Alarcón et al., 2020).
Asimismo, posee gran capacidad para adquirir genes de
resistencia a carbapenemasas, quinolonas mediadas por
plásmidos, metilasas de ARNr 16S y genes mcr (Poirel et
al., 2018).
Las bacterias que producen BLEE son capaces de romper
el anillo betalactámico. Además, inhiben el mecanismo de
acción de antimicrobianos como las penicilinas,
aztreonam y cefalosporinas, incluso las de tercera y cuarta
generación (excepto las cefamicinas) (Astocondor-Salazar,
2018). Mientras que, las especies productoras de
carbapenemasas inactivan a los antibióticos
carbapenémicos, que son de gran utilidad para tratar
infecciones por bacterias Gram negativas productoras de
BLEE. Sumado a ello pueden afectar a los inhibidores de
las enzimas betalactamasas (Rodríguez et al., 2018;
Quiñones et al., 2020).
Estos mecanismos de resistencia son frecuentes tanto en
el ámbito hospitalario como comunitario. En el ambiente
hospitalario pueden aparecer por la estancia prolongada
de los pacientes, utilización de métodos invasivos y terapia de amplio espectro. Mientras que, en el entorno
comunitario se producen principalmente por al uso
masivo e inadecuado de los antibióticos (González et al.,
2019; Losada et al., 2020). Al respecto, un estudio realizado
en el hospital Cayetano Heredia (Perú) evidenció una alta
frecuencia E. coli productora de BLEE (40,85%) en
pacientes ambulatorios, siendo el uso previo de
antibióticos, el factor más significativo (Castillo-Tokumori
et al., 2017).
Es así que el diagnóstico oportuno, identificación y patrón
de susceptibilidad de los uropatógenos es primordial para
un tratamiento y seguimiento adecuado de los pacientes.
De modo que se eviten fracasos del tratamiento y se
originen cuadros clínicos de mayor gravedad. Ante ello, se
planteó como objetivo determinar la etiología de
infecciones urinarias y la prevalencia de Escherichia coli
productora de betalactamasas de espectro extendido y
carbapenemasas en pacientes atendidos en la ciudad de
Chiclayo, durante mayo a diciembre del 2018.
2. Materiales y Métodos
Estudio descriptivo, transversal y prospectivo con diseño no experimental.
Población y muestra
La población estuvo conformada por 201 pacientes
ambulatorios con diagnóstico presuntivo de infección
urinaria. Los pacientes fueron atendidos en los laboratorios
clínicos privados “Genmédica” y “Norlab” ubicados en el
distrito de Chiclayo, provincia Chiclayo, departamento
Lambayeque, Perú. Se incluyeron muestras de orina
provenientes de pacientes de ambos sexos y que fueron
atendidos entre los meses de mayo a diciembre del 2018.
Aislamiento, identificación y susceptibilidad antibiótica
Para el aislamiento e identificación de los patógenos
bacterianos se emplearon medios de cultivo como el Agar
Mac Conkey y el agar cistina-lactosa deficiente en
electrolitos (CLED). Además, se utilizaron medios
bioquímicos como el Citrato, TSI, LIA, INDOL, caldo RM-VP
(marca Merck). La identificación de Staphylococcus se
realizó mediante tinción Gram, prueba de catalasa, oxidasa
y coagulasa.
La susceptibilidad antibiótica in vitro se determinó por el
método de disco difusión en agar. Se emplearon
antibióticos como la amikacina, ampicilina, imipenem,
ciprofloxacino, norfloxacino, ácido nalidíxico, cefotaxima, ceftriaxona, aztreonam, ceftazidima, amoxicilina-ácido
clavulánico (Calderón et al., 2002).
Detección fenotípica de E. coli productoras de BLEE y Carbapenemasas
La presencia de E. coli productora de betalactamasas de
espectro extendido se determinó con el método de Jarlier
(Calderón et al., 2002). Los discos utilizados fueron
cefotaxima (30 ug) y ceftazidima (30 ug) y aztreonam (30
ug), ceftriaxona (30 ug) y amoxicilina/ácido clavulánico
(20/10 ug). La prueba se consideró positiva al observase
efecto sinérgico entre la amoxicilina/ácido clavulánico y los
discos de cefotaxima, ceftriaxona, ceftazidima y aztreonam,
semejante a la “cola de un pez”.
La detección fenotípica de E. coli productora de
carbapenemasas se realizó mediante la prueba de BLUE
CARB (Malbrán, 2014). Se consideró la prueba como
positiva al observar viraje de color (amarillo o verde) en el
tubo que contenía la solución A, imipenem y la cepa en
estudio respecto a un control negativo de color azul o
verde.
Instrumento de recolección de datos
Se empleó como instrumento una ficha de recolección
elaborada para el estudio. Se contó con la autorización de
los laboratorios “Genmédica” y “Norlab”. Además, se
mantuvo estricta confidencialidad de los datos de los
pacientes y solo se utilizaron con fines de investigación, de
acuerdo a lo establecido en la Declaración de Helsinki.
Análisis estadístico de los datos
Los resultados fueron procesados con el programa
Microsoft Office Excel® 2016 y Minitab® 19 para
Windows® versión 8. Se utilizaron medidas de estadística
descriptiva como las frecuencias relativas, absolutas y
porcentajes.
3. Resultados
Se analizaron 201 muestras de orina de pacientes
atendidos en dos laboratorios clínicos privados de la
ciudad de Chiclayo. Las especies bacterianas más
prevalentes fueron la E. coli (57,71%), Staphylococcus
coagulasa negativa (13,93%), Klebsiella sp. (8,46%), Proteus
sp. (6,97%) y Enterobacter sp. (5,47%) (figura 1).
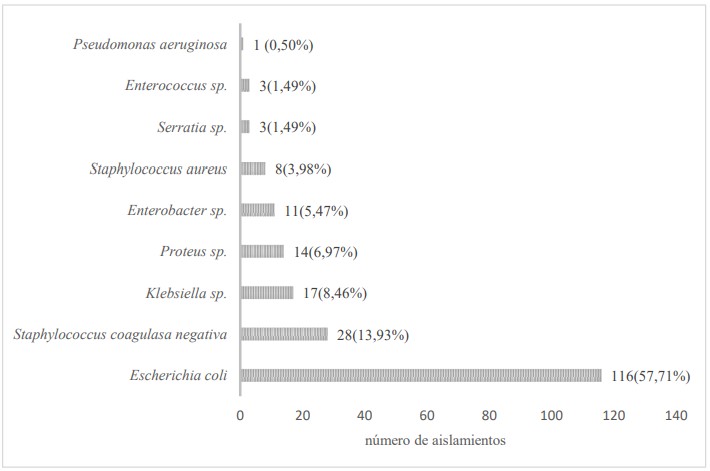
Figura 1. Especies bacterianas aisladas de pacientes ambulatorios con infecciones urinarias.
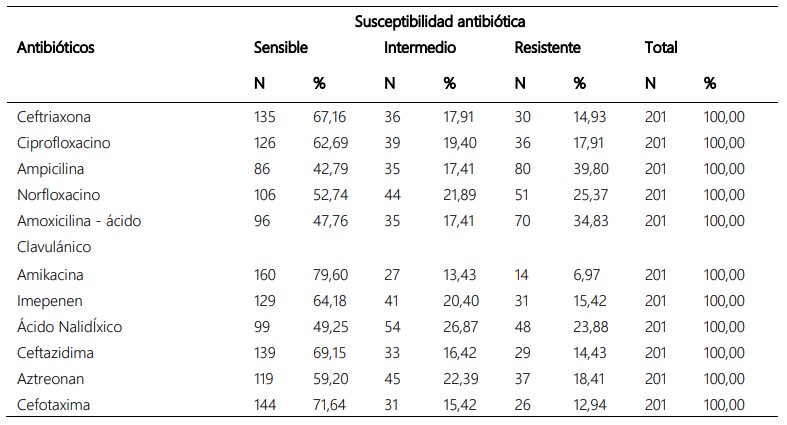
En la tabla 1, se reporta la susceptibilidad antibiótica de las
bacterias aisladas. Estos patógenos presentaron mayor sensibilidad a la amikacina (79,60%), seguido de cefotaxima
(71,64%), ceftazidima (69,15%), ceftriaxona (67,16%) y ciprofloxacino (62,69%). Por otro lado, se evidencia mayor
resistencia a la ampicilina (39,80%), amoxicilina-ácido
clavulánico (34,83%) y norfloxacino (25,37%).
Tabla 1. Susceptibilidad antibiótica de las bacterias aisladas de pacientes ambulatorios con infecciones urinarias.
En la figura 2, se evidencia que el 55,17% de cepas de E. coli aisladas de pacientes ambulatorios con infecciones urinarias presentó resistencia a diversos antibióticos.
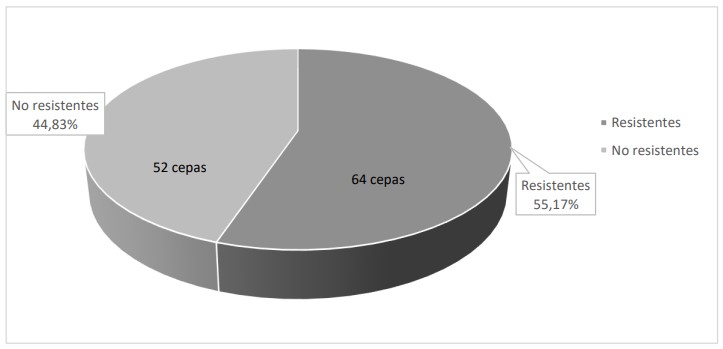
Figura 2. Resistencia antibiótica de cepas de E. coli aisladas de pacientes ambulatorios con infecciones urinarias.
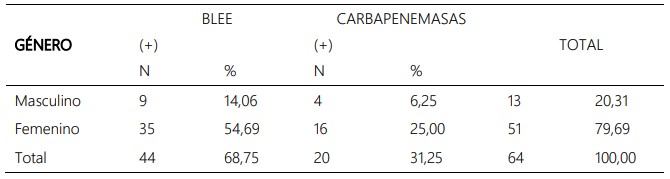
La tabla 2 muestra que 68,75% de cepas de E. coli
producían betalactamasas de espectro extendido y el
31,25% carbapenemasas. Además, en las mujeres se aisló mayor cantidad de cepas productoras de BLEE y
carpapenemasas (79,69%).
Tabla 2. Prevalencia de E. coli productora de betalactamasas y carbapenemasas según el género de pacientes ambulatorios con infección urinaria.
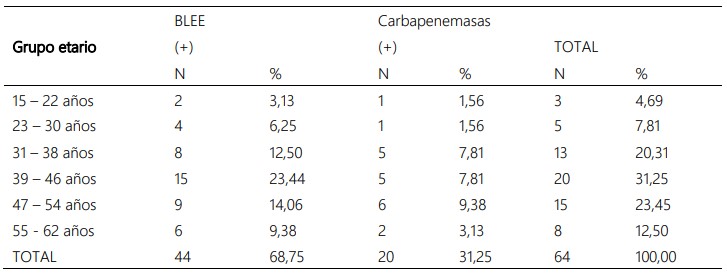
Los pacientes con edades comprendidas entre 39 a 46
años presentaron mayor prevalencia de infecciones
urinarias ocasionadas por E. coli productoras de
betalactamasas de espectro extendido (23,44%) y carbapenemasas (7,81%). Así también, en el grupo etario
de 47 a 54 años se observó una importante prevalencia de
estas enzimas (23,45%) (tabla 3).
Tabla 3. Prevalencia de E. coli productoras de betalactamasas de espectro extendido y carbapenemasas aisladas según el grupo etario de pacientes ambulatorios con infecciones urinarias.
4. Discusión
En el estudio se evaluaron 201 muestras de orina de
pacientes atendidos en dos laboratorios privados de la
ciudad de Chiclayo (Perú). Los patógenos bacterianos
aislados con mayor frecuencia fueron E. coli (57,71%),
Staphylococcus coagulasa negativa (13,93%) y Klebsiella sp.
(8,46%). Estos resultados guardan relación con los
obtenidos Davila-Bellodas et al. (2018), quienes reportaron
que E. coli (43,82%) y Staphylococcus coagulasa negativa
(10,67%) fueron los uropatógenos más aislados en
pacientes ambulatorios atendidos en Chiclayo. Asimismo,
otros estudios tanto locales como internacionales
encontraron que las especies bacterianas más aisladas en
pacientes con infección urinaria fueron Escherichia coli, Klebsiella pneumoniae y Klebsiella sp. (Morales-Espinosa et
al., 2020; Miranda et al., 2019; Castrillón et al., 2019).
Al evaluar la susceptibilidad antibiótica de los gérmenes
aislados se observó mayor sensibilidad a la amikacina,
cefotaxima, ceftazidima, ceftriaxona y ciprofloxacino.
Mientras que, mostraron importante resistencia a la
ampicilina (39,80%), amoxicilina-ácido clavulánico (34,83%)
y norfloxacino (25,37%) (Tabla 1). Resultados similares
reportaron diversos estudios realizados en México, Perú y
Colombia donde se evidenció alta sensibilidad frente a la
amikacina (87,7%-100,0%) y significativa resistencia a la
ampicilina (72,6-74,1%) (Morales-Espinosa et al., 2020;
Miranda et al., 2019; Castrillón et al., 2019).
A diferencia de lo encontrado en esta investigación,
Pacherres-Bustamante et al. (2019) demostraron mayor
resistencia antibiótica al ciprofloxacino (78,60%). Dicho estudio identificó bacterias aisladas de pacientes en unidad
de cuidados intensivos de un hospital del norte peruano.
Esto se explicaría por qué muchas de las especies
bacterianas aisladas por dichos autores, ya han adquirido
resistencia a los fármacos empleados convencionalmente.
Para el tratamiento de una infección urinaria adquirida en
la comunidad frecuentemente se prescriben
antimicrobianos empíricamente. Sin embargo, la
resistencia a estos fármacos incrementa constantemente y
la tasa de efectividad del tratamiento ha decaído de forma
significativa (Galindo-Méndez et al., 2018). Sumado a ello,
E. coli es un patógeno bacteriano capaz de afectar a
pacientes con respuesta inmune deficiente. Sus fimbrias
permiten que se adhiera y colonice fácilmente el epitelio
vaginal y uretral (Luna-Pineda et al., 2018).
La producción de BLEE puede conferir a las bacterias
resistencia contra antibióticos como las penicilinas y
cefalosporinas (primera, segunda y tercera generación) y a
monobactámicos (aztreonam) (Urquizo et al., 2018). Son
enzimas codificadas por genes que se encuentran en el
cromosoma o plásmidos y pueden producirse de manera
constitutiva o inducible (Sedighi et al., 2015).
Actualmente se han registrado más de 200 tipos de
enzimas BLEE codificadas por los genes TEM, SHV y
CTX-M. Las cepas productoras de BLEE también
desarrollan resistencia al cloranfenicol, trimetoprimsulfametoxazol, aminoglucósidos y quinolonas, lo que
reduce significativamente las opciones de tratamiento
disponibles (Cabrera et al., 2019; Sedighi et al., 2015). En el
caso de la resistencia a las quinolonas se relaciona con
genes que codifican la sobre expresión de bombas de
eflujo como el gen MarA (García-Tello et al., 2014).
Asimismo, los genes que codifican la aparición de las
carbapenemasas también se encuentran frecuentemente
mediadas por plásmidos. Los patógenos que sintetizan
estas enzimas presentan resistencia frente a todos los
fármacos β-lactámicos. Además, algunos fármacos que
podrían utilizarse para el tratamiento presentan alta
toxicidad, elevando la mortalidad de los pacientes
afectados. Sumado a ello ya se ha reportado resistencia a
estos antimicrobianos (ceftazidima-avibactam) que sirven
para combatir ciertos patógenos (Astocondor-Salazar,
2018).
En este estudio se encontró que el 55,17% de cepas de E.
coli presentaron resistencia a diversos antibióticos.
Además, el 68,75% de estas cepas eran productoras de BLEE y un 31,25% productoras de carbapenemasas.
Diversos estudios peruanos evidencian la elevada
resistencia de E. coli productora de BLEE (Miranda et al.,
2019; Castillo-Tokumori et al., 2018; Calle et al., 2017).
Respecto a las cepas productoras de carbapenemasas, un
estudio realizado con cepas provenientes de 12 regiones
del Perú durante el año 2019, determinó una prevalencia
del 59,7%, de las cuales el 42,2% provenían de
Enterobacteriaceae. En la región Lambayeque se presentó
un 4,9% de aislamientos de carbapenemasas. Estos
resultados evidencian la rápida diseminación de las cepas
resistentes en el Perú. Sin embargo, solo se incluyeron
cepas provenientes del MINSA (18,4%) y ES SALUD (81,6%),
debido a la poca información reportada acerca de los
pacientes ambulatorios (Mayta-Barrios et al., 2021).
Así también, una investigación realizada en la ciudad de
Trujillo (Perú) reportó un 7% de carbapenemasas
principalmente de clase A. Este resultado difiere con lo
encontrado en esta investigación. En dicho estudio se
evaluó menor cantidad de cepas de E. coli (76 cepas) y se
incluyeron a pacientes atendidos en el Instituto Regional
de Enfermedades Neoplásicas -IREN Norte (Gonzales et al.,
2020).
Todo ello resulta un inconveniente para contar con una
estadística actualizada que permita tener valores reales de
este problema. Cabe señalar que muchos pacientes con
infecciones urinarias no se atienden en hospitales o centros
médicos, ya que optan por consultorios privados o
automedicarse. Por lo que no existe un registro unificado
de este tipo de infecciones, lo que dificulta realizar un
adecuado seguimiento de las mismas.
En la tabla 2 se detalla que las infecciones del tracto
urinario ocasionadas por E. coli productoras de BLEE
(54,69%) y carbapenemasas (25,00%) fueron más
prevalentes en las mujeres respecto a los varones. Estos
resultados se asemejan a los obtenidos por Miranda et al.
(2019), quienes realizaron un estudio empleando los
urocultivos de pacientes geriátricos. Sin embargo, difieren
de lo encontrado en otros estudios donde este tipo de
infecciones ha sido asociado con mayor frecuencia al sexo
masculino (Calle et al., 2017). Las infecciones más comunes
en las mujeres son las urinarias, pero la tendencia se
equilibra o se torna a favor de los varones en pacientes
mayores de 50 años.
Asimismo, las cepas BLEE y carpapenemasas positivas se
aislaron con mayor frecuencia en pacientes con edades comprendidas entre 39 a 46 años (31,25%) y 47 a 54 años
(23,45%), respectivamente. Un estudio que determinó que
la infección urinaria por E. coli productoras de BLEE tienen
relación directamente proporcional con la edad, siendo
más recurrentes en individuos mayores de 45 años (Calle
et al., 2017). Las infecciones urinarias pueden afectar a
personas de cualquier edad y género; sin embargo, se
vuelven más complicadas en edades más avanzadas.
Además, por lo general estos pacientes ya han padecido
anteriormente infecciones urinarias lo que facilita la
aparición de cepas resistentes con mayor frecuencia.
Entre las limitaciones del estudio es importante destacar
que al no contarse con las historias clínicas de los pacientes
no se consideraron datos importantes como el uso de
antibióticos previo al examen de laboratorio. Además, no
se cuenta con información acerca del padecimiento de
infecciones recurrentes u otras patologías que pudieran
haber enriquecido aún más los resultados de esta
investigación. Sin embargo, los datos acerca de bacterias
como E. coli y su capacidad para producir betalactamasas
y carbapenémicos son de gran importancia para evitar la
aparición de cepas cada vez más resistentes, ya que la
vigilancia epidemiológica juega un rol clave en la lucha
contra la resistencia antibiótica.
5. Conclusiones
En conclusión, la bacteria más aislada de infecciones
urinarias fue E. coli, encontrándose alta prevalencia de
cepas productoras de BLEE y carbapenemasas, lo que
evidencia que estos microorganismos ya dejaron de ser
exclusivos de unidades de cuidados intensivos y otros
ambientes de riesgo hospitalario. Cada vez existe mayor
evidencia de su presencia, además aparecen con mayor
frecuencia cepas productoras de carbapenemasas que
limitan aún más las opciones de tratamiento poniendo en
riesgo la salud de los pacientes.
6. Contribución de los autores
SDV y KCT, participaron de la concepción y diseño del estudio, búsqueda bibliográfica, recolección de los datos.
CSCL, participó de la búsqueda bibliográfica, análisis estadístico de los datos y elaboración del borrador del manuscrito y la revisión crítica del contenido intelectual.
FCS y MMM, participaron en la búsqueda bibliográfica, participó en la elaboración del borrador la revisión crítica del contenido intelectual.
Todos los autores aprobaron la versión final del manuscrito.
7. Conflicto de intereses
Los autores declaran que no existe conflicto de interés.
8. Referencias bibliográficas
Alarcón, G., Allauca, M., Tapia, L., & Bastidas, T.M. (2020). Infección
urinaria por Escherichia coli multirresistente. RECIMUNDO,
4(1), 99-107.
Astocondor-Salazar, L. (2018). Betalactamasas: la evolución del
problema. Revista Peruana De Investigación En Salud, 2(2),
42–49.
Cabrera, L., Díaz, L., Díaz, S., Carrasco, A., & Ortiz, G. (2019).
Multirresistencia de Escherichia coli y Klebsiella pneumoniae
provenientes de pacientes con infección del tracto urinario
adquirida en la comunidad. Rev Cubana Med Gen Integr, 35
(1), e814.
Calderón, E., Yagui, M., & Sacsaquispe, C. (2002). Manual de
procedimientos para la prueba de sensibilidad
antimicrobiana por el método de difusión disco. Lima:
Instituto Nacional de Salud.
Calle, A., Colqui, K., Rivera, D. & Cieza, J. Factores asociados a la
presentación de infecciones urinarias por Escherichia coli
productoras de betalactamasas de espectro extendido.
(2017). Rev Med Hered, 28,142-149.
Castillo-Tokumori, F., Irey-Salgado, C., & Málaga, G. (2017).
Worrisome high frequency of extended-spectrum betalactamase-producing Escherichia coli in communityacquired urinary tract infections: a case-control study. Int J
Infect Dis, 55, 16-19.
Castrillón, J., Machado-Alba, J., Gómez, S., Gómez, M., Remolina,
N., & Ríos, J.J. (2019). Etiología y perfil de resistencia
antimicrobiana en pacientes con infección urinaria. Infectio,
23(1), 45-51.
Davila-Bellodas, K., Cruz-Silva, R., Moreno-Mantilla, M., CarrascoSolano, F., Arellano-Sánchez, C., Silva-García, M. & LlocllaGonzales, H. (2018). Etiología, susceptibilidad antibiótica y
detección de betalactamasas en bacterias aisladas de ITU en
pacientes atendidos en el Centro Médico Salud y Vida,
Chiclayo. Revista Experiencia En Medicina Del Hospital
Regional Lambayeque, 4(2), 61 - 66.
Echevarría-Zarate, J., Sarmiento, E., & Osores-Plenge, F. (2006).
Infección del tracto urinario y manejo antibiótico. Acta
Médica Peruana, 23(1), 26-31.
Flores-Mireles, A., Walker, J., Caparon, M., & Hultgren, S. (2015).
Urinary tract infections: epidemiology, mechanisms of
infection and treatment options. Nat Rev Microbiol, 13(5),
269-284.
Galindo-Méndez, M. (2018). Caracterización molecular y patrón de
susceptibilidad antimicrobiana de Escherichia coli
productora de β-lactamasas de espectro extendido en
infección del tracto urinario adquirida en la comunidad.
Revista chilena de infectología, 35(1), 29-35.
García-Tello, A., Gimbernat, H., Redondo, C., Arana, D., Cacho, J.,
Angulo, J. (2014). Betalactamasas de espectro extendido en
las infecciones del tracto urinario causadas por
enterobacterias: aproximación a su conocimiento y pautas de actuación. Actas Urol Esp., 38(10), 678-684.
González, Y., Huayán, G., Zavaleta-Verde, D., Mercado, P., Castillo,
R. (2020). Detección de genes de resistencia a
carbapenémicos en Escherichia coli y Klebsiella pneumoniae
aislados de un centro de salud de Trujillo – Perú. REBIOL,40
(2), 160 –169.
González, J., Maguiña, C., & González, F. (2019). La resistencia a los
antibióticos: un problema muy serio. Acta méd. Peru, 36 (2),
145-151.
Losada, I, Barbeito, G., García-Garrote, F., Fernández-Pérez, B.,
Malvar A., & Hervada, X. (2020). Estudio de sensibilidad de
Escherichia coli productores de infecciones del tracto
urinario comunitarias en Galicia. Período: 2016-2017.
Atención Primaria, 52 (7), 462-468.
Luna-Pineda, V., Ochoa, S., Cruz-Córdova, A., CázaresDomínguez, V., Vélez-González, F., Hernández-Castro, R., &
Xicohtencatl-Cortes, J. (2018). Infecciones del tracto urinario,
inmunidad y vacunación. Boletín médico del Hospital Infantil
de México, 75(2), 67-78.
Malbrán, C. (2014). BLUE CARB-Detección rápida de
carbapenemasas directo de placas de cultivo. Buenos Aires,
INEI-ANLIS.
Mayta-Barrios, M., Ramírez - Illescas, J., Pampa-Espinoza, L., &
Yagui-Moscoso, M. (2021). Caracterización molecular de
carbapenemasas en el Perú durante el 2019. Revista Peruana
de Medicina Experimental y Salud Publica, 38(1), 113-118.
Miranda, J., Pinto, J., Faustino, M., Sánchez-Jacinto, B., & Ramírez,
F. (2019). Resistencia antimicrobiana de uropatógenos en
adultos mayores de una clínica privada de Lima, Perú.
Revista Peruana de Medicina Experimental y Salud Publica,
36(1), 87-92.
Morales-Espinosa, R., Contreras, I., Duran A., Olivares, A., Valencia,
C., García, Y., & González-Pedraza A. (2020). Patterns of in
vitro antimicrobial susceptibility of Gram-negative bacteria
isolated from urinary tract infections in outpatients of a clinic
in southern Ciudad de México. Rev Clin Med Fam,13 (2), 131-
138.
Pacherres-Bustamante, L., Aguilar-Gamboa, F., & Silva-Díaz, H.
(2019). Frecuencia y características epidemiológicas de las
bacterias productoras de betalactamasas de espectro
extendido en la unidad de cuidados intensivos de un
hospital del norte del Perú. Revista Experiencia En Medicina
Del Hospital Regional Lambayeque, 5(2), 70-75.
Poirel, L., Madec, J., Lupo, A., Schink, A., Kieffer, N., Nordmann, P.,
& Schwarz, S. (2018). Antimicrobial Resistance in Escherichia
coli. Microbiol Spectr, 6(4), 1-27.
Quiñones, D., Betancourt, Y., Carmona, Y., Pereda, N., Álvarez, S.,
Soe, M., & Kobayashi, N. (2020). Escherichia coli
extraintestinal, resistencia antimicrobiana y producción de
betalactamasas en aislados cubanos. Revista Cubana de
Medicina Tropical, 72(3), e605.
Rodríguez, J., Gutiérrez, B., & Machuca, I. (2018). Treatment of
infections caused by extended spectrum-betalactamase-,
AmpC- and carbapenemase producing Enterobacteriaceae.
Clin Microbiol Rev, 31 (2), e00079-17.
Saldarriaga, E., Echeverri-Toro, L., & Ospina, S. (2015). Factores
clínicos asociados a multirresistencia bacteriana en un
hospital de cuarto nivel. Infectio, 19(4),161-167.
Sedighi, I., Arabestani, M., Rahimbakhsh, A., Karimitabar, Z., &
Alikhani, M.Y. (2015). Dissemination of Extended-Spectrum
ß-Lactamases and Quinolone Resistance Genes among
Clinical Isolates of Uropathogenic Escherichia coli in
Children. Jundishapur J Microbiol, 8(7), 99-107.
Urquizo, G., Arce, J., & Alanoca, G. (2018). Resistencia bacteriana
por betalactamasas de espectro extendido: un problema
creciente. Rev. Méd. La Paz, 24(2), 77-83.
Valdevenito, J., & Álvarez D. (2018). Infección urinaria recurrente en
la mujer. Revista Médica Clínica Las Condes, 29(2), 222-231.