POTENCIAL BIOFERTILIZANTE DE RIZOBACTERIAS ASOCIADAS A CULTIVOS AMAZÓNICOS DE IMPORTANCIA ECONÓMICA
BIOFERTILIZER POTENTIAL OF RHIZOBACTERIA ASSOCIATED WITH ECONOMICALLY IMPORTANT AMAZONIAN CROPS
Juan Carlos Alvarado-Ibáñez 1 *, José Mostacero-León 2, Mayra Karina Gutiérrez-Araujo 2
1 Universidad Nacional Intercultural “Fabiola Salazar Leguía” de Bagua, Jr. Comercio N° 128, Bagua, Perú
2 Universidad Nacional de Trujillo, Av. Juan Pablo II S/N, Ciudad Universitaria, Trujillo, Perú
Juan Carlos Alvarado-Ibáñez:
Artículo original:
Recibido: 30 marzo 2021
Aceptado: 5 de octubre 2021
Resumen
La rizósfera de los cultivos vegetales posee una gran diversidad microbiana, sobresaliendo la población de bacterias que viven en asociación con las plantas y participan de la nutrición vegetal. Se evaluó el potencial biofertilizante de bacterias nativas aisladas del suelo rizosférico de ocho especies vegetales de importancia económica de las provincias de Bagua y Utcubamba, región Amazonas, Perú. Los criterios de selección fueron, la capacidad solubilizadora de fosfatos, la producción de ácido indol acético y la capacidad de fijación biológica de nitrógeno (FBN), además de cuantificar las bacterias diazotróficas presentes en la rizósfera de cada especie vegetal estudiada. Se colectaron muestras de suelo rizosférico de 57 parcelas ubicadas entre los 385 a 1677 m.s.n.m., mediante siembra directa, se aislaron bacterias, se purificaron y se determinó su grupo funcional. Los suelos estudiados fueron de textura franco-arenosa y franco-limosa principalmente con valores de pH entre 3,30 y 8,09. Se obtuvo 235 aislamientos de bacterias nativas del rizoplano de plantas de cacao, café, piña, plátano, papaya, yuca, yacón y arroz y se seleccionaron 16 de estos cultivos pertenecientes a cuatro especies vegetales. La rizósfera de los cultivos de café posee la mayor cantidad de bacterias fijadoras asimbióticas de nitrógeno, el cacao y el yacón destacan por las bacterias productoras de ácido indol acético, y el café y papaya, por los solubilizadores de fosfatos. Es importante investigar las poblaciones rizósféricas nativas de estos cuatro cultivos vegetales para aislar y seleccionar bacterias con potencial biofertilizante.
Palabras clave: Cultivos amazónicos, fijadores de nitrógeno, productores de ácido indol acético, solubilizadores de fosfatos.
Abstract
The biofertilizer potential of native bacteria isolated from the rhizospheric soil of eight plant species of economic importance from the Bagua and Utcubamba provinces, Amazonas region, Peru, was evaluated. The selection criteria were the solubilizing capacity of phosphates, the production of indole acetic acid and the asymbiotic fixation of atmospheric nitrogen, in addition to quantifying the diazotrophic bacteria present in each plant species studied. 57 plots located between 385 to 1677 m.a.s.l. were sampled, obtaining 235 isolates of native rhizoplane bacteria from cocoa, coffee, pineapple, banana, papaya, yucca, yacon and rice plants. The sampled soils were mainly loamy-sandy and loamy-loamy, with a variable pH between 3.30 and 8.09. Sixteen bacterial cultures of four plant species with biofertilizer potential were selected, finding that the rhizosphere of coffee crops has the highest amount of asbiotic nitrogen fixing bacteria, cocoa and yacon stand out for hosting excellent producers of indole acetic acid coffee and papaya crops, excellent phosphate solubilizers were isolated. In order to replace the use of chemical fertilizers, it is important to investigate the native rhizospheric populations of these four economically important Amazonian crops in search of native bacteria with biofertilizer potential to mitigate the consequences to the environment.
Keywords: Amazonian crops, Biofertilizer potential, plant growth-promoting rhizobacteria.
* Autor para correspondencia: E. mail: jalvarado@unibagua.edu.pe
Citar como:
Alvarado-Ibáñez, J., Mostacero-León, J. & Gutiérrez-Araujo, M. 2021. Potencial biofertilizante de rizobacterias asociadas a cultivos amazónicos de importancia económica. REBIOL, 41(2):156-166.
1. Introducción
El crecimiento exponencial de la población mundial y la demanda de alimentos orgánicos sin contaminar el ambiente, orientan las investigaciones hacia los microorganismos con potencial biofertilizante, debido a que se ha demostrado que el uso excesivo de fertilizantes químicos provoca una disminución de la fertilidad del suelo (Lin et al., 2019), afecta la composición de las comunidades microbianas y una serie de problemas ambientales, mientras que los biofertilizantes incrementan la fertilidad del suelo (Chen et al., 2016). Para mejorar la producción sin el uso de fertilizantes de origen sintético, se incrementó el interés en los microorganismos benéficos del suelo porque pueden promover el crecimiento de las plantas y, en algunos casos, evitar infecciones del tejido vegetal por patógenos (Moreno et al., 2018).
Los microorganismos al interaccionar con las plantas, desempeñan un rol importante en la fertilización de los suelos, en especial, de los suelos amazónicos que están meteorizados y son relativamente pobres en nutrientes (Magalhães et al., 2014; Quesada et al., 2011). Debido a su gran diversidad biológica y geográfica, la rizósfera de las especies vegetales cultivadas en la región Amazonas, cuenta con una abundante microbiota que debería estudiarse a detalle, donde ocurren numerosas interacciones entre las plantas y sus microorganismos. Los microbios del suelo pueden ser atraídos o repelidos por las moléculas liberadas por las diversas especies vegetales (Medina et al., 2014), sin embargo, la mejora del crecimiento y la productividad es influenciada por la exudación de las raíces de las plantas, la colonización bacteriana en las raíces y la salud del suelo (Fanin et al., 2015).
La diversidad de los microorganismos nativos adaptados a vivir en la rizósfera de las plantas de la amazonía, han desarrollado mecanismos de interacción, que permiten colonizar eficazmente la superficie de las raíces de las plantas formando un microecosistema rizosférico mantenido por la agricultura tradicional que se practica en esta zona del país. La interacción rizosférica entre el microbio y la planta, cumple un rol importante para la salud, la productividad de las plantas y la fertilidad del suelo. Las bacterias promotoras del crecimiento vegetal pueden mejorar el crecimiento (Salazar-Henao et al., 2016), protegerlas de enfermedades y estrés abiótico por diversos mecanismos tales como la fijación biológica de nitrógeno, la solubilización de fosfato, la actividad de la enzima ACC desaminasa, la producción de sideróforos y fitohormonas (Banerjee et al., 2017; Souza et al., 2015).
El nitrógeno forma parte de las moléculas biológicas y es el nutriente más requerido por las plantas. La atmósfera representa su mayor potencial biológico de reserva al cual acceden pocos microorganismos fijándolos de manera simbiótica o en vida libre. La elevada necesidad de este elemento incrementa los estudios de las bacterias fijadoras de nitrógeno en plantas de familias diferentes a las leguminosas, destacando la importancia de cuantificar laspoblaciones de bacterias fijadoras asimbióticas de nitrógeno (diazótrofas), utilizando la técnica de Número Más Probable (Argüello et al., 2016), con la finalidad de reducir los impactos negativos que genera la implementación de agroquímicos sobre el medio ambiente para implementar sistemas de agricultura limpia y sustentable, donde las bacterias diazotróficas son una alternativa para la fertilización de los cultivos de una forma más amigable con el ambiente (Jones & Oburger, 2011; Kaschuk & Hungria, 2017; Shin et al., 2016).
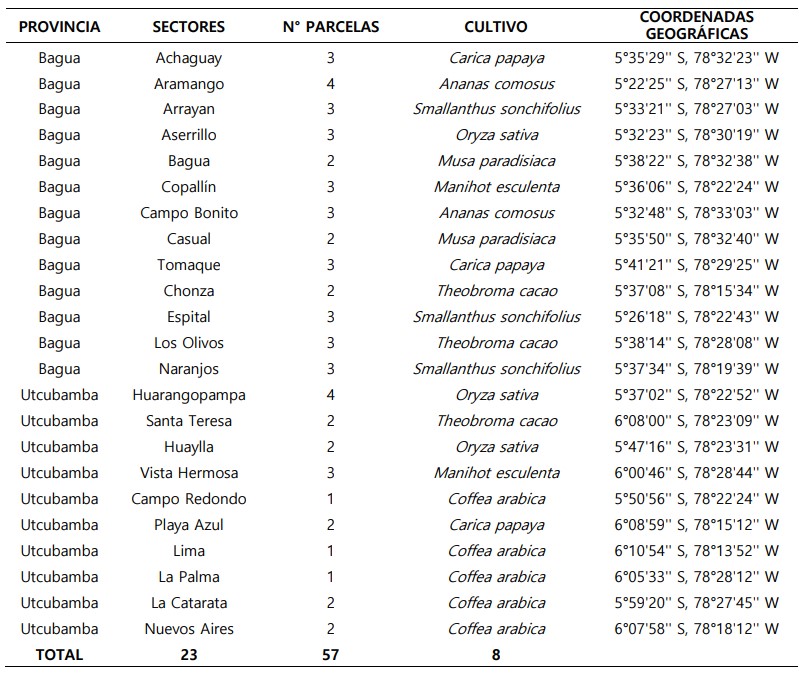
El Perú es un país agrícola y la agricultura está en constante crecimiento económico (Nehra et al., 2016). Las provincias de Bagua y Utcubamba de la región Amazonas, ubicadas en la zona nororiental del país, sustentan su economía en la agricultura y los principales cultivos de interés económico son el cacao, café, piña, plátano, papaya, yuca, yacón y arroz, este último, ampliamente cultivado en las riberas de los principales ríos de la región.
A excepción del arroz, la mayoría de estos cultivos no están bajo una agricultura intensiva, que afecta las funciones del ecosistema y disminuye la diversidad biológica (Landeros-Sánchez et al., 2011); sin embargo, estos mismos cultivos permanecen por largos periodos de tiempo, generando la disminución de materia orgánica y propiciando la progresiva disminución de la fertilidad de los suelos (Duval et al., 2015; Fernández-Ojeda et al., 2016) y cambios en las comunidades microbianas del suelo (Myrold et al., 2014; Wang et al., 2017).
La región Amazonas es conocida por la enorme diversidad de su flora y fauna, sin embargo, a pesar de los estudios realizados sobre biodiversidad, es necesario profundizar las investigaciones para conocer y conservar los recursos genéticos propios de esta región. Existen pocos estudios relacionados a las poblaciones microbianas y su variabilidad genética, sin mencionar que solo entre 1 y 3% de las bacterias del suelo pueden ser cultivadas en medios sintéticos de laboratorio (Rahman et al., 2017), además, los suelos amazónicos son geomorfológicamente diversos (Quesada et al., 2011), y las comunidades vegetales influyen en la diversidad de filos de las comunidades bacterianas en el suelo (Barbosa et al., 2015).
Las bacterias adaptadas a un ecosistema y una región determinada podrían ser más competitivas que las bacterias foráneas o introducidas (Karagoz et al., 2012), por lo tanto, es importante aislar y seleccionar estas bacterias nativas, orientadas al desarrollo de inoculantes destinados a cultivos regionales. Vanegas et al. (2012) afirma que el desarrollo de biofertilizantes debe iniciarse con el aislamiento de microorganismos de interés y la caracterización de los mecanismos asociados con la promoción del crecimiento vegetal. Se ha estudiado las rizobacterias promotoras de crecimiento vegetal, orientando las investigaciones al aislamiento e identificación de cultivos provenientes de arroz (Ríos-Ruiz et al., 2020; Sahoo et al., 2014; Souza et al., 2015), maíz (López-Ortega et al., 2013), plátano (Andrade et al., 2014) y hortalizas como el cilantro y lechuga (Cárdenas et al., 2013).
La búsqueda y el aislamiento de microorganismos nativos con capacidad biofertilizante es importante para reducir el uso de fertilizantes de síntesis química (Banerjee et al., 2017). La reducción o eliminación de estos fertilizantes es posible con inoculantes eficientes, para lo cual, las bacterias nativas deben establecerse y adaptarse exitosamente en estrecha relación con los cultivos de la zona y bajo condiciones particulares de clima y suelo, propios de las provincias de Bagua y Utcubamba. Es por ello que el presente trabajo estuvo orientado a estudiar el potencial biofertilizante de bacterias nativas aisladas de la rizósfera de ocho cultivos amazónicos, como una herramienta biotecnológica para mejorar la disponibilidad de nutrientes en el suelo y lograr disminuir los efectos ambientales causados por el exceso de fertilizantes químicos.
2. Materiales y Métodos
Descripción del área de estudio
El estudio se realizó entre los años 2019 y 2020 en las
provincias de Bagua y Utcubamba de la región Amazonas,
en el nororiente del Perú (Figura 1). Se analizaron muestras
de suelo rizosférico de 57 parcelas ubicadas entre los 385
a 1677 m.s.n.m., de 23 sectores agrícolas cultivados con
ocho especies vegetales de importancia económica (Tabla
1).
Se realizó el análisis de textura del suelo de las parcelas
muestreadas utilizando el hidrómetro de Bouyoucos y las
clases de textura se calcularon según el triángulo de
textura (Bouyoucos, 1962; Quesada et al., 2011),
obteniendo suelos de textura franco-arenosa y francolimosa principalmente y el pH se determinó en una
suspensión de suelo: agua destilada (1:1), encontrando
valores entre 3,30 y 8,09 (Agriculture, 2019).
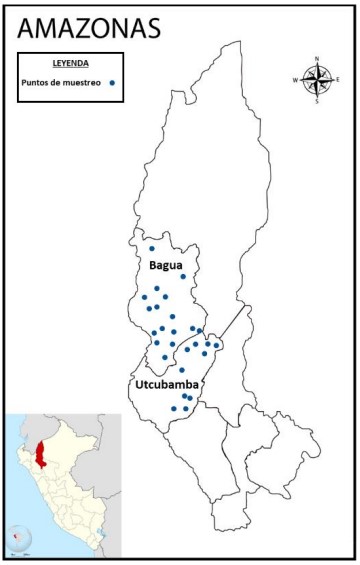
Figura 1. Puntos de muestreo de 23 sectores agrícolas cultivados con especies vegetales de importancia económica en Bagua y Utcubamba, región Amazonas, Perú.
Tabla 1. Distribución de sectores, número de parcelas, coordenadas geográficas y cultivo vegetal muestreado en las provincias de Bagua y Utcubamba.
Aislamiento de rizobacterias de plantas amazónicas
Se aislaron bacterias promotoras del crecimiento vegetal
provenientes de la rizósfera de plantas amazónicas
cultivadas en las provincias de Bagua y Utcubamba de la
región Amazonas, Perú. Estos aislamientos se realizaron a
partir de muestras de suelo rizosférico; obtenido de 10
submuestras de la misma parcela, tomados con una
palana recta hasta los 30 cm de profundidad; en una
cantidad de 500 g, que fueron transportados en un
contenedor con hielo seco hasta el laboratorio de Biología
y Biotecnología de la Universidad Nacional Intercultural
Fabiola Salazar Leguía de Bagua, para su posterior
procesamiento. El aislamiento se realizó mediante
diluciones decimales seriadas en agua peptonada hasta
1x10-6
(Reyes et al., 2006), inoculando a los medios de
cultivo en placas de Petri con 100 µL de las diluciones 10-5
y 10-6
. En el aislamiento se emplearon Agar nutritivo
(Merck®), Agar Tripticasa soya (HiMedia®) y Agar de
aislamiento de Actinomicetos (HiMedia®) para favorecer
la diversidad y el crecimiento bacteriano. Cada
rizobacteria nativa fue sembrada por puntura superficial
con el asa bacteriológica en anillo (0,4 cm de diámetro),
sobre medios de cultivo específico y fueron incubados a
28 °C, por 72 horas en aerobiosis. Las bacterias purificadas
se conservaron a -20 °C en glicerol estéril al 30% y se
realizó pruebas de tinción Gram para determinar sus
características microscópicas.
Evaluación de los mecanismos de promoción de crecimiento de las cepas aisladas
Determinación cualitativa de bacterias solubilizadoras de fosfato
Una colonia de cada cepa fue cultivada en caldo nutritivo
e incubado bajo condiciones de agitación, a 30°C por 24
horas. Las placas de Agar Pikovskaya´s (bioWORLD®)
fueron sembradas colocando 10 µL en el centro de la placa
para determinar su actividad solubilizadora. El tamaño de
los halos se calculó con el Índice de solubilización (IS):
IS=A/B (A: diámetro de la colonia + diámetro del halo y B:
diámetro de la colonia) (Khan et al., 2010), seleccionando
los cultivos que mostraron IS mayores a 3; las mediciones
se realizaron por triplicado 7 días después de la siembra.
Los cultivos bacterianos se mantuvieron en incubadora a
28°C y luz artificial.
Determinación de bacterias productoras de ácido indol acético (AIA)
Para la determinación de ácido indol acético según la
reacción colorimétrica de Salkowski (Cardenas & Eduardo,
2007; García et al., 2010), cada bacteria nativa fue cultivada
en 5 mL de caldo nutritivo por 24 horas, de donde se
tomaron 0,6 mL para inocularlos en 5 mL de caldo
tripticasa soya suplementado con L-triptófano 5 mM.
Después de la incubación a 28ºC, por 72 horas, en
agitación constante (150 rpm), los cultivos fueron
centrifugados a 6000 rpm, durante 15 minutos. A
continuación 0,4 mL de cada uno de los sobrenadantes se
depositaron en tubos, se agregaron 1,6 mL del reactivo de
Salkowski modificado en una relación 1:4, se mezclaron y
se dejaron en reposo durante 30 minutos, en oscuridad.
La positividad a la producción de ácido indol acético
estuvo dada por una coloración grosella y se leyó la
absorbancia en espectrofotómetro de luz visible a 530 nm,
seleccionando a los aislamientos bacterianos con AIA >
12,0 µg/mL (Sosa et al., 2019).
Determinación de bacterias fijadoras asimbióticas de nitrógeno atmosférico
La detección de nitrógeno fijado in vitro se realizó según
(Cadena & Martínez, 2020). Cada bacteria se sembró en 6
mL de medio semisólido Norris Glucose Nitrogen Free
Medium (HiMEDIA®), con azul de bromotimol para
indicar la producción de ácidos en el medio. La incubación
se realizó en aerobiosis, a 28ºC, hasta por una semana y
se consideró como fijadoras de nitrógeno, aquellas donde
se observó su película gruesa blanquecina entre 3 a 5 mm
bajo la superficie del medio de cultivo y el viraje del
indicador.
Cuantificación de bacterias diazótrofas a partir de suelo rizosférico
De cada parcela muestreada, se tomó una muestra de 10
g de suelo y se agregó en un matraz con 90 mL de
solución salina 0,85% agitándose con fuerza, para
posteriormente realizar diluciones decimales hasta 10-4, inoculando 1 mL de las diluciones 10-2 hasta 10
-4 en tubos
que contienen Norris Glucose Nitrogen Free Medium con
azul de bromotimol (Ahemad & Kibret, 2014). Se
consideraron 3 tubos por dilución, incubándose a 28°C
por 7 a 10 días y los datos de la cuantificación por Número
Más Probable (NMP) de las bacterias diazótrofas, se
interpretaron según la tabla de McCrady (Döbereiner et
al., 1995), contando los tubos positivos de cada una de las
diluciones observando viraje de color, turbidez y la
formación de un velo en la superficie del caldo,
reportando en NMP/g (gramo de rizósfera seca).
3. Resultados
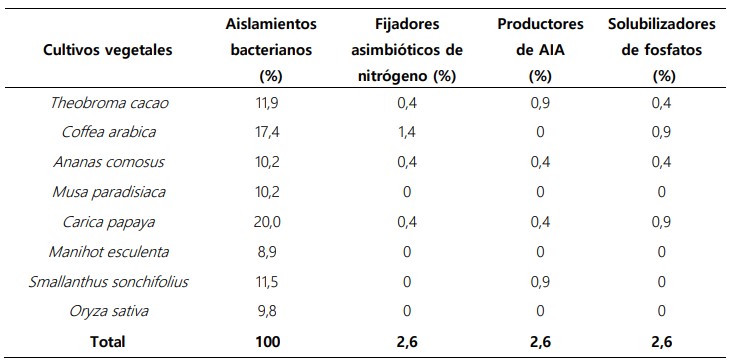
A partir de la rizósfera de cultivos amazónicos de
importancia económica de las provincias de Bagua y
Utcubamba, se aislaron 235 cultivos bacterianos, de los
cuales 28 fueron obtenidos de las plantas de Theobroma
cacao (11,9%), 41 de Coffea arabica (17,4%), 24 de Ananas
comosus (10,2%), 24 de Musa paradisiaca (10,2%), 47 de
Carica papaya (20%), 21 de Manihot esculenta (8,9%), 27
de Smallanthus sonchifolius (11,5%) y 23 de Oryza sativa
(9,8%) (Tabla 2). Siguiendo los criterios de selección de
bacterias con potencial biofertilizante (Tang et al., 2020;
Banerjee et al., 2017; Medina et al., 2014), se seleccionaron
seis cultivos bacterianos por cada criterio. Los criterios de
selección fueron tres; la capacidad de fijación asimbiótica
de nitrógeno (presencia de acidez y película), la
producción de ácido indolacético (AIA>12,0 µg/mL), y la
solubilización de fosfatos (IS>3).
Tabla 2. Porcentaje de rizobacterias aisladas de cultivos vegetales de Bagua y Utcubamba, con potenciales características biofertilizantes.
La actividad promotora del crecimiento vegetal se
determinó in vitro y se seleccionaron 16 cultivos
bacterianos; de los cuales siete fueron aislados de la
rizósfera de C. arabica (CF03, CF05, CF10, CF13, CF14, CF20
y CF30); cuatro de C. papaya (PA07, PA10, PA13 y PA18),
tres de T. cacao (CC01, CC02 y CC10) y dos de A. comosus
(PN03 y PN09). Así tenemos los cultivos seleccionados
como solubilizadores de fosfatos (CC02, CF10, CF14, PA10,
PA13 Y PN03), los productores de ácido indol acético
(CC10, CF05, CF20, CF30, PA07 y PN09), y los fijadores
asimbióticos de nitrógeno (CC01, CF03, CF10, CF13, PA18 y
PN03); dos de los cultivos aislados poseen más de una
actividad de promoción del crecimiento vegetal (CF10 y
PN03), provenientes de la rizósfera de café y piña
respectivamente demostraron fijar el nitrógeno de manera
asimbiótica y solubilizar los fosfatos. El cultivo de café
presenta la mayor cantidad de bacterias fijadoras
asimbióticas de nitrógeno atmosférico, el cacao y el yacón,
los mejores productores de ácido indol acético, el café y la
papaya destacan por las bacterias con los mayores índices
de solubilización de fosfato tricálcico (Tabla 2).
A partir de las muestras de suelo tomadas (Tabla 1) de
cada una de las parcelas de textura franco-arenosa y
franco-limosa principalmente y pH variable entre 3,30 y
8,09 se cuantificó la población de bacterias diazotróficas
de la rizósfera de los cultivos de importancia económica de las provincias de Bagua y Utcubamba de la región
Amazonas, Perú. La población de bacterias diazótrofas en
los ocho cultivos vegetales investigados fue variado,
obteniendo poblaciones mayores a los 1100 NMP/g de
suelo y también hubo muestras con cantidades por debajo
de los 3 NMP/g suelo. Utilizando la técnica de NMP, se
determinó como positivos aquellos crecimientos
bacterianos que presentaron acidez, turbidez y formación
de película a 28°C entre 7 a 10 días de incubación (Figura
2).

Figura 2. Evaluación del crecimiento de bacterias diazótrofas por el método de NMP, en suelo rizosférico de cultivos de importancia económica de las provincias de Bagua y Utcubamba, región Amazonas, Perú.
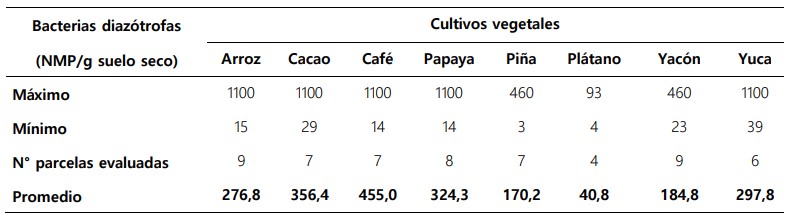
Según la técnica de NMP, los cultivos de C. arabica (café),
T. cacao (cacao) y C. papaya (papaya) presentaron la
máxima cantidad promedio de bacterias diazótrofas,
seguido de M. esculenta (yuca), O. sativa (arroz), S.
sonchifolius (yacón), A. comosus (piña) y por último M paradisiaca (plátano). En la rizósfera de los cultivos de café
se encontró la mayor cantidad promedio de bacterias
diazótrofas (455 NMP/g suelo seco) y en la rizósfera del
plátano las menores poblaciones promedio de estas
bacterias (40,8 NMP/g suelo seco) (Tabla 3).
Tabla 3. Cuantificación de bacterias diazótrofas por la técnica de Número Más Probable, a partir de suelo rizosférico y su relación con el cultivo vegetal.
4. Discusión
La región amazónica destaca por su prometedora
diversidad de organismos del suelo, principalmente los
microorganismos (Ferreira et al., 2018; Giraldo et al., 2013;
Lin et al., 2019), con múltiples ecosistemas que albergan
rizobacterias nativas adaptadas a estas condiciones
climáticas de bosques tropicales húmedos. La actividad
de promoción del crecimiento de las bacterias rizosféricas
de los cultivos vegetales es estudiada por diversos
investigadores en el mundo, demostrando la gran
potencialidad de encontrar bacterias biofertilizantes en
cultivos como, maíz, ají, calabaza (Medina et al., 2014),
totora y arroz silvestre (Teng et al., 2019), caña de azúcar,
árboles frutales (Moreno & Galvis, 2013), cebolla (Afa et al.,
2020), nueces (Sutariati et al., 2020), entre otros; en el Perú
se reporta estas bacterias en cultivos como el café (Curi et
al., 2019), cultivos andinos (Ogata-Gutiérrez et al., 2017),
tara (Cordero et al., 2017) y arroz (Ríos-Ruiz et al., 2020)
sin encontrar investigaciones de estas bacterias en las
provincias de Bagua y Utcubamba de la región Amazonas,
Perú, siendo este un reporte preliminar que demuestra la
existencia de estas bacterias rizosféricas con potencial
biotecnológico como biofertilizantes.
La población de bacterias rizosféricas nativas de los
cultivos de T. cacao, A. comosus y C. papaya (Tabla 2) se
destacan por poseer más de una actividad de promoción del crecimiento vegetal como fijación biológica de
nitrógeno, solubilización de fosfatos y producción de
ácido indolacético, al igual que los resultados obtenidos
en el cultivo de C. arabica obtenido por Curi et al. (2019)
en la provincia de Chanchamayo con una geografía y
clima parecido a las provincias de Bagua y Utcubamba. Sin
embargo, los cultivos bacterianos asilados a partir de M.
esculenta, S. sonchifolius, O. sativa y M. paradisiaca,
presentaron nula actividad promotora del crecimiento,
con excepción de algunas muestras del cultivo de S.
sonchifolius, del cual se aislaron solo bacterias
productoras de ácido indol acético. Esto podría explicarse
debido a que la población nativa de bacterias rizosféricas
promotoras del crecimiento vegetal se ve amenazada por
la sobreexplotación de los suelos, el uso de pesticidas y la
agricultura intensiva (Urgiles-Gómez et al., 2021), que se
practica desde hace mucho tiempo en el cultivo de arroz
en las provincias de Bagua y Utcubamba.
A partir de la rizósfera de C. arabica, se logró aislar la
mayor cantidad de bacterias promotoras del crecimiento
vegetal (Tabla 2) con posible potencial biofertilizante,
comparado con los otros cultivos de importancia
económica en estudio, lo cual concuerda con los
resultados reportados por Muleta et al. (2013). Por otro
lado, investigadores como Andrade et al. (2014) y Koua et
al. (2020), reportan mayor número de aislamientos con potencial biofertilizante en banano y cacao
respectivamente. Habibi et al. (2019), reporta la
predominancia de cultivos bacterianos productores de
ácido indol acético, comparado con las bacterias fijadoras
de nitrógeno y las solubilizadoras de fosfatos, lo que se
asemeja con los resultados encontrados por (Alori et al.,
2017), que concluye que los géneros microbianos capaces
de solubilizar fosfatos, son escasos, sin embargo, en este
estudio de los suelos rizosféricos de las provincias de
Bagua y Utcubamba, las bacterias solubilizadoras de
fosfatos son abundantes, a pesar que en los suelos
tropicales ácidos, el fósforo es uno de los macronutrientes
más limitados disponibles para las plantas (Panhwar et al.,
2014; Rengel & Marschner, 2005).
El pH del suelo influye significativamente en la
composición de la comunidad de bacterias rizosféricas
(Edwards et al., 2015; Pii et al., 2016), y las bacterias aisladas
con potencial biofertilizante provienen de suelos con
amplio rango de pH, desde 3,30 hasta 8,09, siendo el
cultivo de piña el que presentó el menor pH. La
adaptabilidad de estos microorganismos para colonizar
estos tipos de suelo, constituye una gran ventaja para ser
utilizados como parte de consorcios microbianos
biofertilizantes en suelos ácidos y alcalinos (Tang et al.,
2020). Los suelos muestreados en este estudio tienen
características variadas; dependientes de la altitud sobre el
nivel del mar y la geografía de la región Amazonas;
poseen poblaciones microbianas muy heterogéneas que
determinan el tipo y cantidad de exudados radiculares de
las plantas, modificando las propiedades químicas como
el pH del suelo (Wang et al., 2017), así también se conoce
que el pH es considerado un factor dominante que afecta
la función de la microbiota (Zheng et al., 2019).
Tres de los cultivos vegetales estudiados son monocultivos
(arroz, cacao y café), y la mayoría de ciclo perenne, que
viven en microecosistemas establecidos por largo periodo
de tiempo y sus raíces garantizan la producción de
metabolitos secundarios en cantidades suficientes para el
desarrollo vegetal (Patel et al., 2020), pero a diferencia de
los otros cultivos, a partir de la rizósfera de O. sativa no se
aislaron bacterias con características sobresalientes como
biofertilizantes, en contraste con estudios realizados por
otros investigadores (de Souza et al., 2013; Habibi et al.,
2019; Ríos-Ruiz et al., 2020). Cultivos vegetales con disminuida cantidad de bacterias PGPR son vulnerables al
ataque de patógenos y a la falta de absorción de
nutrientes (Fatawi et al., 2021), porque se ha demostrado
que las bacterias promotoras del crecimiento vegetal
determinan la configuración de la arquitectura de la raíz
mediante interacciones directas (mediada por el genoma)
o indirectas (mediada por metabolitos, compuestos
orgánicos volátiles y producción de enzimas) con las
plantas, proporcionando mayor estabilidad de la planta y
absorción de nutrientes y agua del suelo
(Kalyanasundaram et al., 2021), que ayuda a superar el
estrés por salinidad y mitigar la pérdida en la
productividad (Bhat et al., 2020).
Los ocho cultivos amazónicos estudiados tienen bacterias
diazotróficas rizosféricas en cantidades variables
dependiendo del cultivo vegetal (Tabla 3). Utilizando la
técnica de NMP (Figura 2), estas bacterias se cuantificaron
y por lo menos una de las muestras de suelo de café,
cacao, papaya, arroz y yuca, alcanzaron la máxima
cuantificación y en menor cantidad en el cultivo de piña,
yacón y plátano. Las bacterias diazotróficas asociadas a los
vegetales; además, de aportar con nitrógeno también
podrían disminuir los efectos nocivos de las plagas
(Hernández-Rodríguez et al., 2014). Estas bacterias
fijadoras de nitrógeno suelen adaptarse a las condiciones
edafoclimáticas de la región y son predominantes en los
cultivos perennes (Bello et al., 2015), como el café, cacao,
papaya, yuca, arroz, yacón, piña y plátano, lo cual explica
la mayor cantidad promedio de estas bacterias en relación
a los cultivos vegetales, respectivamente.
Los suelos tropicales de las provincias de Bagua y
Utcubamba de la región Amazonas, se caracterizan por
presentar deficiencia en materia orgánica y en
consecuencia, son bajos en nitrógeno (Etesami & Adl,
2020), sin embargo, los suelos cafetaleros poseen cepas
de microorganismos con alto potencial biotecnológico
como biofertilizantes que promueven el crecimiento de las
plantas (Santana-Aragone et al., 2017). Las rizobacterias
nativas aisladas contribuyen principalmente a la fijación
biológica de nitrógeno atmosférico en el suelo (Riaz et al.,
2021), la solubilización de fosfatos y la producción de ácido
indol acético, proporcionan un soporte biotecnológico
para la agricultura sustentable, la producción de alimentos
orgánicos y una alternativa para contrarrestar los impactos ambientales adversos ocasionados por el uso
indiscriminado de fertilizantes químicos (Basu et al., 2021),
además, el empleo de estas bacterias ayuda a diseñar
estrategias para tecnologías agrícolas sostenibles,
respetuosas con el medio ambiente y climáticamente
inteligentes (Bhat et al., 2020).
5. Conclusiones
La rizósfera de los cultivos de importancia económica de
las provincias de Bagua y Utcubamba, región Amazonas,
Perú, poseen bacterias con potencial biofertilizante
asociadas a cultivos amazónicos, principalmente café,
cacao, papaya y piña.
La rizósfera de estos cultivos alberga gran variedad de
bacterias fijadoras asimbióticas de nitrógeno, productoras
de ácido indol acético y solubilizadoras de fosfatos, sin
embargo, la rizósfera de café no presentó bacterias
productoras de auxinas, pero si la mayor cantidad de
bacterias diazotróficas.
6. Contribución de los autores
J.A., J.M. y M.G.: Concepción, diseño, recolección de datos, revisión crítica del artículo y aprobación de la versión final.
J.A. y M.G.: Bioensayos en campo y laboratorio. Todos los autores han leído el manuscrito final y aprobado la versión.
7. Conflicto de intereses
Los autores declaran no tener conflictos de intereses.
8. Referencias bibliográficas
Afa, M., Sadimantara, G., Rahni, N., & Sutariati, G. (2020). Isolation &
Characterization Of Rhizobacteria From Local Shallots Rhizosphere As
Promoting Growth Of Shallot (Allium Ascalonicum L.). 9(03), 6.
Agriculture, U. S. (2019). Soil Survey Field and Laboratory Methods ManualSoil Survey Investigations Report No. 51 (Version 2) Issued 2014.
Ahemad, M., & Kibret, M. (2014). Mechanisms and applications of plant
growth promoting rhizobacteria: Current perspective. Journal of King
Saud University - Science, 26(1), 1-20.
Alori, E., Glick, B., & Babalola, O. (2017). Microbial Phosphorus
Solubilization and Its Potential for Use in Sustainable Agriculture.
Frontiers in Microbiology, 8. https://doi.org/10.3389/fmicb.2017.00971
Andrade, L., de Souza, G., Nietsche, S., Xavier, A., Costa, M., Cardoso, A.,
Pereira, M., & Pereira, D. (2014). Analysis of the abilities of endophytic
bacteria associated with banana tree roots to promote plant growth.
Journal of Microbiology (Seoul, Korea), 52(1), 27-34.
Argüello Navarro, A., Madiedo Soler, N., & Moreno Rozo, L. (2016). Cuantificación de bacterias diazótrofas aisladas de suelos cacaoteros (Theobroma cacao L.), por la técnica de Número Más Probable (NMP). Revista Colombiana de Biotecnología, 18(2), 40-47.
Banerjee, A., Bareh, D., & Joshi, S. (2017). Native microorganisms as potent
bioinoculants for plant growth promotion in shifting agriculture
(Jhum) systems. Journal of Soil Science and Plant Nutrition, ahead,
17(1), 127-140.
Barbosa, A., Cannavan, F., Navarrete, A., Teixeira, W., Kuramae, E., & Tsai,
S. (2015). Amazonian Dark Earth and Plant Species from the Amazon
Region Contribute to Shape Rhizosphere Bacterial Communities.
Microbial Ecology, 69(4), 855-866.
Basu, A., Prasad, P., Das, S., Kalam, S., Sayyed, R., Reddy, M., & El Enshasy,
H. (2021). Plant Growth Promoting Rhizobacteria (PGPR) as Green
Bioinoculants: Recent Developments, Constraints, and Prospects.
Sustainability, 13(3), 1140.
Bello, O., García, J., & Cuervo, W. (2015). Cuantificación de diazótrofos en
la rizósfera del olivo (Olea europaea L.) cultivado en Boyacá,
Colombia. Acta Agronómica, 65(2), 109-115.
Bhat, M., Kumar, V., Bhat, M., Wani, I., Dar, F., Farooq, I., Bhatti, F., Koser,
R., Rahman, S., & Jan, A. (2020). Mechanistic Insights of the Interaction
of Plant Growth-Promoting Rhizobacteria (PGPR) With Plant Roots
Toward Enhancing Plant Productivity by Alleviating Salinity Stress.
Frontiers in Microbiology, 11, 1-20.
Bouyoucos, G. (1962). Hydrometer Method Improved for Making Particle
Size Analyses of Soils1. Agronomy Journal, 54(5), 464-465.
Cadena, S., & Martínez, B. (2020). Caracterización de cepas nativas de
Pseudomonas spp. Y su efecto en_x000D_ la germinación y
emergencia de Zea mays L. «maíz» en Lambayeque. [Tesis de
Bachiller, Universidad Nacional Pedro Ruiz Gallo].
Cárdenas, D., Ramírez, L., & Moreno, L. (2013). Caracterización de
actividades promotoras del crecimiento vegetal por rizobacterias y su
efecto en cultivo de cilantro (Coriandrum sativum L.). Ecoe:
Universidad Francisco de Paula Santander.
Cardenas, M., & Eduardo, M. (2007). Evaluación de la acción de un
bioinoculante sobre un cultivo de crisantemo (Chrysanthemun
morifolium var. Yoko ono) en período de enraizamiento. [Tesis título,
Universidad Nacional Javeriana].
Chen, C., Zhang, J., Lu, M., Qin, C., Chen, Y., Yang, L., Huang, Q., Wang, J.,
Shen, Z., & Shen, Q. (2016). Microbial communities of an arable soil
treated for 8 years with organic and inorganic fertilizers. Biology and
Fertility of Soils, 52(4), 455-467.
Cordero, I., Ruiz-Díez, B., Balaguer, L., Richter, A., Pueyo, J., & Rincón, A.
(2017). Rhizospheric microbial community of Caesalpinia spinosa
(Mol.) Kuntze in conserved and deforested zones of the Atiquipa fog
forest in Peru. Applied Soil Ecology, 114, 132-141.
Curi, M., Jiménez, V., & Ibarra, J.(2019). Cepas bacterianas nativas con
actividades promotoras del crecimiento vegetal aisladas de la
rizosfera de Coffea spp. En Pichanaqui, Perú. Biotecnología Vegetal,
19(4), 285-295.
De Souza, R., Beneduzi, A., Ambrosini, A., da Costa, P., Meyer, J., Vargas,
L., Schoenfeld, R., & Passaglia, L. M. (2013). The effect of plant growthpromoting rhizobacteria on the growth of rice (Oryza sativa L.)
cropped in southern Brazilian fields. Plant and Soil, 366(1-2), 585-603.
Döbereiner, J., Baldani, V., & Baldani, J. (1995). Como isolar e identificar
bactérias diazotróficas de plantas não-leguminosas. Embrapa SPI.
Duval, M., Capurro, J., Galantini, J., & Andriani, J. (2015). Utilización de
cultivos de cobertura en monocultivo de soja: Efectos sobre el balance
hídrico y orgánico. Cienc Scielo 33(2, 247-261).
Edwards, J., Johnson, C., Santos-Medellín, C., Lurie, E., Podishetty, N.,
Bhatnagar, S., Eisen, J., & Sundaresan, V. (2015). Structure, variation,
and assembly of the root-associated microbiomes of rice.
Proceedings of the National Academy of Sciences, 112(8), E911-E920.
Etesami, H., & Adl, S. (2020). Plant Growth-Promoting Rhizobacteria
(PGPR) and Their Action Mechanisms in Availability of Nutrients to
Plants. En M. Kumar, V. Kumar, & R. Prasad (Eds.), Phyto-Microbiome
in Stress Regulation (pp. 147-203). Springer.
Fanin, N., Hättenschwiler, S., Schimann, H., & Fromin, N. (2015). Interactive
effects of C, N and P fertilization on soil microbial community
structure and function in an Amazonian rain forest. Functional
Ecology, 29(1), 140-150.
Fatawi, A., Pujiasmanto, B., Komariah, Zaki, M., & Noda, K. (2021).
Application of organic amendments and PGPR on Salibu Rice yield for
drought adaptation. IOP Conference Series: Earth and Environmental
Science, 824(1), 012079.
Fernández-Ojeda, P., Acevedo, D., Villanueva-Morales, A., Uribe-Gómez,
M., Fernández-Ojeda, P., Acevedo, D., Villanueva-Morales, A., &
Uribe-Gómez, M. (2016). State of the essential chemical elements in
the soils of natural, agroforestry and monoculture systems. Revista
Mexicana de Ciencias Forestales, 7(35), 65-77.
Ferreira, L. de V. M., Carvalho, F. de, Andrade, J., & Moreira, F. de S. (2018).
Growth promotion of common bean and genetic diversity of bacteria
from Amazon pastureland. Scientia Agricola, 75(6), 461-469.
García, F., Muñoz, H., Carreño, C., & Mendoza, G. (2010). Characterization
of native strains of Azospirillum spp. And its effect on growth of Oryza
sativa L. “rice” in Lambayeque. Scientia agropecuaria, 107-116.
Giraldo, M., Ramírez J., Galán, A., & Naciones Unidas (Eds.). (2013).
Amazonia posible y sostenible. Naciones Unidas.
Habibi, S., Djedidi, S., Ohkama-Ohtsu, N., Sarhadi, W., Kojima, K., Rallos, R.,
Ramirez, M., Yamaya, H., Sekimoto, H., & Yokoyama, T. (2019).
Isolation and Screening of Indigenous Plant Growth-promoting
Rhizobacteria from Different Rice Cultivars in Afghanistan Soils.
Microbes and Environments, 34(4), 347-355.
Hernández-Rodríguez, A., Rives-Rodríguez, N., Acebo-Guerrero, Y., Diazde la Osa, A., Heydrich-Pérez, M., & Divan Baldani, V. (2014).
Potencialidades de las bacterias diazotróficas asociativas en la
promoción del crecimiento vegetal y el control de Pyricularia oryzae
(Sacc.) en el cultivo del arroz (Oryza sativa L.). Revista de Protección
Vegetal, 29(1), 1-10.
Jones, D., & Oburger, E. (2011). Solubilization of Phosphorus by Soil
Microorganisms. En Phosphorus in Action (Vol. 26, pp. 169-198).
Kalyanasundaram, G., Syed, N., & Subburamu, K. (2021). Chapter 17-
Recent developments in plant growth-promoting rhizobacteria
(PGPR) for sustainable agriculture. En B. Viswanath (Ed.), Recent
Developments in Applied Microbiology and Biochemistry (pp. 181-
192). Academic Press.
Karagoz, K., ateş, F., Karagöz, H., & Çakmakçı, R. (2012). Characterization
of plant growth-promoting traits of bacteria isolated from the
rhizosphere of grapevine grown in alkaline and acidic soils. European
Journal of Soil Biology, 50, 144-150.
Kaschuk, G., & Hungria, M. (2017). Diversity and Importance of
Diazotrophic Bacteria to Agricultural Sustainability in the Tropics. En
Diversity and Benefits of Microorganisms from the Tropics (pp. 269-
292).
Khan, M., Zaidi, A., Ahemad, M., Oves, M., & Wani, P. (2010). Plant growth
promotion by phosphate solubilizing fungi – current perspective.
Archives of Agronomy and Soil Science, 56(1), 73-98.
Koua, S., N’golo, D., Alloue-Boraud, W., Konan, F., & Dje, K. (2020). Bacillus
subtilis Strains Isolated from Cocoa Trees (Theobroma cacao L.)
Rhizosphere for their use as Potential Plant Growth Promoting
Rhizobacteria in Côte d’Ivoire. Current Microbiology, 77(9), 2258-
2264.
Landeros-Sánchez, C., Moreno-Seceña, J., Nikolskii, I., & BakhlaevaEgorova, O. (2011). Impacto de la agricultura sobre la biodiversidad
(pp. 477-491).
Lin, W., Lin, M., Zhou, H., Wu, H., Li, Z., & Lin, W. (2019). The effects of
chemical and organic fertilizer usage on rhizosphere soil in tea
orchards. PLOS ONE, 14(5), e0217018.
López-Ortega, M., Criollo-Campos, P., Gómez-Vargas, R., CameloRunsinque, M., Estrada-Bonilla, G., Garrido-Rubiano, M., & BonillaBuitrago, R. (2013). Characterization of diazotrophic phosphate
solubilizing bacteria as growth promoters of maize plants. Revista
Colombiana de Biotecnología, 15(2), 115-123.
Magalhães, N. dos S., Marenco, R., & Camargo, M. (2014). Do soil
fertilization and forest canopy foliage affect the growth and
photosynthesis of Amazonian saplings? Scientia Agricola, 71(1), 58-65.
Medina, J., Chimal, C., Gómez, L., & Aguilar, J. (2014). Aislados bacterianos
con potencial biofertilizante para plántulas de tomate. Terra
latinoamericana, 32: 273-281.
Moreno, L., & Galvis, F. (2013). Potencial biofertilizante de bacterias
diazótrofas aisladas de muestras de suelo rizosférico. Pastos y
Forrajes, 36(1), 33-37.
Moreno, A., García, V., Reyes, J., Vásquez, J., & Cano, P. (2018).
Rizobacterias promotoras del crecimiento vegetal: Una alternativa de
biofertilización para la agricultura sustentable. Revista Colombiana de
Biotecnología, 20(1), 68-83.
Muleta, D., Assefa, F., Börjesson, E., & Granhall, U. (2013). Phosphatesolubilising rhizobacteria associated with Coffea arabica L. in natural
coffee forests of southwestern Ethiopia. Journal of the Saudi Society
of Agricultural Sciences, 12(1), 73-84.
Myrold, D., Zeglin, L., & Jansson, J. (2014). The Potential of Metagenomic
Approaches for Understanding Soil Microbial Processes. Soil Science
Society of America Journal, 78(1), 3-10.
Nehra, V., Saharan, B., & Choudhary, M. (2016). Evaluation of Brevibacillus
brevis as a potential plant growth promoting rhizobacteria for cotton
(Gossypium hirsutum) crop. SpringerPlus, 5(1), 948.
Ogata-Gutiérrez, K., Chumpitaz-Segovia, C., Lirio-Paredes, J., Finetti-Sialer,
M., & Zúñiga-Dávila, D. (2017). Characterization and potential of plant
growth promoting rhizobacteria isolated from native Andean crops.
World Journal of Microbiology and Biotechnology, 33(11), 203.
Panhwar, Q., Naher, U., Jusop, S., Othman, R., Latif, M., & Ismail, M. (2014).
Biochemical and Molecular Characterization of Potential PhosphateSolubilizing Bacteria in Acid Sulfate Soils and Their Beneficial Effects
on Rice Growth. PLOS ONE, 9(10), e97241.
Patel, J., Yadav, S., Bajpai, R., Teli, B., & Rashid, M. (2020). PGPR secondary
metabolites: An active syrup for improvement of plant health. En
Molecular Aspects of Plant Beneficial Microbes in Agriculture (pp. 195-
208). Elsevier.
Pii, Y., Borruso, L., Brusetti, L., Crecchio, C., Cesco, S., & Mimmo, T. (2016).
The interaction between iron nutrition, plant species and soil type
shapes the rhizosphere microbiome. Plant Physiology and
Biochemistry, 99, 39-48.
Quesada, C., Lloyd, J., Anderson, L., Fyllas, N., Schwarz, M., & Czimczik, C.
(2011). Soils of Amazonia with particular reference to the RAINFOR
sites. Biogeosciences, 8(6), 1415-1440.
Rahman, S., Siddique, R., & Tabassum, N. (2017). Isolation and identification
of halotolerant soil bacteria from coastal Patenga area. BMC Research
Notes, 10(1), 531.
Rengel, Z., & Marschner, P. (2005). Nutrient availability and management
in the rhizosphere: Exploiting genotypic differences. The New
Phytologist, 168(2), 305-312.
Reyes, I., Valery, A., & Valduz, Z. (2006). Phosphate-solubilizing
microorganisms isolated from rhizospheric and bulk soils of colonizer
plants at an abandoned rock phosphate mine. Plant and Soil, 287(1),
Riaz, U., Murtaza, G., Anum, W., Samreen, T., Sarfraz, M., & Nazir, M. Z.
(2021). Plant Growth-Promoting Rhizobacteria (PGPR) as Biofertilizers
and Biopesticides. En K. R. Hakeem, G. H. Dar, M. A. Mehmood, & R.
A. Bhat (Eds.), Microbiota and Biofertilizers: A Sustainable Continuum
for Plant and Soil Health (pp. 181-196). Springer International
Publishing.
Ríos-Ruiz, W., Torres-Chávez, E., Torres-Delgado, J., Rojas-García, J.,
Bedmar, E., & Valdez-Nuñez, R. (2020). Inoculation of bacterial
consortium increases rice yield (Oryza sativa L.) reducing applications
of nitrogen fertilizer in San Martin region, Peru. Rhizosphere, 14,
100200.
Sahoo, R., Ansari, M., Dangar, T., Mohanty, S., & Tuteja, N. (2014).
Phenotypic and molecular characterisation of efficient nitrogen-fixing
Azotobacter strains from rice fields for crop improvement.
Protoplasma, 251(3), 511-523.
Salazar-Henao, J., Vélez-Bermúdez, I., & Schmidt, W. (2016). The regulation
and plasticity of root hair patterning and morphogenesis.
Development, 143(11), 1848-1858.
Santana-Aragone, D., Colina-Navarrete, E., Castro-Arteaga, C., CadenaPiedrahita, D., Sotomayor-Morán, A., Galarza-Centeno, E., & LópezVillacré, M. (2017). Microorganismos Fijadores De Nitrógeno Y Su
Acción Complementaria A La Fertilización Química En El Cultivos De
Coffea arabica L. European Scientific Journal, 13(3), 211-222.
Shin, W., Islam, Md. R., Benson, A., Joe, M., Kim, K., Gopal, S., Samaddar, S., Banerjee, S., & Sa, T. (2016). Role of Diazotrophic Bacteria in Biological Nitrogen Fixation and Plant Growth Improvement. Korean Journal of Soil Science and Fertilizer, 49, 17-29.
Sosa, M., Ruiz, E., Tun, J., Pinzón, L., & Reyes, A. (2019). Germinación,
crecimiento y producción de glucanasas en Capsicum chinense Jacq.
Inoculadas con Bacillus spp. Ecosistemas y Recursos Agropecuarios,
6(16), 137-146.
Souza, R. de, Ambrosini, A., & Passaglia, L. (2015). Plant growth-promoting
bacteria as inoculants in agricultural soils. Genetics and Molecular
Biology, 38(4), 401-419.
Sutariati, G., Rahni, N., Madiki, A., Mudi, L., & Fua, J. (2020). Isolation And
Viability Test Of Seed Incorporated By Indigenous Rhizobacteria From
Areca Nut As Plant Growth Promoting Rhizobacteria (PGPR). 9(01), 5:
3435-3439.
Tang, A., Haruna, A., Majid, N. Ab., & Jalloh, M. (2020). Potential PGPR
Properties of Cellulolytic, Nitrogen-Fixing, Phosphate-Solubilizing
Bacteria in Rehabilitated Tropical Forest Soil. Microorganisms, 8(3),
442.
Teng, Z., Chen, Z., Zhang, Q., Yao, Y., Song, M., & Li, M. (2019). Isolation
and characterization of phosphate solubilizing bacteria from
rhizosphere soils of the Yeyahu Wetland in Beijing, China.
Environmental Science and Pollution Research, 26(33), 33976-33987.
Urgiles-Gómez, N., Avila-Salem, M., Loján, P., Encalada, M., Hurtado, L.,
Araujo, S., Collahuazo, Y., Guachanamá, J., Poma, N., Granda, K.,
Robles, A., Senés, C., & Cornejo, P. (2021). Plant Growth-Promoting
Microorganisms in Coffee Production: From Isolation to Field
Application. Agronomy, 11(8), 1531.
Vanegas, J., Flórez-Zapata, N., & Uribe-Vélez, D. (2012). Bioprospección de
microorganismos promotores de crecimiento vegetal para su
aplicación en el cultivo de arroz (pp. 151-178).
Wang, R., Zhang, H., Sun, L., Qi, G., Chen, S., & Zhao, X. (2017). Microbial
community composition is related to soil biological and chemical
properties and bacterial wilt outbreak. Scientific Reports, 7(1), 343.
Zheng, B., Zhang, D., Wang, Y., Hao, X., Wadaan, M., Hozzein, W.,
Peñuelas, J., Zhu, Y., & Yang, X. (2019). Responses to soil pH gradients
of inorganic phosphate solubilizing bacteria community. Scientific
Reports, 9:25.