EFECTO DE BACTERIAS PROBIÓTICAS EN LA SUPERVIVENCIA DE LARVAS DE Argopecten purpuratus FRENTE AL DESAFÍO DE Vibrio anguillarum y Aeromonas salmonicida
EFFECT OF PROBIOTIC BACTERIA ON THE SURVIVAL OF LARVAE OF Argopecten purpuratus AGAINST THE CHALLENGE OF Vibrio anguillarum, Aeromonas salmonicida
Ángel Castro-Alvarado 1; Álvaro Edmundo Tresierra Aguilar 2; José Villanueva Carlos 1
1 Facultad de Ciencias, Universidad Nacional del Santa, Perú. Av. Universitaria s/n. Ciudad Universitaria, Urbanización Bellamar, Nuevo Chimbote, Ancash, Perú.
2 Facultad de Ciencias Biológicas, Universidad Nacional de Trujillo, Av. Juan Pablo II s/n. Ciudad Universitaria, Trujillo, Perú.
Ángel Pablo Castro Alvarado:
Álvaro Edmundo Tresierra Aguilar:
José Manuel Villanueva Carlos:
Artículo original:
Recibido: 02 de abril 2021
Aceptado: 18 de junio 2021
Resumen
El objetivo fue evaluar el efecto de bacterias probióticas provenientes del intestino de Argopecten purpuratus en el desafío de bacterias patógenas Vibrio anguillarum y Aeromonas salmonicida en larvas de Argopecten purpuratus. Se aislaron 30 cultivos microbianos del intestino de A. purpuratus adultos de los cuales 12 presentaron acción inhibitoria. Se seleccionaron cinco bacterias con acción antagonista para ambas bacterias patógenas in vitro. La evaluación se realizó mediante sobrecapa con la bacteria patógena. Después de 24 horas de adición de cinco bacterias candidatas a probióticos en las larvas, por separado se desafío con las bacterias patógenas. ANOVA de dos factores indica que los tratamientos son estadísticamente diferentes (p < 0,05) para V. anguillarum y para A. salmonicida. Los probióticos rotulados como Prob A y Prob B redujeron la mortalidad larval por las bacterias patógenas. El Prob A, a 106 células/mL al cabo de 72 horas redujo a 29,88% cuando fue desafiado con A. salmonicida y 34,86% con V. anguillarum; en cambio, el Prob B a 106 células/mL redujo 47,83% cuando fue desafiado con A. salmonicida y 61,08% con V. anguillarum en comparación con el control. Se identificó molecularmente a Prob A como Pseudomonas stuzeri y Prob B como Bacillus sp.
Palabras clave: Argopecten purpuratus, probióticos, desafío larval.
Abstract
The objective was to evaluate the effect of probiotic bacteria from the intestine of Argopecten purpuratus in the challenge of pathogenic bacteria Vibrio anguillarum and Aeromonas salmonicida in larvae of Argopecten purpuratus. Thirty microbial cultures were isolated from the intestine of adult A. purpuratus, of which 12 showed inhibitory action. Five bacteria with antagonistic action were selected for both pathogenic bacteria in vitro. The evaluation was carried out by overcoating with the pathogenic bacteria. After 24 hours of addition of five candidate bacteria to probiotics in the larvae, they were separately challenged with the pathogenic bacteria. Two-factor ANOVA indicates that the treatments are statistically different (p < 0.05) for V. anguillarum and for A. salmonicida. Probiotics labeled Prob A and Prob B reduced larval mortality from pathogenic bacteria. Prob A, at 106 cells/mL after 72 hours, reduced to 29.88% when challenged with A. salmonicida and 34.86% with V. anguillarum; In contrast, Prob B at 106 cells /mL reduced 47.83% when challenged with A. salmonicida and 61.08% with V. anguillarum compared to the control. Prob A was molecularly identified as Pseudomonas stuzeri and Prob B as Bacillus sp.
Keywords: Argopecten purpuratus, probiotics, larval challenge
* Autor para correspondencia: E. mail: acastro@uns.edu.pe
DOI: http://dx.doi.org/10.17268/rebiol.2021.41.01.13
Citar como:
Castro-Alvarado, A., Tresierra, A., & Villanueva, J. 2021. Efecto de bacterias probióticas en la supervivencia de larvas de Argopecten purpuratus frente al desafío de Vibrio anguillarum y Aeromonas salmonicida. REBIOL, 41(1):127-135.
1. Introducción
La concha de abanico A. purpuratus es un molusco bivalvo filtrador, cuya distribución es desde Paita, Perú hasta Valparaíso, Chile (Kluger et al., 2019). El cultivo de concha de abanico en el Perú se encuentra dentro de las cinco especies con mayor exportación al 2018. Se ha convertido en una fuente de trabajo directo e indirecto en forma sostenible, que genera divisas por exportación con un valor económico para el país de US$ 74 millones 34 mil en 2018, con un crecimiento de 39,5% con destino a países como Francia, España, Países Bajos, EE.UU., Bélgica, entre otros (ADEX, s.f.).
En el proceso de cultivo de A. purpuratus, un punto crítico es la etapa inicial de obtención de larvas ya sean de ambientes naturales que normalmente son escasas o de hatcheries. En esa etapa inicial existe una alta mortalidad de las larvas de la concha de abanico, lo que afecta la obtención de su semilla. Bacterias patógenas como Vibrio bivalvicida causaron una mortalidad masiva en larvas de A. purpuratus (Rojas et al., 2019). También, V. alginolyticus causó mortalidad en larvas de vieiras A. ventricosus (Abasolo-Pacheco, 2017) y V. anguillarum en A. purpuratus (Rojas et al., 2021). Otras especies de vibrio como Vibrio aestuarianus causaron una alta infección en Crassostrea gigas (Azéma et al., 2016).
Una alternativa para mitigar el efecto negativo de las bacterias patógenas es el uso de probióticos que son microrganismos generalmente vivos, que se administra en el alimento a los organismos acuáticos. En 1988, la Administración de Drogas y Alimentos (FDA) de los Estados Unidos definió a los probióticos como microbios vivos utilizados en la alimentación animal como "microbios de alimentación directa" (Lauzon et al., 2014). En forma similar la FAO, indica que los probióticos, son microorganismos vivos que, cuando se administran en cantidades adecuadas, confieren un beneficio para la salud del huésped (Knipe et al., 2021). Lauzon et al. (2014) proponen criterios esenciales para la selección de probióticos como: no debe ser patógeno, no solo a la especie huésped; sino también, a animales acuáticos y consumidores humanos. Debe estar libre de genes de resistencia a antibióticos codificados por plásmidos. Debe ser resistente a las sales biliares y a un pH bajo preferentemente para uso en peces.
Los probióticos tiene diferentes mecanismos de acción, algunos producen antibióticos (Tan et al., 2016), otros bacteriocinas (Gaspar et al., 2018); sideróforos ( Panda et al., 2017), compite por los sitios de adhesión (Kuebutornye et al., 2020), interfiere con la detección de quórum de bacterias patógenas (Vadassery & Pillai, 2020). Asimismo, los probióticos utilizan los nutrientes que de otro modo serían consumidos por los microbios patógenos (Ringø et al., 2016). Existen varias bacterias que actúan como probióticos en A. purpuratus presentando un efecto inhibitorio contra vibrios patógenos: como Bacillus, Lactobacillus (Abasolo-Pacheco et al., 2017), Phaeobacter gallaeciensis, Alteromonas macleodii y Neptunomonas sp. (Kesarcodi-Watson et al., 2016), incluso actinomcetos (León et al., 2016).
Se ha escogido como bacterias patógenas de larvas de A. purpuratus, a V. anguillarum y A. salmonicida por reportes encontrados en el Perú, se han aislados los géneros: V. harveyi, V. mediterranei y V. splendidus de un evento de mortalidades larvarias masivas de concha de abanico (Smith, 2017). Adicionalmente, Smith (2017) aisló de medios naturales las especies: V. antiquarius, V. campbellii, V. madracius, V. pomeroyi, V. variabilis y Aeromonas, de los hatcheries y en larvas de A. purpuratus, en un porcentaje apreciable. Y a Aeromonas spp. porque fue patógena para la vieira coreana Yesso (Patinopecten yessoensis) (De Silva et al., 2019).
La presente investigación tuvo por objetivo evaluar el efecto de bacterias probióticas provenientes del intestino de Argopecten purpuratus en el desafío de bacterias patógenas Vibrio anguillarum y Aeromonas salmonicida en larvas de Argopecten purpuratus.
2. Materiales y Métodos
Obtención de larvas D de A. purpuratus
Las larvas D de A. purpuratus de 5 mm y de 3 días de eclosión fueron obtenidas de la Empresa Aquacultivos del Pacifico S.A.C. ubicada, en la Bahía Samanco-La Boquita, distrito de Samanco, departamento de Ancash, transportada en recipientes de bolsa con aireación en un recipiente con hielo al Laboratorio de Investigación de la UNS.
Selección y aislamiento de bacterias con potencial probiótico
Se procedió a obtener muestras del tracto intestinal de A. purpuratus adultas, provenientes de la Empresa El Dorado, distrito de Nuevo Chimbote, provincia del Santa, departamento de Ancash y se aisló de una dilución 10-4 en un medio solido conteniendo agar común con NaCl 2% incubándose a 30 °C durante 2 días.
Evaluación de bacterias candidatas a probióticas con actividad anti-Vibrio in vitro (Gao et al., 2017)
Los cultivos puros obtenidos fueron inoculados con 20 uL en placas Petri que contiene agar común y NaCl 2%. Se dejaron secar durante 30 minutos a temperatura ambiente y se incubaron durante 2 días a temperatura de 30 °C. A las colonias obtenidas en las placas se agregaron vapores de cloroformo durante 20 minutos. Posteriormente, se esperó que los vapores de cloroformo se disipen y se vertió una sobrecapa de agar común suave inoculado con un cultivo patógeno de 24 horas de incubación de V. anguillarum, a una concentración de 7,1 x 104 células/mL. En forma similar se procedió con A. salmonicida. Se incubó adicionalmente las placas dos días a 30 °C y determinó los halos de inhibición neto alrededor de las colonias.
Desafío de las bacterias candidatas a probióticas contra V. anguillarum, A. salmonicida en larvas de A. purpuratus
En cada recipiente que contenía larvas de A. purpuratus se alimentó con 5000 células/mL de la microalga Isochrysis galbana cada 24 horas que habían crecido en Guillard F7 (Gutiérrez et al., 2017) y bacterias candidatas a probióticas a concentraciones de 106 células/mL por separado, en dosis única. Las cinco bacterias candidatas con mayor potencial probiótico y las bacterias patógenas: V. anguillarum y A. salmonicida fueron sembradas en caldo común con NaCl 2% durante 48 horas a temperatura ambiente. Después de 24 horas de la adición de bacterias candidatas a probiótico en las larvas, se agregó las bacterias patógenas: V. anguillarum o A. salmonicida en cada recipiente 1x 104 células/mL en forma separada. Las bacterias candidatas a probióticas se centrifugaron asépticamente y se lavaron con tampón fosfato salino y se ajustó la concentración bacteriana de 106 células/mL mediante turbidimetría a 600 nm mediante curva de calibración, en forma similar se realizó con las bacterias patógenas. Se realizó tres réplicas por cada tratamiento.
Se midió a tiempo cero y cada 24 horas hasta 3 días, la supervivencia de las larvas.
Análisis estadístico
Los datos de supervivencia larval frente al desafío de bacterias patógenas V. anguillarum y A. salmonicida con bacterias candidatas probióticas se realizaron mediante análisis de varianza (ANOVA) de dos factores (p < 0,05) para establecer diferencias entre promedios y análisis de homocedasticidad de la varianza para cada factor, para determinar, si los residuales siguen una distribución normal de acuerdo test: Bartlett, Levene y la prueba Dunnett comparar los tratamientos a un control. Los análisis estadísticos se efectuaron con el software Statistic vs 12.6 y RStudio 1.1.456.
3. Resultados
Aislamiento y evaluación de bacterias antagonista contra V. anguillarum y A. salmonicida
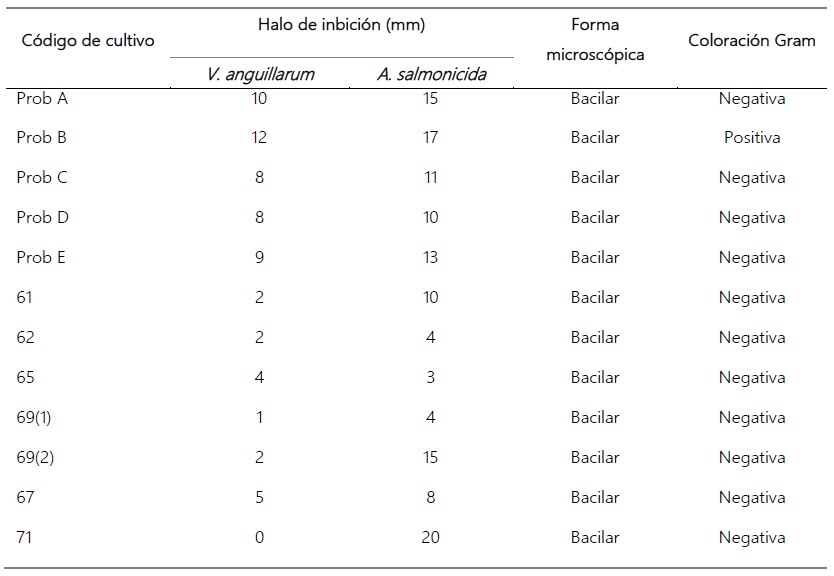
Se aislaron 30 cultivos microbianos provenientes de intestino de A. purpuratus adultas, de los cuales 12 presentaron acción inhibitoria representando un 40% que produce sustancias inhibitorias cuando se evaluó por separado con los patógenos: V. anguillarum y A. salmonicida (Tabla 1), siendo la mayoría Gram negativos.
Los halos netos de inhibición de los cultivos aislados variaron desde 2 a 20 mm según el efecto antimicrobiano de diferentes cultivos microbianos (Fig. 1).
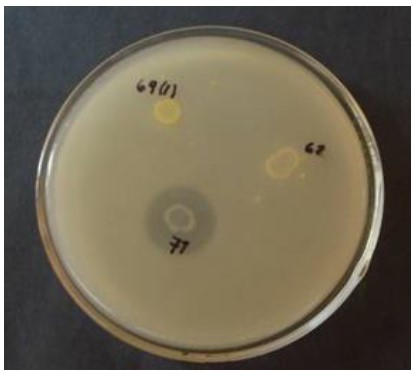
Figura 1. Efecto inhibitorio de los cultivos aislados rotulados 69(2), 67 y 61 mediante sobrecapa de V. anguillarum
Se prepararon recipientes que contenía 300 mL de agua de mar estéril, en ella se agregaron 10 a 15 larvas/mL con aireación con un flujo de 0,1 L. min-1. El agua de mar en el que hizo el desafío estuvo a: 18-21 °C, salinidad: 35 ups, oxígeno disuelto: 7-8 mL/L, pH: 7,2, conductividad: 52 uS/cm medido con un equipo multiparámetro.
Desafío de las bacterias candidatas a probióticas contra V. anguillarum, o A. salmonicida en larvas de A. purpuratus
Se verificó la mortalidad de las bacterias patógenas V. anguillarum y A. salmonicida cuando fueron adicionadas en larvas D de A. purpuratus observándose que ocurre 90±5,57% de mortalidad al cabo de 72 horas. Hay escasos reportes realizados con A. salmonicida infectados experimentalmente en larva de A. purpuratus. Se escogieron para ser desafiados a cinco probióticos rotulados como Prob A, Prob B, Prob C, Prob D y Prob E debido a que tuvieron mayor actividad inhibitoria in vitro para ambas bacterias patógenas V. anguillarum y A. salmonicida (Fig. 2 y 3).
Tabla 1. Halos netos de inhibición y características de los cultivos bacterianos aislados de intestino de A. purpuratus.
En la evaluación de ANOVA de dos vías relacionado con la evaluación de cinco candidatos a probióticos frente al desafío del patógeno de V. anguillarum se observó p < 0,05 relacionado con el tipo de probiótico, día tipo de probiótico*día. El número de días es la variable más fuerte que afecta a la mortalidad, le sigue el tipo de probiótico y finalmente la interacción. En el análisis distribución de datos de los cinco candidatos a probióticos de todos los días desafiados con V. anguillarum se observa una desviación. Solamente puede considerarse cercana a la distribución normal en el tercer día. En la homocedasticidad de la varianza, mediante la prueba de
Barlett referente al efecto de cinco candidatos a probióticos cuando fue desafiado con V. anguillarum, si cumple, el p=2,2e-16, es decir tiene un p < 0,05, concluyendo que las varianzas de los tratamientos son iguales; pero en la prueba de Levene con p=0,4986 indica que los datos no tienen distribución normal (p < 0,05).
Según la prueba T pareada indica que el Prob A es distinto del Prob B (Glover & Mitchell, 2016). El Prob B desde el pinto vista estadística es aproximadamente 2 veces mejor que el Prob A y son los mejores candidatos a probióticos (Figura 2).
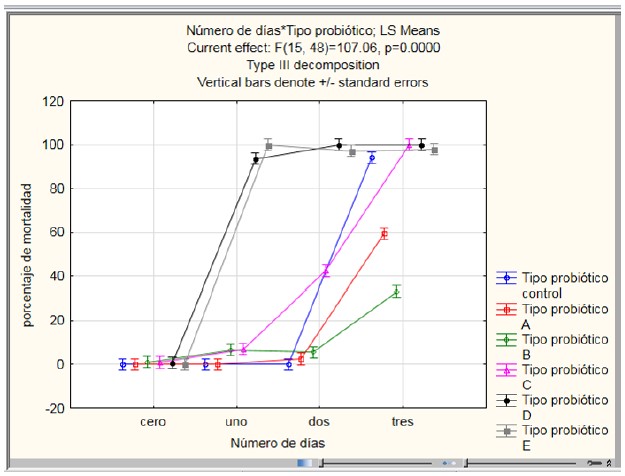
Figura 2. Porcentaje de mortalidad de larvas de A. purpuratus con cinco probióticos adicionados (106 células/mL) desafiados con la bacteria patógena V. anguillarum. Los valores son promedio de tres réplicas.
Los probióticos Prob A y Prob B (Fig. 3), tuvieron un efecto protector cuando fueron desafiados con la bacteria patógena A. salmonicida. Al igual que V. anguillarum, tiene un p < 0,05, indicando, que el tipo de probiótico, día y existe interacción entre estas variables. Es decir, existe un efecto del número de días, tipo de probiótico en la mortalidad y además hay interacción entre tipo de probiótico-día débil.
En la prueba de homocedasticidad de la varianza de acuerdo al test de Bartlett tiene un p < 0,05 concluyendo que las varianzas de los tratamientos son iguales; pero en la prueba de Levene tiene un p que no es menor de p < 0,05 es decir las varianzas no son diferentes en cada tratamiento. En la prueba de Dunnett señala que los probióticos Prob A y Prob B son diferentes al control y de acuerdo a la prueba t pareada indica que ambos probióticos son diferentes.
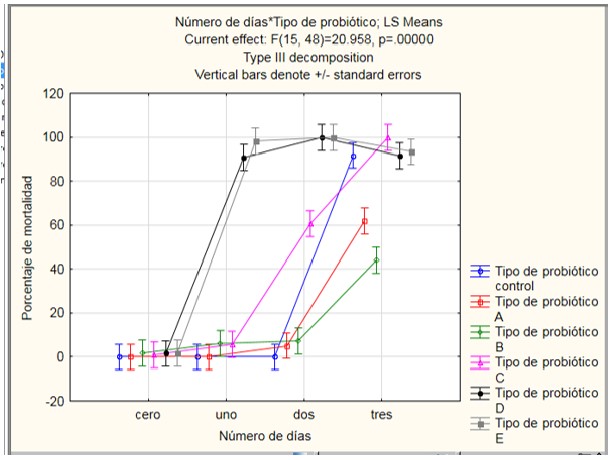
Figura 3. Porcentaje de mortalidad de larvas de A. purpuratus desafiados con la bacteria patógena A. salmonicida y con cinco probióticos. Los valores son promedio de tres réplicas.
Tabla 2. Porcentaje de mortalidad en el día 3 de los patógenos y de disminución de mortalidad de las bacterias candidata a probióticos, Prob A y Prob B en el desafío de patógenos (mortalidad del patógeno V. anguillarum fue 94,21% y A. salmonicida fue 91,73%).
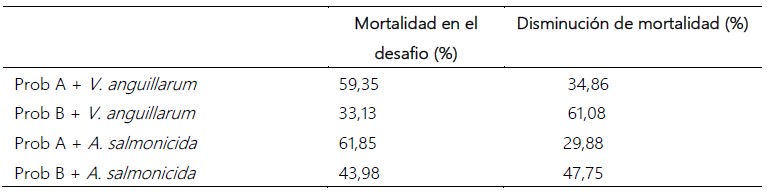
El Prob B logró reducir la mortalidad larval cuando fue desafiado con A. salmonicida en 47,75%, y redujo un 61,08% de mortalidad larval cuando fue desafiado con V. anguillarum en comparación con el control. El Prob A redujo la mortalidad larval cuando fue desafiado con A. salmonicida en 29,88 % y 34,86% con V. anguillarum. Se identificó molecularmente a Prob A como Pseudomonas stuzeri y Prob B como Bacillus sp.
4. Discusión
El oxígeno disuelto del agua de mar en la cual fue desafiado las larvas de A. purpuratus fue ligeramente mayor a lo registrado para el ambiente natural del cultivo de semilla en colectores artificiales los valores de oxígeno disuelto 7-8 mg/L (Kuk-Dzul & Diaz, 2016). El valor del pH fue levemente inferior a lo reportado por White et al. (2013) y el rango la temperatura ambiente en la cual fue desafiado fue similar al ambienta natural, no tuvo influencia en la investigación (Robson et al., 2016). Por consiguiente, la calidad del agua no influyó en la mortalidad de las larvas de la concha de abanico.
En el presente estudio se aislaron 30 cultivos microbianos provenientes de intestino de A. purpuratus, de los cuales 12 presentaron acción inhibitoria representando un 40% que produce sustancias inhibitorias cuando se evaluó con los patógenos: V. anguillarum y A. salmonicida por separado, siendo la mayoría Gram negativos, en forma similar a lo reportado por Wanka et al. (2018). Los halos netos de inhibición de los cultivos aislados variaron desde 2 a 20 mm; valores relativamente bajos a los encontrado por De la Fuente & Fúandez, (2019).
Se verificó la mortalidad de las bacterias patógenas V. anguillarum y A. salmonicida cuando fueron adicionadas en larvas D de A. purpuratus observándose que ocurre 90±5,57% de mortalidad al cabo de 72 horas. Resultados parecidos se obtuvieron con los patógenos de Vibrio VAP16 y VAP 18 que causaron una mortalidad larval de 60 a 80% a las 48 horas (Rojas et al., 201); así como, con Vibrio bibalvicida VAP30 que ocasionó una mortalidad larval en 90-100 % en criadero comercial en menos de 30 horas (Rojas et al., 2019), probablemente el velo y necrosis de la glándula digestiva.
Se han obtenido cinco bacterias candidatos a probióticos destacando a la bacteria rotulada Prob A, identificado molecularmente como Pseudomonas stuzeri, en forma similar a lo reportado por Ringø, (2020). Pellon et al. (2014) reportaron a Pseudomonas sp. con capacidad inhibitoria contra bacterias patógenas como V. anguillarum, V. splendidus, V. vulnificus, A. sobria, A. hydrophila provenientes de A. purpuratus y C. gigas. Del mismo modo, De la Fuente & Fúandez, (2019) comunicaron que al género Vibrio proveniente de Mytilus chilensis inhibía in vitro al patógeno V. anguillarum. Existe pocos estudios del efecto de Pseudomonas usado como probiótico en larvas de A. purpurartus. En otros organismos se ha reportado el uso de Pseudomonas aeruginosa (FARP 72) como antagonista de A. hydrophila, aumentando la tasa de supervivencia de los alevines de Labeo rohita (Hoque et al., 2019).
También, en el presente estudio se han aislado bacterias Gram positivas con potencial probiótico resaltando la bacteria Gram positiva denominado Prob B identificado molecularmente como Bacillus spp. de manera similar a lo señalado por Escamilla-Montes et al. (2015). Gao et al. (2017) mencionaron que Bacillus pumilis H2 tuvo acción inhibitoria contra 29 cepas de Vibrio, entre ellas a V. vulnificus, V. alginolyticus, V. harveyi, V. parahemolyticus y que la sustancia anti-Vibrio purificada era estructuralmente idéntica a la amicumacina A, un antibiótico. Se ha reportado que una dieta de Bacillus sp. YB1701 mostró actividad antibacteriana contra A. hydophila en Carassius auratus (Zhou et al., 2018). En forma similar, Sohn et al. (2016) reportaron el efecto protector del probiótico Bacillus pumilus RI06-95 (RI) en las larvas de C. virginica y A. irradians contra el patógeno Vibrio coralliilyticus RE22. Otra especie Bacillus lincheniformis mejoró la supervivencia del molusco Haliotis discus cuando fue desafiado con V. parahaemolyticus (Gao et al., 2018).
Se observó en la presente investigación una alta mortalidad de larvas (91,73±7,4%) de A. pupuratus cuando se agregó A. salmonicida. Resultados semejantes obtuvieron con especie parecida como A. hydrophila que un provocó 60% de mortalidad en peces (Rasmussen-Ivey et al., 2016).
Asimismo, De Silva et al., (2019) reportaron a Aeromonas spp. fue patógena para otro molusco coreano (Patinopecten yessoensis). Hay escasos reportes realizados con A. salmonicida infectados experimentalmente en larvas de A. purpuratus en presencia de probióticos. Qi et al. (2020) mostraron que Pseudomonas monteilii JK-1 tuvo efecto antagónico contra A. hydrophila, debido a la acción de 1-hidroxifenazina (piocianina) en un ensayo in vivo (Qi et al., 2020) confirmándose con lo reportado por Hardi et al. (2016) que un producto extracelular de Pseudomonas sp. tuvo efecto inhibitorio in vitro contra A. salmonicida. No se ha encontrado información de la especie Pseudomonas stutzeri como probiótico en las larvas de A. purpuratus, esta bacteria asociada a remoción de nitrógeno orgánico (Gao et al., 2019), la cual es poco probable que ha sido ocurrido en la presente investigación por el tiempo trascurrido. Otra especie de Pseudomonas aeruginosa VSG2 inactivado por calor presente en la dieta de Cyprinus carpio aumentó la respuesta inmune cuando fue desafiado por el patógeno A. hydrophila (Giri et al., 2020).
5. Conclusiones
De las cinco bacterias con potencial probiótico rotuladas como Prob. A, Prob. B, Prob. C, Prob. D y Prob. E, por su mayor actividad inhibitoria in vitro frente a bacterias patógenas V. anguillarum y A. salmonicida, destacan el Prob. B, a 106 células/mL, que logró reducir la mortalidad larval de A. purpuratus, en 47,75% cuando fue desafiado con A. salmonicida y en 61,08% de mortalidad larval cuando fue desafiado con V. anguillarum y el Prob. A, a 106 células/mL que redujo la mortalidad larval de A. purpuratus 29,88 % cuando fue desafiado con A. salmonicida y en 34,86% con V. anguillarum. Se identificó molecularmente a Prob. A como Pseudomonas stuzeri y Prob.B como Bacillus sp.
6. Contribución de los autores
ACA: Conceptualización del estudio, revisión de los datos, revisión crítica del contenido intelectual y aprobación definitiva de la versión a publicar.
ATA: Concepción y diseño del estudio, adquisición de datos, análisis de datos, redacción del borrador del artículo, aprobación definitiva de la versión a publicar.
JVC: Concepción y diseño del estudio, adquisición de datos, interpretación de los datos, revisión del borrador del artículo, aprobación definitiva de la versión a publicar.
7. Conflicto de intereses
Los autores declaran que no existe conflicto de interés.
8. Referencias Bibliográficas
Abasolo-Pacheco, F., Campa-Córdova, Á. I., Mazón-Suástegui, J. M., Tovar-Ramírez, D., Araya, R., & Saucedo, P. E. (2017). Enhancing growth and resistance to Vibrio alginolyticus disease in catarina scallop (Argopecten ventricosus) with Bacillus and Lactobacillus probiotic strains during early development. Aquaculture Research, 48(9), 4597–4607.
ADEX. (s.f.). Retrieved July 31, 2020, from https://www.adexperu.org.pe/notadeprensa/exportacion-de-pesca-para-chd-crece-27-9-el-2018/
Azéma, P., Travers, M.-A., Benabdelmouna, A., & Dégremont, L. (2016). Single or dual experimental infections with Vibrio aestuarianus and OsHV-1 in diploid and triploid Crassostrea gigas at the spat, juvenile and adult stages. Journal of Invertebrate Pathology, 139, 92–101.
De la Fuente, M., & Fúandez, V. (2019). Evaluación in vitro de bacterias marinas para potencial biocontrol en cultivo de moluscos bivalvos. Revista de Biologia Marina y Oceanografia, 54(3), 272–282.
De Silva, B. C. J., Hossain, S., Dahanayake, P. S., & Heo, G. J. (2019). Aeromonas spp. from marketed Yesso scallop (Patinopecten yessoensis): molecular characterization, phylogenetic analysis, virulence properties and antimicrobial susceptibility. Journal of Applied Microbiology, 126(1), 288–299.
Escamilla-Montes, R., Luna-González, A., Flores-Miranda, M. del C., Álvarez-Ruiz, P., Fierro-Coronado, J. A., Sánchez-Ortiz, A. C., & Ávila-Leal, J. (2015). Isolation and characterization of potential probiotic bacteria suitable for mollusk larvae cultures. Thai Journal of Veterinary Medicine, 45(1), 11–21.
Gao, X.-Y., Liu, Y., Miao, L.-L., Li, E.-W., Hou, T.-T., & Liu, Z.-P. (2017). Mechanism of anti-Vibrio activity of marine probiotic strain Bacillus pumilus H2, and characterization of the active substance. AMB Express, 7(1), 23.
Gao, X., Zhang, M., Li, X., Han, Y., Wu, F., & Liu, Y. (2018). Effects of a probiotic (Bacillus licheniformis) on the growth, immunity, and disease resistance of Haliotis discus hannai Ino. Fish & Shellfish Immunology, 76, 143–152.
Gaspar, C., Donders, G. G., Palmeira-de-Oliveira, R., Queiroz, J. A., Tomaz, C., Martinez-de-Oliveira, J., & Palmeira-de-Oliveira, A. (2018). Bacteriocin production of the probiotic Lactobacillus acidophilus KS400. AMB Express, 8(1), 153.
Giri, S. S., Jun, J. W., Yun, S., Kim, H. J., Kim, S. G., Kim, S. W., Woo, K. J., Han, S. J., Oh, W. T., Kwon, J., Sukumaran, V., & Park, S. C. (2020). Effects of dietary heat-killed Pseudomonas aeruginosa strain VSG2 on immune functions, antioxidant efficacy, and disease resistance in Cyprinus carpio. Aquaculture, 514, 734489.
Glover, T., & Mitchell, K. (2016). An Introduction to Biostastic (I. Waveland Press (Ed.); Third Edit).
Gutiérrez, M., Jaúregui, A., Barros, A., & Ruiz, J. (2017). Cultivo de microalgas Isochrysis galbana y Nannochloropsis sp. para alimentación de larvas de peces marinos. Revista Mutis, 7.
Hardi, E. H., Kusuma, I. W., Suwinarti, W., Saptiani, G., & Agustina. (2016). Antagonistic activity of extra cellular product and component bacteria of Pseudomonas sp. against Aeromonas hydrophila from tilapia aquaculture in East Borneo. AIP Conference Proceedings, 1755(1), 130001.
Hoque, F., Jawahar Abraham, T., Nagesh, T. S., & Kamilya, D. (2019). Pseudomonas aeruginosa FARP(72) Offers Protection Against Aeromonas hydrophila Infection in Labeo rohita. Probiotics and Antimicrobial Proteins, 11(3), 973–980.
Kesarcodi-Watson, A., Miner, P., Nicolas, J.-L., Asmani, K., & Robert, R. (2016). Pathogenic threats and probiotic use in larviculture of the scallop, Pecten maximus. Aquaculture Research, 47(4), 1221–1230.
Kluger, L. C., Taylor, M. H., Wolff, M., Stotz, W., & Mendo, J. (2019). From an open-access fishery to a regulated aquaculture business: the case of the most important Latin American bay scallop (Argopecten purpuratus). In Reviews in Aquaculture (Vol. 11, Issue 1, pp. 187–203).
Knipe, H., Temperton, B., Lange, A., Bass, D., & Tyler, C. R. (2021). Probiotics and competitive exclusion of pathogens in shrimp aquaculture. Reviews in Aquaculture, 13(1), 324–352.
Kuebutornye, F. K. A., Abarike, E. D., Lu, Y., Hlordzi, V., Sakyi, M. E., Afriyie, G., Wang, Z., Li, Y., & Xie, C. X. (2020). Mechanisms and the role of probiotic Bacillus in mitigating fish pathogens in aquaculture. Fish Physiology and Biochemistry, 46(3), 819–841.
Kuk-Dzul, J., & Diaz, V. (2016). The Relationship between Mollusks and Oxygen Concentrations in Todos Santos Bay, Baja California, Mexico. Journal of Marine Biology, 2016, 1–10.
Lauzon, H. L., Dimitroglou, A., Merrifield, D. L., Ringø, E., & Davies, S. J. (2014). Probiotics and Prebiotics: Concepts, Definitions and History. In Aquaculture Nutrition (pp. 169–184).
León, J., Aponte, J. J., Cuadra, D., Galindo, N., Jaramillo, L., Vallejo, M., & Marguet, E. (2016). Actinomicetos aislados de Argopecten purpuratus productores de enzimas extracelulares y con actividad inhibitoria de patógenos marinos. Revista de Biologia Marina y Oceanografia y Oceanografía, 51(1), 69–80.
Panda, S. H., Goli, J. K., Das, S., & Mohanty, N. (2017). Production, optimization and probiotic characterization of potential lactic acid bacteria producing siderophores. AIMS Microbiology, 3(1), 88–107.
Pellon, F., Orozco, R., & León, J. (2014). Bacterias marinas con capacidad antimicrobiana aisladas de moluscos bivalvos en cultivos. Revista Peruana de Biología, 8(2), 159–170. https://doi.org/10.15381/rpb.v8i2.6718
Qi, X., Xue, M., Cui, H., Yang, K., Song, K., Zha, J., Wang, G., & Ling, F. (2020). Antimicrobial activity of Pseudomonas monteilii JK-1 isolated from fish gut and its major metabolite, 1-hydroxyphenazine, against Aeromonas hydrophila. Aquaculture, 526, 735366.
Rasmussen-Ivey, C. R., Hossain, M. J., Odom, S. E., Terhune, J. S., Hemstreet, W. G., Shoemaker, C. A., Zhang, D., Xu, D.-H., Griffin, M. J., Liu, Y.-J., Figueras, M. J., Santos, S. R., Newton, J. C., & Liles, M. R. (2016). Classification of a Hypervirulent Aeromonas hydrophila Pathotype Responsible for Epidemic Outbreaks in Warm-Water Fishes. Frontiers in Microbiology, 7, 1615.
Ringø, E. (2020). Probiotics in shellfish aquaculture. Aquaculture and Fisheries, 1–27.
Ringø, E., Zhou, Z., Vecino, J. L. G., Wadsworth, S., Romero, J., Krogdahl, Å., Olsen, R. E., Dimitroglou, A., Foey, A., Davies, S., Owen, M., Lauzon, H. L., Martinsen, L. L., De Schryver, P., Bossier, P., Sperstad, S., & Merrifield, D. L. (2016). Effect of dietary components on the gut microbiota of aquatic animals. A never-ending story? Aquaculture Nutrition, 22(2), 219–282.
Robson, A. A., Halsey, L. G., & Chauvaud, L. (2016). Feet, heat and scallops: what is the cost of anthropogenic disturbance in bivalve aquaculture? Royal Society Open Science, 3(3), 150679.
Rojas, I., Cárcamo, C., Stambuk, F., Mercado, L., Rojas, R., Schmitt, P., & Brokordt, K. (2021). Expression of immune-related genes during early development of the scallop Argopecten purpuratus after Vibrio splendidus challenge. Aquaculture, 533, 736132.
Rojas, R., Miranda, C. D., Romero, J., Barja, J. L., & Dubert, J. (2019). Isolation and pathogenic characterization of Vibrio bivalvicida associated with a massive larval mortality event in a commercial hatchery of scallop Argopecten purpuratusin Chile. Frontiers in Microbiology, 10(MAY).
Smith, C. (2017). Comparación de especies de Vibrio asociadas a la semilla de Argopecten purpuratus (Lamarck, 1819) proveniente de cultivo controlado y del medio natural. Tesis de maestria, Universidad Peruana Cayetana Heredia.
Sohn, S., Lundgren, K., Tammi, K., Smolowitz, R., Nelson, D., Rowley, D., & Gomez-Chiarri, M. (2016). Efficacy of Probiotics in Preventing Vibriosis in the Larviculture of Different Species of Bivalve Shellfish. Journal of Shellfish Research, 35, 319–328.
Tan, L. T. H., Chan, K. G., Lee, L. H., & Goh, B. H. (2016). Streptomyces bacteria as potential probiotics in aquaculture. In Frontiers in Microbiology (Vol. 7, Issue FEB).
Vadassery, D. H., & Pillai, D. (2020). Quorum quenching potential of Enterococcus faecium QQ12 isolated from gastrointestinal tract of Oreochromis niloticus and its application as a probiotic for the control of Aeromonas hydrophila infection in goldfish Carassius auratus (Linnaeus 1758). Brazilian Journal of Microbiology, 51(3), 1333–1343.
Wanka, K. M., Damerau, T., Costas, B., Krueger, A., Schulz, C., & Wuertz, S. (2018). Isolation and characterization of native probiotics for fish farming. BMC Microbiology, 18(1), 119.
White, M. M., McCorkle, D. C., Mullineaux, L. S., & Cohen, A. L. (2013). Early exposure of bay scallops (Argopecten irradians) to high CO₂ causes a decrease in larval shell growth. PloS One, 8(4), e61065.
Zhou, S., Xia, Y., Zhu, C., & Chu, W. (2018). Isolation of Marine Bacillus sp. with Antagonistic and Organic-Substances-Degrading Activities and Its Potential Application as a Fish Probiotic. Marine Drugs, 16(6).