Efecto del 2,4 Diclorofenoxiacético en la inducción de callos a partir de limbos foliares de Ipomoea batatas (L.) Lam. “camote”
Effect of 2,4 Dichlorophenoxyacetic on the induction of callus from leaf blades of Ipomoea batatas (L.) Lam. "sweet potato"
Lindy Pamela Alvarado López 1; Segundo Eloy López-Medina 1; José Mostacero-León 1; Angélica López-Zavaleta 1; Armando Efraín Gil-Rivero 1, Anthony J. De La Cruz-Castillo 1; Luigi Villena-Zapata 2
1 Laboratorio de Biotecnología del Instituto de Papa y Cultivos Andinos. Universidad Nacional de Trujillo. Av. Juan Pablo II S/N; Ciudad Universitaria, Trujillo - Perú.
2 Facultad de Ciencias Naturales y Aplicadas. Universidad Nacional Intercultural Fabiola Salazar Leguía de Bagua
Anthony J. De La Cruz-Castillo:
Artículo original:
Recibido: 13 de abril 2021
Aceptado: 14 de junio 2021
Resumen
Ipomoea batatas (L.) Lam. “camote”, es un cultivo rústico, de importancia nacional por su valor energético y la presencia de antocianinas y carotenos. Su manejo agronómico implica su propagación asexual mediante esquejes, siendo la biotecnología vegetal una buena alternativa para la multiplicación masiva, conservación in vitro y/o mejoramiento del cultivo, para ello se hacen uso de reguladores de crecimiento vegetal. Uno de ellos es el 2,4 Diclorofenoxiacético (2,4-D), el cual a bajas concentraciones se comporta como una auxina inductora en la generación de callos. Ante la necesidad de conocimiento en esta área, se propuso como objetivo de investigación determinar el efecto del 2,4 Diclorofenoxiacético en la inducción de callos a partir de limbos foliares de I. batatas “camote”. En laboratorio se cultivaron explantes a partir de limbos foliares previamente desinfectados de hojas jóvenes de I. batatas de la variedad amarilla, en medio de cultivo MS, suplementado con ácido 2,4-Diclorofenoxiacético (2,4-D), a las concentraciones de 0 μM; 9,48 μM; 11, 3 μM y 13, 56 μM, empleándose un diseño completamente aleatorizado. A los 50 días de evaluación no se encontró diferencias estadísticamente significativas, sin embargo, en la concentración de 9,48 μM μM de 2,4-D se observó la presencia de un 100 % de callos. Se concluye que el ácido 2,4-Diclorofenoxiacético a la concentración de 9,48 μM es favorable en la inducción de callos a partir de limbos foliares de I. batatas (L.) Lam. “camote”.
Palabras clave: Embriones somáticos, limbo, camote, 2,4 Diclorofenoxiacético.
Abstract
Ipomoea batatas (L.) Lam. “camote”, is a rustic crop, of national importance for its energy value and the presence of anthocyanins and carotenes. Its agronomic management implies its asexual propagation through cuttings, being plant biotechnology a good alternative for massive multiplication, in vitro conservation and/or crop improvement, for this, plant growth regulators are used. One of them is 2.4- Dichlorophenoxyacetic (2.4-D), which at low concentrations behaves as an inducer auxin in the generation of calluses. Given the need for knowledge in this area, it was proposed as a research objective to determine the effect of 2.4-Dichlorophenoxyacetic acid on the induction of calluses from leaf blades of I. batatas. In the laboratory, explants were grown from previously disinfected leaf blades of young leaves of I. batatas of the yellow variety, in the MS culture medium, supplemented with 2.4-Dichlorophenoxyacetic acid (2.4-D), at the concentrations of 0 μM; 9.48 μM; 11.3 μM y 13.56 μM, using a completely randomized design. At 50 days of evaluation, no statistically significant differences were found, however, at the 9.48 μM concentration of 2.4-D the presence of 100% calluses was observed. It is concluded that 2.4- Dichlorophenoxyacetic acid at a concentration of 9.48 μM is favorable in the induction of calluses from leaf blades of I. batatas (L.) Lam. "sweet potato".
Keywords: Somatic embryos, limbus, sweet potato, 2,4 Dichlorophenoxyacetic.
* Autor para correspondencia: slopezm@unitru.edu.pe
DOI: http://dx.doi.org/10.17268/rebiol.2021.41.01.12
Citar como:
Alvarado, L., López-Medina, S., Mostacero-León, J., López-Zavaleta, A., Gil-Rivero, A., De La Cruz-Castillo, A., Villena-Zapata, L. 2021. Efecto del 2,4 Diclorofenoxiacético en la inducción de callos a partir de limbos foliares de Ipomoea batatas (L.) Lam. “camote”. REBIOL, 41(1):120-126.
1. Introducción
Ipomoea batatas (L.) Lam. “camote”, pertenece a la familia de las Convolvulaceae, su centro de origen se encuentra entre la Península de Yucatán en México y la boca del río Orinoco en Venezuela (Tincopa, 2010). Existe variedades de color amarilla, blanca y naranjada, siendo la variedad anaranjada la más cultivada para alimentación humana y animal, siendo catalogado el octavo cultivo más importante del mundo después del trigo, arroz, papa, tomate, maíz, yuca y bananas, con una producción que supera los 105 millones de toneladas al año, en países tropicales y subtropicales del mundo (Centro Internacional de la Papa, 2015; Basurdo, 2015; Gallo et al., 2000). I. batatas puede cultivarse en suelos arenosos de la costa peruana hasta los 2500 m.s.n.m. Se caracteriza por su rusticidad requiriendo pocos insumos agrícolas y poca mano de obra comparado con otros cultivos como el maíz, frejol, entre otros (Balbín, 2014; Centro Internacional de la Papa, 2015). Existiendo una gran diversidad de variedades con diferentes colores de cáscara y de pulpa, desde el blanco, naranja, morado y amarillo. Desde el punto de vista nutricional es una fuente valiosa de vitaminas B, C y E, además de contener niveles moderados de hierro y zinc. La presencia de antioxidantes del tipo antocianinas y carotenos, ha contribuido a que sea catalogado como alimento nutraceútico, ya que pueden nutrir y a la vez curar y/o prevenir enfermedades degenerativas (Boucher, 2000; Gil et al., 2019).
De manera tradicional, los agricultores propagan asexualmente I. batatas “camote”, mediante esquejes. Sin embargo, con fines de conservación, saneamiento y mejoramiento del germoplasma se recurre a la biotecnología vegetal (López et al., 2019a). El cultivo de tejidos celulares constituye ser una valiosa técnica para la multiplicación acelerada de una especie, para ello se requieren de reguladores de crecimiento para controlar los procesos fisiológicos (López et al., 2019b; Vidal et al., 2018).
Durante la inducción de la embriogénesis somática pueden ocurrir dos sucesos diferentes como son la embriogénesis somática directa y la indirecta, donde la primera permite obtener embriones somáticos directamente de células aisladas o grupos de células mientras la segunda se origina a partir de la formación de un callo (Freire, 2003).
Investigaciones de Guevara et al. (2012), sostienen que, para la inducción de tejidos embriogénicos en I. batatas, se pueden utilizar diferentes explantes como: Lámina foliar y peciolo, pudiendo emplearse la concentración de 2,26 μM de 2,4-D, durante ocho semanas a una temperatura de 25 ºC, registrándose un mayor porcentaje de inducción empleando peciolos. De la misma manera Tapia (2018), sostiene que la concentración de 22,62 μM de 2,4-D, induce a la generación de callos friables, poco compactos y poco nodulares, empleando como explantes la lámina foliar con peciolo de I. batatas. Mientras que López (2019), sostiene que el tratamiento constituido por MS a la mitad de componentes suplementado con 0,004 mg/L paclobutrazol, 0,49 mg/L chlormequat, es adecuado para la preservación y conservación in vitro de I. batata. Ante la necesidad de un mayor conocimiento en esta área, se propuso como objetivo de investigación determinar el efecto del 2,4 diclorofenoxiacético en la inducción de callos a partir de limbos foliares de I. batatas “camote”.
2. Materiales y Métodos
Obtención de las plantas madres
La presente investigación se realizó en el Laboratorio de Biotecnología del Instituto de la Papa y Cultivos Andinos de la Facultad de Ciencias Biológicas, Universidad Nacional de Trujillo. Donde se instaló parcelas experimentales de 120 cm x 180 cm de la variedad amarilla de Ipomoea batatas (L.) Lam. “camote”. Las coordenadas de la ciudad universitaria son: 8°06′53″S 79°02′19″O , con una humedad relativa de 80±5% y 22±3 °C de temperatura. Para la identificación botánica de I. batatas (L.) Lam. “camote”, se determinó por comparación con los especímenes registrados en el Herbarium Truxillense de la Universidad Nacional de Trujillo. También se recurrió a claves taxonómicas de Brako y Zarucchi (1993) y Mostacero et al. (2009) y por comparación con los portales virtuales de Trópicos y The Plant List.
Preparación del medio de cultivo
Se empleó el medio de cultivo Murashige y Skoog (1962), suplementado con sacarosa al 3%, agar al 0,8% y 2,4-D (ácido diclorofenoxiacético) empleando las concentraciones de T1:0 μM; T2: 9,48 μM; T3: 11,3 μM y T4: 13,56 μM, los cuales conformaron los tratamientos. El pH se ajustó a 5,7-5,8 y se dispensó 2 ml del medio de cultivo en cada tubo de ensayo, los cuales fueron cubiertos en la parte superior con papel aluminio, para finalmente ser esterilizarlos en autoclave a 121°C por 15 minutos.
Establecimiento in vitro
A los 60 días de sembradas las plantas madres, se tomaron 5 esquejes de 15cm y se transportaron a laboratorio, donde se eliminó todas las hojas y fueron colocados en frascos con agua corriente. Pasado 15 días, después de brotar nudos, se cortaron con una navaja estéril segmentos de hoja de 1cm de lado, los cuales fueron depositados en un recipiente con agua estéril.
Desinfectado el área de siembra y encendidos los mecheros, los explantes fueron desinfectados con alcohol de 70º grados por 15 segundos y luego en lejía al 1% durante 2 minutos, seguido de 4 enjuagues con agua destilada estéril. Una vez terminada la actividad, con la ayuda de las pinzas, se colocó cada explante de 1cm cuadrado en su respectivo tubo de ensayo.
Concluida la actividad el material in vitro fue transportado a cámara de incubación, a un fotoperiodo de 16-8 horas luz-oscuridad y a una humedad relativa de 80% y 22 ±2 °C de temperatura. Como inductor para la formación de callos embriogénicos se consideró las diferentes concentraciones de 2,4 Diclorofenoxiacético.
Análisis estadístico
Se empleó un diseño completamente al azar. Los cuatro tratamientos constaron con 60 unidades experimentales.
Para la toma de datos se consideró el tamaño de 0,5 cm de diámetro, el color (crema- amarillo y anaranjado-pálido) y el tipo de consistencia (Semiblando y blando). Los resultados fueron analizados con el software libre R Studio versión 4.0.3.; empleándose la prueba del Chi-cuadrado.
3. Resultados
Los callos obtenidos de I. batatas mostraron diferentes características morfológicas en cada una de los tratamientos (Tabla 1), asimismo fue en el tratamiento 2, constituido por 9,48 μM de 2,4 Diclorofenoxiacético, el que alcanzó un 100% en la formación de callos para la variedad amarilla de I. batatas (Figura 1).
Tabla 1. Porcentaje de inducción de callos a partir de limbos foliares de I. batatas (L.) Lam. “camote, según tratamiento y variables.
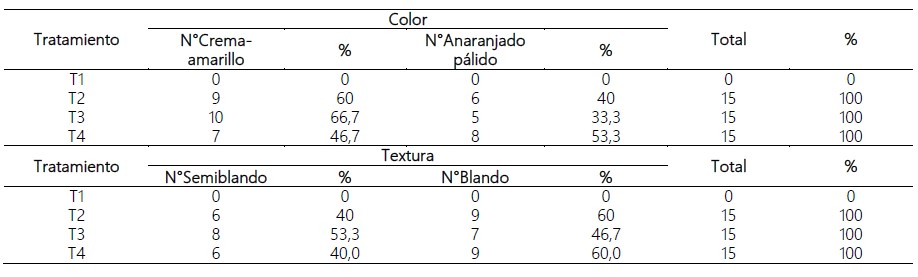
En la Tabla 2 se muestra que el p-valor de significancia de la prueba de Chi-cuadrado se ajusta a una distribución uniforme, resultó ser mayor que 0,05 en el análisis de cada uno de los tratamientos tanto para la variable color y la variable textura, indicando que las proporciones de las categorías crema-amarillo y anaranjado pálido de la variable color como en las categorías de la variable textura obtenido por cada uno de los tratamientos no presentan diferencia significativa, así mismo, la prueba Chi-cuadrado para más de dos proporciones con muestras independientes presentó un p-valor mayor que 0,05, tanto para la variable color (p=0,529>0,05) y para la variable textura (p=0,698>0,05), corroborándose que no existen diferencias significativas en las categorías crema-amarillo y anaranjado pálido entre los tratamientos evaluados así como entre las categorías semiblando y blando.
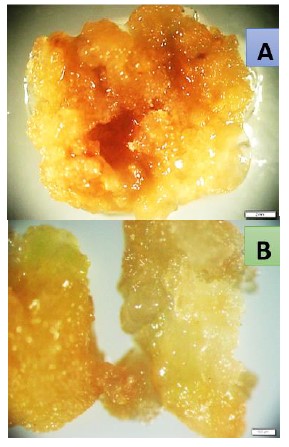
Figura 1. Callos de I. batatas (L.) Lam. “camote” variedad amarilla, a los 50 días del cultivo in vitro A) Callo semiblando y anaranjado B) Callo blando y crema-amarillo.
Tabla 2. Prueba Chi-cuadrado para el estudio, efecto del 2,4 Diclorofenoxiacético en la inducción de callos a partir de limbos foliares de I. batatas (L.) Lam. “camote”.
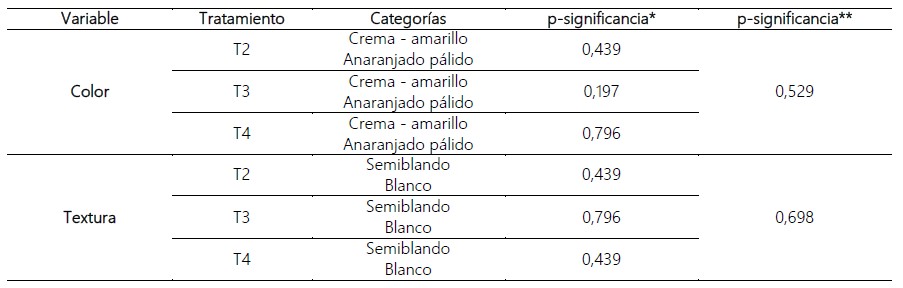
Nota: No se consideró el tratamiento 1 en las pruebas estadísticas, por ser el testigo experimental.
*Prueba Chi-cuadrado de ajuste a la distribución uniforme.
**Prueba Chi-cuadrado para más de dos proporciones con muestras independientes
4. Discusión
Se obtuvo callos a los 50 días de siembra (Tabla 1), debido principalmente a la presencia de la hormona 2,4-D en el medio de cultivo, ya que induce el crecimiento desordenado y acelerado, conformando una masa amorfa de células (Tabla 1 y Figura 1). Investigaciones han demostrado que las auxinas como el 2,4-D influye en la generación de callos celulares, acidifica la pared celular, promueve el alargamiento de la célula y regular la arquitectura de los meristemos, cabe resaltar que la callogénesis es un paso importante en la posterior inducción de la embriogénesis somática (Durango et al., 2019; García, 2013; Tapia, 2018; Zubiaga, 2019).
En la producción de callos está íntimamente ligada estrés físico o químico, sin embargo, este efecto puede verse potencializado con la adición de otra hormona ya sea auxinas y citoquininas. Cabe indicar que el 2,4-D es la principal hormona empleada en la inducción de callos celulares, motivo por la cual, a los 50 días de siembra in vitro de limbos foliares de I. batata, se pudo observar su presencia (Sánchez, 2013). Investigaciones de Sánchez et al. (2019), corrobora esta afirmación al emplear BAP, 2,4-D y 2,4-D+KIN en un medio de cultivo, obteniendo callos y posteriores embriones somáticos. Los callos se caracterizan por tener una apariencia blanda, de color crema, amarillo pálido y con cierto aspecto desorganizado, como lo observado en la Figura 1. Factores como la textura del tejido y formación de nuevos tejidos están condicionados por el efecto de las auxinas (Figura 1). Mientras que el color puede variar de acuerdo al tipo de explante y al tiempo en el que ha sido cultivado, inclusive factores ambientales como nutricionales contribuyen con la presencia de clorofila, carotenos, antocianinas entre otros (García, 2013; Valderrama et al., 2008).
La presencia de un 100% de callos en I. batatas (Figura 1), se debió a que la concentración de 9,48 μM de 2,4-D favorezca la desdiferenciación y división celular. Resultados similares obtuvieron Sharmin y Mahabubur (2011), en peciolos de I. batata, empleando la concentración de 9,48 μM de 2,4-D a los 30 días de cultivo. Sin embargo, Guevara et al. (2012) sostiene que mayores porcentajes de inducción (>80%), se obtienen cuando se emplea la concentración de 2,26 μM de 2,4-D.
En la tabla 2, se evidencia que las categorías crema-amarillo y anaranjado pálido de la variable color, como en las categorías de la variable textura no evidencian diferencias estadísticamente significativas, así mismo, la prueba Chi-cuadrado, corrobora esta afirmación, probablemente se deba a la concentración o al tiempo de exposición de la hormona (Enríquez, 2019; Martínez, 2017). De los resultados obtenidos se afirma que el ácido 2,4-diclorofenoxiacético a la concentración de 9,48 μM es la más favorable en la inducción de callos a partir de limbos foliares de I. batatas (L.) Lam. “camote, cabe resaltar que investigaciones de Rojas et al. (2014) y Konczak-Islam et al. (2003), sostienen que el empleo de 2,4-D, para la inducción de callos, contribuye con un mayor rendimiento de antocianinas y compuestos fenólicos, lo cual resulta favorable para estudios fitoquímicos. Mientras que Solís et al. (2018), sostiene que el empleo del 2,4-Diclorofenoxiacético es fundamental para maximizar la producción de callos, los cuales darán origen a los embriones somáticos.
5. Conclusión
Se concluye que el ácido 2,4-Diclorofenoxiacético a la concentración de 9,48 μM es favorable en la inducción de callos a partir de limbos foliares de I. batatas (L.) Lam. “camote”.
6. Agradecimientos
Un agradecimiento especial al Laboratorio de Biotecnología del “Instituto de La Papa y Cultivos Andinos” (IPACA) de la Universidad Nacional de Trujillo, Perú; por el apoyo logístico y de ambientes brindados, posibilitando de esta manera la realización de la presente investigación.
7. Contribución de autores
Lindy Pamela Alvarado López: Ejecución del trabajo de laboratorio.
Segundo E. López-Medina: Concepción de la idea, interpretación de datos y aprobación final de informe.
José Mostacero-León: Concepción de la idea, interpretación de datos y aprobación final de informe.
Angélica López-Zavaleta: Ejecución del trabajo de campo
Armando E. Gil-Rivero: Redacción de informe.
Anthony J. De La Cruz-Castillo: Recolección y procesamiento de datos.
Luigi Villena-Zapata: Análisis y diseño estadístico.
8. Conflicto de intereses
No existe conflicto de intereses entre los autores.
9. Referencias bibliográficas
Brako, L., Zarucchi, J. (1993). Catalogue of the Flowering Plant and Gymnosperms of Peru. Ed. Missouri Bot. Garden. USA. 1286 pp.
Basurdo, F. (2015). Conocimiento actual del cultivo de camote (Ipomoea batatas (L.) Lam. en México. Agro Productividad, 8(1),30-34.
Balbín, B. (2014). Nutracéutico peruanos que previenen enfermedades. Cultura. Ciencia y Tecnología, 5, 9-16.
Boucher, F. (2000). Los productos nutracéuticos: Oportunidad para los recursos naturales autóctonos. El papel de los investigadores. Ed. IICA. Lima, Perú.
Centro Internacional de la Papa (CIP). (2015). Datos y cifras del camote. https://cipotato.org/es/programas-de-investigacion/camote/datosycifrasdelcamote/
Durango, E., Suarez, A., Padilla, Y. (2019). Formación de callos y embriones somáticos en dos variedades de yuca. Revistas De Investigación Agropecuaria Y Desarrollo Sostenible, 4(1), 28-33.
Enríquez, A. (2019). Análisis fisiológico, bioquímico y molecular del desarrollo y maduración del embrión somático de Musa. [Tesis de postgrado, Centro de Investigación Científica de Yucatán].
Freire, M. (2003). Aspectos básicos de la embriogénesis somática. Biotecnología Vegetal, 3(4), 195-209.
Gallo, P., Escobar, H, Chávez, R., Jiménez, M., Torres, A. & Carrión, H. (2000). Introducción y evaluación de variedades mejoradas de camote (Ipomoea batatas L.) en las zonas áridas salinas del Norte de Chile. IDESIA.19.
García, J. (2013). Establecimiento de un sistema de regeneración in vitro de Cempaxuchitl (Tagetes erecta) vía organogénesis indirecta. [Tesis de pregrado, Universidad Autónoma de Querétaro].
Gil, A., López, E., Mostacero, J., De la Cruz, A. (2019). Papas nativas con potencial antioxidante, cultivadas en el norte del Perú. Boletín Latinoamericano y del Caribe de Plantas Medicinales y Aromáticas, 18(3), 289-324.
Guevara, Y., Suarez, I., Salgado, J. (2012). Inducción y proliferación in vitro de tejidos celulares de batata (Ipomoea batatas (L.) Lam) en medio con 2,4-D. Revista temas agrarios, 17(2), 9-17.
Hinkle, D., Wiersma, W., & Jurs, S. (2003). Applied statistics for the behavioral sciences (5th ed.). Houghton Mifflin.
Konczak-Islam, I., Okuno, S., Yoshimoto, M., Yamakawa O. (2003). Composition of phenolics and anthocyanins in a sweet potato cell suspension culture. Biochemical Engineering Journal, 14, 155-1
López, S., Mostacero, J., Gil, A., López, A., De la Cruz, A. (2019a). Efecto del ácido giberélico y del ácido indolacético en la micropropagación in vitro de Solanum tuberosum var. Maria Reiche. Rebiol, 39(1), 1-6.
López, S., Mostacero, J., Gil, A., López, A., De la Cruz, A., Villena, L. (2019b). Efecto sinérgico del ácido giberélico y del ácido indolacético en la propagación in vitro de Solanum tuberosum L. ‘‘papa nativa de pulpa de color”. Rebiol, 39 (2), 49-57.
López, D. (2019). Efecto de sorbitol e inhibidores de giberelinas en crecimiento in vitro de segmentos nodales de camote (Ipomoea batatas L. Lam.) y papa (Solanum tuberosun L.) [Tesis de pregrado, Universidad Zamorano].
Martínez, S., Gómez, R., Barbón, R., Collado, R., Pérez, M., Veitia, N., Rodríguez, M. (2017). Maduración y germinación de embriones somáticos de Sorghum bicolor (L.) Moench cultivar ‘CIAP 132R-05’. Biotecnología Vegetal, 17(1), 33-39.
Mostacero, J., Mejía, F., Gamarra, O. (2009). Fanerógamas del Perú: taxonomía, utilidad y ecogeografía. 1ra Edición. Ed. CONCYTEC. Trujillo, Perú. 1330 pp.
Rojas, C., Kato, M., Delgado, G., Sega, E., Handro, W. (2014). Producción de metabolitos secundarios en cultivo de raíces in vitro y suspensiones celulares de Ipomoea carnea spp. carnea Jacq. Anales de Biología, 36, 107-120.
Sánchez, V. (2013). Establecimiento de un protocolo para la obtención de embriones somáticos tanto en medio sólido como en suspensión celular, a partir de embriones cigóticos inmaduros de palma coco cumbé (Parajubaea cocoides Burret). [Tesis de pregrado, Universidad de las Fuerzas Armadas].
Sánchez, J. Cabrera, R., & Jiménez, J. (2019). Inducción de embriogénesis somática a partir de explantes foliares en tres variedades de café. Scientia Agropecuaria, 10(2), 259-264.
Sharmin, R. & Mahabubur, M. (2011). Cell proliferation and cell aggregate development in suspensión culture of sweet potato (Ipomoea batatas L.). International Journal of Biosciences, 1(6), 6-13.
Solis, A., Espinal, D., Rueda, A., & Bravo, M. (2008). Inducción de embriogénesis somática a partir de vitrosegmentos nodales y vitroláminas foliares durante el establecimiento in vitro de camote (Ipomoea batatas). [Tesis de pregrado, Universidad Zamorano].
Tapia, B. (2018). Inducción de callo embriogénico en camote (Ipomoea batatas L.) con ácido 2,4-diclorofenoxiacético. [Tesis de pregrado, Universidad Zamorano] Honduras.
Tincopa, L. (2010). Establecimiento de un índice de genes en Ipomoea batatas (L.) Lam. usando secuenciamiento 454 a partir de bibliotecas de cDNA y desarrollo de marcadores microsatélites. [Tesis de posgrado, Universidad Nacional Mayor de San Marcos].
Valderrama, S., Chico, J., Tejada, J., & Vega, A. (2008). Regeneración de plántulas, vía embriogénesis somática, a partir de hojas de fresa, Fragaria virginiana, utilizando ANA y BAP. REBIOL, 28(2), 1-12
Vidal, A., Zaucedo, A., Ramos, M. (2018). Propiedades nutrimentales del camote (Ipomoea batatas L.) y sus beneficios en la salud humana. Revista Iberoamericana de Tecnología Postcosecha, 19(2), 1-15.
Zubiaga, S. (2019). Efecto del Tidiazurón y del 2,4-Diclorofenoxiacético en la inducción de callos de Cyclamen persicum Mill. Primulaceae. [Tesis de pregrado, Universidad Nacional de Trujillo].