COMPOSICIÓN Y ABUNDANCIA DE LA DIETA DE Mugil cephalus (LISA), REGIÓN LA LIBERTAD - PERÚ, 2016
COMPOSITION AND ABUNDANCE OF Mugil cephalus “LISA”, LA LIBERTAD REGION - PERU, 2016
Brenda Villanueva Gómez 1; Dennis Atoche-Suclupe 2; Zoila Culquichicón Malpica 3
1 Egresada de la Universidad Nacional de Trujillo
2 Instituto del Mar del Perú
3 Universidad Nacional de Trujillo
Zoila Culquichicón Malpica:
Artículo original:
Recibido: 31 de marzo 2021
Aceptado: 28 de mayo 2021
Resumen
Se determinó la composición y abundancia de la dieta de Mugil cephalus en la región La Libertad durante el año 2016. Se analizó una muestra de 962 estómagos. La composición de la dieta fue estimada con el uso de los métodos numérico y volumétrico (biomasa húmeda de presas). La dieta estuvo conformada por 32 presas agrupadas en cuatro ítems presa. Las diatomeas pelágicas fueron las más numerosas, sin embargo, en cuanto al porcentaje de biomasa húmeda, fue mayor en el ítem copépodo. Los resultados constituyen un aporte significativo al conocimiento del régimen alimentario de M. cephalus, no obstante, se necesitan estudios a mayor escala espacial y temporal, que permitan un análisis a nivel de hábitat trófico de peces planctófagos.
Palabras Clave: Mugil cephalus, composición y abundancia de dieta, región La Libertad.
Abstract
The composition and abundance of Mugil cephalus diet in La Libertad region during 2016 was determined. A sample of 962 stomachs was analyzed. The composition of the diet was estimated using the numerical and volumetric (wet biomass of prey) methods. The diet consisted of 32 preys grouped into four prey items. The pelagic diatoms were the most numerous, however, in terms of the percentage of wet biomass, it was higher in copepod item. The results constitute a significant contribution to the knowledge of the M. cephalus food regime, however, studies on a larger spatial and temporal scale are needed, which allow an analysis at the trophic habitat level of planctophagous fish.
Keywords: Mugil cephalus, diet composition and abundance, La Libertad region
* Autor de correspondencia: datoche@imarpe.gob.pe
DOI: http://dx.doi.org/10.17268/rebiol.2021.41.01.07
Citar como:
Villanueva, B., Atoche-Suclupe, D., & Culquichicón, Z 202 1 Composición y abundancia de la dieta de Mugil cephalus (lisa), región La Libertad - Perú, 2016. REBIOL, 41(1):68-74.
1. Introducción
La determinación de la dieta de los peces a través del análisis de contenido estomacal es un método efectivo (Buckland et al., 2017). Comprender las variaciones en la composición alimenticia de los peces, proporcionan bases complementarias para el crecimiento, desove, ritmo circadiano, desarrollo de su ciclo de vida e interacciones ecológicas (Wootton,1990; Link y Almeida, 2000; Khan’ko et al., 2009; Choy et al., 2015; Shaw et al., 2016; Yuneva et al., 2016), para establecer métodos que logren una efectiva gestión de los recursos hidrobiológicos (Jaramillo, 2009).
Mugil cephalus (Linnaeus, 1758) es uno de los principales recursos pesqueros desembarcados en la región La Libertad (Atoche, 2021), su hábitat se encuentra en la zona pelágica de la costa de regiones tropicales y subtropicales principalmente. Esta especie es cosmopolita y se encuentra en los océanos Atlántico y Pacífico. En el Pacífico Oriental abarca desde el sur de California (Bahía de San Francisco) hasta Valdivia en Chile (Chirichigno y Cornejo, 2001; FAO, 2006).
Investigaciones sobre biología trófica de M. cephalus, destacan los aportes descriptivos de Hendricks (1961); Thompson (1964); Llanos (1974); y reciente como Fernández (2014). Sin embargo, pocos son realizados en el norte de Perú, por lo que es necesario obtener indicadores cuantitativos de la dieta de esta especie. Por ello, el objetivo de este estudio fue determinar la composición y abundancia de la dieta de M. cephalus en la región La Libertad durante el año 2016.
2. Material y Métodos
El área de estudio se localizó en la zona costera de la región La Libertad, donde se desarrolla la pesca artesanal.
Los lugares de muestreo fueron: Puerto Pacasmayo, Puerto Malabrigo, Caleta Huanchaco, Puerto Salaverry y Caleta Puerto Morín. Los muestreos se realizaron de febrero a diciembre, se trabajó con 21 muestras; éstas procedieron de 15 zonas de pesca (Fig. 1). Estas capturas fueron realizadas por embarcaciones de madera denominadas “bote” de 2 a 4 t de capacidad de bodega, utilizando redes cortina de 3” a 4,5” de tamaño de malla.
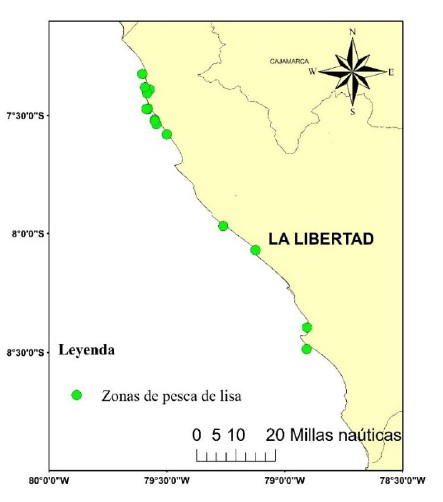
Figura 1. Ubicación geográfica de la zona de estudio.
Se trabajó con 926 ejemplares de M. cephalus de 25 a 45 cm de longitud total. Del total de ejemplares, se obtuvieron datos de peso de estómago lleno, peso de estómago vacío y peso de contenido estomacal, en gramos; para ello se utilizó una balanza marca KERN de 6 kg de capacidad y 0,01 g de sensibilidad.
Para el análisis del contenido estomacal se analizó el primer estómago por intervalo de talla. Los ejemplares fueron agrupados por intervalos de talla de 3 cm de amplitud, siendo en total 7 intervalos. Posterior a ello, se filtró la muestra con el uso de dos tamices, uno con tamaño de malla de 75 μm para fitoplancton y de 300 μm para zooplancton.
Para determinar la composición de la dieta de M. cephalus se reconocieron los organismos presa con el uso de un microscopio binocular Zeiss - Primo Star, en el cual se analizaron las muestras de los contenidos estomacales a un aumento de 10x; además de un estereoscopio Leica - 6sd; y bibliografía especializada, para fitoplancton (Cupp, 1943; Balech, 1988) y para zooplancton (Santander et al., 1981; Boltovskoy, 1981). Las presas fueron organizadas en ítems alimentarios o presa, para un mejor entendimiento de los patrones; en fitoplancton, las presas se clasificaron en: diatomeas bentónicas, diatomeas pelágicas, dinoflagelados; en zooplancton, solo se consideró un ítem alimentario, copépodos; y otras presas constituyeron huevos, larvas, tintínidos, Euphausiacea, Amphipoda, Apendicularia, Zoea y nauplio de crustáceos.
La abundancia de la dieta de M. cephalus consistió en la determinación en número de los componentes fitoplanctónico y zooplanctónico. La componente fitoplanctónica, se analizó en un frasco de 30 ml, luego se llevó una alícuota (0,1 ml) a una lámina portaobjeto; cubriéndola con una laminilla; realizándose un conteo total del campo. La componente zooplanctónica; se diluyó en un vaso de precipitación, llevándolo a 50 ml y con ayuda de una pipeta se tomó una alícuota de 10 ml, la cual fue vertida en una cámara Bogorov, donde se realizó el conteo respectivo.
Para estimar la biomasa húmeda por presa según el método volumétrico, se utilizaron factores de conversión de biovolúmenes individuales de fitoplancton y zooplancton (Sun y Liu 2003; Taylor, 2008) y se siguió el procedimiento propuesto por el protocolo interno del Laboratorio de Ecología trófica del IMARPE (Villanueva, 2016). Posterior a ello, se aplicó la prueba estadística de Kruskal Wallis para verificar si existe diferencia significativa en la biomasa húmeda de ítems alimentarios por mes y por rangos de longitud total, para los principales ítems alimentarios.
3. Resultados
La dieta de M. cephalus estuvo conformada por 32 presas.
Estos ítems fueron constituidos por: 4 géneros de diatomeas bentónicas, 9 géneros de diatomeas pelágicas, 5 géneros de dinoflagelados, 3 géneros de copépodos, 3 géneros de larvas, 1 de tintínidos y 7 de miscelánea.
La dieta de M. cephalus según el método numérico indicó que el ítem alimentario más abundante en todo el periodo de estudio fueron las diatomeas pelágicas (73,1%); y hay patrones de variación para diatomeas y copépodos. En el caso de las diatomeas bentónicas, se observó que los mayores valores correspondieron al periodo junio-septiembre. En el caso de los copépodos se observó que el mayor valor se dio en junio (Fig. 2).
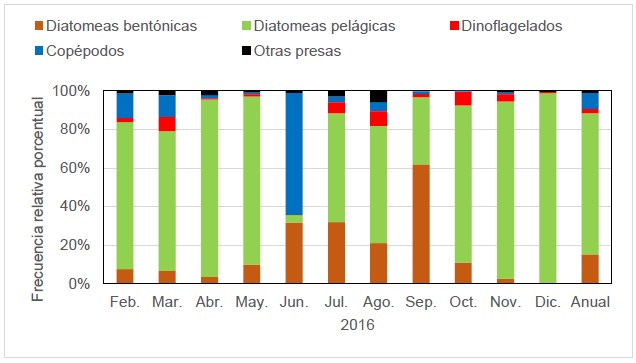
Figura 2. Variación mensual de ítems alimentarios de M. cephalus, según el método numérico.
La dieta de M. cephalus según el método volumétrico indicó que el ítem alimentario más abundante en todo el periodo de estudio fueron los copépodos (80,6%); y hay un patrón de variación para diatomeas pelágicas y copépodos. Este patrón indicó que las diatomeas pelágicas, predominaron principalmente en el periodo octubre-diciembre; caso contrario se observó en los copépodos, que predominaron casi todo el año, pero en el periodo octubre-diciembre se observó menores porcentajes (Fig. 3). Esto se verificó con un análisis no paramétrico, que indicó que no hay evidencia estadística para demostrar diferencias entre el consumo de dinoflagelados (p valor: 0,097) en función al tiempo (mes); sin embargo, para el caso de diatomeas pelágicas (p valor: 0,000), diatomeas bentónicas (p valor: 0,003) y copépodos (p valor: 0,010) si hay diferencias, por lo que no es consumido en la misma cantidad en todos los meses.
Las presas con mayor importancia en porcentajes de biomasa húmeda en todo el año fueron: Orden Cyclopoida (72,3%), Coscinodicus sp (10,5%), Calanus sp (7,6%), Helicostomella (4,4%), y larvas de cirrípedos (1,4%). Esto demuestra que la dieta de lisa en función al método volumétrico, tuvo preferencia por el Orden Cyclopoida.
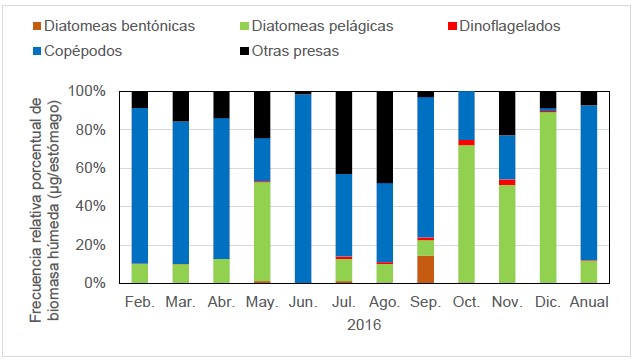
Figura 3. Variación mensual de ítems alimentarios de M. cephalus, según el método volumétrico.
La dieta de M. cephalus según intervalos de longitud total (cm) no presentó evidencia estadística para demostrar variación ontogénica en el consumo diatomeas pelágicas (p. valor: 0,938), diatomeas bentónicas (p. valor: 0,611), dinoflagelados (p. valor: 0,745) y copépodos (p. valor: 0,662). Se observó que, desde los 25 cm hasta los 42 cm, hay una predominancia de copépodos; y de 43 cm a 45 cm, predominaron diatomeas pelágicas y larvas de cirrípedos (otras presas) (Fig. 4).
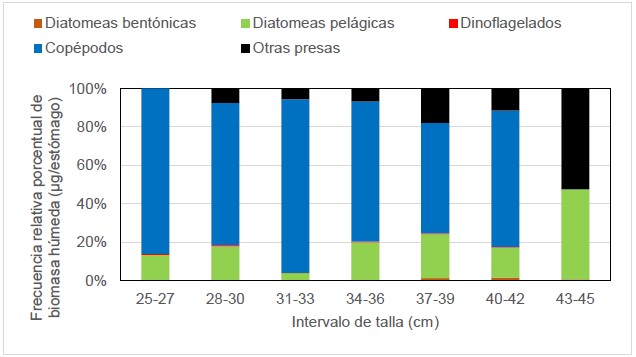
Figura 4. Variación ontogénica de la dieta de M. cephalus.
4. Discusión
El número total de presas reportadas en este estudio fue de 32, correspondientes a zooplancton y fitoplancton.
Estos valores son inferiores a 87 presas, reportado por Fernández (2014), que utilizó una metodología similar para determinar la variación de la dieta de M. cephalus frente al Callao. Estas diferencias pueden ser explicadas por corresponder a periodos y zona de estudio diferentes.
El método numérico es utilizado para estimar la abundancia de presas de algún grupo en la dieta de los peces. En esta investigación se observó que el grupo diatomeas fue el más abundante, similar a los resultados de Atoche (2016); Islam et al., (2009); Mondal et al., (2015); Fernández (2014); Asuquo (2015). Sin embargo, hay autores como Dankwa et.al. (2005), que reportan el consumo de partículas de arena y poliquetos, como parte de la dieta de M. cephalus, no obstante, la arena puede ser ingerido incidentalmente y no es considerada una presa, en cambio los poliquetos sí pueden formar parte de la dieta, y es ingerido en lugares someros y con abundancia de fango.
Una de las desventajas del método numérico es que, si las presas no son similares en tamaño, puede no ser el adecuado para expresar la importancia de un item alimentario (Pillay, 1952). Como el caso de los clupeoideos, que fueron catalogados como consumidores de fitoplancton, según estimaciones utilizando el método numérico, y que posteriormente fueron consideradas como una catalogación errónea (Hyslop, 1980; Konchina, 1991). Ante ello, en esta investigación el método numérico fue referencial y sirvió para la estimación volumétrica del aporte de las presas.
En los resultados, el método volumétrico destaca un aporte mayoritario de consumo de zooplancton (88%); cuyo ítem más representativo fueron los copépodos. Estos resultados coinciden con Fernández (2014) quién reporta un 54 % de contenido de carbono por parte de los zooplanctontes (Calanus sp. Eucalanus sp. y Harpatocoida principalmente). Investigaciones en otras especies planctófagas, indican contenidos de zooplancton, expresados en contenidos de carbono, superiores al 98 % en anchoveta (Espinoza, 2010; Espinoza & Bertrand, 2008) y sardina (Espinoza et al., 2009).
Por lo tanto, a mayor tamaño de presa, el contenido de energía o nitrógeno será superior (Smayda, 1978, Hitchcock 1982). Es decir, está directamente relacionado con el volumen de la presa (Mullin et al., 1966). Por ello, es posible que con excepción del género Coscinodiscus, que es el que mayor contenido de carbono aporta (Espinoza y Bertrand, 2008; Espinoza et al., 2009), el grupo fitoplancton fue ingerido de manera incidental, a través del filtrado que ejercen las branquias. Esta hipótesis fue respaldada por Cushing (1978), analizando el contenido estomacal de Sardinops sagax.
La variación ontogénica en la dieta de peces, se refiere a las distintas preferencias de presas según la variación de su tamaño del pez. Para el caso de M. cephalus, Fernández (2014) indica que no hay una variación ontogénica. Sin embargo, Kurma y Ramesh (2013), afirman que los adultos de la especie se alimentan de materia orgánica muerta y en descomposición junto con harpacticoides y poliquetos, a diferencia de los juveniles que ingieren fitoplancton; Pincay (2017) también observó diferencias entre individuos de mayor tamaño, debido a que la boca del pez es más grande. Estas diferencias observadas en la dieta de los peces se dan por competencia intraespecífica (favorece la variación de la dieta) e interespecífica (limita el aumento de la variación de la dieta) (Cachera et al., 2016); fluctuaciones estacionales (Lawson et al. 2017), incluso por parásitos (Vivas et al. 2021).
Los resultados de este estudio muestran un aporte al conocimiento de composición y abundancia de la dieta a través de dos métodos cuantitativos. Es necesario que se siga recopilando información para observar patrones de variación interanual. Además, se sugiere ampliar la escala de estudio, para observar variaciones latitudinales; analizar en lo posible individuos de menor tamaño, para lograr un mejor análisis de la ontogenia de la dieta y analizar otras especies con las que M. cephalus comparte hábitat.
5. Conclusiones
Mugil cephalus se alimenta de diatomeas, dinoflagelados y copépodos, sin embargo, las presas más abundantes en biomasa húmeda fueron del grupo copépodos. No presenta variación temporal en el consumo de dinoflagelados, pero sí de diatomeas y copépodos. No hay evidencia estadística para demostrar variación ontogénica en el consumo de presas.
6. Agradecimiento
Al Ing. Luis Escudero Herrera, coordinador del Laboratorio Costero de Huanchaco en el periodo cuando se desarrolló el estudio, por brindar las facilidades para el uso de materiales y equipos utilizados. También, a la Blga. Betsy Buitrón Díaz, actual coordinadora del Laboratorio Costero de Huanchaco, por la gestión efectiva en la coordinación IMARPE-UNT, al finalizar la investigación. Esta investigación formó parte de la tesis: “Alimento y hábitos alimentarios Mugil cephalus “lisa” en la Región La Libertad durante el año 2016” de la Blga. Pesq. Brenda Olenka Villanueva Gómez, desarrollada por el Laboratorio Costero de Huanchaco (IMARPE) y la escuela de Biología Pesquera de la Universidad Nacional de Trujillo.
7. Contribución de autores
Brenda Villanueva Gómez: Apoyo en la realización de muestreos biológicos, reconocimiento de presas y redacción del artículo.
Dennis Atoche-Suclupe: Encargado de coordinar los muestreos, asesoramiento en el procedimiento de muestreo de contenido estomacal, tratamiento y análisis de datos del método volumétrico.
Zoila Culquichicón Malpica: Investigadora encargada de asesorar en la redacción del artículo y obtención de resultados utilizando el método numérico.
8. Conflicto de intereses
Los autores declaran que no existe conflicto de interés.
9. Referencias bibliográficas
Asuquo, P., Eyo, V., Ikechukwu, C. (2015). Feeding Ecology, Length-Weight relationship and Condition Factor of Mugil cephalus (Pisces: Mugilidae; Linnaeus, 1758) From Cross River Estuary, Nigeria. European academic research, 2 (12).
Atoche, D. (2021). Seguimiento de la pesquería demersal y costera en la región La Libertad, 2020. Informe interno anual, IMARPE sede Huanchaco.
Atoche, D. (2016). Seguimiento de la Pesquería Demersal Costera en la Región La Libertad, 2015. Informe interno anual, IMARPE sede Huanchaco.
Balech, E. (1988). Los Dinoflagelados Atlántico Sudoccidental. Publ. Espec. Inst. Esp. Oceanogr. 299 p.
Boltovskoy, D. (1981). Atlas del zooplancton del Atlántico Sudoccidental y métodos de trabajo con el zooplancton marino. Publicación Especial del INIDEP, Mar de Plata, 936p.
Buckland, A., Baker, R., Loneragan, N., Sheaves, M. (2017). Standardising fish stomach content análisis: The importance of prey condition. Fisheries Researck, 196(2017), 126-140.
Cachera, M., Ernande, B., Villanueva, M.C., Lefebvre, S. (2016). Individual diet variation in a marine fish assemblage: Optimal Foraging Theory, Niche Variation Hypothesis and functional identity. Journal of Sea Research, 120 (2017), 60-71.
Chirichigno, N., Cornejo R.M. (2001). Catálogo comentado de los peces marinos del Perú. Pub. Esp. Inst. Mar Perú, 314 p.
Choy, C., Popp, B., Hannides, C., Drazen, J. (2015). Trophic structure and food resource of epipelagic and mesopelagic fishes in the north Pacific Subtropical Gyre ecosystem inferred for nitrogen isotopic compositions. Limnology and oceanography, 60(4),1156 -1171.
Cupp, E. (1943). Marine Plankton Diatoms of the West Coast of North America. Bulletin of the Scripps Institution of Oceanography, 5(1), 237 p.
Cushing, D. (1978). Upper trophic levels in upwelling areas. En: Boje, R.Tomczak, M. (Eds.) Upwelling ecosystems. Springer-Verlag.
Dankwa, H., Blay, J., Yankson, K. (2005). Food and Feeding Habits of Grey Mullets (Pisces: Mugilidae) in Two Estuaries in Ghana. West African Journal of Applied Ecology, 8(1).
Espinoza, P. (2010). Dinámica espaciotemporal en la ecología trófica de la Anchoveta Engraulis ringens (Jenyns, 1842; PISCES: Engraulidae) en el mar peruano. [Universidad Nacional Mayor de San Marcos].
Espinoza, P., Bertrand, A., van der Lingen, C., Garrido, S., Rojas de Mendiola, B. (2009). Diet of sardine (Sardinops sagax) in the northern Humboldt Current system and comparison with the diets of clupeoids in this and other eastern boundary upwelling systems. Progress in Oceanography, 83 (2009), 242–250.
Espinoza, P., Bertrand, A. (2008). Revisiting Peruvian anchovy (Engraulis ringens) trophodynamics provides a new vision of the Humboldt Current system. Progress in Oceanography, 79 (2008), 215–227.
Fernández, C. (2014). Variación estacional e interanual de la dieta de la lisa, Mugil cephalus Linnaeus, 1758, frente a callao (12°S), en 2005 y 2013, Ecología Aplicada, 13(2).
Hendricks, L. (1961). The striped mullet Mugil cephalus Linnaeus. California Department of Fish and Game, Fishery Bulletin, 113, 95-103.
Hitchcock, G. (1982). A comparative study of the size-dependent organic composition of marine diatoms and dinoflagellates. J. Plankt. Res, 4, 363-377.
Hyslop, E. (1980). Stomach contents analysis: a review of methods and their application. Journal of Fish Biology, 17, 411–429.
Islam, R., Belal, M., Das, N., Rafi, R. (2009). Food and feeding behaviour of grey mullet, Mugil cephalus, of Bangladesh coastal water. Bangladesh J. Prog. Sci. & Tech, 7(2).
Jaramillo, A. (2009). Estudio de la biología trófica de cinco especies de peces bentónicos de la costa de Cullera. Relaciones con la acumulación de metales pesados. [Universidad Politécnica de Valencia].
Khal’ko, V., Kiyashko, V., Khal’lko, N. (2009). Circadian Rhythmic Changes in the Lipid Composition of Muscles in Kilka Clupeonella cultriventris (Clupeidae, Clupeiformes) during Natural Periodicity of Feeding in the Feeding and Spawning Periods in the Rybinsk Reservoir. Journal of Ichthyology, 49 (7), 527–539.
Konchina, Y. (1991). Trophic status of the Peruvian anchovy and sardine. Journal of Ichthyology, 31, 59–72.
Kurma R., Ramesh, B. (2013). Studies on food and feeding habits of Mugil cephalus (Linnaeus, 1758) east coast off Andhra pradesh, India. Canadian journal of pure and applied sciences, 7(3), 2499-2504.
Lawson, C., Suthers, L., Smith, J., Schilling, H., Stewart, J., Hughes, J., Brodie, S. (2018). The influence of ontogenetic diet variation on consumption rate estimates: a marine example. Scientific Reports, (2018) 8, 10725.
Link, J., Almeida, F. (2000). An overview and history of the food web dynamics program of the Northeast Fisheries Science Center, Woods Hole, Massachusetts. NOAA Technical Memorandum NMFS-NE 159, 1–60.
Llanos, J. (1974). Algunas consideraciones bioecológicas de la “lisa” Mugil cephalus L. en la Laguna de Medio Mundo. [Tesis de pregrado, Universidad Nacional de Trujillo, Perú].
Mondal, A., Chakravortty, D., Mandal, S., Bhattacharyya, S., Mitra, A. (2015). Feeding Ecology and Prey Preference of Grey Mullet, Mugil cephalus (Linnaeus, 1758) in Extensive Brackish Water Farming System, J Marine Sci Res Dev, 6, 178.
Mullin, M., Sloan, P., Eppley, R. (1966). Relationship between carbon content, cell volume, and area in phytoplankton. Limnol. Oceanogr, 11(2).
Nikolski, C. (1963). The ecology of fishes. Academic Press, London, 352 p.
Organización de las Naciones Unidas para la Alimentación y la Agricultura (FAO). (2006). Cultured Aquatic Species Information Programme Mugil cephalus. Cultured Aquatic Species Fact Sheets.
Pillay, T. (1952). A critique of the methods of study of food of fishes. Journal of the Zoological Society of India, 4(1), 185-200.
Pincay, E. (2017). Ecología trófica de Mugil cephalus (Linnaeus, 1758) en el estuario interior del Golfo de Guayaquil. [Tesis de pregrado, Universidad de Guayaquil].
Santander, H., Luyo, G., Carrasco, S., Véliz, M., Castillo, O. (1981). Catálogo de zooplancton en el Mar peruano. Primera parte: Área Pisco – San Juan. Bol. Inst. Mar Perú 6, 75 p.
Shaw, A., Frazier, B., Kucklick, J., Sancho, G. (2016). Trophic ecology of a predatory community in a shallow-water, high-salinity estuary assessed by stable isotope analysis. Marine and Coastal Fisheries, 8(1), 46-61.
Smayda, T. (1978). From phytoplankters to biomass. In Phytoplankton Manual. Sournia, A. (Ed.). Unesco Monographs on Oceanographic Methodology, 6, 273–279.
Sun, J., Liu, D. (2003). Geometric models for calculating cell biovolume and surface area for phytoplankton. Journal of Plankton Research, 11 (25), 1331–1346.
Taylor, M. (2008). The Northern Humboldt Current Ecosystem and its resource dynamics: Insights from a trophic modeling and time series anaylisis. [University Bremen].
Thomson, J. M. (1964). The organs of feeding and the food of some Australia mullets. Australian J. Mar. Freshwater Research, 5, 469-486.
Villanueva, B. (2016). Alimento y hábitos alimentarios de Mugil cephalus “lisa” en la Región La Libertad durante el año 2016 [Tesis de pregrado, Universidad Nacional de Trujillo].
Vivas, J., Feld, C., Hilt, S., Manfrin, A., Nachev, M., Köster, D., Jochmann, M., Schmidt, T., Sures, B., Zikova, A., Knopf, K. (2021). Eye fluke infection changes diet composition in juvenile European perch (Perca fluviatilis). Scientific reports, (2021) 11, 3440.
Wootton, R. (1990). Ecology of teleost fishes. First Edition. Kluwer Academic Publishers. The Netherlands, 386 p.
Yuneva, T., Zabelinskii, S., Datsyk, N., Shchepkina, A., Nikolsky V., Shulman G. (2016). Influence of Food Quality on Lipids and Essential Fatty Acids in the Body of the Black Sea Sprat Sprattus sprattus phalericus (Clupeidae). Journal of Ichthyology, 56(3), 397-405.