EVALUACIÓN MEDIANTE UN INMUNOENSAYO ENZIMÁTICO (ELISA) DE ANTÍGENOS DEL FLUIDO SEUDOCELOMATICO DE Toxocara canis PARA DETECTAR ANTICUERPOS ESPECÍFICOS
EVALUATION BY AN ENZIMATIC IMMUNOASSAY (ELISA) OF Toxocara canis SEUDOCOELOMATIC FLUID ANTIGENS FOR DETECT SPECIFIC ANTIBODIES
César Jara-Campos 1 *; Hermes Escalante Añorga 1; Adderly Benites Murrieta 1
1 Departamento de Microbiología y Parasitología. Universidad Nacional de Trujillo. Trujillo. Perú.
Artículo original
Recibido: 28 de abril 2021
Aceptado: 4 de junio 2021
Resumen
Toxocara canis es un parásito cuyas larvas L3 causan la toxocariasis humana, zoonosis de distribución mundial con elevadas prevalencias en áreas neotropicales. La toxocariasis se diagnostica mediante la prueba inmunoenzimatica (ELISA) indirecta con antígenos de excreción-secreción (TES), considerada la prueba de referencia; sin embargo, existen otros tipos de antígenos aun no investigados. En la presente investigación se evaluó el rendimiento (la capacidad) de una prueba de ELISA indirecta utilizando como antígeno al sobrenadante del fluido seudocelómico de las formas adultas hembras de Toxocara canis (TFS). Los parásitos fueron recolectados de cachorros de perro (Canis lupus familiaris) naturalmente infectados y el TFS se obtuvo en condiciones de esterilidad cortando el extremo final del parásito y luego centrifugado. La concentración de proteínas se midió con un kit de Bradford (KB) y la antigenicidad mediante la técnica de Western blot (Wb) con suero hiperinmune de conejo experimentalmente inmunizado. Las pruebas de ELISA se hicieron con el TFS y 20 sueros positivos a Toxocara, 10 sueros positivos a otras parasitosis y negativos a Toxocara y 52 sueros de niños de una zona rural de la provincia de Pataz (La Libertad, Perú). El punto de corte fue de 3,0 a densidades ópticas de 450 nm en un lector de ELISA (Perkin-Elmer). Se encontró, mediante el KB una concentración de proteínas de 3500 ug/uL y mediante el Wb, 18 bandas reactivas (entre 9,1 y 87,2 KDa). Todos los sueros positivos de la seroteca resultaron también positivos y los positivos a otras parasitosis resultaron negativos. En el lote de sueros de niños de la zona rural se encontró un porcentaje de 7,8% (4/52). En conclusión, La prueba de ELISA indirecta utilizando como antígeno el sobrenadante del fluido seudocelómico de las formas adultas hembras de Toxocara canis obtenidas de perro, Canis lupus familiaris, infectado naturalmente rinde adecuadamente (es eficaz) en la detección de anticuerpos específicos.
Palabras clave: Antigenicidad, Canis lupus familiaris, ELISA, fluido seudocelomico, Toxocara canis
Abstract
Toxocara canis is a causative agent of human toxocariasis, a zoonosis with a worldwide distribution with high prevalences in Neotropical areas. Toxocariasis is diagnosed by indirect enzyme immunoassay (ELISA) with excretion-secretion antigens (TES), considered the gold standard test; however, there are other types of antigens not yet investigated. In the present investigation, the performance (capacity) of an indirect ELISA test was evaluated using the supernatant of the pseudocoelomic fluid of the adult female forms of Toxocara canis (TFS) as antigen. The parasites were collected from naturally infected dog puppies (Canis lupus familiaris) and the TFS was obtained under sterile conditions by cutting the end of the parasite and then centrifuging. Protein concentration was measured with a Bradford kit (KB) and antigenicity by Western blot technique (Wb) with experimentally immunized rabbit hyperimmune serum. The ELISA tests were made with the TFS and 20 sera positive for Toxocara, 10 sera positive for other parasites and negative for Toxocara, and 52 sera from children from a rural area of the Pataz province (La Libertad, Peru). The cut-off point was 3.0 at optical densities of 450 nm in an ELISA reader (Perkin-Elmer). A protein concentration of 3500 ug/uL was found by KB and 18 reactive bands (between 9.1 and 87.2 KDa) were found by Wb. All the positive sera from the seroteca were also positive and those positive for other parasites were negative. A percentage of 7.8% (4/52) was found in the lot of sera from children in rural areas. In conclusion, the indirect ELISA test using as antigen the supernatant of the pseudocoelomic fluid of the adult female forms of Toxocara canis obtained from the naturally infected dog, Canis lupus familiaris, performs adequately (is effective) in the detection of specific antibodies.
Keywords: Antigenicity, Canis lupus familiaris, ELISA, pseudocoelomic fluid, Toxocara canis
* Autor para correspondencia: E mail: cjara@unitru.edu.pe
DOI: http://dx.doi.org/10.17268/rebiol.2021.41.01.06
Citar como:
Jara-Campos, C., Escalante, H., & Benites, A. (2021). Evaluación mediante un inmunoensayo enzimático (ELISA) de antígenos del fluido seudocelomatico de de Toxocara canis para detectar anticuerpos específicos. REBIOL 41(1): 59-67.
1. Introducción
Toxocara canis, nematodo parásito común de perros y otros canidos, presenta distribución mundial y causa una de las zoonosis parasitarias más prevalentes en regiones tropicales y subtropicales: la toxocariasis; por ello, y por tratarse de una enfermedad emergente tanto en países desarrollados como en vías de desarrollo, la Organización Mundial de la Salud (OMS) la ha incluido en la lista de las denominadas enfermedades zoonóticas desatendidas, que en conjunto deben ser abordadas desde varios aspectos, entre ellos el científico, a fin de obtener conocimientos acerca de su distribución, diagnóstico y lograr su control (Hotez et al., 2008; Overgaauw & van Knepen, 2013; Ma et al., 2018).
El hombre es un hospedero accidental (paraténico) de T. canis y es parasitado sólo por sus formas larvarias; los niños son los más expuestos a la toxocariasis y los principales afectados debido a que la infección se produce por ingestión accidental de huevos infectivos (contienen la L2 en su interior y sobreviven largos periodos de tiempo) procedentes del suelo de parques públicos y traspatios, que son áreas donde los perros infectados con el nematodo depositan los huevos contenidos en sus heces; luego de la ingestión de los huevos infectivos, la L2 es liberada en el duodeno, penetra la mucosa intestinal y migra al hígado, pulmones y otros órganos tales como musculo esquelético, corazón, cerebro y ojos (Archelli et al., 2014; Barret et al., 2017; Ma et al., 2018).
La toxocariasis posee un amplio rango de manifestaciones clínicas; sin embargo, se reconocen tres principales síndromes: la larva migrans hepática, la toxocariasis ocular y la neurotoxocariasis (Jenecek et al., 2014; Fan et al., 2015; Chen et al., 2018; Luna et al., 2018). Según Ma et al. (2018) y Magnaval et al. (2020) tales síndromes pueden presentarse sin síntomas y que las prevalencias varían respecto de los siguientes factores asociados: la edad (es más frecuente en niños en edad escolar), el área donde se vive (al tratarse de geohelmintiasis es más frecuente en áreas rurales de zonas tropicales y sub-tropicales), la tenencia de perros, el contacto con el suelo, el consumo de alimentos con cocción deficiente y el nivel socioeconómico (es más frecuente en poblaciones de bajos recursos económicos).
Se ha informado que a nivel mundial el 19,0% de la población presenta serología positiva a Toxocara sp. y que el porcentaje en América es del 22,8%, con variaciones respecto de los países, pero siempre por sobre el 20% en la mayoría (Zyoud, 2017; Ma et al., 2018; Rostami et al., 2019). En el Perú, Espinoza et al. (2003) estandarizaron una prueba de ELISA-IgG, que es la prueba de referencia en el inmunodiagnóstico de la toxocariasis a nivel mundial, y desde entonces se han hecho investigaciones puntuales en algunas partes, tales como Perené (Espinoza et al., 2006), Mórrope (Espinoza et al., 2008), comunidades andinas de Lima (Espinoza et al., 2010), Yurimaguas (Roldán et al., 2010), Región Lima y La Esperanza de Trujillo (Ramírez, 2019), en donde se encontraron sero-prevalencias que variaron entre 7,3 y 44,9%.
Adicionalmente, en el Perú la infección canina varía de 2,0 a 43,0% (Huapaya et al., 2009; Breña et al., 2011) y en parques públicos de 2,9 a 75,0% (Cáceres et al., 2017; Malca et al., 2019).
La prueba de ELISA-IgG (indirecta), dirigida a detectar anticuerpos específicos anti-Toxocara sp., presenta, dependiendo del tipo de antígeno utilizado, sensibilidades que varían entre 92,2 y 100% y permite analizar numerosas muestras simultáneamente (Fillaux & Magnaval, 2013; García et al., 2014). Existe consenso que cuando la técnica utiliza los antígenos excretados-secretados (TES) de las larvas L3 que se obtienen cultivándolas en medios libres de proteínas (Thomas et al., 2016) se obtienen los mejores resultados (Espinoza et al., 2003; Roldán et al., 2010; Mendonca et al., 2012; Fillaux & Magnaval, 2013; García et al., 2014). Se sabe que los TES son producidos en el esófago e intestino de las L3 y secretados por las glándulas secretoras; asimismo, que juegan un rol biológico profundo en el ciclo biológico del parásito debido a que participan en el metabolismo (fosfatasas ácida y alcalina), en la infectividad, evasión inmune y patogenicidad (proteasas, nucleotidasas, esterasas, glicasas, dismutasas), en la invasividad por poseer funciones anticoagulantes (retardan el tiempo de actividad de la tromboplastina para facilitar la penetración a la mucosa intestinal), en el establecimiento (tienen actividad antimicrobiana) y varios se comportan como alérgenos (Chen et al., 2018; Ma et al., 2018; Morales-Yañez et al., 2020).
Utilizando la técnica de Western blot, que permite fraccionar proteínas y determinar los pesos moleculares en KDa, se ha verificado que los TES de las larvas L3 cultivadas en medio Eagle (Eagle Media, Sigma) y enfrentadas con suero hiperinmune de perro, Canis lupus familiaris, presentan las bandas inmuno reactivas de 25, 27, 34, 43, 48, 80 y 200 KDa (Jara et al., 2003; Fillaux & Magnaval, 2013) y cultivadas en medio RPMI 1640 y utilizando suero humano detectaron l bandas similares: 24, 28, 30, 35, 48-56, 67, 117, 136 y 152 KDa (Roldán & Espinoza, 2009); posteriormente, considerando ciertas ventajas, tales como: (i) el menor número de ejemplares necesarios (se requieren pocos ejemplares adultos en comparación de las miles de L3 para obtener el mismo volumen de proteínas) y (ii), el menor tiempo invertido (sólo unas horas para obtener los adultos vivos y no menos de tres semanas para obtener larvas, que es el tiempo de formación en agua libre de microbios) Chuyo-Zavaleta & Jara-Campos (2010) y Sudhacar et al. (2014) experimentaron la misma metodología usada para las larvas con las formas adultas de T. canis y verificaron que las bandas inmuno-reactivas de bajo peso (entre 21 y 90 KDa) son similares en larvas y adultos.
Debido a la ubicación tisular de T. canis en el hospedero humano, el diagnóstico directo es poco practicado y, más bien, la detección de anticuerpos mediante la prueba de ELISA-indirecta utilizando como antígeno los TES asume un gran rol (Fillaux & Magnaval, 2013; JeneceK et al., 2014; Lim et al., 2015; Ma et al., 2018; Magnaval et al., 2020). Sin embargo, como se ha señalado, obtener los TES requiere contar con: (i) las L3 vivas e íntegras en cantidades superiores a las mil larvas, (ii) medios de cultivo libres de proteínas (los llamados medios mínimo esenciales hechos a base de aminoácidos) que son costosos para mantener a las L3 vivas por periodos de 16, 24 o 48 h y (iii) un tiempo no menor a tres semanas (Thomas et al., 2016). Esta dificultad orientó a investigar nuevas fuentes antigénicas de posible utilidad en pruebas de ELISA-indirecta, como por ejemplo el fluido seudocelomico (FS) que, como se sabe, ocupa toda la cavidad interna de los nematodos, es de naturaleza proteica y varios elementos constituyen los productos secretados excretados (Giorello et al., 2017) y ofrece la ventaja de poder contar con un gran volumen de material de trabajo de fácil obtención y a bajo costo.
Colina et al. (2011) verificaron que el FS de T. canis hembra presenta concentraciones proteicas elevadas (8500 mg/mL) y elevada antigenicidad mediante Western blot al detectar 15 bandas inmuno-reactivas con pesos moleculares entre 9,1 y 125,8 KDa, dentro de las que se encuentran las bandas de 25, 27, 34, 43 y 48 Kda también presentes en los TES (antígeno excretado-secretado de las larvas L3) y Alva et al. (2014) determinaron la utilidad del FS, pero en una ascariasis (enfermedad semejante a la toxocariasis) experimental en ratón, Mus musculus BALB/c.
Sin embargo, aún no se determina su funcionalidad o rendimiento y, por lo tanto, su utilidad en la detección de anticuerpos anti-Toxocara en sueros positivos a la infección por este parásito. Los antecedentes permiten afirmar que sí se podrá detectar anticuerpos en sueros positivos, por lo tanto, podría usarse como prueba de tamizaje en estudios seroepidemiológicos. La presente investigación estuvo dirigida a evaluar el rendimiento (la utilidad) de una prueba de inmunoensayo enzimático (ELISA) indirecto utilizando como antígenos el sobrenadante del fluido seudocelomatico de formas adultas hembras de T. canis (TFS) en la detección de anticuerpos específicos.
2. Materiales y Métodos
Obtención de las formas adultas de Toxocara canis:
Las formas adultas de T. canis se obtuvieron mediante la desparasitación de dos ejemplares cachorros de Canis lupus familiaris, de aproximadamente dos meses de edad, machos, los cuales fueron adquiridos en puestos de venta del Mercado Mayorista de Trujillo (Perú) y trasladados, por separado, en jaulas de plástico de 60x37x37 cm al Laboratorio de Helmintología Parasitaria de la Universidad Nacional de Trujillo (Trujillo, Perú). En el laboratorio se practicaron exámenes directos, con solución salina fisiológica al 8,5% (SSF), a fin de determinar el parasitismo por T. canis. A los dos perros positivos al parasitismo por este nematodo se les administró, por vía oral, una dosis de 200 mg/kg de piperazina (PIPERAZINA 100 elmer) a fin de lograr la expulsión de los nematodos vivos. Los ejemplares fueron recolectados de las heces con ayuda de pinceles y depositados en placas de Petri conteniendo SSF estéril (SSFE) para ser lavados tres veces durante 10 min y seleccionados (Peixoto et al., 2011; Colina et al., 2011).
Obtención del fluido seudocelómico (TFS) y determinación de la concentración de proteínas.
Para obtener el TFS, se seleccionaron dos ejemplares hembras, las cuales fueron observadas al estereomicroscopio para verificar su integridad. Estas fueron lavadas cinco veces con SSFE durante 10 min y una con SSFE más antibióticos (Gentamicina 0,5 ml/100mL y Penicilina G sódica 0,5 mL/100mL de 1 000 000 UI) durante 20 min; luego, en condiciones de esterilidad, se cogió con una pinza al nematodo a nivel de la faringe y con la ayuda de un bisturí nuevo se procedió a realizar un corte en la cola del parásito (sección entre el ano y el extremo final posterior) a fin de obtener el líquido seudocelomico el cual se recolectó en tubos de ensayo de 13x16 mm, estériles, para ser centrifugado a 5000 rpm por 10 minutos a 4 ºC, el sobrenadante se depositó en viales estériles, los cuales fueron colocados en refrigeración, a -20ºC, hasta su utilización (Chuyo-Zavaleta & Jara-Campos, 2010; Colina et al., 2011).
La determinación de concentración de proteínas se hizo por el método colorimétrico de Bradford (Bradford, 1976).
Determinación de la antigenicidad del fluido seudocelomico de Toxocara canis (TFS) por Western blot (Wb)
La técnica de Wb se realizó según lo indicado por Colina et al. (2011) y Davelois et al. (2016). Se utilizaron sueros hiperinmunes en dos ejemplares de conejo, Oryctolagus cuniculus, obtenidos, con la debida certificación, en el Bioterio del Instituto Nacional de Salud del Perú (INS) de Lima, los cuales fueron transportados en jaulas proporcionadas por el INS (de plástico de 62x37x37 cm) al Bioterio de Parasitología de la UNT, donde fueron cuidados y alimentados conforme el referido certificado.
Allí se efectuó cuatro inmunizaciones por vía subcutánea a la altura de la cara interna de las patas posteriores, con intervalos de siete días: la primera, 1 mL de TFS mezclado con 1 mL de adyuvante completo de Freund y los tres restantes, 1 mL de TFS mezclado con 1 mL de adyuvante incompleto. Previo a las inoculaciones se sacó 5 mL de sangre mediante punción cardiaca para obtener suero preinmune para ser utilizado como control negativo. A las cinco semanas de la primera inmunización se obtuvo 10 mL de sangre del conejo por punción cardiaca, la cual fue centrifugada a 3000 rpm por 15 minutos para obtener el suero inmune, el cual fue conservado en tubos de 13x160mm a -20ºC hasta el momento de su procesamiento.
La ejecución de la técnica de Electroinmunotransferencia y la preparación de los reactivos se realizó siguiendo las indicaciones sugeridas por Davelois et al. (2016), con las siguientes particularidades: (i) los antígenos del LS fueron preparados a la concentración de 0,05 ug/uL, una parte de los antígenos fueron tratados con dithiothreitol (DDT), 1% de dodecil sulfato de sodio (SDS), 6% de glicerol y 0,025% de azul de Bromofenol y la parte restante se preparó sin DDT, (ii) la SPS-PAGE se realizó a la concentración del 15% de acrilamida del gel separador y al 3% del gel concentrador, colocando 15ul de antígeno en cada uno de los pocillos del gel concentrador, a 60V en el gel de apilamiento por 10 minutos y a 200V en el gel separador por 50 minutos, hasta que el colorante trazador, azul de bromofenol, alcance el extremo inferior del gel, (iii) la transferencia se hizo en una cámara de electroforesis horizontal (Trans- Blot Cell, Bio Rad) a 100V por espacio de una horas y a 4ºC, utilizando un buffer de transferencia constituido por 0,2M Tris/HCL pH 8; 20% de metanol y agua destilada y (iv) los pesos moleculares se determinaron por comparación con el marcador de bajo peso molecular conocido (SDS- PAGE Molecular Weight Standards Low Range), hallándose la movilidad relativa (Rf) del marcador y de los antígenos en estudio.
ELISA-IgG
El rendimiento (la capacidad o comportamiento) de una prueba de ELISA indirecto utilizando como antígeno el sobrenadante del fluido seudocelomico de las formas adultas de Toxoca canis se evaluó utilizando tres lotes de sueros: (i) 20 sueros positivos a Toxocariasis (con anticuerpos anti-Toxocara) proporcionados por la Seroteca del Instituto de Ciencia y Tecnología de la empresa Escacorp SAC, Trujillo, Perú (ESCAICYT), (ii) 10 sueros positivos a infecciones parasitarias distintas a la toxocariasis, también proporcionados por la seroteca de ESCAICYT y (iii) 52 sueros obtenidos en una investigación anterior y mantenidos a -20°C en el Laboratorio de Helmintología Parasitaria de la Universidad Nacional de Trujillo correspondientes a igual número de escolares de la Institución Educativa Primaria del poblado rural Nuevo Porvenir (08º07´27´´LS, 77º23´34¨ LO, del distrito de Buldibuyo, provincia de Pataz, Región La Libertad (Perú).
Este Anexo, ubicado a 3162 m.s.n.m., se caracteriza por ser una zona agrícola, con casas espaciadas y construidas con materiales de la zona (paredes tipo “tapia” o de adobe, con techos de tejas de barro cocido o calaminas) y donde se aprecia la presencia de perros en el 100% de casas y en los corrales y campos de juego donde acuden a jugar los niños; también se aprecia falta de sanidad básica ambiental apropiada.
El ELISA indirecto se hizo según lo propuesto por Espinoza et al. (2003) y Roldán et al. (2010). Los pasos principales fueron: (i) se colocó en policubetas de fondo plano Inmunolon II, 50 uL de TFS total, diluido al 1/2 y 1/4, durante 18 horas en la refrigeradora, (ii) se lavó tres veces con buffer P/T (PBS pH: 7,4, 0,1% Tween 20) durante 5 min y se bloqueó con buffer PBS pH: 7,4, leche descremada 1,5% durante 1 hora, a 37ºC, (iii) se incubó con 50 uL de las diluciones 1/50 de los sueros, durante 30 min, a 37ºC, en cámara húmeda, (iv) se lavaron las policubetas nuevamente y se incubaron con 50 uL de anti IgG humana (Sigma a 8667) marcada con peroxidasa, a una concentración de 1/5 000, diluida con P/T, (v) se repitieron los lavados y la reacción se reveló por el agregado de 100 uL del sustrato 2,2’azinodi (3ethylbencilthiazoline sulfonic acid) y (vi) después de incubar las placas 10 min, la reacción se detuvo con 100 uL de ácido fluorhídrico 0,1N, pH: 3,2 y se leyó a 410 nm en un lector de ELISA (Perkin-Elmer).
Todas las muestras se analizaron por duplicado y en todas las placas se colocaron sueros controles negativos y positivos.
El valor del punto de corte se definió calculando la absorbancia más tres desviaciones standard (0,030 + 0,039 x 3) de los valores de 10 sueros controles (no infectados con Toxocara), la concentración proteica usada fue de 1,5ug/uL, suero control negativo a la dilución de 1/200 y de conjugado enzimático anti IgG humano a la dilución de 1/5000 y la Densidad Óptica (DO) medida a la longitud de onda de 450nm/630nm (García et al., 2014).
Entonces, un DO superior a 0,30 fue definido como positivo a la presencia de anticuerpos en el suero.
Consideraciones éticas:
El proyecto fue aprobado por el Comité de Ética en Investigación de la Facultad de Ciencias Biológicas de la Universidad Nacional de Trujillo y registrado en la Oficina de Investigación con el N° 36691912141, luego de que se completó los formatos señalados para este tipo de investigaciones por dicho Comité, entre ellos, los asentimientos informados de los niños participantes (Acta de reunión del Comité de Ética de la Facultad de Ciencias Biológicas: 002-2015).
3. Resultados
Se logró el desarrollo de una prueba de ELISA indirecta utilizando como antígenos el sobrenadante del fluido seudocelomico de T. canis (TFS) que permite la detección de anticuerpos específicos. Se determinó que el TFS presentó una concentración de proteínas de 3500 ug/mL, y que funcionan en la prueba cuando se utilizan diluciones al ¼ y volúmenes de 50 uL.
El Western blot, utilizado para determinar la antigenicidad del TFS, detectó 16 bandas reactivas antígeno-anticuerpo, cuyos pesos moleculares variaron entre 9,1 y 125,8 KDa, dentro de las que se encuentran las de 25, 34, 43 y 48 KDa consideradas útiles en el diagnóstico de la toxocariasis (Figura 1).
El lote de 20 sueros de la seroteca catalogados previamente como positivos a anticuerpos anti-Toxocara, también resultaron positivos luego de ejecutada la prueba de ELISA-indirecta con TFS: todos reaccionaron por encima del punto de corte (Figura 2). Asimismo, el lote de sueros de la seroteca catalogados previamente positivos a anticuerpos contra parásitos distintos a Toxocara y negativos a éste, también resultaron negativos luego de ejecutada la prueba de ELISA-indirecta con TFS: todos reaccionaron por debajo del punto de corte (Figura 3).
Cuando se evaluó el ELISA-indirecta con TFS y con sueros de niños de la zona rural se encontró que el 7,8% (4/52) reaccionaron por encima del punto de corte (Figura 4); es decir, se detectó que es útil en estudios de seroepidemiología.
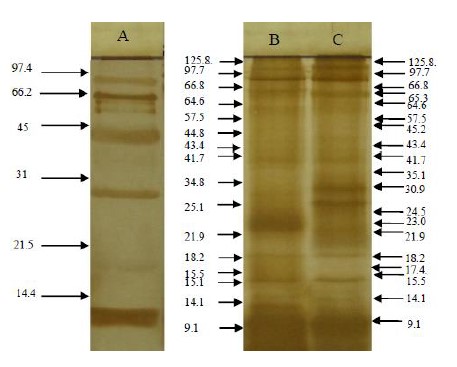
Figura 1. Bandas inmunoreactivas, resultado de la prueba de Western blot, con antígenos del fluido seudocelomico de ejemplares adultos hembras de Toxocara canis obtenidas de cachorro de perro, Canis lupus familiaris, infectado naturalmente y suero de conejo, Oryctolagus cuniculus, inoculado experimentalmente
A = Pesos moleculares
B = antígenos tratados con Dithiothreitol (DTT)
C = antígenos no tratados con DTT.
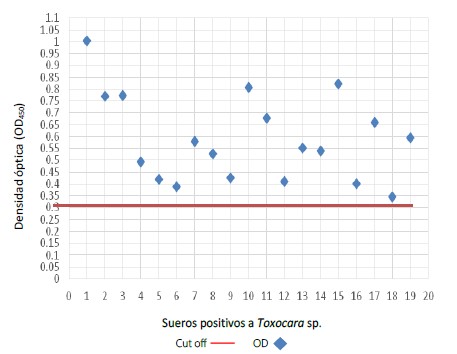
Figura 2. Distribución de las Densidades Ópticas (DO) a 450 nm de una prueba de ELISA-indirecta utilizando como antígeno el fluido seudocelomico de adultos hembras de Toxocara canis obtenido de Canis lupus familiaris naturalmente infectado y sueros de individuos con toxocariasis confirmada.
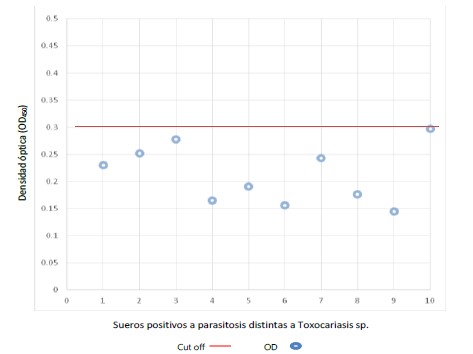
Figura 3. Distribución de las Densidades Ópticas (DO) a 450 nm de una prueba de ELISA-indirecta) utilizando como antígeno el fluido seudocelomico de adultos hembras de Toxocara canis obtenido de Canis lupus familiaris naturalmente infectado y sueros de individuos con parasitosis confirmada distintas a la toxocariasis.
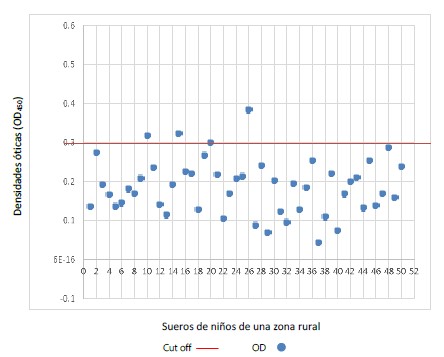
Figura 4. Distribución de las Densidades Ópticas (DO) a 450 nm de una prueba de ELISA-inidirecta utilizando como antígeno el fluido seudocelomico de adultos hembras de Toxocara canis obtenido de Canis lupus familiaris naturalmente infectado y sueros de niños de una zona rural (IE Primaria Nuevo Porvenir, distrito de Buldibuyo, provincia de Pataz, Región La Libertad-Perú).
4. Discusión
La calidad del antígeno en el desarrollo de pruebas de ELISA-IgG con elevadas sensibilidad, especificidad y reproducibilidad son requisitos indispensables que deben tomarse en cuenta para mejorar el diagnóstico de la toxocariasis (García et al., 2014; Chen et al., 2018; Morales-Yañez et al., 2020). Los primeros antígenos usados fueron homogenizados de parásitos adultos, pero estos tenían fosforilcolina, un hapteno común de los helmintos, lo que le daba muy baja especificidad a la prueba; posteriormente, se utilizaron los TES (antígenos de excreción-secreción de Toxocara) que no tienen fosforilcolina y mejoraron la especificidad, pero dentro de la Familia Ascaridae (Jin et al., 2013; Santillán et al., 2013) que presenta otros miembros, tales como Ascaris lumbricoides y Anisakis sp. que causan en el Perú enfermedades zoonóticas frecuentes (Espinoza et al., 2016) y con las que puede haber reacciones cruzadas debido a que los TES siguen siendo una mezcla de productos. En esta investigación se logró determinar que una prueba de ELISA-indirecta utilizando antígenos del fluido seudocelomatico de las hembras de T. canis (TFS) permiten detectar anticuerpos específicos.
La prueba de ELISA-indirecta, debido a que la reacción enzima-sustrato potencia la detección antígenoanticuerpo, presenta por naturaleza elevada sensibilidad y, por ello, es de gran utilidad en estudios seroepidemiológicos debido a que mide el grado de exposición de una población a un determinado agente patógeno; en el caso de la toxocariasis esta prueba se ejecuta, en la mayoría de investigaciones, utilizando los denominados TES o TESA, que son los antígenos de excreción-secreción de las larvas L2 y que pueden obtenerse en un laboratorio clásico (Roldán et al., 2010; Sudhacar et al., 2014; Espinoza et al., 2016); para ello, sin embargo, (i) se requiere un tiempo no menor de un mes, porque primero se obtienen las hembras, de ella los huevos que necesitan 21 días para formar en su interior las larvas L2, (ii) los costos de dinero son elevados, porque la formación larvaria en un alto porcentaje requiere del uso de antibióticos en el medio, de reactivos para liberar a las larvas L2 del cascarón del huevo y mantenerlas vivas (no menor de mil larvas para obtener cantidad necesaria) en medios de cultivo esenciales, que tienen solamente aminoácidos como fuente de nutrientes, para que ahí eliminen los productos de excreción-secreción (Thomas et al., 2016). Por su lado, los TFS pueden obtenerse sólo en un día, porque el fluido seudocelomico es parte del parásito y se halla en cantidad suficiente incluso de un solo ejemplar adulto hembra de T. canis que mide entre 10 a 13 cm (Breña et al., 2011), además, no se requiere de medios costosos. Estas ventajas son importantes si se tiene en cuenta que la prueba de ELISA-indirecta se aplica a un gran número de muestras de suero y yen periodos cortos de tiempo cuando se hacen estudios de seroprevalencias; por ello, también se requiere disponer de gran volumen de antígeno.
El TFS, además de tener funciones de soporte en la movilidad y equilibrio hídrico de los parásitos, es un gran almacén de bioproductos dentro de ellos los TES que son secretados por las glándulas secretoras presentes en el esófago de las formas larvarias y adultas de T. canis (Jin et al., 2013; Sudhacar et al., 2014; Giorello et al., 2017); se asume, entonces, que tienen sustancias antigénicas semejantes. Existe solo una investigación previa en la cual se propone el uso de los productos del fluido seudocelomico (FS) con fines de diagnóstico; se trata de la propuesta para detectar anticuerpos anti- Dioctophyme renale, un helminto renal de gran tamaño de los animales y el hombre (Giorello et al., 2017). Pero, la presencia de sustancias análogas en diferentes especies dentro de la misma Familia (Santillán et al., 2013) convierte al FS en un candidato menos específico, pero no menos sensible, para el diagnóstico comparado con otros. En efecto, los TES (anígenos de excreción-secreción de Toxocara) son más específicos, pero aun comparten sustancias análogas dentro del género taxonómico Toxocara y los antígenos recombinantes, como es el caso de TES30, que es solamente la fracción de 30 KDa de los TES clonado presente sólo en T. canis y por ello altamente específico (Fillaux & Magnaval, 2013; Olave et al., 2016); sin embargo, para investigaciones de prevalencias y factores asociados puede tener utilidad por su elevada sensibilidad y, como en el caso del TES30, podría seleccionarse ésta o probablemente otras fracciones específicas y usarlas en el diagnóstico confirmativo, con la ventaja que habría más fracciones seleccionables; en efecto, el Western blot permitió detectar siete fracciones de los TES (Jara et al., 2003) y 16 en TFS como se logró en esta investigación y anteriormente por Colina et al. (2011).
Tan importante como la fuente de antígenos, que tiene que ver con la mayor cantidad disponible y con menor tiempo y costos, es la calidad de éstos que tiene que ver con la antigenicidad, o sea la capacidad de provocar la síntesis de anticuerpos. Como los antígenos son proteínas o glicoproteínas, se opta por determinar la cantidad de éstas y la técnica más usada es la colorimétrica de Bradford (Bradford, 1967; Davelois et al., 2016; Ma et al., 2018). La cantidad de proteínas encontrada en la presente investigación (3500 mg/mL) es menor a los 8500 mg/mL hallado anteriormente por Colina et al. (2011) también en adultos hembras de T. canis. Debe entenderse que estos valores pueden cambiar de un tiempo a otro y de un individuo a otro; sin embargo, lo importante para los fines de diagnóstico es que, en todos los casos, la cantidad de proteínas presentes en el FS es mucho mayor a los TES producidas por las L2 (Jara et al., 2003) y adultos (Chuyo-Zavaleta & Jara-Campos, 2010; Sudhacar et al., 2014) en un medio mínimo esencial. Este hallazgo enfatiza la utilidad de la TFS en reemplazo de las TES.
En esta investigación se verificó que el TFS posee elevada inmunogenicidad porque aparecieron numerosas bandas inmunoreactivas en los resultados del Western blot (Wb) que es una de las técnicas más utilizadas para tal fin (Roldán et al., 2009; Magnaval et al., 2020). La presencia de las bandas demuestra que hay reacción antígeno-anticuerpo (que es específica) en cantidades suficientes para poder ser usadas en las técnicas de diagnóstico, entre ellas ELISA. El número de bandas inmunoreactivas encontradas en el Wb son las mismas en número (16) y peso (77,0 a 120,2 KDa) a lo hallado en un trabajo previo (Colina et al., 2011). Esto era de esperar ya que se usó el mismo protocolo, que es el mismo que se viene usando en investigaciones que utilizan el Wb y que está estandarizado (Sandhacar et al., 2014; Davelois et al., 2016).
La determinación de la inmunogenicidad mediante en Wb resulta importante porque permitió obtener dos datos relevantes: primero, indica que el TFS es capaz de inducir la formación de anticuerpos en modelos animales y que reacciona con ellos in vitro, adquiriendo un requisito elemental para ejecutar una prueba de ELISA y segundo, permitió determinar que tiene cuatro (24, 28, 30 y 35 KDa) de las siete bandas reactivas de los TES (Jara et al., 2003; Fillaux & Magnaval, 2013), lo que enfatiza que puede usarse en reemplazo de los TES en investigaciones de seroprevalencias y factores asociados y presenta candidatos para seleccionar una de las glicoproteínas y proponer una prueba de ELISA con sensibilidad del 100%, tal como se ha hecho con el TES30 (Olave et al., 2016).
Como se sabe, las pruebas serológicas de ELISA, sobre todo las indirectas que se discrimina los positivos de los negativos por cambio de coloración en el lector de ELISA, deben tener el denominado punto de corte (cut-off) precisamente porque tiene que distinguir entre infectados y no infectados. Este punto de corte es de suma importancia porque lo que se propone en la presente investigación es nuevo. En otras investigaciones en las que también se proponen antígenos nativos los puntos de corte fueron similares (Espinoza et al., 2003; Espinoza et al., 2016).
Todos los sueros proporcionados por la seroteca y catalogados como positivos a T. canis también dieron positivos en esta investigación; es decir, se encontró que la prueba de ELISA-IgG con TFS detecta anticuerpos específicos. Esto se debería, a que dentro de la alta carga de proteínas presentes en el FS (determinada por la técnica de Bradford) se encuentran una o más de las siete fracciones de glicoproteínas específicas de T. canis (determinada por el Westernblot) y reaccionan con los anticuerpos presentes en los sueros de la seroteca mediante la prueba de ELISA, cuyo diseño permite detectar pequeñas cantidades de fracciones antígeno-anticuerpo mediante la coloración de productos derivados de la reacción enzima-sustrato (Fillaux & Magnaval, 2013; Lin et al., 2015; Morales-Yañez et al., 2020); esto permite afirmar que el TFS podría usarse en pruebas de ELISA de tamizaje en estudios sero-epidemiológicos en poblaciones numerosas y seleccionar, luego, sólo a los señalados como positivos y a éstos aplicar una técnica específica.
Por el contrario, ningún suero de la seroteca positivo a parasitosis distintas a toxocariasis reaccionó en la prueba de ELISA-IgG utilizando TFS, lo que se interpreta como que, en efecto, no detecta anticuerpos anti-Toxocara en sueros que no los presentan. Sin embargo, este aspecto debe ampliarse en otras investigaciones a fin de determinar el porcentaje de especificidad utilizando una fórmula (Davelois et al., 2016) porque el número de sueros probados es muy bajo, aspecto que no le da solidez, porque se recomienda el uso de mayor número de sueros positivos a protozoarios y helmintos prevalentes de la zona de estudio y que se incluyan sueros de personas sanas (Lim et al., 2015; Miranda-Choque, 2014). Sin embargo, el diseño de una prueba de ELISA-indirecta apunta a hacerlas sensibles, más que específicas, para que sean útiles en la detección de positivos (reactivos) en investigaciones de seroprevalencias, los cuales pueden ser luego confirmados con pruebas específicas.
El bajo porcentaje de serología positiva a Toxocara encontrado en los niños de la zona rural de la sierra (Pataz) comparada con lo hallado en otras investigaciones utilizando la misma técnica en países vecinos del Perú, también en poblaciones infantiles, tales como el 25,4% hallado en Chile (Vargas et al., 2016) y al 38,3% detectado en Argentina (Archelli et al., 2014); también es menor al valor hallado en algunas localidades del Perú ubicadas fuera de la Región La Libertad, tales como Yurimaguas, donde se encontró el 32,0% (Roldán et al., 2010); Lima, 37,8% (Espinoza et al., 2010); Mórrope, 32,4% y al 27,0% del Sector Manuel Arévalo de Trujillo (Ramírez Reyes, 2019). Es probable que, debido a que no se cuenta con antecedentes de la zona de la cual provienen los sueros, la seroprevalencia sea realmente baja; sin embargo, la presente investigación no ha sido epidemiológica, por eso no se usaron muchas muestras (la mayoría de investigaciones utilizan por encima de las 300 muestras de sangre), sino determinar el rendimiento (la capacidad) de una prueba de ELISA indirecta utilizando como antígeno al fluido seudocelómico de las formas adultas hembras de Toxocara canis (TFS).
5. Conclusiones
La prueba de ELISA indirecta utilizando como antígeno el sobrenadante del fluido seudocelómico de las formas adultas hembras de Toxocara canis obtenidas de perro, Canis lupus familiaris, infectado naturalmente rinde adecuadamente (es eficaz) en la detección de anticuerpos específicos.
6. Contribución de los autores
JCC y EH participaron en la concepción y diseño del estudio, JCC y BA en la recolección de datos, JCC y BA en el análisis e interpretación de datos, EH con asesoría técnica y JCC y EH realizaron la revisión crítica del artículo.
Todos los autores aprobaron la versión final del artículo y asume la responsabilidad del contenido.
7. Conflicto de intereses
Los autores declaran no tener conflicto de intereses
8. Referencias bibliográficas
Alva, R., Alvarado, E., Casana, W., Ríos, M., & Jara, C. A. (2014). La técnica de ELISA con antígenos del fluido seudocelomico de Ascaris suum en el diagnóstico de la ascariasis pulmonar experimental. REBIOLEST, 2 (2), e34.
Archelli, S., Santillan, G., Fonrouge, R., Cespedes, G., Burgos, L., & Radman, N. (2014). Toxocariasis: seroprevalence in abandoned-institutionalized children and infants. Rev Argen Microbiol, 46 (1), 3-6.
Barret, A. N., Erickson, L. D., Gale, S. D., Stone, A., Brown, B. L., & Hedges, D. W. (2017). Toxocara Seroprevalence and Associated Risk Factors in the United States. Am. J. Trop. Hyg., 97 (6), 1846–1850.
Bradford, M. M. (1976). A rapid and sensitive method for quantification of microgram quantities of protein utilizing the principle of protein dye binding. Annal Biochem, 72, 248-254.
Breña, J. P., Hernández, R., Hernández, A., Castañeda, R., Espinoza, &., Roldán, W., Ramírez, C., & Maguiña, C. (2011). Toxocariosis humana en el Perú: aspectos epidemiológicos, clínicos y de laboratorio. Acta Med Per, 28 (4), 220-230.
Cáceres, C. M., Butinza, R. H., & Valderrama, A. A. (2017). Contaminación con huevos de Toxocara sp. y evaluación sanitaria en parques en la Ciudad de Abancay, Perú. Rev Inv Vet Peru, 28 (2), 376-386.
Chen, J., Liu, Q., Liu, G.-H., Zheng, W.-B., Hong, S.-J., Sugiyama, H., Zhu, X.Q., & Elsheikha, H. M. (2018). Toxocariasis: a silent threat with a progressive public health impact. Infectious Disease of Poverty, 7(1), 59.
Chuyo-Zavaleta, M., & Jara-Campos, C. (2010). Antígenos de excreción-secreción de las formas adultas de Toxocara canis detectados por Western Blot utilizando anticuerpos específicos producidos en conejo. SCIENDO, 13(2), 11-19.
Colina, J., Leiva, D., Escalante, H., & Jara, C. (2011). Antígenos del líquido seudocelomico de Toxocara canis identificados mediante la técnica de Electroinmunotransferencia utilizando anticuerpos producidos en Oryctolagus cuniculus. REBIOL, 31(2), 25-31.
Davelois, K., Escalante, H., & Jara, C. (2016). Rendimiento diagnóstico del Western blot para detectar simultáneamente anticuerpos en pacientes con cisticercosis, hidatidosis y fascioliasis humana. Rev Peru Med Exp Salud Publica, 33(4), 616-624.
Espinoza, Y., Huapaya, P., Suarez, R., Chavez, V., Sevilla, C., Davila, E., Huiza, A., Naquira, C. & Alva, P. (2003). Estandarización de la técnica de ELISA para el diagnóstico de la toxocariasis humana. An Fac med, 64(1), 7-12.
Espinoza, Y., Roldan, W., Huapaya, P., Huiza, A., Jimenez, S., & Sevilla, C. (2006). Prevalencia de anticuerpos IgG anti-Toxocara, en pobladores del distrito de Perené, departamento de Junín. An Fac Med, 67(Supl. 1), S66.
Espinoza, Y. A., Huapaya, P. H., Roldán, W. H., Jiménez, S., Arce, Z. & Lopez, E. (2008). Clinical and serological evidence of Toxocara infection in school children from Morrope district, Lambayeque, Peru. Rev. Inst. Med. trop Sao Paulo, 50(2), 101-5.
Espinoza, Y. A., Huapaya, P. E., Roldán, W. H., Jiménez, S., Abanto, E. P., Rojas, C. A., Cavero, Y. A., & Gutiérrez, C. A. (2010). Seroprevalence of human toxocariasis in Andean communities from the Northeast of Lima, Peru. Rev. Inst. Med. Trop. Sao Paulo, 52(1), 31-36.
Espinoza, Y., Vildózola, H., Jiménez, S., Roldán, W., Huapaya, P., Villar, C., & Rojas, C. (2016). Prevalencia estimada de toxocariosis en la Región Lima. An Fac med., 77(1), 21-4.
Fan, C. K., Holland, C. V., Loxton, K., & Barghouth, U. (2015). Cerebral toxocariasis: silent progression to neurodegenerative disorders? Clin Microbiol Rev, 28(3), 663-686.
Fillaux, J., & Magnaval, J.K. (2013). Laboratory diagnosis of human toxocariasis. Vet Parasitol, 193: 327-336.
García, G. M., Telmo, P. L., Mendonca, M., Nunes, A., McBride, A. J., Scaini, J., & Conceicao, F. (2014). Human toxocariasis: current advances in diagnostic, treatment and interventions. Trends in Parasitol, 30(9), 456-464.
Giorello, A. N., Kennedy, M. W., Butti, M. J., Rodman, N. E., Córsico, B., & Franchini, G. R. (2017). Identification and characterization of the major pseudocoelomic proteins of the giant kidney worm, Dioctophyme renale. Parasites & Vectors, 10, 446.
Hotez, P. J., Bottazzi, M. E., Franco-Paredes, C., Ault, S. K., & Periago, M.R. (2008). The Neglected Tropical Diseases of Latin America and the Caribbean: A Review of Disease Burden and Distribution and a Roadmap for Control and Elimination. PLoS Negl Trop Dis, 2(9), e300.
Huapaya, P. E., Espinoza, Y., Roldan, W. & Jiménez, S. (2009). Toxocariasis humana: ¿un problema de salud pública? An Fac med, 70(4), 283-290.
Jara, C. A., Escalante, H., Díaz-Limay, E., & Reyes-Vega, W. (2003). Antígenos de excreción/secreción de geohelmintos parásitos del hombre productores de anticuerpos policlonales IgG. SCIENDO, 6(1-2), 81-87.
Jenecek, E., Beineke, A., Schneider, T., & Strube, K. (2014). Neutotoxocarosis: marked preference of Toxocara canis for the cerebrum and T. cati for the cerebellum in the paratenic model host mouse. Parasites & Vectors, 7, 194.
Jin, Y., Shen, C., Huh, S., Sohn, W.-M, Choi, M.H., & Hong, S.-T. (2013). Serodiagnosis of toxocariasis by ELISA using crude antigen of Toxocara canis larvae. Korean J Parasitol, 51(4), 433-439.
Lim, P. K. C., Yamasaki, H., Mak, J. W., Wong, S. F., Chong, C. W., Yap, L. K. S., Ambu, S., & Kumarasamy, V. (2015). Field evaluation of a rapid diagnostic test to detect antibodies in human toxocariasis. Acta Tropica, 148, 32-37.
Luna, J., Ciuro, C. E., Ratian, G., Quattrocchi, G., Marín, B., Bruno, E., Dalmay, F., Druet-Cabanac, M., Nicoletti, A., & Preux, P.-M. (2018). Updated evidence of the association between toxocariasis and epilepsy: Systematic review and meta-analysis. PLoS Neglected Tropical Diseases, 12(7).
Ma, G., Holland, C. V., Wang, T., Hofmann, A., Fan, Ch.-K., Maizels, K. M., Hotez, P. J., & Gasser, R. B. (2018). Human toxocariasis. Lancet Infectious Disease, 18, e14-24.
Magnaval, J.-F. Fillaux, J., Cassaing, S., Valentin, A., Iriart, X., & Berry, A. (2020). Human toxocariasis and atopy. Parasite, 27, 32.
Malca, C., Chavez, A., Pinedo, R., & Abad-Ameri, D. (2019). Contaminación con huevos de Toxocara spp en parques públicos del distrito de La Molina, Lima, y su relación con el programa de vigilancia sanitaria de parques y Jardines. Rev Inv Vet Peru, 30(2), 848-855.
Mendonca, L. R., Veiga, R. V., Dattoli, V. C. C., Figueiredo, C. A., Fiaccone, R., Santos, J., Cruz, A. A., Rodrigues, L. C., Cooper, P. J., Pontes-de-Carvalho, L. C., Barreto, L. M., & Alcantara-Neves, N. M. (2012) Toxocara Seropositivity, Atopy and Wheezing in Children Living in Poor Neighbourhoods in Urban Latin American. PLoS Negl Trop Dis 6(11), e1886.
Miranda-Choque, E. (2014). Alta frecuencia de serología positiva contra toxocara en un hospital pediátrico del Perú. An Fac med, 75(3):223-6.
Morales-Yañez, F., Trashin, S., Sariego I., Roucher, C., Paredis, L., Chico, M., De Wael, K., Muyldermans, S., Cooper, Ph., & Polman, K. (2020). Electrochemical detections of Toxocara canis excretory-secretory antigens in children from rural communities in Esmeraldas Province, Ecuador: association between active infection and eosinophillia. Parasites & Vectors, 13, 245.
Olave, A. M., Mesa, J. A., Botero, J. H., Patiño, E. B., García, G. M., & Alzate, J. F. (2016). Producción y evaluación del antígeno recombinante TES30 de Toxocara canis para el inmunodiagnóstico de la toxocariasis. Biomédica, 36, 39-51.
Overgaauw, P. A., & van Knapen, F. (2013). Veterinary and public health aspects of Toxocara spp. Veterinary Parasitology, 193, 398-403.
Peixoto, P. L., Nascimento, E., Lopes Concado, G. G., Cambraia de Miranda, R. R., Rocha, R. L., Nascimento Araújo R., & Fujiwara, R. T. (2011). Identificaction of candidate antigens from adult stages of Toxocara canis for the diagnosis of human toxocariasis. Mem Inst Owaldo Cruz, 106(2), 200-206.
Ramírez, R. P. (2019). Seroprevalencia de anticuerpos contra Toxocara sp. en niños del “Sector Manuel Arévalo” La Esperanza (Trujillo, Perú). [Tesis maestría, Universidad Nacional de Trujillo. Trujillo. Perú].
Roldán, W. H., Cavero, Y. A., Espinoza, Y. A., Jiménez, S., & Gutiérrez, C. A. (2010). Human toxocariasis: a seroepidemiological survey in the amazonian city of Yurimaguas, Peru. Rev. Inst. Med. Trop. Sao Paulo, 52(1), 37-42.
Roldán, W. H., Espinoza, Y.A., Huapaya, P. E., & Jiménez, S. (2010). Diagnóstico de la Toxocarosis Humana. Rev Peru Med Exp Salud Pública, 27 (4), 613-20.
Roldán, W. H., & Espinoza, Y. A. (2009). Evaluation of an enzyme-linked immunoelectrotransfer blot test for the confirmatory diagnosis of human toxocariasis. Mem Inst Oswaldo Cruz, Rio de Janeiro, 104(3), 411-418.
Rostami, A., Riahi, S. M., Holland, C. V., Taghipour, A., Khalili-Fomeshi, M., Fakhri, Y., Omrani, V. F. Hotez, P. J., & Gasser, R. B. (2019). Seroprevalence estimates for toxocariasis in people worldwide; A systematic review and meta-analysis. PLoS Negl Trop Dis, 13(12), e0007809.
Santillán, G., Bastin, V., Céspedes, G., & Monkiewicz, A. (2013). Evaluación de un antígeno purificado para el diagnóstico de la toxocariosis. Rev Argent Microbiol, 45(2), 80-85.
Sudhacar, N. R., Samanta, S., Sahu, S., Raina, O. K., Gupta, S. C., Goswami, T. K., Lokesh, K. M., & Kumar A. (2014). Characterization of excretory-secretory antigens of adult Toxocara canis by western blotting. J Parasit Dis, 38(2), 166-169.
Thomas, D. Jeyathilakan, M., Basith, S. A., & Senthilkumar, T. M. (2016). In vitro production of Toxocara canis excretory-secretory (TES) antigens. Journal Parasitic Diseases, 40(3), 1038-1043.
Vargas, C., Torres, P., Jersi, M.I., Lobos, M., Oyarse, A., Miranda, J.C., & Ayala, S. (2016). Frequency of anti-Toxocara spp. Antibodies in individuals attended by the Centro de Salud Familiar and environmental contamination with Toxocara canis eggs in dog feces, in the Costal Niebla town, Chile. Rev. Inst. Med. trop. Sao Paulo, 58:62.
Zyoud, S. H. (2017). Global toxocariasis research trend from 1932 to 2015: a bibliometric analysis. Health Research Policy and Systems, 15, 14.