PARASITISMO DE Billaea claripalpis SOBRE LARVAS DE Diatraea saccharalis EN CONDICIONES DE CAMPO
PARASITISM OF Billaea claripalpis ON LARVAE OF Diatraea saccharalis IN FIELD CONDITIONS
Charles Frank Saldaña-Chafloque 1 (*); Aureliano Florencio Ramírez-Cruz 2; Julio Chico-Ruíz 2
1 Universidad Nacional Autónoma de Tayacaja. Huancavelica. Perú.
2 Universidad Nacional de Trujillo. La Libertad. Perú.
Charles Frank Saldaña-Chafloque:
Artículo original
Recibido: 16 de noviembre 2020
Aceptado: 15 de abril 2021
Resumen
El objetivo de la investigación fue determinar el parasitismo de hembras grávidas y no grávidas de Billaea claripalpis sobre larvas de diferentes instares de Diatraea saccharalis, en el cultivo de caña de azúcar. En el Valle de Virú, se observó que los tratamientos que presentaron mayor parasitismo fueron T1: liberación de hembras no grávidas de B. claripalpis a una dosis de 40 parejas/ha y T2: liberación de hembras grávidas de B. claripalpis a una dosis de 50 parejas/ha, con 57,56% y 57,94% respectivamente; el menor parasitismo se presentó en el T3: liberación de hembras grávidas de B. claripalpis a una dosis de 40 parejas/ha con 50,93%. En condiciones desérticas de la zona de Alto Salaverry, el T1: liberación de hembras no grávidas de B. claripalpis a una dosis de 60 parejas/ha, obtuvo el mayor parasitismo con 51%, además, los tratamientos en donde se obtuvo menor parasitismo fueron el T2: liberación de hembras grávidas de B. claripalpis a una dosis de 80 parejas/ha y T3: liberación de hembras grávidas de B. claripalpis a una dosis de 60 parejas/ha, con 32,01% y 37,66% respectivamente. En las pruebas de regresión lineal, r= -0,81 y R2= 0,8535, muestran una correlación negativa.
Palabras clave: Agroecosistema, Billaea claripalpis, caña de azúcar, Diatraea saccharalis, parasitismo.
Abstract
The main purpose of this research is find out the parasitism of gravid and non-gravid females of Billaea claripalpis larvaes of Diatraea saccharalis in sugarcane fields. At viru valley we can observed the treatments has the highest parasitism were T1: release of non-gravid B. claripalpis females at a dose of 40 pairs/ha and T2: release of gravid B. claripalpis females at a dose of 50 pairs/ha, with 57.56% and 57.94% respectively, likewise, the lowest parasitism occurred in T3: release of gravid B. claripalpis females at a dose of 40 pairs/ha with 50.93%. In desert conditions in the Alto Salaverry area, T1: release of non-gravid females of B. claripalpis at a dose of 60 pairs/ha, obtained the highest parasitism with 51%. Also, the treatments that obtained the least parasitism were T2: release of gravid females of B. claripalpis at a dose of 80 pairs/ha and T3: release of gravid females of B. claripalpis at a dose of 60 pairs/ha, with 32.01% and 37.66% respectively. In the linear regression tests, r = -0.81 and R2 = 0.8535, show a negative correlation.
Keyword: Agroecosystem, Billaea claripalpis, Diatraea saccharalis, parasitism, sugar cane.
* Autor para correspondencia:E mail: charles.saldana.chafloque@gmail.com
DOI: http://dx.doi.org/10.17268/rebiol.2021.41.01.05
Citar como:
Saldaña-Chafloque, C., Ramírez-Cruz, A., Chico-Ruíz, J. 2021. Parasitismo de Billaea claripalpis sobre larvas de Diatraea saccharalis en condiciones de campo. REBIOL, 41(1):49-58.
1. Introducción
En el cultivo de caña de azúcar Saccharum officinarum L., existe una gran variedad de insectos plaga que afectan al cultivo, salvo algunas especies que son cosmopolitas, que poseen una distribución geográfica limitada, trasladándose de otras gramíneas para alimentarse de la caña de azúcar (Sánchez et al., 2019). El representante más importante de este grupo son algunos insectos de barrenadores, siendo Diatraea saccharalis Fabr. (Lepidoptera: Pyralidae), la de vital importancia económica que ataca al cultivo de caña de azúcar, en América (Astola & Narrea, 2019; Leyton et al., 2018; Saldaña & Ayquipa, 2021; Sánchez et al., 2019).
El daño causado por D. saccharalis que, en su estado larval, ataca los brotes jóvenes, barrenando los tallos, provoca pérdidas económicas a la industria azucarera de nuestro país, motivo por el cual se debe dar prioridad al control biológico, incluyendo los monitoreos, liberaciones de Billaea claripalpis Wulp. (Diptera: Tachinidae) criadas en laboratorio (Echeverri-Rubiano et al., 2017; Pollack et al., 2018; Velez et al., 2020).
Las larvas recién nacidas de esta plaga se alimentan del parénquima foliar y migran hacia el tallo de la caña, donde penetran después del segundo estadio larvario, alimentándose de los tejidos conductores de la planta, construyendo túneles y finalmente dejando el tallo como polillas (Solis & Metz, 2016; Vargas et al., 2015). Los barrenadores del tallo pueden reducir significativamente el rendimiento del cultivo al disminuir el peso del tallo, en algunos casos, puede causar la muerte de la planta. Pérdidas por el daño del barrenador del tallo se han estimado en alrededor del 0,83% del peso de la caña y un rendimiento adicional del 0,26% en la molienda por ha para cada unidad de porcentaje de entrenudos perforados (Vargas et al., 2015). El control biológico, utiliza parasitoides de larvas demostrando ser eficaz en controlar a D. saccharalis en América Latina (Arboleda & Vargas, 2019; Solis & Metz, 2016; Vargas et al., 2015).
El control biológico en los agroecosistemas se ve beneficiado dada la conservación de la biodiversidad en los agroecosistemas incorporando componentes diversos como son los cultivos, artrópodos y microorganismos asociados, así como los componentes geográficos, climáticos, edáficos, humanos y socioeconómicos (Gil & López, 2017).
El control de D. saccharalis, se ha fundamentado en el control biológico, con las liberaciones de biocontroladores como B. claripalpis, que en su estado larval parasita las larvas del barrenador en estudio y se alimenta de ellas provocando la disminución de la población de la plaga (Rodriguez, 2015).
La distribución de B. claripalpis mosca nativa, abarca desde los Estados Unidos, hasta Argentina incluyendo los países caribeños (Morales, 2008). La acción parasítica de la mosca nativa es específica para las especies del género Diatraea, siendo su hábito permanecer dentro de los tallos de caña de azúcar, lo que imposibilita otro tipo de control y por ello solo el control biológico lograría provocar la muerte de las larvas (Arispe et al., 2019; Zúñiga & Soto, 2018).
La hembra de B. claripalpis es larvípara, deja sus maggots en los orificios de los tallos de la caña de azúcar dañados por D. saccharalis, así estas irán en busca de las larvas de la plaga siendo atraídos por la oscuridad del túnel o por el olor del mismo huésped (Rodriguez, 2015). Luego que B. claripalpis completa su estado larval dentro de la plaga, está la abandona y en la etapa final se transforma en pupario; 14 días después de la emergencia del adulto comienza la acción de parasitación sobre las larvas de D. saccharalis (Rodriguez, 2015; Suárez et al., 2018). Asimismo, en investigaciones recientes en el valle del río Cauca en Colombia, se logró determinar que el parasitismo de B. claripalpis llegaría a 28% considerándose de gran relevancia en la regulación de D. saccharalis (Vargas et al., 2015); en La Libertad, Perú, el rol que desarrolla B. claripalpis como excelente parasitoide de D. saccharalis ocasionando la disminución de los niveles de daño provocado por esta plaga en el cultivo de caña de azúcar (Limo, 2017; Ludeña, 2014); también en el Ingenio Risaldala en Colombia, el manejo de la plaga D. saccharalis en el cultivo de caña de azúcar para mantenerla en niveles por debajo del umbral de daño económico es necesaria la liberación del parasitoide B. claripalpis a los seis meses de edad del cultivo (Gómez, 2014); además, en Virú, Perú, pruebas realizadas del parasitismo de B. claripalpis criadas en laboratorio en diferentes huésped lograron parasitaciones de 34% a 44% en campo sobre la D. saccharalis la plaga clave del cultivo de caña de azúcar (Saldaña, 2019).
En la actualidad, el papel que desempeña B. claripalpis, como eficaz biocontrolador de larvas de D. saccharalis, permite disminuir el nivel de daño en el cultivo de caña de azúcar; es por ello que el objetivo de esta investigación fue determinar el nivel de parasitismo de B. claripalpis sobre las larvas de D. saccharalis, en el cultivo de caña de azúcar en condiciones de la zona desértica de Alto Salaverry y en el valle de Virú. La Libertad – Perú.
2. Materiales y Métodos
Lugar de ejecución
El presente trabajo se realizó en dos zonas, la primera en los campos de caña de azúcar Santa Clara I, con una superficie de 23,66 has, ubicada en el Sector de Huancaquito Alto, provincia de Virú y la segunda en el campo San Miguel, zona desértica con una superficie de 24,87 has, del sector Alto Salaverry, provincia de Virú. Asimismo, se procedió con la toma de datos climáticos de ambos lugares.
Liberación de B. claripalpis
El material biológico fue entregado por una empresa de crianza de controladores biológicos, en parejas (macho y hembra) en proporción (1: 1), luego se procedió con las liberaciones de hembras grávidas y no grávidas de B. claripalpis en parejas/ha, en los campos de Santa Clara I y San Miguel respectivamente, sembrados con la variedad CC87-434, caña soca, al sexto mes de edad del cultivo, cuya dosificación y condiciones a liberar se detalla en los tratamientos de la tabla 1. Asimismo, cabe indicar que no se utilizó un tratamiento testigo debido a que los campos de caña de azúcar son atacados por D. saccharalis y al no haber un control biológico provocaría daños a nivel económico.
Tabla 1. Tratamientos de las evaluaciones de parasitismo de hembras grávidas y no grávidas de B. claripalpis, sobre larvas de D. saccharalis, en condiciones del Valle de Virú y desierto de Alto Salaverry.

Evaluaciones del Parasitismo
Se realizaron evaluaciones mensuales de parasitismo de B. claripalpis, desde el sexto mes de edad de cultivo, hasta el décimo primer mes y al momento de la cosecha que fue al décimo sexto mes.
Para el proceso de evaluaciones se tomó una muestra de 120 tallos/cuartel, distribuidas en zigzag, posteriormente se procedió con las evaluaciones de parasitismo que consistía en cortar la caña, con un machete, en dos mitades longitudinales. El porcentaje de parasitismo fue calculado con base en el número de larvas y pupas de D. saccharalis parasitadas por B. claripalpis así como el total de estados de desarrollo de D. saccharalis, según la siguiente fórmula, siendo los indicadores de parasitismo la presencia del parasitoide en los estados de larva y pupa en D. saccharalis (Badilla, 2002; Vargas & Gomez, 2005):
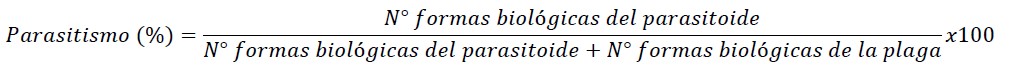
Evaluación de la Infestación e Intensidad de Infestación de D. saccharalis a la cosecha.
Cuando la caña de azúcar se cosechó al décimo sexto mes, se procedió con la toma de muestra de 120 tallos/ cuartel, posteriormente se realizó la determinación de la infestación, que se define como el porcentaje de cañas barrenadas y la intensidad de infestación, como el porcentaje de entrenudos barrenados por D. saccharalis (Badilla, 2002; Vargas & Gomez, 2005):

Determinación de regresión y la correlación entre el porcentaje de intensidad de infestación y el parasitismo
Para la determinación del grado de asociación entre D. saccharalis y B. claripalpis, se procedió a realizar el modelo de regresión lineal entre el porcentaje de intensidad de infestación y el parasitismo (Badilla, 2002; Vargas & Gomez, 2005).
Análisis estadístico
Se realizaron cuatro repeticiones por cada tratamiento, con un diseño de bloques completamente al azar utilizando el Softwarrd Estadístico Info Stat, versión 1.1., efectuándose el análisis de varianza y la prueba Tukey, con una probabilidad de 0,05 (Carreño & Mayorga, 2017; Flores-Ruíz et al., 2017; González et al., 2019; Herrera et al., 2016; Reyes & Maturel, 2015; Vera, 2019).
3. Resultados
Tabla 2. Análisis de varianza del efecto parasítico de hembras grávidas y no grávidas de B, claripalpis, sobre larvas de D. saccharalis, en condiciones de Valle y Desierto. Virú. La Libertad. 2018 – 2019.
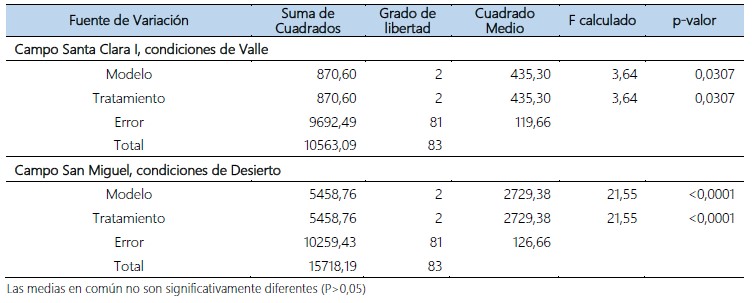
Tabla 3. Separación de medias por medio de Tukey al 95% de confianza, del efecto parasítico de hembras grávidas y no grávidas de B. claripalpis, sobre larvas de D. saccharalis, en condiciones de Valle y Desierto. Virú. La Libertad. 2018 – 2019.
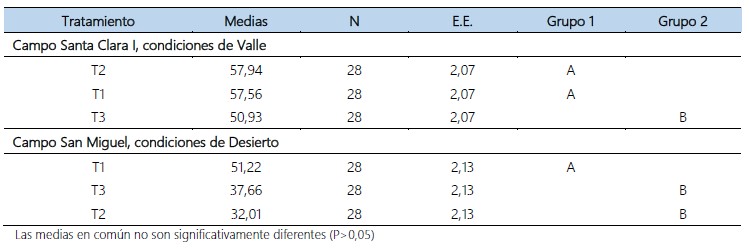
Tabla 4. Promedio de Infestación e intensidad de infestación de D. saccharalis y porcentaje de parasitismo de hembras grávidas y no grávidas de B. claripalpis sobre larvas de D. saccharalis al momento de la cosecha, en condiciones de valle y desierto. Virú. La Libertad. 2018 – 2019.
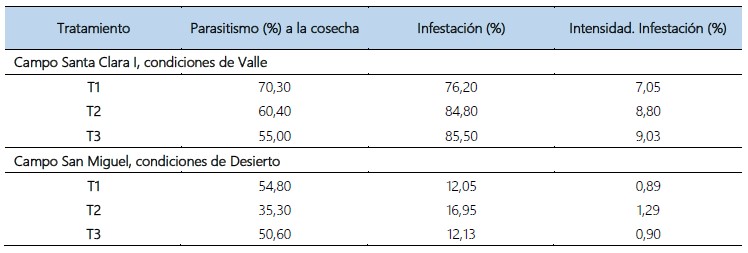
Tabla 5. Temperatura (°C) y Humedad (%) en el fundo San Miguel, en condiciones de desierto. Virú La Libertad. 2018 – 2019.
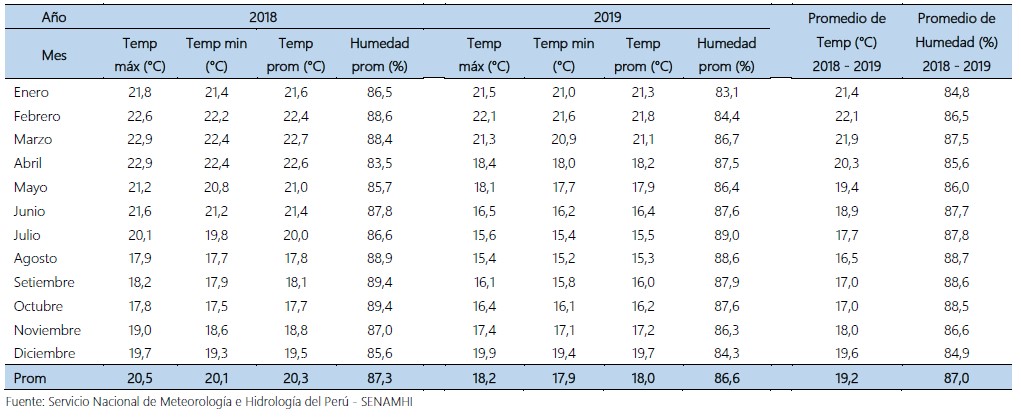
Tabla 6. Temperatura (°C) y Humedad (%) en el fundo Santa Clara I, en condiciones de valle. Virú La Libertad. 2018 – 2019.
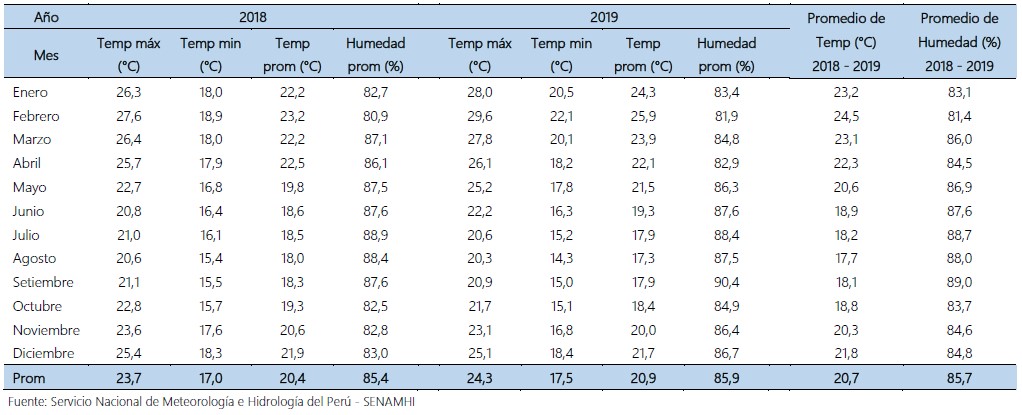
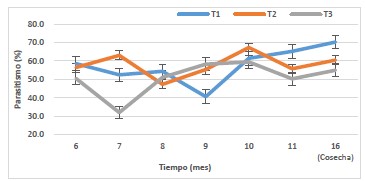
Figura 1. Efecto parasítico de hembras grávidas y no grávidas de Billaea claripalpis sobre larvas Diatraea saccharalis en condiciones de Valle. Campo Santa Clara I, 2018-2019.
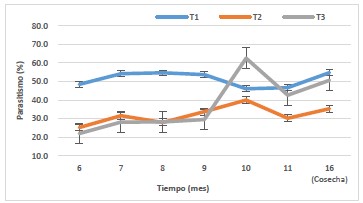
Figura 2. Efecto parasítico de hembras grávidas y no grávidas de Billaea claripalpis sobre larvas Diatraea saccharalis en condiciones de Desierto. Fundo San Miguel, 2018-2019.
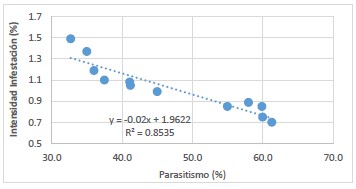
Figura 3. Correlación entre el parasitismo (%) y la intensidad de infestación (%), en condiciones de Valle, Fundo Santa Clara I, 2018-2019.
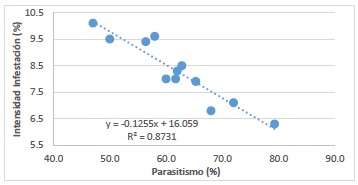
Figura 4. Correlación entre el parasitismo (%) y la intensidad de infestación (%), en condiciones de Desierto, Fundo San Miguel, 2018-2019.
4. Discusión
Investigaciones realizadas en el cultivo de caña de azúcar sobre el parasitismo de hembras grávidas de B. claripalpis para el control de D. saccharalis, muestran luego de realizadas las liberaciones un aumento de parasitismo para la variedad H32-8560 al cuarto mes y décimo primer mes con valores de 8,1% a 53,8% respectivamente y en la variedad Mex73-523 al cuarto mes y décimo primer mes con valores de 7,4% a 38,5% respectivamente; indicando que el motivo del uso de hembras grávidas de B. claripalpis es para reducir la mortalidad, mostrándose más efectivo el parasitismo, en tal sentido la utilidad de estas liberaciones en ecosistemas agrícolas áridos donde se siembra el cultivo de caña de azúcar; en dicho ecosistema el comportamiento de D. saccharalis causa un mayor daño realizando ciclos biológicos cortos de cincuenta días promedio, en cambio en el valle Chicama su ciclo biológico es de sesenta días promedio (Sociedad Entomológica del Perú, 2015). Sin embargo, lo mencionado anteriormente difiere con los resultados de la presente investigación, según el análisis de varianza realizado, muestra diferencias significativas entre los tratamientos (tabla 2) y la formación de grupos según la prueba de Tukey al 95% de confianza (tabla 3). En condiciones de Valle, se observó que los tratamientos que presentaron mayor parasitación fueron T1: liberación de hembras no grávidas de B. claripalpis a una dosis de 40 parejas/ha y T2: liberación de hembras grávidas de B. claripalpis a una dosis de 50 parejas/ha, con 57,56% y 57,94%. Asimismo, la menor parasitación se presentó en el T3: liberación de hembras grávidas de B. claripalpis a una dosis de 40 parejas/ha con 50,93%. Además, en la tabla 6, se muestra temperatura promedio del fundo de 20,7°C y Humedad de 85,7% correspondiente a los años 2018 – 2019, las cuales son propicias para el desarrollo del parasitoide. Sin embargo, dichas liberaciones de hembras grávidas y no grávidas de B. claripalpis, se vieron favorecidas por las condiciones del agroecosistema de Valle, por la existencia de factores ambientales que afectan positivamente el desarrollo de B. claripalpis, como son las condiciones microclimáticas; temperatura, humedad relativa, disponibilidad de alimento, como el agua, polen; recursos de hábitat, tales como sitios de reproducción, refugio, entre otros. Asimismo, estos factores determinan las condiciones del cultivo de caña de azúcar que es afectado por la población de D. saccharalis y su parasitoide B. claripalpis, influyendo en su migración, mortalidad y fecundidad (Ferron & Deguine, 2005; Hidalgo & Acevedo, 2012; Paredes et al., 2013).
En condiciones desérticas, posiblemente el parasitismo de las hembras grávidas y no grávidas de B. claripalpis, esté influenciado por los factores ambientales en su biología y sus requerimientos. Siendo el tratamiento T1, donde se realizaron liberaciones de hembras no grávidas de B. claripalpis, presentó el mayor promedio de parasitismo con un 51,22%, (Nicholls & Altieri, 2002); asimismo, en todo el fundo se instalaron corredores biológicos donde los parasitoides encontraron alimento, también las hembras no grávidas tuvieron un mayor tiempo de adaptación al agroecosistema, pues fueron liberadas a los cuatro días de emergidas. Además, en los tratamientos T2: liberación de hembras grávidas de B. claripalpis a una dosis de 80 parejas/ha y T3: liberación de hembras grávidas de B. claripalpis a una dosis de 60 parejas/ha, donde se obtuvieron promedios menores de parasitismo de 32,01% y 37,66% respectivamente, estas liberaciones de B. claripalpis se realizaron a los catorce días de emergencia, presentando un menor tiempo de adaptación al medio.
Todos los tratamientos fueron expuestos a los mismos factores climáticos (Morales, 2008; Nicholls & Altieri, 2002).
Además, en la tabla 5, se muestra la temperatura promedio del fundo de 19,2°C y humedad de 87% correspondiente a los años 2018-2019, las cuales son propicias para el desarrollo del parasitoide.
En las liberaciones de B. claripalpis en condiciones de Valle, en el fundo Santa Clara I, al momento de la cosecha, el T1 obtuvo el mayor parasitismo y el T3 presentó el menor parasitismo, con 70,3% y 55% respectivamente; además, el T3 presentó el mayor porcentaje de intensidad de infestación y el T1 mostró el menor porcentaje de intensidad de infestación con 9,03% y 7,05% respectivamente, determinándose una correlación negativa (r= -0,93) entre el parasitismo y la intensidad de infestación y (r= -0,72). El modelo cuadrático (R2= 0,8731) fue el que mejor explica los resultados de intensidad de infestación (Tabla 4, Fig. 3). Además, en condiciones de desierto, en el fundo San Miguel, al momento de la cosecha, el T1 y T2 presentaron el mayor y menor porcentaje de parasitismo con 54,8% y 35,3% respectivamente; asimismo, el T2 y T1 presentaron el mayor y menor porcentaje de intensidad de infestación con 1,29% y 0,89% respectivamente, determinándose una correlación negativa (r= -0,92) entre el parasitismo y la intensidad de infestación y (r= -0,81).
Correspondiendo el modelo cuadrático (R2= 0,8535) (Tabla 4, Fig. 4), el que mejor explica los resultados de intensidad de infestación, evidenciando que este parasitoide es el responsable de mermar los daños de D. saccharalis en el campo. Asimismo, se determinó que la información obtenida por el daño causado por D. saccharalis, como la intensidad de infestación es más coherente que la infestación para correlacionar datos de los daños en la caña de azúcar y el parasitismo a nivel de campo (Badilla, 2002).
Esto se debe a que la intensidad de infestación que corresponde al porcentaje de entrenudos barrenados, muestra en su máxima expresión los daños causados por D. saccharalis vinculado con la acción de otros organismos tales como hongos y bacterias causando daños en los entrenudos siguientes. Por ende, en la infestación, se determina el porcentaje de cañas barrenadas, puesto que no incluye el abrir las cañas.
5. Conclusiones
En el agroecosistema de valle, en los tratamientos T1 y T2, donde se realizaron liberaciones con hembras no grávidas y grávidas de B. claripalpis respectivamente, presentaron el mayor parasitismo y en el agroecosistema desértico el tratamiento T1, donde se realizó liberaciones con hembras no grávidas de B. claripalpis obtuvo el mayor parasitismo, viéndose favorecida B. claripalpis en ambos agroecosistemas, por la existencia de factores ambientales que afectan positivamente la actividad del parasitoide.
A medida que se incrementa el porcentaje de parasitismo de B. claripalpis, disminuye el porcentaje de intensidad de infestación de D. saccharalis, demostrándose que este parasitoide es el responsable de la disminución del daño causado por D. saccharalis.
El hábitat de B. claripalpis, está decreciendo a medida que se extiende el cultivo de caña de azúcar en diversos agroecosistemas, volviéndose desfavorable para el control biológico, debido a la quema de la caña de azúcar al momento cada cosecha del cultivo o después de ella, motivo por el cual es imprescindible brindar las condiciones para este parasitoide y probar nuevas alternativas para el control biológico contra D. saccharalis.
6. Contribución de autores
Todos los autores han realizado conjuntamente y a partes iguales la argumentación y la redacción del artículo científico.
7. Conflicto de intereses
Los autores ratifican que no existe conflicto de interés en la publicación del presente artículo.
8. Referencias bibliográficas
Arboleda, B., & Vargas, G. (2019). Efficacy of Cotesia flavipes (Hymenoptera: Braconidae) in Reducing Diatraea tabernella (Lepidoptera: Crambidae) Injury in Sugar Cane. Florida Entomologist, 102(3), 520–525.
Arispe, J., Sánchez, A., & Galindo, E. (2019). Presencia de Diatraea saccharalis (Fabricius) (Lepidoptera: Crambidae) en Tepalcingo, Morelos, México, con evaluación del daño causado en el cultivo de maíz (Zea mays L.). Revista Chilena de Entomología, 45(4), 587–592.
Astola, S., & Narrea, M. (2019). Biología y comportamiento de Cotesia flavipes Cameron (Braconidae) parasitoide de Diatraea saccharalis Fabricius (Crambidae). Ecología Aplicada, 18(1), 77–83.
Badilla, F. (2002). Un programa exitoso de control biológico de insectos plaga de la caña de azúcar en Costa Rica. Manejo Integrado de Plagas y Agroecología, 1(64), 77–87.
Carreño, S., & Mayorga, J. (2017). Pensamiento estadístico: herramienta para el desarrollo de la enfermería como ciencia. Avances En Enfermería, 35(3), 345–356. 84
Echeverri-Rubiano, C., Chico-Ramírez, H., & Vargas-Orozco, G. (2017). Resistencia varietal al ataque por Diatraea spp. (Lepidoptera: Crambidae) en caña de azúcar. Revista Colombiana de EntomologÍa, 43(2), 186–194. 2
Ferron, P., & Deguine, J. (2005). Crop protection, biological control, habitat management and integrated farming. A review. Agronomie, 25(1), 17–24.
Flores-Ruíz, E., Miranda-Novales, M., & Villasís-Keever, M. (2017). El protocolo de investigación VI: cómo elegir la prueba estadística adecuada. Estadística inferencial. Revista Alergia México, 64(3), 364–370. 4
Gil, A., & López, S. (2017). Principales plagas y controladores biológicos de Gossypium hirsutum L. “algodón nativo” de fibra verde en relación a su ciclo fenológico. Arnaldoa, 24(1), 359–368.
Gómez, F. (2014). Diatraea y elementos para su manejo en el Ingenio Risaralda y actividades complementarias en un ingenio azucarero [Tesis de pregrado, Corporación Universitaria Lasallista].
González, A., Pérez, D., Rubí, M., Gutiérrez, F., Franco, J., & Padilla, A. (2019). InfoStat, InfoGen y SAS para contrastes mutuamente ortogonales en experimentos en bloques completos al azar en parcelas subdivididas. Revista Mexicana de Ciencias Agrícolas, 10(6), 1417–1431.
Herrera, M., Guerra, C., & Medina, Y. (2016). Integral evaluation of indicators in models of parametric and non-parametric analysis of variance. Use of the categorical principal component. Cuban Journal of Agricultural Science, 50(2), 185–191.
Hidalgo, J., & Acevedo, A. (2012). Efectos de la biodiversidad en el control biológico dentro de los agroecosistemas. Inventum, 7(13), 30–35.
Leyton, S., Gordillo, M., González, P., Ospina, J., & Vargas, G. (2018). Spatial and temporal distribution of Diatraea spp. (lepidoptera: Crambidae) in the Cauca River Valley, Colombia. Revista Colombiana de Entomologia, 44(2), 177–186.
Limo, S. (2017). Ciclo biológico y comportamiento de Tetrastichus howardi Olliff en puparios de Billaea (Paratheresia) claripalpis Wulp. [Tesis de maestría, Universidad Nacional de Trujillo].
Ludeña, V. (2014). Producción intensiva de Diatraea saccharalis en dieta artificial, para difusión de sus parasitos Cotesia flavipes y Billaea claripalpis. [Tesis de pregrado, Universidad de Guayaquil].
Morales, M. (2008). Evaluación de cuatro parasitoides para el control de dos especies de barrenadores Diatraea saccharalis Fabricius y Diatraea crambidoides Grote en caña de azúcar a nivel de laboratorio [Tesis de pregrado, Universidad de San Carlos de Guatemala].
Nicholls, C., & Altieri, M. (2002). Biodiversidad y diseño agroecoló gico: un estudio de caso de manejo de plagas en viñedos. Manejo Integrado de Plagas y Agroecología, 1(65), 50–64.
Paredes, D., Campos, M., & Cayuela, L. (2013). El control biológico de plagas de artrópodos por conservación: técnicas y estado del arte. Ecosistemas, 22(1), 56–61.
Pollack, M., Helfgott, S., & Tejada, J. (2018). El cultivo de caña de azúcar en la Costa del Perú durante los eventos de El Niño 1982-83 y 1997-98. Ecología Aplicada, 17(1), 77–84.
Reyes, Y., & Maturel, L. (2015). El análisis estadístico aplicado a la gestión de la enseñanza para la toma de decisiones. Revista Cubana de Ciencias Informáticas, 9(3), 113–127.
Rodriguez, L. (2015). Ciclo Biológico de Galleria mellonella Linnaeus (Lepidoptera:Pyralidae) [Tesis de pregrado, Universidad Nacional Agraria La Molina].
Saldaña, C. (2019). Efecto del parasitismo en campo de Billaea claripalpis Wulp. criadas en Diatraea saccharalis Fabr. y Galleria mellonella L. Revista Tayacaja, 2(2), 8–18.
Saldaña, C., & Ayquipa, G. (2021). Efecto del cebo tóxico con trampa de melaza en el control de Elasmopalpus lignosellus Zeller. Manglar, 18(1), 47–52.
Sánchez, J., Valle, J., Pérez, E., Neira, M., & Calderón, C. (2019). Biological control of Spodoptera frugiperda in Zea mays culture: Use of entomopathogenic nematodes. Scientia Agropecuaria, 10(4), 551–557.
Sociedad Entomológica del Perú. (2015). Convención Nacional de entomología : Resúmenes LVII Convención Sociedad Entomológica del Perú (Sociedad Entomológica del Perú (ed.); Primera Ed).
Solis, M., & Metz, M. (2016). An illustrated guide to the identification of the known species of Diatraea guilding (Lepidoptera, Crambidae, Crambinae) based on genitalia. ZooKeys, 1(565), 73–121.
Suárez, R., Figueredo, L., De Sousa-Vieira, O., Briceño, R., Diaz, A., Aza, G., & George, J. (2018). Genotype by environment interactions for damage caused by Diatraea spp. borers in sugarcane. Acta Agronomica, 67(2), 355–361.
Vargas, G., Gómez, L., & Michaud, J. (2015). Sugarcane Stem Borers of the Colombian Cauca River Valley: Current Pest Status, Biology, and Control. Florida Entomologist, 98(2), 728–735. 9
Vargas, G., & Gomez, L. (2005). La evaluacion del daño causado por Diatraea spp en caña de azucar y su manejo en el valle del rio cauca. Cenicaña, 1(1), 8.
Velez, E., Castro, R., & Chirinos, D. (2020). Biología de Cotesia flavipes Cameron sobre el Taladrador del Tallo, Diatraea saccharalis Fabricius, en Varios Medios de Cría. Investigatio, 13(13), 77–88.
Vera, O. (2019). La interpretación de los resultados : un elemento de significado para la inferencia estadística A interpretação dos resultados : The interpretation of results : an element of meaning for statistical inference. Educar Em Revista, 35(78), 131–152.
Zúñiga, M., & Soto, A. (2018). Control microbiológico de Diatraea saccharalis Fabricius (Lepidoptera: Crambidae) en caña panelera a nivel de campo. Boletin Cientifico Del Centro de Museos, 22(2), 33–41.