DESARROLLO DE UN SISTEMA DE DETECCIÓN DE OCRATOXINA A BASADO EN NANOSENSORES APTAMÉRICOS EN MICROPLACAS
DEVELOPMENT OF AN OCHRATOXIN A DETECTION SYSTEM BY A MICROPLATE - BASED NANOAPTASENSOR
Angeline S. Saldaña 1; Yulán Hernández 1; Betty C. Galarreta 1 *
1 Pontificia Universidad Católica del Perú, Departamento de Ciencias-Sección Química, Lima, Perú
Artículo original
Recibido: 31 de marzo 2021
Aceptado: 04 de mayo 2021
Resumen
La ocratoxina A (OTA) es una micotoxina altamente tóxica producida por algunas variedades de hongos, capaz de contaminar productos agroindustriales, lo que ha obligado a establecer normas de regulación en varios países. Por tal motivo, es necesario contar con métodos confiables y sensibles para su detección temprana, que puedan ser utilizados de manera rutinaria. Los nanosensores aptaméricos representan una alternativa que puede mejorar la detección de moléculas de interés, debido a la alta afinidad y selectividad de los biorreceptores aptaméricos por objetivos específicos. Además, el uso de nanomateriales de metales nobles permite desarrollar sensores a partir de sus propiedades ópticas, como la resonancia de plasmón superficial localizado (LSPR), al poder monitorear los cambios en la superficie y relacionarlo con la concentración de una sustancia de interés. En este trabajo se muestran los avances en el desarrollo de un sistema alternativo de detección de OTA basado en nanosensores aptaméricos. El procedimiento contempla la síntesis y funcionalización de nanoesferas de oro (AuNEs) con un aptámero selectivo a OTA (APT), el proceso de modificación de microplacas con la hebra complementaria a dicho aptámero (HC) y la hibridación entre los oligonucleótidos conjugados. Finalmente, a modo de prueba de concepto, se realizaron algunas pruebas que permitieron discriminar la presencia de 336 ppb de OTA.
Palabras clave: Aptámeros, micotoxinas, microplacas, nanosensores, ocratoxina A, oro.
Abstract
Ochratoxin A (OTA) is a highly toxic mycotoxin produced by some varieties of fungi, capable of contaminating agro-industrial products, this has forced the establishment of regulatory standards in several countries. Therefore, it is required to have reliable and sensitive methods for its early detection that could be implemented in routine assays. Aptameric nanosensors are an alternative method that can improve the detection of specific target molecules, due to the high affinity and selectivity of aptameric bioreceptors for specific targets. In addition, the use of noble metal nanomaterials allows the development of sensors based on their optical properties such as localized surface plasmon (LSPR), as it is possible to monitor changes in their surface and relate them to the concentration of a target analyte. This work has focused in the development of an alternative OTA detection system, based on aptameric nanosensors. The procedure contemplates the synthesis and functionalization of gold nanospheres (AuNEs) with an OTA-selective aptamer (APT), a microplate surface modification procedure with the complementary strand to the aptamer (HC) and the hybridization between the oligonucleotides. Lastly, as a proof of concept, some assays were performed to discriminate the presence of 336 ppb of OTA.
Keywords: Aptamers, gold, microplates, mycotoxins, nanosensors, ochratoxin A.
* Autor para correspondencia: E. mail: bgalarreta@pucp.pe
DOI: http://dx.doi.org/10.17268/rebiol.2021.41.01.01
Citar como:
Saldaña, A., Hernández, Y., & Galarreta, B. 2021. Desarrollo de un sistema de detección de ocratoxina A basado en nanosensores aptaméricos en microplacas REBIOL, 41(1):23-34.
1. Introducción
Las micotoxinas son metabolitos secundarios producidos naturalmente por ciertos hongos capaces de contaminar alimentos como granos, especias, frutos y hortalizas (Turner et al., 2009). Estos compuestos son químicamente estables, por lo que suelen ser resistentes frente a los procesos industriales de producción de alimentos (World Health Organization, 2008). Dentro de las toxinas más recurrentes en productos alimentarios de consumo masivo se encuentra la ocratoxina A (OTA), la cual es producida por varias especies de hongos filamentosos de los géneros Aspergillus, Penicillium verrucosum y nordicum (Turner et al., 2009). Se puede encontrar mayormente en alimentos con contenido en almidón, cereales, café, especias y frutos secos (Zinedine y Mañes, 2009). Entre sus efectos nocivos se encuentran su naturaleza como agente nefrotóxico, hepatotóxico y posible agente carcinógeno (Bennett y Klich, 2003).
Debido a los efectos nocivos que causa la ingesta de OTA, en Perú, el Servicio Nacional de Sanidad Agraria (SENASA) ha establecido disposiciones para garantizar la inocuidad de alimentos, fijando el contenido máximo de esta toxina según los reglamentos establecidos por el Comité Científico de la Unión Europea (SENASA, 2017). Por tal motivo, se considera necesario contar con métodos analíticos accesibles y efectivos que aseguren la inocuidad de los productos alimenticios en el proceso de control de calidad, con el fin de proteger a la población que los consume.
Actualmente, los métodos de cuantificación de OTA se basan en técnicas como cromatografía líquida acoplada a detectores de masas en tándem (LC-MS/MS) (Nielsen et al., 2015; Arroyo-Manzanares et al., 2014). Estos métodos son, en la mayoría de los casos, poco accesibles y difíciles de implementar debido al elevado costo de los equipos y la infraestructura que se precisa para el análisis de muestras. Por otro lado, existen métodos basados en inmunoensayos (ELISA) (Turner et al., 2009; Wu et al., 2011), los cuales suelen ser rápidos y portátiles. Sin embargo, estos kits de ensayo empleados utilizan anticuerpos que requieren de condiciones ambientales bastante específicas para evitar su desnaturalización y, al ser kits no reutilizables, representan un costo global significativo (Turner et al., 2009). En los últimos años, se han reportado métodos alternativos de detección basados en el uso de nanopartículas (NPs) de metales nobles como oro y plata (Saha et al., 2012; Farahi et al., 2012). Entre las ventajas de usar estos materiales se encuentran la eficiente adsorción de los analitos sobre la superficie de las NPs y sus excelentes propiedades ópticas debido a la resonancia del plasmón superficial localizado (LSPR). Estas dos características propician el desarrollo de un sistema de detección que podría mejorar la sensibilidad respecto a los métodos convencionales para el análisis de micotoxinas como la ocratoxina A (Saha et al., 2012; Hernández et al., 2020). La amplia área superficial de estas NPs se puede modificar químicamente con agentes de reconocimiento selectivos a una sustancia de interés, y dado que sus señales espectrales de LSPR son muy sensibles a los cambios en su entorno, es posible monitorear la presencia de muy bajas concentraciones de analito, y permitir el diseño de sistemas de detección eficientes y selectivos (Halas et al., 2011; Zhao et al., 2006).
Actualmente, existen métodos basados en la adsorción de toxinas mediante el uso de aptámeros (oligonucleótidos diseñados para unirse de manera específica con algún analito de interés) inmovilizados en la superficie de las NPs (Galarreta et al., 2013; Guo et al., 2014). Los aptámeros son estables frente a cambios ambientales (temperatura y pH), su costo es menor que el de los tradicionales anticuerpos y, además, pueden ser sintetizados y modificados químicamente (Bunka y Stockley, 2006). Estos beneficios, en combinación con el uso de métodos analíticos conocidos, como la espectroscopía UV-Vis, ha permitido que estos sensores se puedan integrar en otros sistemas ya establecidos, por ejemplo, en microplacas, para el desarrollo de métodos de detección más sencillos y aplicables en el proceso de control de calidad en la industria alimentaria.
Aprovechando los avances en la nanotecnología y en la generación de aptámeros selectivos, el presente trabajo propone desarrollar un sistema de detección de OTA basado en nanosensores aptaméricos que se encuentren integrados en una microplaca modificada superficialmente. Este sistema podría sentar las bases de un método selectivo, sensible y económicamente accesible para la detección de OTA, micotoxina presente en productos agroindustriales de interés nacional como el café y la kiwicha. Se espera que este sistema pueda, eventualmente, contribuir al desarrollo de nuevos procesos rutinarios de control de calidad de alimentos con el fin de asegurar la inocuidad de los productos y proteger la salud de la población.
2. Materiales y Métodos
Reactivos y Materiales
Todas las soluciones fueron preparadas utilizando agua ultrapura. Los reactivos HAuCl4, dodecilsulfato sódico (SDS), KH2PO4, K2HPO4, NaH2PO4, Na2HPO4, ácido-3- mercaptopropiónico (MPA) y OTA fueron adquiridos en Sigma Aldrich (USA). Citrato sódico, NaCl y NaOH fueron adquiridos en JT Baker (USA). Alfa-tio-omega-(ácido propiónico)octa(etilenglicol) (PEG-SH) fue adquirido de IRIS Biotech (Alemania), Tween® 40 fue adquirido de Fluka (USA) y etiltioglicolato (ETG) fue adquirido de Merck (USA). Las placas NUNC® Immobilizer Amino fueron adquiridas de Thermo Scientific™ (USA).
Los oligonucleótidos: aptámero de OTA (APT) y hebra complementaria al aptámero de OTA (HC) de secuencias 5’-HS-(CH2)6-GAT-CGG-GTG-TGG-GTG-GCG-TAA-AGG-GAG-CAT-CGG-ACA-3’ y 5´-HS-(CH2)6-TTT-TTT-GTC-CGA-TGC, respectivamente, fueron adquiridos de Eurogentec (Bélgica).
Equipos
Espectrofotómetro UV-Vis-NIR (espectrofotómetro Genesys 10S, Thermo Scientific - USA), microscopio electrónico de transmisión (TEM) (LVEM5, Delong Instruments - República Checa), lectora de microplacas con filtros a 450 nm, 521 nm y a 595 nm (Multiskan, Thermo Scientific™ - USA) centrífuga (Eppendorf 5430R, - USA), incubadora (MyTemp mini H2200-HC, Benchmark Scientific - USA), agitador vórtex (MVOR 03, SBS - España), agitador con incubadora (Polymax1040, Heidolph - Alemania) y baño de ultrasonido (VWR 97043-930 - USA).
Síntesis de AuNEs
Para la preparación de AuNEs se siguió un protocolo basado en la reducción de HAuCl4 con citrato sódico en medio acuoso, desarrollado por Turkevich et al. (1951); Frens (1973) y que además contempló una técnica de nucleación y crecimiento desarrollada por Bastus et al. (2011) y adaptada por Hernández et al. (2017). Para ello, se agregó 1,83 mL de citrato sódico 0,06 M a un balón, luego se completó el volumen hasta 50 mL con agua ultrapura, y se calentó el balón bajo reflujo, en un baño de silicona y en agitación constante. Al alcanzar la ebullición, se hizo una primera adición de 167 μL de HAuCl4 50 mM. Tras 30 minutos se enfrió el baño de silicona hasta aproximadamente 90°C, y se agregaron inalmente, dos alícuotas sucesivas de 167 μL de HAuCl4 50 mM en un intervalo de 30 minutos cada una.
Funcionalización de nanopartículas con PEG- SH
Previo a la funcionalización con APT, las AuNEs fueron modificadas con PEG-SH, para lo cual, se añadieron, en orden, las siguientes soluciones: 4995 μL de AuNEs, 2505 μL de agua ultrapura, 22,5 μL SDS 10% m/V, y 75 μL de PEG-SH 0,1 g/L. Tras homogeneizar con cuidado, se añadieron 150 μL de NaOH 1 M y se dejó agitando toda la noche. Finalmente, las muestras se centrifugaron 3 veces durante 30 min a 6000 RPM y 10°C. Después de la última centrifugación, se retiró el sobrenadante (aproximadamente 6,75 mL) y se obtuvieron las AuNEs funcionalizadas con PEG-SH (AuNEs@PEG-SH), las cuales, además, se utilizaron como prueba control en los ensayos de hibridación de oligonucleótidos y detección de OTA.
Adicionalmente se contempló una segunda adición de PEG-SH a la solución de AuNEs, para poder evaluarlas como prueba control, al igual que en el caso anterior. Para ello se añadió un paso adicional previo a la etapa de centrifugación, que consistió en agregar 4,6 μL de PEG-SH 1 g/L a 500 μL de la solución de AuNEs@PEG-SH y dejarlo agitando toda la noche. Por último, estas muestras se centrifugaron 3 veces durante 1 hora a 6000 RPM y 10°C.
Después de la última centrifugación, se retiró el sobrenadante (aproximadamente 450 μL) y se obtuvieron las AuNEs doblemente funcionalizadas con PEG-SH (AuNEs@PEG-SH_2).
Funcionalización de nanopartículas con el aptámero de OTA
Luego del primer paso de recubrimiento con PEG-SH, las AuNEs se funcionalizaron con los oligonucleótidos tiolados. Se colocaron, en orden, las siguientes soluciones: 820 μL de agua ultrapura, 2,5 μL SDS 10% m/V, 50 μL de AuNEs@PEG-SH, 100 μL buffer de fosfato de potasio (KP) 0,1 M pH 8, 10 μL de APT 200 μM y, finalmente, 4 adiciones de NaCl a lo largo de 24 horas (25 μL de la solución 1 M en cada adición). Después de cada adición de NaCl, se sonicaron brevemente las muestras y se dejaron en agitación. Por último, las muestras se centrifugaron 3 veces siguiendo las mismas condiciones anteriormente descritas. Después de la última centrifugación, se retiró el sobrenadante (aproximadamente 1000 μL) y se obtuvieron las AuNEs@PEG-SH recubiertas con el aptámero de OTA (AuNEs@PEG-SH@APT).
Caracterización de las nanopartículas
Las AuNEs sintetizadas fueron caracterizadas mediante espectroscopía UV-Vis-NIR y microscopía electrónica de transmisión (TEM). Las AuNEs funcionalizadas (con PEG-SH y APT) también fueron caracterizadas mediante espectroscopía UV-Vis-NIR. La concentración de las nanopartículas se estimó a partir de los valores del espectro obtenido y siguiendo los parámetros reportados por Haiss et al. (2007).
Modificación superficial de microplacas
Se funcionalizaron las microplacas NUNC® Immobilizer Amino con la HC siguiendo el protocolo recomendado por Thermo Scientific™ NUNC®. Este procedimiento consistió en añadir en cada pocillo 50 μL de HC (0,2 μM - 2 μM), 10 μL de buffer de fosfato 0,1 M pH 8 y 40 μL de agua ultrapura. Luego de añadir los reactivos, la microplaca se mantuvo en agitación toda la noche a temperatura controlada.
Se evaluaron distintos parámetros en el proceso de modificación superficial de las microplacas con el propósito de encontrar las condiciones óptimas para el ensayo de hibridación de oligonucleótidos. Entre estas condiciones se encontraron: la concentración de la HC (0,2 μM y 2 μM), la temperatura (22°C, 25°C y 29°C) y la adición de un agente de relleno. Se contempló la adición de dos agentes de relleno, MPA y ETG, y se evaluaron tres condiciones: la adición de 22 μL de MPA 11,49 μM, 22 μL de ETG 9,08 μM y 22 μL de ETG 45,4 μM. Después de agregar el agente de relleno a la microplaca, esta se dejó agitando por 2 horas a 29°C. Finalmente, cada pocillo modificado de la microplaca se lavó 3 veces con 300 μL de PBS 1X + 0,1 % V/V Tween® 40. Una vez lavadas, las microplacas modificadas con HC (NUNC@HC) pudieron ser empleadas para los ensayos de hibridación de oligonucleótidos y detección de OTA.
Hibridación de oligonucleótidos
El proceso de hibridación entre la hebra complementaria unida NUNC@HC y el aptámero unido a las AuNEs@PEG-SH@APT, se realizó en base al protocolo reportado por Mirkin et al. (1996), para lo cual se empleó una lectora de microplacas controlada mediante el software SkanIt versión 5.0. La lectora se programó para obtener los valores de extinción a 450, 521 y a 595 nm en cada pocillo de interés. Para estos ensayos se realizaron dos tipos de pruebas: la prueba control (empleando AuNEs@PEG-SH) y la prueba con AuNEs modificadas con APT (AuNEs@PEG-SH@APT). El procedimiento implicó añadir, alternadamente, en cada pocillo las AuNEs para la prueba control y la prueba con AuNEs@APT, seguidas de agua ultrapura, buffer KP 0,1 M pH 8 (concentración final 0,02 M) y una solución de NaCl 4 M hasta un volumen total de 100 μL. Todos los cambios de intensidad que pudieron generarse debido a la preparación de diferentes lotes o los procesos de lavado fueron corregidos, mediante el cálculo del volumen de solución necesario que permitiera mantener siempre la misma concentración de las AuNEs durante los ensayos. Para optimizar este proceso de hibridación, se analizó la influencia de diversos parámetros. Uno de estos parámetros fue emplear como prueba control dos tipos de AuNEs: AuNEs@PEG-SH y AuNEs@PEG-SH_2. Por otro lado, también se evaluó cambiar la concentración final de las AuNEs@PEG-SH@APT (0,75 nM, 1,5 nM y 2 nM), la concentración final de NaCl (0,1 M, 0,2 M, 0,4 M y 0,6 M) y la temperatura de hibridación (22°C, 25°C y 29°C).
Finalmente, para evaluar la eficiencia de la modificación de microplacas y la hibridación de oligonucleótidos se registraron las medidas de la intensidad de los espectros de extinción a 450, 521 y 595 nm con la lectora de microplacas, cada hora hasta, como mínimo, 4 horas.
Entre cada medida se almacenó la placa en un agitador con temperatura controlada, y después de la cuarta medida se dejó bajo agitación toda la noche. Por último, al día siguiente se realizaron 2 mediciones, la primera sin lavar y la última después de lavar cada pocillo con PBS 1x + 0,1 % v/v Tween® 40. Esta última medición es la que se tomó en cuenta para el tratamiento de los datos.
Detección de OTA empleando una microplaca modificada superficialmente
Se evaluó la respuesta del sistema de detección de las microplacas modificadas con HC y AuNEs funcionalizadas con APT, para lo cual se realizaron ensayos ante la presencia y ausencia de un estándar de OTA, el proceso se resume en el esquema mostrado en la figura 1. Esta figura muestra el análisis realizado a las pruebas control (AuNEs@PEG-SH_2), las cuales mostraron mejores resultados que el control AuNEs@PEG-SH y las pruebas con AuNEs modificadas con APT (AuNEs@PEG-SH@APT), con las condiciones óptimas. Como se observa en ausencia de OTA se espera la hibridación de oligonucleótidos, mientras que en presencia de la toxina se espera que la hibridación se vea mayormente impedida.
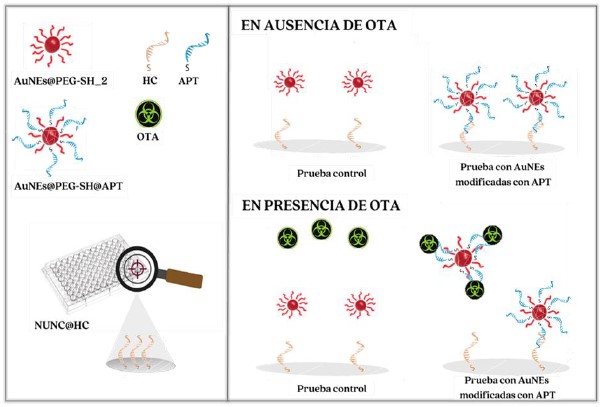
Figura 1. Esquema del sistema de detección en ausencia y presencia de OTA, empleando una microplaca modificada superficialmente con HC (NUNC@HC), AuNEs @PEG-SH_2 como prueba control y AuNEs@PEG-SH@APT como prueba con AuNEs modificadas.
El ensayo de detección se inició con la preparación de las muestras para la prueba control (AuNEs@PEG-SH_2) y para la prueba con AuNEs@PEG-SH@APT, para lo cual se agregaron a un microtubo, las siguientes soluciones: 10 μL de OTA 12,5 μM preparado en buffer de OTA 1X pH 8,5 (10 mM Tris, 120 mM NaCl, 20 mM CaCl2, 5 mM KCl), un volumen calculado de esferas (AuNES@PEG-SH_2 o AuNES@PEG-SH@APT), de tal manera que la concentración final de AuNEs fuera 1,5 nM, 9 μL de buffer de OTA 10x y, finalmente, agua ultrapura hasta completar un volumen de 100 μL. Ambas pruebas se agitaron por 15 minutos, luego el contenido se transfirió a los pocillos de NUNC@HC, de tal manera que en cada pocillo se alternó entre la prueba control y la prueba con AuNEs@PEG-SH@APT. Finalmente se agregaron 3,75 μL de NaCl 4 M y 46,2 μL de agua ultrapura (completando un volumen de 150 μL) y se tomaron las medidas de intensidad de la extinción a 450, 521 y 595 nm de la placa, como lo descrito anteriormente para la hibridación.
3. Resultados
Síntesis, funcionalización y caracterización de las AuNEs con oligonucleótidos específicos.
Se prepararon y se funcionalizaron las AuNEs con PEG-SH y con APT, y se caracterizaron las nanoestructuras siguiendo los métodos descritos previamente. En la figura 2 se muestra el espectro UV-Vis-NIR de las AuNEs sintetizadas (Fig. 2A), una de las micrografías TEM adquiridas (Fig. 2B), y el gráfico de distribuciones de tamaño de al menos 100 partículas analizadas de 17 micrografías (Fig. 2C). Como se puede observar, la longitud de onda de la banda LSPR fue 525 nm y el diámetro aproximado de las nanopartículas fue de 29 ± 2 nm.
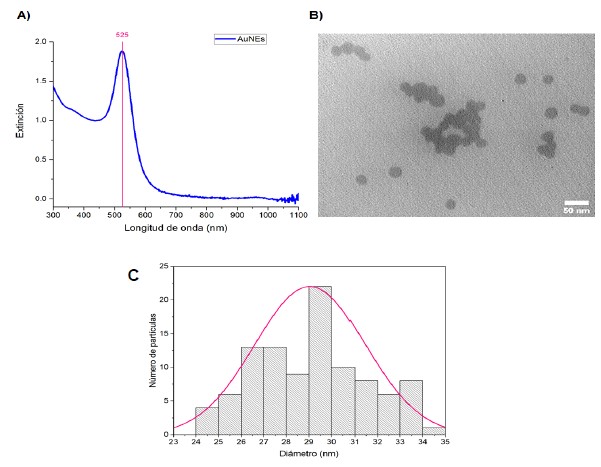
Figura 2. A) Espectro de extinción en el rango UV-Vis-NIR de las AuNEs sintetizadas y normalizado a λ= 450 nm. B) Micrografía TEM de las AuNEs sintetizadas, la escala representa 50 nm. C) Gráfico de distribución de tamaños obtenido para 100 nanoesferas de oro.
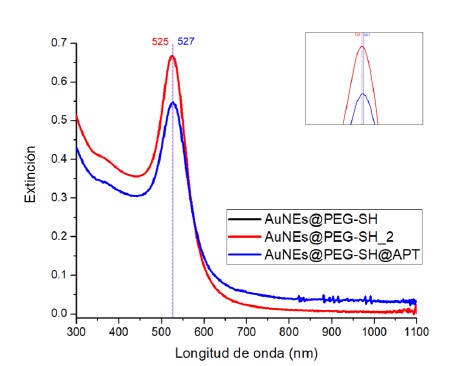
Figura 3. Espectros UV-Vis-NIR de AuNEs sintetizadas, AuNEs@PEG-SH, AuNEs@PEG-SH_2 y AuNEs@PEG-SH@APT. Los espectros de AuNEs@PEG-SH y AuNEs@PEG-SH_2 se encuentran superpuestos. La imagen insertada muestra una ampliación de la zona de la banda plasmónica.
La Figura 3 muestra los espectros UV-Vis-NIR de las AuNEs@PEG-SH, AuNEs@PEG-SH_2 y las AuNEs modificadas con APT (AuNEs@PEG-SH@APT). Como se observa en el cuadro del lado derecho de la figura, el espectro UV-Vis-NIR de las AuNEs@PEG-SH presenta un máximo de banda a 525 nm, mientras que las AuNEs recubiertas con el aptámero presentan un máximo de banda a 527 nm.
Modificación superficial de las microplacas e hibridación de oligonucleótidos
La eficiencia de la modificación superficial de microplacas se evaluó mediante la hibridación de oligonucleótidos, analizando si las hebras del aptámero unidas a las AuNEs interaccionaban con las cadenas complementarias unidas a la microplaca. La interacción entre las hebras de oligonucleótidos fue monitoreada registrando el valor de intensidad del espectro de extinción a 450, 521 y a 595 nm de longitud de onda, para lo cual se utilizó una lectora de microplacas con un filtro a 521 nm, que concuerda con el rango en el que se encuentran los máximos de la banda LSPR de las AuNEs modificadas (525 nm y 527 nm), y dos filtros adicionales a 450 y 595 nm, que monitorean potenciales cambios en la banda LSPR debido a la agregación de AuNEs. Sin embargo, no se observaron cambios representativos que sugieran la formación de agregados, por lo que los valores de extinción a estas longitudes de onda no se muestran en los resultados presentados. Para evaluar la interacción mencionada, en cada ensayo se utilizaron 2 pruebas, la prueba control (AuNEs recubiertas con PEG-SH) y la prueba con AuNEs modificadas (AuNEs@PEG-SH@APT), las cuales se monitorearon al inicio de la hibridación, cada hora (durante 3 horas), al día siguiente y, finalmente, después de la primera lavada con PBS 1X + Tween 40.
Se evaluaron distintos parámetros en el procedimiento de modificación superficial de la microplaca y en la hibridación, tales como la temperatura, las concentraciones de reactivos empleados, la preparación del control, y la concentración de AuNEs modificadas, con el objetivo de encontrar las condiciones óptimas permitieran el desarrollo del sistema de detección de OTA.
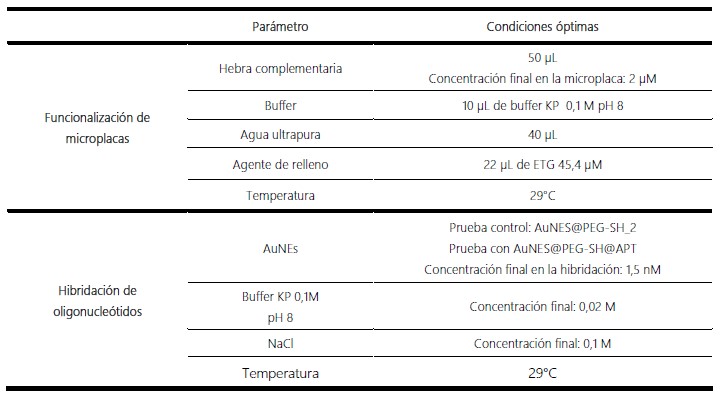
La tabla 1 muestra las condiciones óptimas encontradas para la modificación superficial de microplacas y la hibridación de oligonucleótidos.
Tabla 1. Condiciones óptimas analizadas en la funcionalización de las microplacas NUNC® Immobilizer Amino y en la hibridación de oligonucleótidos.
La figura 4 muestra los resultados de la evaluación del recubrimiento de las AuNEs. Así, la figura 4A muestra las medidas de intensidad a 521 nm, de dos réplicas de la prueba control y dos réplicas de la prueba con AuNEs@PEG-SH@APT, durante todo el tiempo de análisis, siguiendo los parámetros resumidos en la tabla 1, excepto por el tipo de AuNEs de las pruebas control (AuNEs@PEG-SH). Por su parte, la figura 4B muestra los resultados de otro ensayo empleando como control nanoesferas de oro que fueron recubiertas con dos adiciones de PEG tiolado (AuNEs@PEG-SH_2), de tal manera que estas nanopartículas hayan sido expuestas a la misma cantidad de moléculas tioladas que las AuNEs@PEG-SH@APT durante la etapa de funcionalización, y dejando el resto de las condiciones iguales.
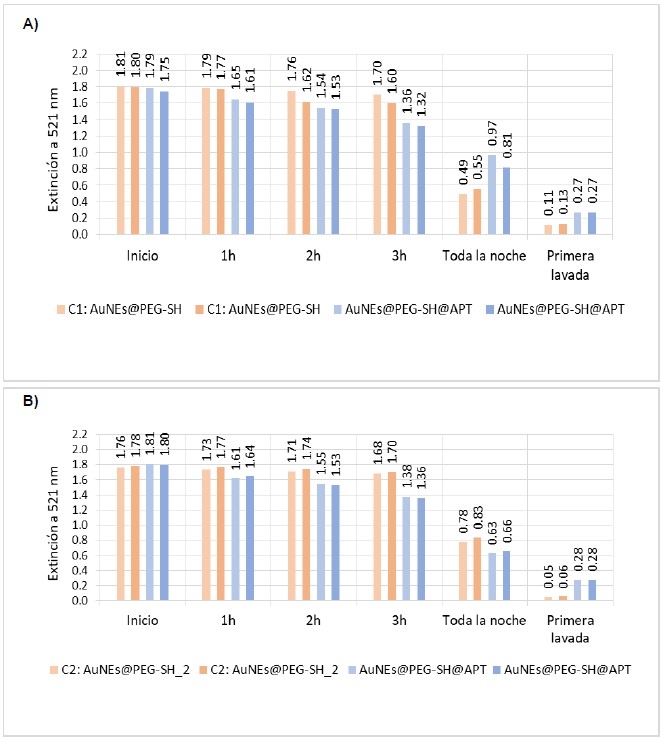
Figura 4. Gráfico de barras los valores de extinción a 521 nm de la microplaca recubierta con [HC] = 2,0 μM, en la cual se empleó diferentes pruebas control. (A) AuNEs@PEG-SH y (B) AuNEs@PEG-SH_2.
Detección de OTA empleando una microplaca modificada superficialmente con HC
Una vez establecidas las condiciones óptimas (tabla 1) para los procesos de modificación superficial de la placa y la hibridación de oligonucleótidos, se realizaron los ensayos de detección de un estándar de OTA siguiendo las mismas condiciones de la figura 4B. En el ensayo de detección se compararon los resultados obtenidos para dos ensayos diferentes realizados en simultáneo y sobre una misma microplaca, el primero en ausencia de OTA (fig. 5A) y el segundo, en presencia de una solución de 12,5 μM de OTA (fig. 5B). La figura 5 muestra los gráficos de barras que representan el cambio en el valor de la extinción monitoreada a 521nm a lo largo del tiempo de análisis.
Estos resultados se presentan para dos réplicas de la prueba control (AuNEs@PEG-SH_2) y dos réplicas de la prueba con AuNEs@PEG-SH@APT.
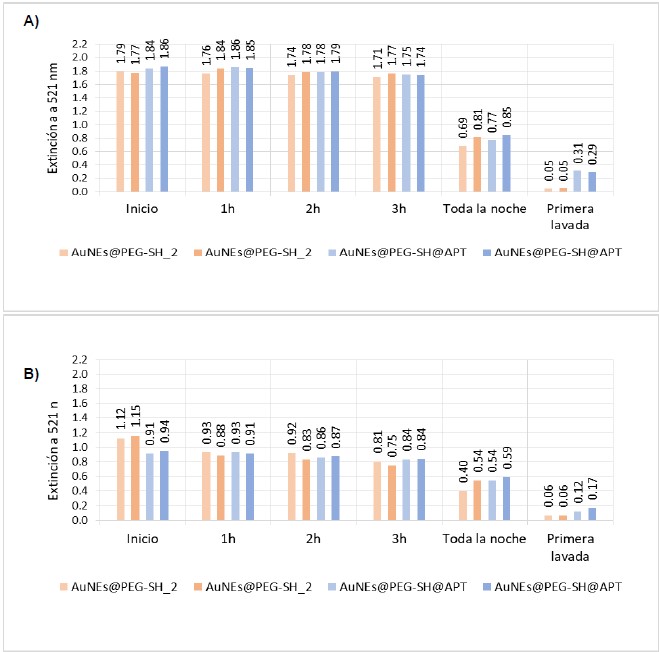
Figura 5. Gráfico de barras para los valores de extinción a 521 nm del ensayo de hibridación empleando NUNC@HC y AuNEs@PEG-SH@APT en ausencia (A) y en presencia (B) de OTA.
4. Discusión
Síntesis, funcionalización y caracterización de las AuNEs con oligonucleótidos específicos
El primer objetivo de este trabajo fue la síntesis de AuNEs, lo cual se llevó a cabo de manera satisfactoria utilizando un método de reducción de una sal de oro con citrato sódico siguiendo una estrategia de nucleación y crecimiento. A continuación, se procedió a la caracterización de las AuNEs preparadas, mediante espectroscopía UV-Vis-NIR y TEM. En el espectro UV-Vis-NIR mostrado en la figura 2A se aprecia que la longitud de onda de la banda LSPR fue 525 nm, mientras que la micrografía de la figura 2B muestra la forma esférica y la monodispersidad de las mismas. A partir de las micrografías obtenidas y el análisis de 100 nanopartículas se pudo calcular también el tamaño promedio (diámetro de 29 ± 2 nm), lo cual concuerda con lo esperado.
Otro de los objetivos del trabajo, fue la modificación superficial de las AuNEs con PEG-SH y el aptámero de OTA (APT). La modificación superficial se llevó a cabo en varias etapas, comenzando con el recubrimiento de las AuNEs con PEG-SH con el objetivo de aumentar su estabilidad antes de la funcionalización con los oligonucleótidos, además, de evitar la adsorción inespecífica de otros compuestos sobre las nanopartículas (Saha et al., 2012; Her et al., 2017; Sanz et al., 2012). Una vez modificada la superficie con PEG-SH, las AuNEs se funcionalizaron con el oligonucleótido tiolado APT, aprovechando, una vez más, la buena interacción entre el oro y el azufre presente en estos compuestos (Saha et al., 2012; Her et al., 2017).
Para minimizar las repulsiones propias de las cadenas de la estructura de los oligonucleótidos, se añadió un agente tensioactivo (SDS) y NaCl. La adición de esta sal durante la funcionalización se hizo de forma progresiva para mejorar la unión del oligonucleótido sobre la nanopartícula (Hurst et al., 2006) sin comprometer su estabilidad por el aumento de la fuerza iónica. Por otro lado, el proceso se llevó a cabo en buffer de fosfato, ya que se ha reportado que su uso también maximiza la unión con las AuNEs (Hurst et al., 2006). Cabe mencionar que la sonicación después de cada adición de NaCl ayuda a reducir la interacción entre las hebras de los oligonucleótidos y la superficie del oro, y promover que las hebras se unan únicamente por el tiol y se mantengan extendidas (Hurst et al., 2006). El cálculo de concentraciones de AuNEs para todos los ensayos se realizó en base a los valores del diámetro estimado de las AuNEs y el coeficiente de extinción molar a 450 nm, de ese tamaño, reportado en la literatura (Haiss et al., 2007).
En la figura 3 se muestran los espectros UV-Vis-NIR de las AuNEs modificadas donde los espectros superpuestos en negro y rojo corresponden a las AuNEs recubiertas parcialmente con PEG-SH (AuNEs@PEG-SH) y las AuNEs con una segunda adición de cadenas de PEG-SH con respecto al caso anterior (AuNEs@PEG-SH_2). Tal y como se indica en la metodología, se procedió con un recubrimiento en dos etapas, donde se buscó que las AuNEs estuvieran expuestas a la misma cantidad de moléculas tioladas que en el caso de las AuNEs recubiertas con APT (AuNEs@PEG-SH@APT), por lo que se utilizó la misma cantidad de cadenas de PEG-SH que de aptámero en la segunda adición, para que así todas las muestras se encontraran en las mismas condiciones en el ensayo de hibridación. Ambos tipos de AuNEs (AuNEs@PEG-SH y AuNEs@PEG-SH_2) fueron empleadas y analizadas en las pruebas control para los ensayos de modificación superficial de la microplaca e hibridación de oligonucleótidos lo que permitió poder estudiar el efecto de esta mencionada mayor presencia de cadenas de PEG, en la reducción de interacciones inespecíficas. Como se observa en la figura 3, los espectros de ambas muestras control, que solo contienen PEG, presentan una banda LSPR centrada a 525 nm, lo cual evidencia que el recubrimiento adicional con PEG-SH no genera mayor diferencia espectral. Por otro lado, el espectro en azul corresponde a las AuNEs@PEG-SH@APT, y como se muestra en la figura 3 la longitud de onda de la banda LSPR se encuentra a 527 nm. Este desplazamiento de 2 nm hacia el infrarrojo en comparación a las AuNEs recubiertas con PEG-SH sugiere que ha existido un cambio significativo en el entorno de las AuNEs, por tanto, confirma que el procedimiento realizado para la funcionalización de AuNEs fue efectivo.
Modificación superficial de las microplacas e hibridación de oligonucleótidos
La modificación superficial de microplacas NUNC® Immobilizer Amino con la hebra complementaria se evaluó mediante la hibridación posterior entre las cadenas de este oligonucleótido y las cadenas de las AuNEs@PEG-SH@APT, conforme a lo descrito previamente. Se esperaba que después de la primera lavada (tras retirar todas las AuNEs que no hubieran interaccionado de manera selectiva), se registrasen valores de intensidad más altos en el caso de las pruebas con AuNEs@PEG-SH@APT (debido a la hibridación) y menores en las pruebas control (debido, precisamente, a esa falta de especificidad) a 521 nm. Los valores mínimos de intensidad en las pruebas control, descartaron la posibilidad de que gran parte de las AuNEs añadidas a la microplaca se hubieran adsorbido inespecíficamente y aseguraron que las AuNEs@PEG-SH@APT añadidas se adherían a la microplaca por complementariedad entre el APT y la HC.
A partir de la comparación de los resultados de los ensayos mostrados en la figura 4, se obtuvo que conforme pasa el tiempo, la intensidad de las señales a 521 nm de longitud de onda van disminuyendo debido a la agregación de AuNEs, pero no se aprecia un cambio significativo hasta después de la segunda o tercera hora, en las cuales se ven diferencias apreciables entre las pruebas control y las pruebas con AuNEs@PEG-SH@APT.
Aunque los valores de intensidad para las pruebas con AuNEs@PEG-SH@APT en ambos ensayos (fig. 4A y 4B) son bastante cercanos, lo que confirma el éxito de la modificación superficial de la placa y de la hibridación de los APT con HC en los dos experimentos, es apreciable la disminución de los valores de intensidad para las muestras control del ensayo de la figura 4B (0,05-0,06) respecto del ensayo de la figura 4A (0,11-0,13). Los resultados obtenidos en este último caso para la prueba control, confirman la presencia de un mayor número de moléculas tioladas unidas a la superficie de las AuNEs, lo cual las hace más estables y menos susceptibles a interacciones inespecíficas en comparación al control empleado en el ensayo mostrado en 4A. Por tal motivo, se decidió emplear el control usado en este ensayo junto con las condiciones optimizadas (tabla 1) para el ensayo de detección de OTA.
Detección de OTA empleando una microplaca modificada superficialmente con HC
Finalmente, se evaluó la detección de una solución estándar de 12,5 μM (336 ppb) de OTA empleando el sistema descrito en los ensayos de modificación de microplacas e hibridación de oligonucleótidos. Los resultados mostrados para los ensayos en ausencia y presencia de OTA, muestran que en el caso de la figura 5A, al llevar a cabo el ensayo en ausencia de micotoxina, los valores de extinción después de la primera lavada evidencian la hibridación de los oligonucleótidos para el caso de las pruebas con AuNEs@PEG-SH@APT, ya que se obtuvieron valores aceptables de las intensidades a 521 nm (0,28-0,31). Estos resultados concuerdan con lo esperado, ya que en ausencia de OTA, se espera la hibridación de los oligonucleótidos (APT de las AuNEs y HC de la microplaca).
Por otro lado, en el caso de la figura 5B se presentan los resultados para el ensayo en presencia de micotoxina, los cuales muestran que los valores de extinción de las pruebas con AuNEs@PEG-SH@APT son menores que en el ensayo sin OTA. Esto se debe a que, en comparación al ensayo en ausencia de la toxina, la hibridación se ve mayormente impedida debido a que las cadenas del aptámero de OTA se encuentran ahora unidas a la micotoxina y no pueden interactuar con las hebras complementarias. Adicionalmente al análisis de intensidad a 521 nm, también se monitorearon los posibles cambios de intensidad a 450 y 595 nm, pues un incremento en los valores a estas longitudes de onda podría sugerir el desplazamiento de la banda LSPR debido a la formación de agregados. Estos valores no se mostraron como parte de los resultados ya que mostraron cambios representativos, al igual como se mencionó en la sección 3.2, lo cual implica que no se presenta agregación sino un menor número de nanopartículas presentes en la microplaca luego de la primera lavada. Los resultados mostrados en los ensayos de detección permitieron demostrar que es posible discriminar de manera muy sencilla la presencia y ausencia de 12,5 μM (336 ppb) de OTA empleando el sistema desarrollado y que los cambios no son resultado de la posible formación de agregados de AuNEs.
5. Conclusiones
Se sintetizaron nanoesferas de oro (AuNEs) de 29 ± 2 nm de diámetro y se logró modificar su superficie con un aptámero tiolado selectivo a OTA (APT) y material de relleno como PEG-SH, y optimizar las condiciones para dicha funcionalización. Además, se realizó la caracterización de las AuNEs por espectroscopía UV-Vis-NIR y TEM. Mediante el análisis de los valores de intensidad de los espectros de extinción a 521 nm de longitud de onda, se evaluó la influencia del doble recubrimiento con PEG-SH para las pruebas control y la influencia de la concentración de AuNEs modificadas con aptámeros, asimismo se determinaron los parámetros óptimos para la modificación superficial de microplacas con HC y la hibridación de oligonucleótidos que detectan la presencia de OTA. Los valores de intensidad de los espectros de extinción a 521 nm en los ensayos de hibridación para las pruebas control fueron mínimos en comparación a los valores para las pruebas con AuNEs@PEG-SH@APT, por lo que se descartó la posibilidad de que gran parte de las AuNEs añadidas a la microplaca se hubieran adsorbido inespecíficamente, asegurando la eficacia de la modificación superficial de las microplacas y la hibridación de oligonucleótidos.
Finalmente, empleando el sistema basado en las microplacas modificadas con HC y AuNEs@PEG-SH@APT, se logró discriminar la presencia y ausencia de una solución estándar de OTA (336 ppb). Se espera que los avances mostrados en este trabajo puedan contribuir a la implementación de un sistema cuantitativo que permita la detección de diversas micotoxinas.
6. Agradecimientos
Este trabajo fue financiado por la Dirección de Gestión de la investigación de la PUCP (PAIP 2019 y CAP2017-431) y el Programa Nacional de Innovación Agraria (N°021-2016-INIA-PNIA/UPMSI/IE).
7. Contribución de los autores
El presente trabajo formó parte de la tesis para obtener el grado de Magíster en Química de Angeline Saldaña.
Bach. Angeline Saldaña: Trabajo experimental y redacción del manuscrito.
Dra. Yulán Hernández: Guía en el trabajo experimental, colaboración en la redacción y revisión del manuscrito.
Dra. Betty Galarreta: Asesora de la tesis, colaboración en la redacción y revisión del manuscrito.
8. Conflicto de intereses
Los autores declaran no tener conflicto de interés.
9. Referencias Bibliográficas
Arroyo-Manzanares, N., Huertas-Pérez, J. F., García-Campaña, A. M., Gámiz-Gracia, L. (2014). Simple methodology for the determination of mycotoxins in pseudocereals, spelt and rice. Food Control, 36(1), 94–101.
Bastús, N. G., Comenge, J., Puntes, V. (2011). Kinetically controlled seeded growth synthesis of citrate stabilized gold nanoparticles of up to 200 nm: Size focusing versus ostwald ripening. Langmuir, 27(17), 11098–11105.
Bennett, J. W., y Klich, M. (2003). Mycotoxins. Society, 16(3), 497–516.
Bunka, D. H. J., y Stockley, P. G. (2006). Aptamers come of age - At last. Nature Reviews Microbiology, 4(8), 588–596.
Farahi, R. H., Passian, A., Tetard, L., Thundat, T. (2012). Critical issues in sensor science to aid food and water safety. ACS Nano, 6(6), 4548–4556.
Frens, G. (1973). Controlled nucletion for the regulation of the particle size in monodisperse gold suspensions. Nature Physical Science, 241(105), 20–22.
Galarreta, B. C., Tabatabaei, M., Guieu, V., Peyrin, E., Lagugné-Labarthet, F. (2013). Microfluidic channel with embedded SERS 2D platform for the aptamer detection of ochratoxin A. Analytical and Bioanalytical Chemistry, 405(5), 1613–1621.
Guo, X., Wen, F., Zheng, N., Luo, Q., Wang, H., Wang, H., Li, S., Wang, J. (2014). Development of an ultrasensitive aptasensor for the detection of aflatoxin B1. Biosensors and Bioelectronics, 56, 340–344.
Haiss, W., Thanh, N. T. K., Aveyard, J., Fernig, D. G. (2007). Determination of size and concentration of gold nanoparticles from UV-Vis spectra. Analytical Chemistry, 79(11), 4215–4221.
Halas, N. J., Lal, S., Chang, W.-S., Link, S., Nordlander, P. (2011). Plasmons in Strongly Coupled Metallic Nanostructures. Chemical Reviews, 111(6), 3913–3961.
Her, S., Jaffray, D. A., Allen, C. (2017). Gold nanoparticles for applications in cancer radiotherapy: Mechanisms and recent advancements. Advanced Drug Delivery Reviews, 109, 84–101.
Hernández, Y., Coello, Y., Fratila, R. M., de la Fuente, J. M., Lionberger, T. A. (2017). Highly sensitive ratiometric quantification of cyanide in water with gold nanoparticles via Resonance Rayleigh Scattering. Talanta, 167, 51–58.
Hernández, Y., Lagos, L. K., Galarreta, B. C. (2020). Development of a label-free-SERS gold nanoaptasensor for the accessible determination of ochratoxin A. Sensing and Bio-Sensing Research, 28, 100331.
Hurst, S. J., Lytton-Jean, A. K. R., Mirkin, C. A. (2006). Maximizing DNA loading on a range of gold nanoparticle sizes. Analytical Chemistry, 78(24), 8313–8318.
Mirkin, C. A., Letsinger, R. L., Mucic, R. C., Storhoff, J.J. (1996) A DNA-based method for rationally assembling nanoparticles into macroscopic materials. Nature, 382 (6592), 607-609.
Nielsen, K. F., Ngemela, A. F., Jensen, L. B., De Medeiros, L. S., Rasmussen, P. H. (2015). UHPLC-MS/MS determination of ochratoxin a and fumonisins in coffee using QuEChERS extraction combined with mixed-mode SPE purification. Journal of Agricultural and Food Chemistry, 63(3), 1029–1034.
Saha, K., Agasti, S. S., Kim, C., Li, X., Rotello, V. M. (2012). Gold Nanoparticles in Chemical and Biological Sensing. Chemical Reviews, 112(5), 2739–2779.
Sanz, V., Conde, J., Hernández, Y., Baptista, P. V., Ibarra, M. R., De La Fuente, J. M. (2012). Effect of PEG biofunctional spacers and TAT peptide on dsRNA loading on gold nanoparticles. Journal of Nanoparticle Research, 14(6).
SENASA. (2017). Informe del monitoreo de residuos químicos y otros contaminantes en alimentos agropecuarios primarios. 1–132.
Turkevich, J., Stevenson, P. C., Hillier, J. (1951). A study of the nucleation and growth processes in the synthesis of colloidal gold. Discussions of the Faraday Society, 11(c), 55–75.
Turner, N. W., Subrahmanyam, S., Piletsky, S. A. (2009). Analytical methods for determination of mycotoxins: A review. Analytica Chimica Acta, 632(2), 168–180.
Wu, S., Duan, N., Zhu, C., Ma, X., Wang, M., Wang, Z. (2011). Magnetic nanobead-based immunoassay for the simultaneous detection of aflatoxin B 1 and ochratoxin A using upconversion nanoparticles as multicolor labels. Biosensors and Bioelectronics, 30(1), 35–42.
Zhao, J., Zhang, X., Yonzon, C. R., Hoes, A. J., & Van Duyne, R. P. (2006). Localized surface plasmon resonance biosensors. Nanomedicine, 1(2), 219–228.
Zinedine, A., y Mañes, J. (2009). Occurrence and legislation of mycotoxins in food and feed from Morocco. Food Control, 20(4), 334–344.