DISEÑO Y CONSTRUCCIÓN DE UN BIORREACTOR BATCH TIPO TANQUE AGITADO Y AIREADO PARA LA PRODUCCIÓN DE PROTEÍNA UNICELULAR
DESIGN AND CONSTRUCTION OF AN AGITATED AND AERATED TANK-TYPE BATCH BIOREACTOR FOR THE PRODUCTION OF UNICELLULAR PROTEIN
Luis Arturo Gil Ramírez 1; Carlos Alberto León Torres 1
1 Universidad Nacional de Trujillo, Av. Juan Pablo II s/n Urbanización San Andrés, Trujillo, Perú
Carlos Alberto León Torres:
Artículo original:
Recibido: 20 de enero 2021
Aceptado: 30 de mayo 2021
Resumen
El presente trabajo de investigación tiene como objetivo diseñar y construir un biorreactor batch tipo tanque agitado y aireado con capacidad de un litro para la producción de proteína unicelular. Para su diseño y construcción se empleó un software que genera las especificaciones ideales para este tipo de trabajo, materiales y accesorios fácilmente manipulables y esterilizables a base de vidrio, tapones de caucho para uso químico y mangueras de plástico, el sistema de agitación se construyó con materiales de acero inoxidable más la adición de un motor de paso de 12 V. El biorreactor construido garantiza la esterilidad del sistema, una buena transferencia de oxígeno, calor y masa, al mismo tiempo que genera un mezclado uniforme tanto de la suspensión celular como del caldo fermentativo. Este tipo de biorreactor se diseñó con el propósito de generar las condiciones ideales para el crecimiento de ciertos microorganismos, los cuales usan algunos desechos industriales como su principal fuente de nutrición.
Palabras claves: biorreactor, construcción, diseño, proteína unicelular, tanque agitado.
Abstract
The objective of this research is to desing and built a stirred and aerated tank-type batch bioreactor with a capacity of one liter for the production of unicellular protein. For the construction of this biorreactor it used a specific software according to the glass model specifications, rubber stoppers for chemical use and plastic hoses. The agitation system was built with stainless steel materials plus the addition of a 12 V step motor guarantees sterilization in the whole system, a good transfer of oxygen, heat and cellular mass, also it makes a homogenous mix of the the cell suspension and the fermentation broth. This type of bioreactor was designed with the purpose of generating ideal conditions for the growth of certain microorganisms, which use some industrial waste as their main source of nutrition.
Keywords: bioreactor, building, design, unicellular protein, stirred tank.
* Autor para correspondencia: E. mail: larturo0208@gmail.com
DOI: http://dx.doi.org/10.17268/rebiol.2021.41.01.02
Citar como:
Gil, L., & León, C. 2021. Diseño y construcción de un biorreactor batch tipo tanque agitado y aireado para la producción de proteína unicelular. REBIOL, 41(1):16-22.
1. Introducción
Un biorreactor es un recipiente o sistema que mantiene un ambiente biológicamente activo en el cual se realizará un proceso bioquímico que involucra organismos o sustancias activas, estos biorreactores son comúnmente cilíndricos y se pueden encontrar en diferentes proporciones, pequeños desde unos pocos centímetros que generalmente se trabajan a escala de laboratorio u otros muy grandes y complejos fabricados usualmente de acero inoxidable empleados a escala industrial (Serrat & Méndez, 2015).
El biorreactor es la estructura fundamental de todo proceso bioquímico, el cual diseñado debidamente es capaz de suministrar y conservar las condiciones ambientales adecuadas para la transformación óptima de las materias primas y la generación de los futuros productos (Ruíz et al., 2007). Durante este proceso comienzan a surgir algunas variables importantes como la temperatura, el pH, oxígeno, la intensidad de agitación, entre otras, las cuales deben ser monitoreadas con el fin de obtener el producto deseado (Serrat & Méndez, 2015).
Cada biorreactor posee diferentes estructuras, sin embargo, a pesar de la variación de sus diseños comparten algunos elementos como paletas, placas deflectoras y sensores que permiten monitorear la temperatura, velocidad de agitación, viscosidad del medio, flujo y concentración de gases, espuma, pH, oxígeno disuelto y CO2 (Castells, 2012).
Existe una gran variedad de biorreactores los cuales son empleados en distintos procesos biotecnológicos, entre estos sistemas se pueden diferenciar dos grupos, uno de ellos son los biorreactores tubulares y los biorreactores tipo tanque, estos últimos son los más utilizados a escala de laboratorio y en procesos industriales. Existen ciertas diferencias geométricas en los sistemas tipo tanque entre los cuales podemos resaltar el diseño de sus agitadores, el número de agitadores, la distancia entre los impulsores y la relación que tiene el diámetro respecto a la altura del tanque (Ruíz et al., 2007).
Los biorreactores también se pueden clasificar dependiendo del tipo de sistema operacional, entre los cuales se encuentran los de tipo batch o discontinuos, estos sistemas trabajan con una disolución en donde se tienen los nutrientes esenciales para el crecimiento y desarrollo de los microorganismos, esta etapa se inicia agregando una cantidad de microorganismos conocida, a medida que el proceso va avanzado, la cantidad de microorganismos, nutrientes y el producto va tomando diversos valores; el proceso termina cuando el sustrato es consumido por los microrganismos. Entre las principales ventajas de estos biorreactores destaca el mínimo riesgo de contaminación y un costo mínimo para su fabricación (Ertola et al., 1994). Los biorreactores fed-batch o semi-continuos operan de manera similar a los de tipo batch, en donde al biorreactor se le adiciona una solución rica en nutrientes y luego de ello se inocula cierta concentración de microrganismos, al inicio de este proceso hay un determinado tiempo de latencia o adaptación del medio en donde no hay generación de producto, ya cuando esta etapa ha alcanzado su nivel máximo, se sustituye un volumen conocido del biorreactor y se reemplaza por otro con la misma cantidad de nutrientes que hubo al inicio, de esta forma el nuevo proceso parte desde la fase de crecimiento exponencial de los microorganismos y se enriquece el medio con nuevos nutrientes. Una de las ventajas de estos sistemas es que permite erradicar tiempos muertos en la etapa de producción (Abbott et al., 2013) y los biorreactores de sistemas continuos que trabajan con una disolución rica en nutrientes, a la cual se agrega una cantidad conocida de microorganismos; este tipo de biorreactores se caracteriza porque pueden trabajar en serie y entre sus principales beneficios que nos ofrece este sistema es el crecimiento controlado y constante de los microorganismo (Ravishankar, 2015).
Otra forma de clasificar a los biorreactores es dependiendo del tipo de agitación, entre ellos se encuentran los biorreactores de columna, compuestos por un recipiente cilíndrico el cual presenta un expulsor y dispensadores de gas en la parte inferior del sistema con el fin de garantizar la correcta homogenización de la mezcla (Ruíz et al., 2007) y los biorreactores tipo tanque agitado los cuales se diferencian por poseer un eje transmisor de potencia, el cual está conectado a un motor, que se encarga de transmitir esa misma fuerza hacia las hojas o aspas, y por la presencia de un impulsor el cual se encarga de distribuir la potencia a todo el volumen del fluido y minimizar la turbulencia en el medio, el uso más aceptable para estos sistemas es la turbina Rushton debido al alto perfil hidrodinámico que esta posee (Raffo et al., 2014). Este tipo de biorreactor nació hace más de 50 años con el propósito de luchar con muchas limitaciones y se han ido perfeccionando en busca de un control más preciso de los ambientes de desarrollo de cultivos vivos, estableciéndose como un estándar en la industria biotecnológica (Najafpour, 2015).
El término proteína unicelular (PUC) se usa para referirse a aquella biomasa obtenida de microorganismos como bacterias, levaduras, algas y hongos filamentosos; rica en altas concentraciones proteicas ; los cuales son empleados para la alimentación humana o animal (Ramírez, 2012), por medio del aprovechamiento de sustratos económicos compuestos por o enriquecidos con fuentes carbonadas, nitrogenadas y fosfatadas; esta producción de PUC se propone como una alternativa de solución para mejorar el contenido nutricional en la alimentación humana y animal (FAO, 2011; Ferrer et al., 2004).
Conociendo la gran importancia, utilidad y el costo que los diferentes biorreactores actualmente tienen en el mercado y tomando en cuenta el valor actual de los desechos orgánicos, la presente investigación tiene como objetivo diseñar y construir un biorreactor batch tipo tanque agitado y aireado con materiales y accesorios asequibles que garanticen la esterilidad del biorreactor. Este sistema se plantea como una alternativa biotecnológica, orientada a proporcionar las condiciones ideales para el crecimiento y desarrollo de cultivos microbiológicos dependientes de oxígeno que usan desechos industriales como su principal fuente de nutrición para la producción de proteína unicelular.
2. Materiales y Métodos
Materiales
Componentes y accesorios de vidrio, tapones de caucho, mangueras de plástico y accesorios de acero inoxidable.
Diseño del biorreactor batch tipo tanque agitado y aireado para la producción de proteína unicelular
Para el diseño se ha considerado los criterios técnicos y operacionales ideales para el funcionamiento correcto del biorreactor, estas consideraciones se estiman a partir de un software para diseños y escalamientos de biorreactores tipo tanque agitado; las variables a tomar en cuenta fueron las siguientes: altura, diámetro y volumen del biorreactor, volumen de trabajo, altura del líquido, ancho y altura del bafle, diámetro de la turbina, diámetro del disco de la turbina, ancho y altura de la paleta, distancia de fondo de la turbina hacia la base del tanque, eficiencia del motor, velocidad del agitador, densidad de la disolución y el flujo de aire (Singh et al., 2014).
Capacidad de Mezclado
Para la evaluación de la eficiencia del mezclado dentro del biorreactor se empleó sulfato de bario (BaSO4) como soluto, el cual se obtuvo al mezclar las soluciones de cloruro de bario (BaCl2) y sulfato de sodio (Na2SO4) a 0,29 mol.L-1 en las mismas proporciones (Serrat & Méndez, 2015), tras la formación del BaSO4 este fue agregado a 700 mL de agua estéril dentro del biorreactor, posterior a ello se procede a poner en funcionamiento el sistema a 600 rpm, con un flujo de aire de 3 L/min a una temperatura de 23 °C.
Tanque del biorreactor
Se empleó una botella de vidrio de fondo redondo provisto de una sola boca con 1 L de capacidad y de 700 mL de capacidad de trabajo, 16 cm de altura, 10 cm de base y 10 cm de diámetro, la cual fue previamente cortada de forma horizontal; posterior a ello se insertaron en el interior del vaso cuatro buflles de vidrio con el fin de evitar el efecto vórtice dentro del sistema; sus dimensiones fueron de 10 cm de altura y 1 cm de ancho, estos componentes de vidrio se alinearon de manera equidistante. Luego de ello se adaptó una tapa a presión hecha de jebe de microporoso de 2 plg, a este material se le hizo una abertura de 1 cm de diámetro para poder adaptarle un tubo de acero inoxidable del mismo diámetro con una altura de 9 cm, permitiendo así la salida de los gases producidos dentro del sistema.
Sistema de agitación
Este sistema se estableció por medio de un motor de paso (PAP) de 12 V, a este dispositivo se acopló una varilla de acero inoxidable de 12 cm de altura, la cual se ajusta a una turbina Rushton de siete paletas, donde esta última se encuentra a 3 cm de la pared del vaso. Se añadió un tapón de goma (que previamente fue adaptado para que pueda encajar con la boca más grande del envase de vidrio) de manera que sirva de base para el motor, así como también para proporcionar una buena estabilidad y movimiento adecuado dentro del biorreactor.
Sistema de aireación
Se contó con un motor aireador que presenta un flujo de aire de 3 L/min el cual se conectó con una manguera de 0,6 cm de diámetro con uno de los dos tubos de vidrio de 11 cm de altura y 0,7 cm de diámetro, dichos canales forman parte de un depósito de vidrio con capacidad de 300 mL. El aire suministrado por el motor aireador atraviesa una solución de metalbisulfito de sodio al 1 %, ascendiendo por el segundo tubo de vidrio, este conducto está unido con una segunda manguera de plástico de 0,6 cm de diámetro, esta a su vez se conecta al biorreactor por medio de unos canales formados por materiales de plástico, una tapa de jebe de microporoso y una piedra difusora de aire, de esta manera se lleva aire estéril en pequeñas burbujas de menor tamaño hacia el sistema.
Esterilidad del Sistema
El material de vidrio y de acero inoxidable se esterilizó en el autoclave a una temperatura de 121 ºC, por un tiempo de 15 min, luego de ello se dejó enfriar estos materiales a temperatura ambiente, los accesorios restantes fueron tratados con una solución de hipoclorito de sodio al 0,25.% por un tiempo de 48 horas, posteriormente se trataron con fenol al 3 % por un tiempo de 15 min, luego con etanol al 70 % por 15 min, se enjugaron con agua estéril y se llevaron a la cámara ultravioleta (UV) por un tiempo de 15 min. Seguidamente se ensamblaron todos los materiales y accesorios del biorreactor, se agregó 700 mL de caldo nutritivo al biorreactor y se puso en funcionamiento todo el sistema a 600 rpm, con un flujo de aire de 3 L/min a una temperatura de 23 °C. Se dispuso cuatro puntos de muestreo para el control de esterilidad a las 0, 8, 16 y 24 horas, en donde se extrajo 20 mL de la disolución del interior del biorreactor a través del sistema de toma de muestra, la primera toma, en la hora cero, se realizó 10 min después del funcionamiento del sistema con el propósito de verificar la eficiencia del proceso de esterilización de todos los componentes del biorreactor, las muestras obtenidas se sembraron (10 μL) en placas Petri que contenían agar Sabouraud, todas estas siembras se realizaron por triplicado y se incubaron por 48 horas a una temperatura de 23 °C.
3. Resultados
Se logró diseñar y construir un biorreactor batch tipo tanque agitado y aireado para la producción de proteína unicelular.
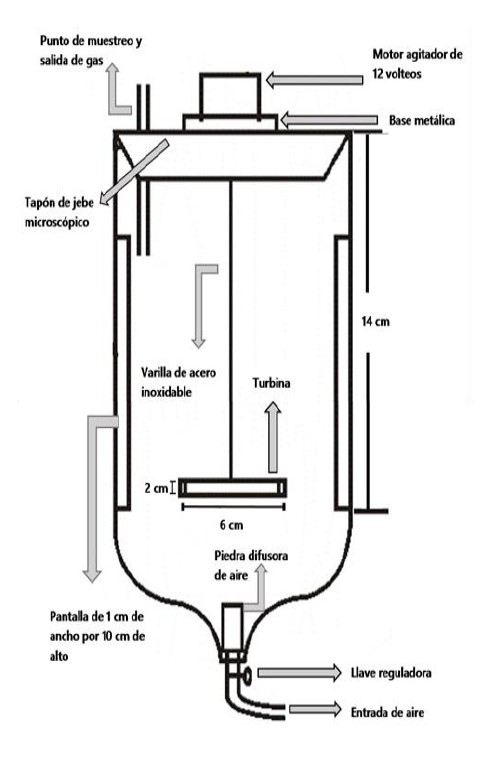
Figura 1. Diseño de un biorreactor batch tipo tanque agitado y aireado para la producción de proteína unicelular.

Figura 2. Características del diseño del biorreactor batch tipo tanque agitado y aireado construido con componentes básicos y dispositivos auxiliares
4. Discusión
El diseño del biorreactor batch tipo tanque agitado y aireado para la producción de proteína unicelular se realizó a través de un software con el fin de obtener las dimensiones ideales tanto del tanque como de los accesorios para su construcción y futuro funcionamiento.
En la figura 1 se muestra el diseño, dicho bosquejo presenta un volumen total de un 1 L, el área de desgasificado y toma de temperatura, la cual está conformado por un tubo de acero inoxidable de un 1 cm de diámetro y de una altura de 9 cm acoplado a la tapa de jebe de microporoso de 2 plg en la parte superior del sistema, los cuatro bafles de 10 cm de altura y 1 cm de ancho fueron ensamblados en las paredes internas del biorreactor a una distancia de 14 cm desde la base del bafle hasta la superficie del biorreactor, estos materiales de vidrio equidistan entre sí a una distancia de 8 cm. El sistema de agitación está constituido por un motor de paso de 12 V, una varilla de acero inoxidable de 12 cm de altura y una turbina Rushton de siete paletas; para el suministro de aire se usó un compresor que cuenta con un flujo de aire de 3 L/min, este sistema de aireación está acoplado a la parte inferior del biorreactor por medio de canales de materiales de plástico, una tapa de jebe de microporoso y una piedra difusora de aire (Serrat & Méndez, 2015).
La agitación es el proceso mecánico que genera un flujo dentro del biorreactor cuyo objetivo principal es homogenizar los compuestos inmersos dentro del sistema; así también se encarga de proporcionar una buena transferencia de oxígeno, garantizar el suministro adecuado de nutrientes, generar una buena transferencia de calor y masa evitando la sedimentación de las partículas en disolución (Zlokarnik, 1999). El sistema de agitación compuesto por una turbina Rushton de siete paletas acoplada a la varilla de acero inoxidable de 12 cm de altura conectada al motor de paso (PAP) de 12 V, empleado en la siguiente investigación produjo un buen homogenizado dentro del sistema, desplazando la disolución hacia las paredes del tanque generando diversos modelos de circulación; uno de ellos produjo un flujo desde la parte inferior del biorreactor hasta retornar hacia la parte central del elemento móvil de la turbina, mientras que el otro modelo de circulación se eleva hacia la superficie y regresa al mismo punto del primer flujo, estas corrientes favorecen una buena dispersión del gas dentro del sistema, generando la formación de burbujas más finas y uniformes (Gelves et al., 2013).
Los bafles o deflectores son estructuras fabricadas de acero inoxidable o de vidrio; tienen como función principal disminuir la turbulencia generada por las palas u hojas de los impulsores, evitar la formación de remolinos y mejorar la eficiencia del mezclado (García & Jáuregui, 2006). Los cuatro buflles de vidrio de 10 cm de altura y 1 cm de ancho ensamblados de manera equidistante dentro del biorreactor generaron flujos con orientaciones radiales y axiales produciendo una mejor turbulencia y agitación en el medio (Paul et al., 2004).
El sistema de aireación proporciona una adecuada transferencia de masas entre la fase gaseosa y líquida del medio, siempre y cuando se halla implementado un sistema eficiente de aireación. Los sistemas de microdispersión de gas son muy empleados, ya que brindan una alta trasferencia de masa y son sencillos de manejar (Ge et al., 2006). El oxígeno suministrado es uno de los sustratos esenciales en los procesos metabólicos de las células dependientes de oxígeno, esta molécula influye de manera directa en el crecimiento y desarrollo de las células (Keira et al., 2004). El sistema de aireación de la presente investigación cuenta con un flujo de aire de 3 L/min, este aire previamente esterilizado llega hasta la base del biorreactor por canales formados por materiales de plástico, esta mezcla gaseosa antes de tener contacto con la disolución del sistema atraviesa una piedra difusora de aire generando burbujas de 3 mm de diámetro lo cual genera una mayor área superficial de contacto, una disminución en la velocidad de ascenso y una mejor transferencia de oxígeno dentro del sistema (Genck, 2008).
Las pruebas de esterilidad son procedimientos que forman parte del control de calidad microbiológico en los procesos de producción de alimentos y tienen como objetivo demostrar la presencia o ausencia de microorganismos contaminantes en el producto (OMS, 1973). En el presente trabajo no se detectó el crecimiento de ningún tipo de contaminante dentro las placas Petri sembradas para las horas 0, 8, 16 y 24, estos resultados indican que el índice posible de contaminación es inferior a 3 cél. mL-1 según las estadísticas del Número Más Probable (Rice et al., 2017). Los datos obtenidos en la presente investigación asegura la esterilidad de todas las piezas del biorreactor, siempre que el autoclave nos garantice un proceso de esterilización adecuado, los insumos empleados para la higienización de los elementos que no son de acero inoxidable ni de vidrio estén en óptimas condiciones, la cámara UV funcione adecuadamente, se garantice la hermeticidad y el correcto ensamblaje del biorreactor y se tengan las condiciones necesarias para la toma, manipulación y siembra de la muestra (Serrat & Méndez, 2015).
5. Conclusiones
Se diseñó y construyó un biorreactor batch tipo tanque agitado y aireado con capacidad de un litro para la producción de proteína unicelular con instrumentos, así como con accesorios construidos a base de vidrio, tapones de caucho, mangueras de plástico y acero inoxidable garantizando la esterilidad, buena transferencia de oxígeno, calor y masa además de un mezclado uniforme tanto de la suspensión celular como del caldo fermentativo.
6. Agradecimientos
Al Dr. Carlos Alberto León Torres, por facilitarme los equipos, reactivos y el espacio en su laboratorio de investigación docente, así como también, por su asesoría en la presente investigación.
7. Contribución de los autores
L.G.: Construcción del biorreactor y escritura del artículo.
C.L.: Contribución al diseño de experimentación, revisión crítica del contenido del artículo.
8. Conflicto de intereses
Los autores declaran no tener conflicto de interés.
9. Referencias bibliográficas
Abbott, M., Harvey, A., Perez, G. & Theodorou, M. (2013). Biological processing in oscillatory baffled reactors: operation, advantages and potential. Interface Focus, 3(1), 20120036.
Castells, X. (2012). Tratamiento y valorización energética de residuos. Díaz de Santos S.A. Ediciones.
Ertola, R., Yantorno, O., & Mignone, C. (1994). Microbiología Industrial. Organización de los Estados Americanos.
FAO (2011). FAO Food and Nutrition Paper. Food and Agriculture Organization of the United Nations.
Ferrer, J., Davalillo, Y., Chandler, C., Páez, G., Mármol, Z., & Ramones, E. (2004). Producción de proteína microbiana a partir de los desechos del procesamiento de la caña de azúcar (bagacillo). Archivos Latinoamericanos de Producción Animal, 12(2), 59-65.
García, C., & Jáuregui, H. (2006). Hidrodinámica en tanques agitados con turbinas de disco con paletas planas. Revista facultad de ingeniería. 38: 97-113.
Ge, X., Hanson, M., Shen, H., Kostov, Y., Broson, Kurt., Frey, D., Moreira, A., & Rao, G. (2006). Validation of an optical sensor-based high- throughput bioreactor system for mammalian cell culture. Journal of Biotechnology, 122 (3), 293-306.
Gelves, R., Benavides, A., & Quintero, J. (2013). Predicción del comportamiento hidrodinámico en el escalado de un reactor de tanque agitado para procesos aerobios, mediante CFD. Ingeniare. Revista chilena de ingeniería, 21(3), 347-361.
Genck, W. (2008). Perry's Chemical Engineers' Handbook (8ª Ed). McGraw-Hill.
Keira, S., Ferreira, L., Gragnani, A., Duarte, I., Santos, I. (2004). Experimental model for fibroblast culture. Acta Cirurgica Brasileira, 19(1), 11-16.
Najafpour, G. (2015). Biochemical Engineering and Biotechnology (2nd ed.). Elsevier.
Organización Mundial de la Salud. (1973). Serie de informes técnicos N°530: Comité de expertos de la OMS en patrones biológicos. OMS.
Paul, E., Atiemo-Obeng, V., & Kresta, S. (2004). Handbook of industrial mixing: Science and Practice. Jhon Wiley & Sons, INC., Publication.
Raffo, J., Figueredo, A., & Dustet, J. (2014). Características de la hidrodinámica de un biorreactor industrial tipo tanque agitado. Revista Mexicana de Ingeniería Química, 13(3), 823-839.
Ramírez, J. (2012). Aprovechamiento industrial de lactosuero mediante procesos fermentativos. Publicaciones e investigación, 6, 69 – 83.
Ravishankar, V. (Ed.) (2015). Advances in Food Biotechnology. Wiley Blackwell.
Rice, E., Baird, R., & Eaton, L. (Eds). (2017). Standard methods for the examination of water and wastewater. 23rd edition. Washington, D.C.: American Public Health Association.
Ruíz, H., Rodríguez, M., Rodríguez, R., Contreras, J., & Aguilar, C. (2007). Diseño de biorreactores para fermentación en medio sólido. Revista Mexicana de Ingeniería Química, 6(1), 33-40.
Serrat, M., & Méndez, A. (2015). Construcción y validación experimental de un biorreactor artesanal tipo tanque agitado para fermentaciones sumergidas a escala de laboratorio. Tecnología Química, 35 (3), 362-375.
Singh, J., Kaushik, N., & Biswas, S. (2014). Bioreactors-Technology & Design Analysis. The Scitech Journal, 1, 28-36.
Zlokarnik, M. (1999). Rührtechnik: theorie und traxis. Springer.