Artículo Original
CRECIMIENTO Y SUPERVIVENCIA DE POSTLARVAS DEL CAMARÓN DE RÍO Cryphiops caementarius ALIMENTADAS CON DIETAS SUPLEMENTADAS CON PÁPRIKA
GROWTH AND SURVIVAL OF RIVER SHRIMP POSTLARVAS Cryphiops caementarius FEED WITH DIETS SUPPLEMENTED WITH PAPRIKA
Rocío Díaz Mendoza, Lady Díaz Valverde, Walter Reyes-Avalos *
Universidad Nacional del Santa, Perú. Laboratorio de Acuicultura ornamental. Facultad de Ciencias Escuela de Biología en Acuicultura. Av. Universitaria s/n Urbanización Bellamar, Nuevo Chimbote, Ancash, Perú.
* Autor para correspondencia: wreyes@uns.edu.pe
Recibido: 24 de junio 2020 / Aceptado: 9 de noviembre 2020
RESUMEN
El objetivo fue evaluar el crecimiento y supervivencia de postlarvas del camarón de río Cryphiops caementarius alimentadas con dietas suplementadas con páprika. Las postlarvas procedieron del río Lacramarca (Ancash, Perú). El cultivo fue realizado en 12 acuarios (12 L) con agua salobre (12‰) donde fueron sembradas postlarvas a 227 postlarvas m-2. Una dieta basal fue suplementada con harina de páprika (Capsicum annuum) en las proporciones de 0, 200, 250 y 300 mg kg-1. La tasa de alimentación fue del 10% de la biomasa por día. El experimento duró 60 días y se determinaron los parámetros de crecimiento en longitud y peso, así como la supervivencia. El crecimiento en longitud de las postlarvas no fue afectado (p > 0,05) por las dietas con 200 a 300 mg kg-1 de páprika, pero fue diferente con las alimentadas sin páprika. El crecimiento en peso fue mayor (p < 0,05) con 300 mg kg-1 de páprika a los 15 días de cultivo y, a los 30 días, el crecimiento fue mayor (p < 0,05) con 250 y 300 mg kg-1 de páprika. La supervivencia fue alta (95% - 97%) en las postlarvas alimentadas con páprika y de baja (75%) alimentadas sin páprika. El uso de páprika en la dieta tiene efectos benéficos en el crecimiento y supervivencia de las postlarvas de esta especie de camarón.
Palabras claves: Capsicum, suplemento alimenticio, postlarvas, camarón, Cryphiops
ABSTRACT
The aim was to evaluate the growth and survival of postlarvae of river shrimp Cryphiops caementarius fed with diets supplemented with paprika. Postlarvae came from the Lacramarca river (Ancash, Peru). Culture was carried out in 12 aquariums (12 L) with brackish water (12 ‰), where postlarvae (13.50 mm total length) were stocked to 227 postlarvae m-2. A basal diet was supplemented with paprika flour (Capsicum annuum) in the proportions of 0, 200, 250 and 300 mg kg-1. The feeding rate was 10% of the biomass per day. Experiment lasted 60 days and growth parameters in length and weight were determined, as well as survival. Postlarvae growth in length was not affected (p > 0.05) by diets with 200 to 300 mg kg-1 of paprika, but was different with those fed without paprika. Growth in weight was greater (p < 0.05) with 300 mg kg-1 of paprika at 15 days of culture and, at 30 days, growth was greater (p > 0.05) with 250 and 300 mg kg-1 of paprika. Survival was high (95% - 97%) in postlarvae fed paprika and low (75%) fed without paprika. The use of paprika in the diet has beneficial effects on the growth and survival of the postlarvae of this species of shrimp.
Keywords: Capsicum, food supplement, postlarvae, shrimp, Cryphiops
DOI: http://dx.doi.org/10.17268/rebiol.2020.40.02.03
1. INTRODUCCIÓN
El camarón Cryphiops caementarius es una especie endémica de los ríos de la vertiente occidental de los Andes, que se distribuye desde Lambayeque en Perú hasta Valparaíso en Chile (Méndez, 1981; Moscoso, 2012). Esta especie tiene importancia económica y comercial en las zonas donde hay abundancia poblacional, como en los ríos Ocoña, Majes-Camaná, Tambo (Wasiw y Yépez, 2015) y Cañete (Wasiw y Yépez, 2017), cuya extracción de 997 t (PRODUCE, 2018), ingresaron al mercado de Lima principalmente. Algunos estudios con la especie de camarón se refieren a aspectos bio ecológicos (Icochea et al., 1988; Escobar et al., 2017), reproductivos (Reyes et al., 2010; Reyes, 2014) y nutricionales (Cornejo et al., 2015; Terrones y Reyes, 2018; Cabrera et al., 2019), entre otros. La nutrición de los crustáceos es un tema que merece atención y principalmente aquellos insumos que al suplementarse en las dietas coadyuvan con el crecimiento y la supervivencia para permitir el cultivo comercial.
Páprika Capsicum annuum es una planta herbácea, cuyo fruto contiene selenio, zinc y cobre que son cofactores de las enzimas que participan en los procesos de oxidación-reducción de los crustáceos (Carrillo et al., 2000). También poseen mono, di y triglicéridos, ácidos grasos libres, vitamina C y carotenoides como carotenos (ß-caroteno, criptoxantina, etc.) y xantofilas (luteínas, cis-capsantina, trans-capsantina, zeaxantinas, violaxantina) (Fernández, 2007). La capsantina y la capsorrubina son los principales carotenoides de C. annum que representa más del 60% del total de los carotenoides que dan el color rojo al fruto, siendo bastante raro porque estas sustancias no se encuentran en otros vegetales (Plaza y Ugaz, 1997; Kumar et al., 2011).
Los carotenoides protegen las células de los efectos de compuestos oxidantes y peroxidantes (Kurshize et al., 1990). Además, los carotenoides y flavonoides de C. annuum contribuyen con su capacidad antioxidante del ácido graso docosahexanoico y del colesterol (Sun et al., 2007). En Litopenaeus vannamei los antioxidantes naturales (vitaminas E y C) y los carotenoides de la dieta, estimulan el crecimiento al disminuir la concentración de radicales libres y los trastornos que se derivan de su presencia en el organismo (Carrillo et al., 2000); además incrementa la respuesta inmune (Tapia et al., 2008). En Macrobrachium rosenbergii, los carotenoides de la dieta ocasionan incremento de los hemocitos y de la profeniloxidasa (Kumar et al., 2009).
En crustáceos, los carotenoides mejoran el crecimiento y supervivencia. En M. rosenbergii, mayores parámetros de crecimiento se logran con 50 y 200 mg kg-1 de astaxantina en la dieta (Kumar et al., 2009). En L. vannamei, mayor crecimiento y alta supervivencia se obtiene con dietas suplementadas con 200 y 250 mg kg-1 del carotenoide de C. annum (Arredondo-Figueroa et al., 2003). Además, los carotenoides de Phaffia rhodozyma, Adonis aestivalis y Spirulina sp. en dietas, también mejoran la supervivencia, el crecimiento y el rendimiento para L. vannamei (Ponce-Palafox et al., 2006). Sin embargo, no se ha investigado el uso de páprika C. annum en la dieta del camarón C. caementarius, pero es probable que los componentes nutricionales presentes en la harina de páprika tengan similares efectos como aquellos de otros crustáceos marinos y de agua dulce. Por consiguiente, el objetivo fue evaluar el crecimiento y supervivencia de postlarvas del camarón de río C. caementarius alimentadas con dietas suplementadas con harina de páprika.
2. MATERIALES Y MÉTODOS
Los animales
Las postlarvas (N = 220) de camarón fueron capturadas de la desembocadura del río Lacramarca (09°07’70’’ S y 78°34’20’’ W) (Santa, Ancash, Perú). El transporte terrestre duró 30 min y se realizó en baldes plásticos (20 L). En laboratorio, las postlarvas de la especie C. caementarius fueron reconocidas con clave taxonómica (Méndez, 1981), luego aclimatadas durante siete días en acuarios (50 L) con agua potable sin cloro y alimentadas a partir del tercer día de aclimatación con balanceado comercial para camarón (30% de proteína bruta). En este estudio, se tuvo en cuenta la Ley peruana vigente (Ley 27265, Ley de protección a los animales domésticos y a los animales silvestres mantenidos en cautiverio) y se ha hecho todo lo posible para minimizar el sufrimiento durante el mantenimiento de los camarones.
Sistema de cultivo
El cultivo fue realizado en 12 acuarios de vidrio (0,30 x 0,22 x 0,20 m y de 0,066 m^2) con 10 L de agua salobre (12‰) para disminuir el canibalismo (Cano et al., 2014). El agua de mar (35‰) procedió de la playa El Dorado (Nuevo Chimbote) y en laboratorio se dejó decantar durante dos días para luego ser filtrada en tamiz (20 μm) y almacenada en recipientes (50 L) de plástico. El agua potable fue aireada durante 48 h para eliminar el cloro. Las postlarvas seleccionadas al azar (n = 180 postlarvas) para el experimento fueron sembradas a la densidad de 227 postlarvas m^-2 (15 por acuario).
Dietas
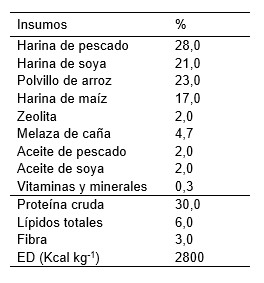
La dieta basal fue la formulada para M. rosenbergii (Sosa, 2004) (Tabla 1). Los frutos rojos deshidratados de páprika C. annum fueron adquiridos en el mercado Buenos Aires (Nuevo Chimbote) y molidos hasta obtener polvo fino. Para los tratamientos experimentales, la dieta basal fue molida y luego suplementada con harina de páprika (Capsicum annuum) en las proporciones de 200, 250 y 300 mg kg^-1, mezclada y peletizada en húmedo en prensa casera y los filamentos fueron secados a temperatura ambiente (21,6 ± 0,8°C) durante 48 h. Los filamentos fueron cortados (5 mm de largo y 3 mm de diámetro) para ser almacenados en recipientes de plástico de cierre hermético. La dieta basal sin páprika fue el tratamiento control. Cada tratamiento dietario tuvo tres repeticiones. Las postlarvas fueron alimentadas tres veces al día (08:00, 13:00 y 18:00 h), durante seis días por semana, en las proporciones diarias de 20%, 20% y 60%, respectivamente, dado el comportamiento alimenticio nocturno de la especie (Icochea et al., 1988). La tasa de alimentación fue del 10% de la biomasa húmeda por día.
Tabla 1. Composición de la dieta y contenido proximal (Sosa, 2004) usado en el experimento con postlarvas de C. caementarius.
Parámetros zootécnicos
Las postlarvas fueron muestreadas cada 30 días. La longitud total (desde escotadura postorbital hasta el extremo posterior del telson) se midió con regla graduada (± 0,5 mm) con los animales posicionados ventralmente. El peso total se determinó en balanza analítica digital (± 0,01 mg).
Los parámetros zootécnicos fueron ganancia porcentual (GP), tasa de crecimiento absoluto (TCA), tasa de crecimiento específica (TCE) y la supervivencia (S), cuyas fórmulas fueron las siguientes:
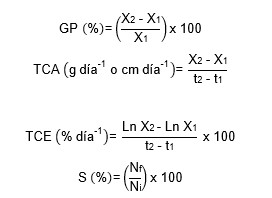
donde X1 y X2 es el peso húmedo (mg) o longitud total (mm), inicial y final; t1 y t2 es la duración en días; ln X1 y ln X2 es el logaritmo natural del peso o longitud inicial y final. No y Ni es el número inicial y final de camarones.
Calidad de agua
Los desechos que se acumularon en los acuarios fueron extraídos con sifón dos veces por semana lo que permitió reponer el volumen de agua en 25%. La calidad del agua fue monitoreada cada dos días y se registró temperatura del agua con termómetro digital (± 0,01ºC), oxígeno con Oxímetro YSI 55 (± 0,01 mg L^-1), pH con pH metro digital Pocket (± 0,01 unidades) y salinidad con refractómetro ATAGO (± 1‰). Además, cada 15 días se determinó alcalinidad total, amonio total y nitritos con kit colorimétrico Nutrafin (± 0,5 mg L^-1).
Análisis estadístico
Los datos fueron sometidos a la prueba de homogeneidad de varianza y la normalidad fue determinada con la prueba de Shapiro-Wilk. Los datos se expresaron como media ± desviación estándar. Las diferencias entre las medias de los tratamientos fueron determinadas mediante análisis de varianza de una vía (α = 0,05) y con la prueba post hoc de Duncan. Los análisis estadísticos se efectuaron con el software estadístico SPSS versión 18 para Windows.
3. RESULTADOS
Crecimiento
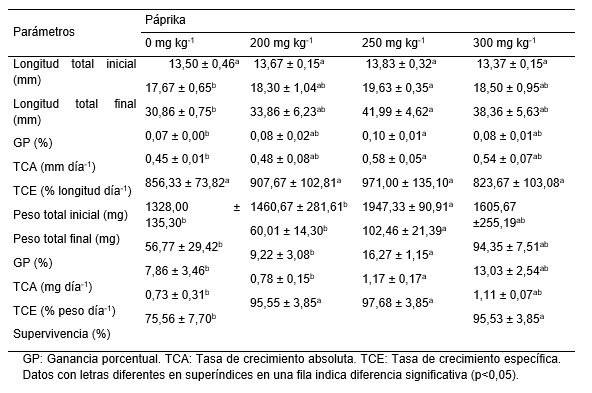
Las postlarvas alimentadas con paprika no presentaron diferencias (p > 0,05) en el crecimiento en longitud durante los primeros 30 días de cultivo; sin embargo, a los 60 días, hubo mayor crecimiento en longitud cuando fueron alimentadas con páprika en la dieta (p < 0,05) en relación con la dieta control; pero la mayor tendencia a crecer más en longitud se obtuvo con 250 mg kg^-1 de páprika, siendo diferente (p < 0,05) solo con la dieta control (Fig. 1A, Tabla 2).
Las postlarvas alcanzaron mayor peso (1988 mg) cuando fueron alimentadas con 300 mg kg^-1 de páprika durante los primeros 30 días de cultivo, el cual fue diferente (p < 0,05) a los demás tratamientos (1240 a 1443 mg). En cambio, a los 60 días, el peso de las postlarvas fue mayor (1947 mg) con 250 mg kg^-1 de páprika en la dieta, el mismo que fue diferente (p < 0,05) de las postlarvas alimentadas con 200 mg kg^-1 (1460 mg) y con la dieta control (1328 mg); aunque fue similar (p < 0,05) con aquellas alimentadas con 300 mg kg^-1 de páprika (1605 mg) (Fig.1B, Tabla 2).
Supervivencia
La supervivencia de postlarvas se mantuvo alta (95% - 97%) y sin diferencias (p > 0,05) en los tratamientos donde se alimentó con páprika, en cambio todas ellas fueron diferentes (p < 0,05) con la dieta control (75%) (Tabla 2).
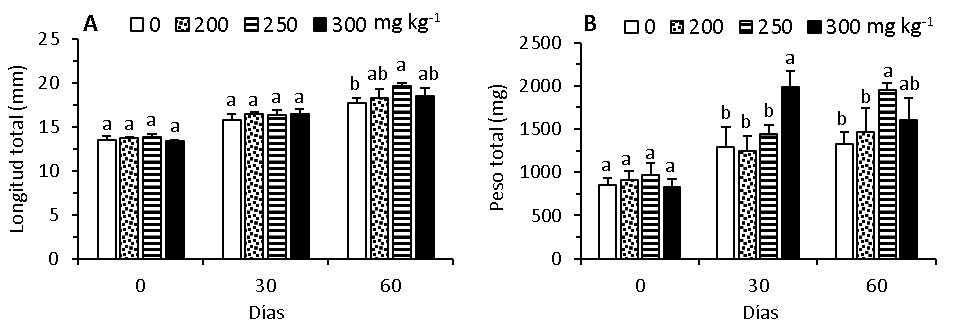
Figura 1. Crecimiento en longitud (A) y peso (B) de postlarvas de C. caementarius alimentadas con dietas suplementadas con paprika, después de 60 días de cultivo en agua salobre (12‰). Letras diferentes sobre la columna indica diferencia significativa (p < 0,05).
Tabla 2. Parámetros de crecimiento en longitud, peso y supervivencia de postlarvas de C. caementarius alimentadas con dietas suplementadas con paprika, a los 60 días de cultivo en agua salobre (12‰) (Media ± desviación estándar).
Calidad del agua
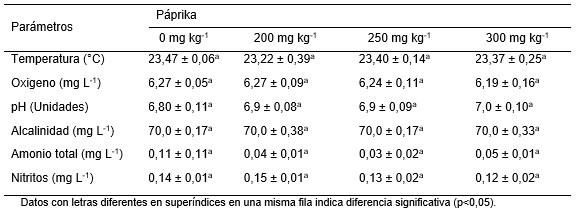
Durante la experiencia, los parámetros de calidad del agua del cultivo de postlarvas fue similar (p > 0,05) entre tratamientos. La temperatura del agua varió entre 23,22ºC a 23,47ºC, el oxígeno disuelto varió de 6,19 mg L^-1 a 6,27 mg L^-1, el pH varió entre 7,0 a 7,8 y la alcalinidad fue de 70 mg L^-1. El amonio total varió entre 0,03 mg L^-1 a 0,11 mg L^-1 y los nitritos entre 0,12 mg L^-1 a 0,15 mg L^-1 (Tabla 3).
Tabla 3. Parámetros físicos y químicos del agua salobre (12‰) del cultivo de postlarvas de C. caementarius, después de 60 días de alimentación con dietas suplementadas con páprika (Media ± desviación estándar).
4. DISCUSIÓN
La calidad del agua del cultivo de postlarvas de C. caementarius, fue similar a lo registrado para el ambiente natural de la especie de camarón (Yépez y Bandín, 1998; Wasiw y Yépez 2015) y los valores de amonio total (≤0,07 mg L^-1) y nitritos (≤0,15 mg L^-1) estuvieron dentro de lo aceptable para especies acuáticas de agua dulce (Timmons et al., 2002). Por consiguiente, la calidad del agua no influyó en el crecimiento ni en la supervivencia de las postlarvas del camarón.
En el presente estudio se demostró por primera vez que las postlarvas de C. caementarius alimentadas con dietas suplementadas con páprika (200 a 300 mg kg^-1) crecen más y mantienen alta supervivencia, que aquellas alimentadas sin páprika en la dieta. Estos resultados sugieren que la páprika en la dieta tiene efectos benéficos en las postlarvas de esta especie de camarón.
Similares efectos suceden en Penaeus semisulcatus alimentado con harina de páprika en la dieta (Göçer et al., 2006), en L. vannamei alimentado con astaxantina extraída de páprika (Arredondo-Figueroa et al., 2003) y en M. rosenbergii y P. vannamei alimentados con astaxantina pura (Kumar et al., 2009; Quintana-López et al., 2019).
El crecimiento en longitud de las postlarvas de C. caementarius no fue afectado (p > 0,05) por las diferentes concentraciones de páprika en las dietas, pero solo aquellas que fueron alimentadas con 250 mg kg^-1 de páprika en la dieta fue diferente (p < 0,05) del control, lo que sugiere que la páprika tiene un efecto leve en incrementar la longitud de las postlarvas. Sin embargo, el crecimiento en peso de las postlarvas tuvo diferente comportamiento que el de la longitud. En los primeros 30 días de cultivo, el mayor crecimiento en peso de las postlarvas fue obtenida con 300 mg kg^1 de páprika en la dieta, pero disminuyó en los siguientes 30 días y fue similar con aquellas alimentadas con 200 mg kg^-1 de páprika e incluso con la dieta control. Estos resultados indican que las postlarvas de esta especie de camarón soportan alta concentración de páprika durante corto periodo de cultivo (15 días), pero la disminución del peso con el tiempo sugiere un efecto adverso, y es probable que la harina de páprika en alta concentración en la dieta haya excedido la capacidad de metabolización de los carotenoides. Similares resultados suceden en L. vannamei de 5 a 6 g de peso, donde los carotenoides esterificados de páprika llegan a saturarse en el tejido muscular con el incremento de la concentración de carotenoides de la dieta (200 a 250 mg kg^-1) y con el tiempo de cultivo (14 a 28 días), seguido de agotamiento (Arredondo-Figueroa et al., 2003); aunque, en ejemplares de 2,5 g, la absorción y transporte de astaxantina en el tejido del camarón es saturado con niveles entre 200 a 400 mg kg^-1 de astaxantina en la dieta (Yamada et al., 1990).
El crecimiento en peso de las postlarvas de C. caementarius, a los 60 días de cultivo, fue mayor (p < 0,05) con 250 y 300 mg kg^-1 de páprika, en relación con las otras dietas; sin embargo, el crecimiento es favorecido por la dieta con 250 mg kg^-1 de páprika porque hubo incremento del peso en el último mes de cultivo que ocasionó mayores parámetros de crecimiento, como la TCE en peso que fue de 1,17 % día^-1. Estos resultados sugieren que las postlarvas aprovecharon muy bien los carotenoides de la páprika de la dieta, pues en juveniles de M. rosenbergii alimentados con 50 y 200 mg kg^-1 de astaxantina en la dieta, la TCE fue de 0,38 y 0,46 % día^-1, respectivamente (Kumar et al., 2009). Es probable que los componentes de la páprika hayan conducido a un incremento de la frecuencia de muda (que no medimos en la experiencia) y a la mayor acumulación de biomasa. La páprika reduce significativamente la descomposición del colesterol y la degradación del ácido graso docosahexanoico en los alimentos durante la cocción (Sun et al., 2007). El colesterol en la dieta es precursor de la hormona ecdisona que regula la muda de los crustáceos (Bonilla-Gómez et al., 2012; Kumar et al., 2018). Esto explicaría el mayor crecimiento en peso de las postlarvas de C. caementarius alimentadas con páprika en la dieta, y por ello, es probable que las postlarvas tuvieron más energía que le permitió acumular en biomasa. En L. vannamei, mayor asimilación de nutrientes se logra cuando las dietas son suplementadas con 200 y 250 mg kg^-1 de carotenoides extraída de páprika (Arredondo-Figueroa et al., 2003). Además, los carotenoides como la astaxantina en la dieta también incrementan la frecuencia de muda en P. japonicus (Petit et al., 1997) y en M. rosenbergii (Kumar et al., 2009).
La inclusión de carotenoides como la astaxantina favorece no solo el crecimiento sino también la sobrevivencia de los animales acuáticos por la mayor resistencia a enfermedades (Meyers, 2000). En M. rosenbergii, los carotenoides estimulan la actividad de la fenoloxidasa y la respuesta inmune (Kumar et al., 2009) y actúa como antioxidante involucrado en la protección de lípidos y de ácidos grasos del cuerpo (Parakarma et al., 2009). De igual manera, sucede en L. vannamei (Kurshize et al., 1990; Carrillo et al., 2000). En la presente investigación, las postlarvas de C. caementarius alimentadas con páprika en la dieta (200 a 300 mg kg^-1) mantuvieron una significativa (p < 0,05) alta supervivencia (95% a 97%) que aquellas alimentadas sin páprika (75%), lo que es otra evidencia de que los carotenoides fueron asimilados y contribuyeron con mantener o mejorar las condiciones fisiológicas de los animales durante el periodo experimental.
Zhang et al. (2013), consideraron que la astaxantina en la dieta aumenta la resistencia al estrés ambiental de los juveniles de L. vannamei, mediante el cual mantiene el estado saludable de los animales y con ello una alta tasa de supervivencia.
La páprika (C. annuum) posee capsantina en alta proporción (>50%) que es el antioxidante más eficaz que β-caroteno y, los ésteres de sus ácidos grasos tienen la misma capacidad de eliminar los radicales libres (Matsufuji et al., 1998; Gómez-García y Ochoa-Alejo, 2013). Los radicales libres son producidos por el metabolismo normal y están involucrados en varias condiciones fisiológicas y patológicas de los organismos, pero cuando hay desequilibrio entre los antioxidantes y los oxidantes, los radicales que se acumulan provocan daño a las macromoléculas (ácidos nucleicos, proteínas y lípidos), lo que conduce a daños en los tejidos en diversas enfermedades (Phaniendra et al., 2015). Esto también explicaría la mayor supervivencia obtenida con las postlarvas de C. caementarius que fueron alimentadas con páprika en la dieta.
En adultos de L. vannamei, alta supervivencia (92% y 94%) se logra con 200 y 250 mg kg^-1 de carotenoides extraídos de C. annuum en comparación con la dieta control (80%) (Arredondo-Figueroa et al., 2003). En P. japonicus, se logra alta sobrevivencia (86%) alimentados con dietas suplementadas con 200 mg kg^-1 de astaxantina (Yamada et al., 1990). En juveniles de L. vannamei, se logra alta supervivencia (87% y 95%) con 75 y 150 mg kg^-1 de xantofilas extraídas de Tagetes erecta, respectivamente (Aguirre-Hinojosa et al., 2012). En P. semisulcatus alimentado con 100 mg kg^-1 carotenoides extraído de C. annuum se logra mantener alta supervivencia (83%) en relación con la dieta control (75%) (Göçer et al., 2006). Es conveniente investigar la respuesta antioxidante e inmune de las postlarvas de C. caementarius alimentadas con páprika en la dieta.
5. CONCLUSIONES
El crecimiento en longitud de las postlarvas de C. caementarius no fue afectado (p > 0,05) por las dietas suplementadas con páprika (200 a 300 mg kg^-1), pero fue diferente con aquellas alimentadas sin páprika. El crecimiento en peso fue mayor (p < 0,05) con 300 mg kg^-1 de páprika a los 15 días de cultivo. En cambio, a los 30 días, el crecimiento en peso fue mayor (p < 0,05) con 250 y 300 mg kg^-1 de páprika. La supervivencia fue alta (95% - 97%) en las postlarvas alimentadas con páprika y baja (75%) en aquellas alimentadas sin páprika. El uso de páprika en la dieta tiene efectos benéficos en el crecimiento y la supervivencia de las postlarvas de esta especie de camarón.
6. CONTRIBUCIÓN DE LOS AUTORES
RDM: Concepción y diseño del estudio, adquisición de datos, análisis de datos, redacción del borrador del artículo, aprobación definitiva de la versión a publicar.
LDV: Concepción y diseño del estudio, adquisición de datos, interpretación de los datos, revisión del borrador del artículo, aprobación definitiva de la versión a publicar.
WRA: Conceptualización del estudio, revisión de los datos, revisión crítica del contenido intelectual y aprobación definitiva de la versión a publicar.
7. CONFLICTO DE INTERESES
Los autores declaran que no existe conflicto de interés.
8. REFERENCIAS BIBLIOGRÁFICAS
Aguirre-Hinojosa, E., Garza-Aguirre, R. C., Piña-Valdez, P., Montoya-Olvera, R., Torres, J. O., y Nieves-Soto, M. (2012). Pigmentary and zootechnical responses of juvenile Litopenaeus vannamei (Boone, 1931) maintained on diets supplemented with xanthophylls of marigold Tagetes erecta flowers. The Israeli Journal of Aquaculture-Bamidgeh, 64, 795-802. http://hdl.handle.net/10524/31830.
Arredondo-Figueroa, J., Pedroza-Islas, R., Ponce-Palafox, J., y Vernon, E. (2003). Pigmentation of Pacific white shrimp (Litopenaeus vannamei, Boone, 1931) with esterified and saponified carotenoides from red chile (Capsicum annuum) in comparison to astaxanthin. Revista Mexicana de Ingeniería Química, 2, 101-108.
Bonilla-Gómez, J. L., Chiappa-Carrara, X., Galindo, C., Jerónimo, G., Cuzon, G., y Gaxiola, G. (2012). Physiological and biochemical changes of wild and cultivated juvenile pink shrimp Farfantepenaeus duorarum (Crustacea: Penaeidae) during molt cycle. Journal of Crustacean Biology, 32(4), 597-606. https://doi.org/10.1163/193724012X630679.
Cabrera, E., Marcelo, Z., Reyes W., y Azañero, C. (2019). Efecto de dietas con alta concentración de Saccharomyces cerevisiae sobre la proliferación de hemocitos en camarones Cryphiops caementarius machos. Revista de Investigaciones Veterinarias del Perú, 30(3), 1057-1067 http://dx.doi.org/10.15381/rivep.v30i3.16733.
Cano, F., Carrión, S., y Reyes, W. (2014). Efecto de altas densidades de siembra en el crecimiento y supervivencia de postlarvas de Cryphiops caementarius (Crustacea: Palaemonidae) en agua salobre. Revista Citecsa, 5(8), 62-78. https://revistas.unipaz.edu.co/index.php/revcitecsa/article/view/77/pdf_15.
Carrillo, O., Vega, F., Nolasco, H., y Gallardo, N. (2000). Aditivos alimentarios como estimuladores del crecimiento de camarón. 90-101 pp. En: Cruz-Suarez, L. E., Ricque-Marie, D., Tapia-Salazar, M., Olvera-Novoa, M. A., y Civera, R. (Eds.). Avances en Nutrición Acuícola V. Memorias del V Simposium Internacional de Nutrición Acuícola. Mérida, Yucatán., México 19-22. https://interconsorcio.com/wp-content/uploads/2019/06/Aditivos-alimentarios-como-promotores-de-crecimiento.pdf.
Cornejo, J., Pérez, L., y Reyes, W. (2015). Effect of Saccharomyces cerevisiae yeast in the diet of male shrimp Cryphiops caementarius (Crustacea, Palaemonidae) on total and differential hemocytes count. Revista Bio Ciencias, 3(3), 173-186. http://dx.doi.org/10.15741/revbio.03.03.04.
Escobar, C., Pachamoro, M., y Reyes, W. (2017). Supervivencia y crecimiento de machos adultos del camarón de río Cryphiops caementarius Molina, 1782 (Crustacea, Palaemonidae) expuestos a salinidades. Ecología Aplicada, 16(2), 75-82. http://dx.doi.org/10.21704/rea.v16i2.1010.
Fernández, P. (2007). Extracción convencional de oleorresina de pimentón dulce y picante I. Generalidades, composición, proceso e innovaciones y aplicaciones. Grasa y Aceites, 58(3), 252-263.
Göçer, M., Yanar, M., Kumlu, M., y Yanar, Y. (2006). The effects of red pepper, marigold flower, and synthetic astaxanthin on pigmentation, growth, and proximate composition of Penaeus semisulcatus. Turkish Journal of Veterinary and Animal Sciences, 30, 359-365. https://journals.tubitak.gov.tr/veterinary/issues/vet-06-30-4/vet-30-4-3-0503-25.pdf.
Gómez-García, M. R., y Ochoa-Alejo, N. (2013). Biochemistry and molecular biology of carotenoid biosynthesis in chili peppers (Capsicum spp.). International Journal of Molecular Sciences, (14), 19025-19053. http://www.doi.org/10.3390/ijms140919025.
Icochea, E., Culquichicon, Z., y Veneros, B. (1988). Consumo de oxígeno y ritmo respiratorio del camarón de río Cryphiops caementarius. Rebiol, 8(1), 17-30.
Kumar, V., Pillai, B. R. Sahoo, P. K. Mohanty, J., y Mohanty, S. (2009). Effect of dietary astaxanthin on growth and immune response of giant freshwater prawn Macrobrachium rosenbergii (de Man). Asian Fisheries Science, 22, 61-69.
Kumar, R., Dwivedi, N., Singh, R., Kumar, S., Rai, V.P., y Singh, M. (2011). A review on molecular characterization of pepper of capsaicin and oleoresin. International Journal of Plant Breeding and Genetics, 5(2), 99-110. https://www.doi.org/10.3923/ijpbg.2011.99.110.
Kumar, V., Kumar, A., Romano, M., Allen, K.M., Bowman, B. A., Thompson, K. R., y Tidwell, J. H. (2018). Metabolism and nutritive role of cholesterol in the growth, gonadal development, and reproduction of crustaceans. Reviews in Fisheries Science & Aquaculture, 26(2), 254-273. https://doi.org/10.1080/23308249.2018.1429384.
Kurshize, M., Okimasu, E. E., Inoue, E., y Utsuma, K. (1990). Inhibition of oxidative injury of biological membranes by astaxanthin. Physiological Chemistry and Physics and Medical NMR, 22, 27-38.
Matsufuji, H., Nakamura, H., Chino, M., y Takeda, M. (1998). Antioxidant activity of capsanthin and the fatty acid esters in paprika (Capsicum annuum). Journal of Agricultural and Food Chemistry, 46, 3468-3472.
Méndez, M. (1981). Claves de identificación y distribución de los langostinos y camarones (Crustacea: Decapoda) del mar y ríos de la costa del Perú. Boletín del Instituto del Mar del Perú, 5, 1- 170. http://biblioimarpe.imarpe.gob.pe/handle/123456789/1028.
Meyers, S. (2000). Papel del carotenoide astaxantina en nutrición de especies acuáticas. pp 473-491 p. En: Civera-Cerecedo, R., Pérez-Estrada, C. J., Ricque-Marie, D., y Cruz-Suarez, L. D. (Eds.). Avances en Nutrición Acuícola IV. Memorias del IV Simposium Internacional de Nutrición Acuícola. Noviembre 15-18, 2000. La Paz, B.C.S., México. https://www.uanl.mx/utilerias/nutricion_acuicola/IV/archivos/28meyers.pdf.
Moscoso, V. (2012). Catálogo de crustáceos decápodos y estomatópodos del Perú. Boletín del Instituto del Mar del Perú, 27(1-2), 8-207. http://biblioimarpe.imarpe.gob.pe/handle/123456789/2190.
Parakarma, M. G. I. S., Rawat, K.D., Venkateshwarlu, G., y Reddy, A. K. (2009). Feeding vitamins, antioxidants and cod liver oil enriched formulated feed influences the growth, survival and fatty acid composition of Macrobrachium rosenbergii (de Man, 1879) postlarvae. Sri Lanka Journal of Aquatic Sciences, 14, 59-74. https://doi.org/10.4038/sljas.v14i0.2200.
Petit, H., Nègre-Sadargues, G., Castillo, R., y Trilles, J. P. (1997). The effects of dietary astaxanthin on growth and moulting cycle of postlarval stage of the prawn, Penaeus japonicus (Crustacea, Decapoda). Comparative Biochemistry and Physiology Part A: Phisiology, 117A(4), 539–544. https://doi.org/10.1016/S0300-9629(96)00431-8.
Phaniendra, A., Jestadi, D. B., y Periyasamy, L. (2015). Free radicals: Properties, sources, targets, and their implication in various diseases. Indian Journal of Clinical Biochemistry, 30(1),11-26. https://doi.org/10.1007/s12291-014-0446-0.
Plaza, A., y Ugaz, O. L. (1997). Colorantes naturales y la oleorresina de páprika. Revista de Química, 11(1), 73-93.
Ponce-Palafox, J. T., Arredondo, J., Ponce, J., y Vermon, E. (2006). Carotenoids from plants used in diets for the culture of the pacific white shrimp (Litopenaeus vannamei). Revista Mexicana de Ingeniería Química, 5, 157-165.
PRODUCE (Ministerio de la Producción). (2018). Anuario estadístico pesquero y acuícola 2017. La actividad productiva del sector en números. Perú. http://ogeiee.produce.gob.pe/images/Anuario/Pesca_2017.pdf.
Quintana-López, A., Hurtado-Oliva, M. A., Manzano-Sarabia, M., López-Peraza, D. J., Hernández, C., García, A., y Palacios, E. (2019). Effect of rearing conditions on astaxanthin accumulation in the white shrimp Penaeus vannamei (Boone, 1931). Latin American Journal of Aquatic Research, 47(2), 303-309. https://doi.org/10.3856/vol47-issue2-fulltext-10.
Reyes, W., Melgarejo, G., y Rojas, E. (2010). Maduración, muda y crecimiento de hembras del camarón de río Cryphiops caementarius con ablación del pedúnculo ocular, en condiciones de laboratorio. Sciendo, 13(2), 80-87. https://revistas.unitru.edu.pe/index.php/SCIENDO/article/view/325/302
Reyes, W. (2014). Interrelación del ciclo de muda, el ciclo ovárico y el Desarrollo embrionario en hembras de Cryphiops caementarius Molina 1782 (Crustacea, Palaemonidae). Revista Intropica, 9, 33-42. https://dialnet.unirioja.es/servlet/articulo?codigo=5111592.
Sosa, A. (2004). Proceso productivo de "camarón gigante de Malasia" Macrobrachium rosembergii en la camaronera ·Carlos Fon L. en la Provincia de Virú La Libertad - Perú. [Informe de Suficiencia Profesional para Título no publicado]. Universidad Nacional del Santa. Perú.
Sun, T., Xu, Z., Wu, C. T., Janes, M., Prinyawiwatkul, W., y No, H. K. (2007). Antioxidant activities of different colored sweet bell peppers (Capsicum annuum L.). Journal of Food Science, 72(2), 98-102. https://www.doi.org/10.1111/j.1750-3841.2006.00245.x.
Tapia, M., Ricque, D., Nieto M., y Cruz, L. (2008). Uso de pigmentos de flor de campasuchil Tagetes erecta como Aditivos en Alimentos para camarón L. vannamei. 492-513 pp. En: Cruz, E., Ricque, D., Tapia, M., Nieto, M. G., Villarreal, D. A., Pablo, J., Viana, M. T. (Eds.). Avances en nutrición Acuícola IX. IX Simposio Internacional de Nutrición Acuícola 24-27 noviembre. Universidad Autónoma de Nuevo León, Monterrey, Nuevo León, México. http://eprints.uanl.mx/id/eprint/8437.
Terrones, S., y Reyes W. (2018). Efecto de dietas con ensilado biológico de residuos de molusco en el crecimiento del camarón Cryphiops caementarius y tilapia Oreochromis niloticus en co-cultivo intensivo. Scientia Agropecuaria, 9(2), 167-176. http://www.doi.org/10.17268/sci.agropecu.2018.02.01.
Timmons, M. B., Ebeling, J. M., Wheaton, F. W., Summerfelt, S. T., y Vinci, B. J. (2002). Sistemas de recirculación para la acuicultura. 2da. Edic. Fundación Chile.
Wasiw, J., y Yépez, V. (2015). Evaluación poblacional del camarón Cryphiops caementarius en ríos de la costa sur del Perú. Revista de Investigaciones Veterinarias del Perú, 26(2), 166-181. http://dx.doi.org/10.15381/rivep.v26i2.11103.
Wasiw, J., y V. Yépez. (2017). Evolución de la condición poblacional del camarón Cryphiops caementarius en el río Cañete (200-2015). Revista de Investigaciones Veterinarias del Perú, 28(1), 13-32. http://dx.doi.org/10.15381/rivep.v28i1.12942.
Yamada, S., Tanaka, Y., Sameshima M., y Ito, Y. (1990). Pigmentation of prawn (Penaeus japonicus) with carotenoids. I. Effect of dietary astaxanthin, β-carotene, and canthaxantin on pigmentation. Aquaculture, 87, 323-330. https://doi.org/10.1016/0044-8486(90)90069-Y.
Yépez, V., y Bandín, R. (1998). Evaluación del recurso camarón de río Cryphiops caementarius en los ríos Ocoña, Majes-Camaná y Tambo. Octubre 1997. Informe Progresivo del Instituto del Mar del Perú, 77, 3-25. http://biblioimarpe.imarpe.gob.pe/handle/123456789/1259.
Zhang, J., Liu, Y-J., Tian, L-X., Yang, H-J., Liang, G-H., Yue, Y. R., y Xu, D. H. (2013). Effects of dietary astaxanthin on growth, antioxidant capacity and gene expression in Pacific white shrimp Litopenaeus vannamei. Aquaculture Nutrition, 19(6), 917-927. https://doi.org/10.1111/anu.12037.
Citar como:
Díaz, R.; Díaz, L.; Reyes-Avalos, W. 2020. Crecimiento y supervivencia de postlarvas del camarón de río Cryphiops caementarius alimentadas con dietas suplementadas con páprika. REBIOL 40(2):149-159. DOI: http://dx.doi.org/10.17268/rebiol.2020.40.02.03.