Artículo Original
EFECTO ANTIOXIDANTE DEL EXTRACTO HIDROALCOHÓLICO DE Annona muricata L. FRENTE A ESTRÉS OXIDATIVO INDUCIDO POR ACRILAMIDA EN HÍGADO DE RATÓN
ANTIOXIDANT EFFECT OF THE HYDROALCOHOLIC EXTRACT FROM Annona muricata L. AGAINST OXIDATIVE STRESS INDUCED BY ACRYLAMIDE IN THE LIVER OF THE MOUSE
Cinthya Aspajo-Villalaz 1, Sarah Pajuelo-Mendoza 2, Jesús Morales-Aniceto 2, Abhel Calderón-Peña 1
1 Profesor del Departamento de Química Biológica y Fisiología Animal, Facultad de Ciencias Biológicas, Universidad Nacional de Trujillo, Av. Juan Pablo II s/n Ciudad Universitaria. Trujillo-Perú.
2 Bachiller en Ciencias Biológicas, Facultad de Ciencias Biológicas, Universidad Nacional de Trujillo, Av. Juan Pablo II s/n Ciudad Universitaria. Trujillo-Perú.
Autor para correspondencia: acalderonp@unitru.edu.pe
Recibido: 11 de junio 2020 / Aceptado: 26 de diciembre 2020
RESUMEN
Annona muricata posee compuestos bioactivos con propiedades antioxidantes. El objetivo de esta investigación fue determinar el efecto antioxidante del extracto hidroalcohólico de A. muricata frente al estrés oxidativo inducido por acrilamida en hígado de ratón. Se obtuvo el extracto hidroalcohólico de hojas de A. muricata; se indujo estrés oxidativo usando acrilamida vía intraperitoneal; se formaron cinco grupos: tres experimentales GE10, GE30 y GE50 (tratados con extracto a dosis de 10, 30 y 50 mg/Kg pc, respectivamente), un grupo control negativo (CN) sin inducción de estrés oxidativo, un grupo control positivo (CP) con inducción de estrés oxidativo, ambos tratados con solución salina fisiológica. El estrés oxidativo se determinó mediante la técnica de reacción de sustancias al ácido tiobarbitúrico; a los resultados se aplicaron las pruebas de normalidad de Shapiro-Wilk, análisis de varianza (ANAVA) y Tukey, con un 95% de confianza. La prueba de Shapiro-Wilk mostró una tendencia normal de cada grupo; la prueba ANAVA mostró un p < 0,05; en la prueba Tukey se formaron 3 grupos homogéneos: a (CN=3,52±0,27 µg malondialdehído/g de hígado (µgMDA/gH) y GE30=3,22±0,39 µgMDA/gH), b (CP=4,87±0,20 µgMDA/gH y GE10=4,56±0,28 µgMDA/gH) y c (GE50=2,37±0,25 µgMDA/gH). Se determinó que existe efecto antioxidante del extracto hidroalcohólico de A. muricata L. frente a estrés oxidativo inducido por acrilamida en hígado de ratón, siendo la dosis de 50 mg/Kg pc la que mostró el mayor efecto antioxidante, la cual generó una concentración de 2,37 µgMDA/g de tejido hepático.
Palabras claves: Annona muricata, estrés oxidativo, antioxidantes
ABSTRACT
Annona muricata has bioactive compounds with antioxidant properties. The objective of this research was to determine the antioxidant effect of the hydroalcoholic extract of A. muricata against the oxidative stress induced by acrylamide in mouse liver. The hydroalcoholic extract of A. muricata leaves was obtained; oxidative stress was induced using acrylamide intraperitoneally; five groups were formed: three experimental GE10, GE30 and GE50 (treated with extract at doses of 10, 30 and 50 mg/Kg bw, respectively), a negative control group (CN) without induction of oxidative stress, a positive control group (PC) with induction oxidative stress, both treated with physiological saline. Oxidative stress was determined using the technique of reaction of substances to thiobarbituric acid; Shapiro-Wilk normality tests, analysis of variance (ANOVA) and Tukey were applied to the results, with 95% confidence. The Shapiro-Wilk test showed a normal trend for each group; the ANAVA test showed a p < 0.05; In the Tukey test, 3 homogeneous groups were formed: a (CN = 3.52 ± 0.27 µg malondialdehyde/g liver (µgMDA/gH) and GE30 = 3.22 ± 0.39 µgMDA/gH), b (CP = 4.87 ± 0.20 µgMDA/gH and GE10 = 4.56 ± 0.28 µgMDA/gH) and c (GE50 = 2.37 ± 0.25 µgMDA/gH). It was determined that there is an antioxidant effect of the hydroalcoholic extract of A. muricata L. against the oxidative stress induced by acrylamide in mouse liver, being the dose of 50 mg / Kg bw the one that showed the highest antioxidant effect, which generated a concentration of 2.37 µgMDA / g of liver tissue.
Keywords: Annona muricata, oxidative stress, antioxidants
DOI: http://dx.doi.org/10.17268/rebiol.2020.40.02.01
1. INTRODUCCION
El estrés oxidativo es el desequilibrio entre las moléculas oxidantes y antioxidantes, a favor de las oxidantes, que causa el envejecimiento y un gran número de enfermedades (Sánchez-Rodríguez y Mendoza-Núñez, 2019); es un estado fisiológico donde se generan altos niveles de especies reactivas de oxígeno y nitrógeno (ERON) y radicales libres (Saha et al., 2017). Las ERON, ya sean endógenas o exógenas, causan modificaciones oxidativas en hidratos de carbono, lípidos, proteínas y ADN (Liguori et al., 2018; Singh et al., 2019). El estrés oxidativo genera patologías como cáncer, aterosclerosis, diabetes, trauma e inflamación (Li et al., 2016), enfermedades relacionadas con la edad como las cardiovasculares, neurodegenerativas, pulmonares, renales, incluyendo también la sarcopenia y la fragilidad (Liguori et al., 2018); es un mecanismo patológico que contribuye al inicio y progresión de la lesión hepática (Li et al., 2015). La lipoperoxidación generada por las ERON o un radical libre se inicia cuando interactúan con un ácido graso poliinsaturado propio de las membranas o de las lipoproteínas, originando una reacción en cadena que libera numerosas moléculas, siendo el malondialdehído (MDA) un aldehído que se ha utilizado comúnmente como marcador de estrés oxidativo (Saldaña-Balmori et al., 2003; Contesse, 2010).
En las plantas existen sustancias bioactivas que actúan como antioxidantes, protegiendo la salud humana y animal mediante la disminución de los efectos del estrés oxidativo (Kahkeshani et al., 2015). Las plantas medicinales, que contienen vitaminas C, E y carotenoides, antocianidinas, flavonoides, antocianinas y otros compuestos fenólicos, tienen la capacidad de reducir la toxicidad de los radicales libres y las ERON (Correa et al., 2012; Delgado et al., 2010). Entre las plantas medicinales tenemos a Annona muricata L. (guanábana o graviola); es una especie endémica de Perú, es silvestre neotropical y presenta una distribución amplia; es heliófila, higrófila, psamófila, argilícola y eutrofa, habita las vertientes occidentales de Perú. A. muricata es un árbol de tres a cuatro metros de alto y muy ramificado, sus frutos contienen componentes beneficiosos para la salud humana; los pueblos indígenas antiguos y actuales han utilizado y utilizan el tallo, hojas y semillas de la familia Annonaceae en medicina tradicional (Leiva et al., 2018). Se ha demostrado que los preparados de hojas de esta planta contienen metabolitos como carbohidratos, polifenoles, flavonoides, esteroides libres, saponinas y alcaloides (Poma et al., 2014). Posee actividad antioxidante, antiinflamatoria, antidiabetógena (Adefegha et al., 2015; Vit et al., 2014), e induce apoptosis en células de cáncer de mama (Moghadamtousi et al., 2014).
La presente investigación tuvo por objetivo el determinar el efecto antioxidante del extracto de hojas de Annona muricata L. frente a estrés oxidativo inducido por acrilamida en hígado de ratón.
2. MATERIALES Y MÉTODOS
Obtención del extracto hidroalcohólico de hojas de Annona muricata
Se colectó 1 Kg de hojas frescas en buen estado de árboles de A. muricata L. del Jardín Botánico “Manuel Fernández Honores” de la Facultad de Ciencias Biológicas de la Universidad Nacional de Trujillo. Las hojas fueron lavadas con agua corriente y luego con agua destilada, posteriormente se llevaron a estufa marca MEMMERT calibrada a 45ºC, hasta su secado total. Una vez secas, fueron molidas en molino manual marca CORONA, y cernidas en tamiz de 0,5 mm marca Amping Yuansheng Mesh Co., Ltd. hasta la obtención de un polvo fino. Se tomó 100 g de este polvo fino y se procedió a maceración en un litro de etanol al 70 % en frascos ámbar de cierre hermético con agitación durante 5 min diarios por 10 días. Posteriormente, se filtró al vacío con papel filtro marca Boeco 389 punto blanco, con tamaño nominal de poro de 8-12 µm, evaporándose luego el filtrado por convección mediante ventilación continua hasta la obtención del extracto, el cual fue conservado en frasco ámbar en refrigeración (2-4 °C) hasta su utilización (Torres et al., 2007).
Animales de laboratorio y consideraciones éticas
Se emplearon veinticinco ratones BALB/c machos de 12 semanas de edad, con un peso de 30 g ± 2 g, obtenidos del Instituto Nacional de Salud, todos los animales utilizados en este estudio se colocaron en jaulas de polietileno, en grupos de cinco individuos. Estos animales se alojaron en el laboratorio de Neurofisiología del Departamento de Química Biológica y Fisiología Animal de la Facultad de Ciencias Biológicas de la Universidad Nacional de Trujillo. Los animales de laboratorio fueron aclimatados por quince días previos al inicio del experimento y mantenidos en un periodo cíclico de 12 horas de luz/oscuridad, alimentados con una mezcla de alimento balanceado y maíz y, con agua a libre disposición (Arts et al., 2014). El manejo y cuidado de los individuos se realizaron bajo protocolos de ética según la “Guía de manejo y cuidado de animales de laboratorio: ratón” (Instituto Nacional de Salud, 2008). Como punto final, se aplicó eutanasia mediante sobredosis con 1,3 mg de pentobarbital sódico con una inyección vía intraperitoneal (ip) a cada animal de experimentación siguiendo las normas de bioética animal (Rollin, 2009; Barrios, et al., 2011; Zatroch et al., 2017).
Inducción de estrés oxidativo y diseño del estudio
La inducción del estrés oxidativo fue realizada con acrilamida marca Merckmillipore, la cual se pesó y diluyó en agua destilada estéril (5 mg/mL), la solución preparada se inyectó vía ip en dosis única equivalente a 50 mg/Kg de peso corporal (pc), según el peso de cada individuo (Ansar et al., 2016), a todos los individuos que conformaban los grupos de investigación, con excepción del grupo control negativo.
Los veinticinco ratones fueron divididos aleatoriamente en cinco grupos, cada grupo formado por cinco ratones, de la siguiente manera:
Control negativo (CN): recibieron una dosis única 0,20 mL de solución salina fisiológica (SSF) estéril vía ip y 0,50 mL de SSF por sonda orogástrica desde el día de la inyección cada 24 horas por dos días.
Control positivo (CP): recibieron acrilamida vía ip y 0,50 mL de SSF por sonda orogástrica desde el día de la inyección cada 24 horas durante 48 horas.
Grupos experimental 10 mg/Kg (GE10): recibieron acrilamida vía ip, además de una dosis de 10 mg/Kg pc del extracto hidroalcohólico de A. muricata resuspendido en agua destilada estéril, mediante sonda orogástrica desde el día de la inyección cada 24 horas durante 48 horas.
Grupos experimental 30 mg/Kg (GE30): recibieron acrilamida vía ip, además de una dosis de 30 mg/Kg pc del extracto hidroalcohólico de A. muricata resuspendido en agua destilada estéril, mediante sonda orogástrica desde el día de la inyección cada 24 horas durante 48 horas.
Grupos experimental 50 mg/Kg (GE50): recibieron acrilamida vía ip, además de una dosis de 50 mg/Kg pc del extracto hidroalcohólico de A. muricata resuspendido en agua destilada estéril, mediante sonda orogástrica desde el día de la inyección cada 24 horas durante 48 horas.
Determinación del estrés oxidativo
Inmediatamente después del punto final se realizó una laparotomía y se reseccionó de manera total el hígado; la determinación del estrés oxidativo se realizó mediante la reacción de las sustancias al ácido 2-tiobarbitúrico (TBARS), el cual mide la concentración de malondialdehído, que es una medida indirecta de la lipoperoxidación, que demuestra el grado de estrés oxidativo que posee el tejido (Halliwell y Chirico, 1993).
Análisis estadístico
A los datos obtenidos se les aplicó la prueba de normalidad de Shapiro-Wilks con el software libre Shapiro-Wilk test for normality con un nivel de confianza del 95% (Statistical tools for high-throughput data analysis, 2020). Se calculó el promedio y desviación estándar de los resultados de cada grupo. Así mismo, se utilizó el software libre One-way ANOVA (Analysis of Variance) with post-hoc Tukey HSD (Honestly Significant Difference) Test Calculator for comparing multiple treatments (Vasavada, 2016) para realizar el análisis de varianza y prueba de comparación de medias de Tukey, ambas pruebas con un nivel de confianza del 95,0%.
3. RESULTADOS
La prueba Shapiro-Wilk (95% de confianza) mostró la probabilidad crítica de cada uno de los grupos: CN = 0,12; CP = 0,34; GE10 = 0,80; GE30 = 0,18 y GE50 = 0,25; confirmándose que todos los grupos obedecen a una distribución normal. Al aplicar la prueba ANAVA con el 95% de confianza, se obtuvo un p < 0,05.
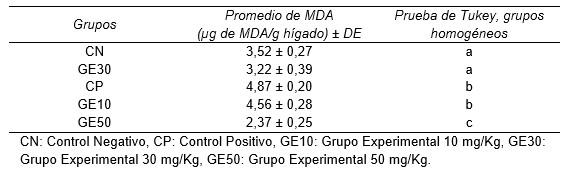
En la Tabla 1 se observa las medias y desviaciones estándar de las concentraciones de malondialdehído (MDA) por gramo de hígado de cada grupo; además, se muestra el resultado de la prueba Tukey (95% de confianza), en el cual se observa la formación de tres grupos homogéneos: grupo a (baja concentración de MDA), grupo b (mayor concentración de MDA) y grupo c (con la menor concentración de MDA de todos los grupos homogéneos formados).
Tabla 1. Promedios y desviaciones estándar (DE) de las concentraciones de malondialdehído (µg MDA/g hígado) y grupos homogéneos formados en el análisis realizado con la Prueba de Tukey (95,0% de confianza)
4. DISCUSIÓN
Al aplicar la prueba Shapiro-Wilk con 95% a cada uno de los grupos (CN = 0,12; CP = 0,34; GE10 = 0,80; GE30 = 0,18 y GE50 = 0,25), estos mostraron un p > 0,05, por lo cual se infiere que obedecen a una distribución normal. Estos resultados permitieron aplicar la prueba ANAVA, que obtuvo un p < 0,05. En la tabla 1 se observa que existe diferencias estadísticamente significativas; como se aprecia, a medida que se aumenta la dosis (GE10 = 10 mg/kg pc, GE30 = 30 mg/kg pc, GE50 = 50 mg/kg pc) disminuye la concentración de MDA, esto indica una disminución en la lipoperoxidación y, por consiguiente, en el estrés oxidativo. El grupo CN (3,51 µg MDA/g hígado) muestra un valor bajo de MDA en comparación con el grupo CP (4,87 µg MDA/g hígado), este último mostró mayor lipoperoxidación debido a que se indujo estrés oxidativo con acrilamida y solamente recibió SSF como tratamiento (CP vs CN: p < 0,05). Debido a que la acrilamida es un alqueno tipo 2 es un mediador endógeno del estrés oxidativo celular; los alquenos de tipo 2 actúan sinérgicamente con aldehídos insaturados generados endógenamente para amplificar el daño celular y, por lo tanto, acelerar los procesos que implican estrés oxidativo (LoPachin y Gavin, 2012).
Después de ingresar al cuerpo, aproximadamente el 50% de la acrilamida se metaboliza a glicidamida (su metabolito epóxido) por la enzima CYP2E1 del citocromo P-450 (Sumner et al., 1992). La acrilamida y la glicidamida tienen características electrofílicas y la capacidad de formar aductos. La acrilamida produce una respuesta tóxica aguda dependiente del tiempo en el tejido hepático. Así mismo, la acrilamida produce un aumento de la bilirrubina directa, que es altamente específica para la enfermedad hepática y la disminución de la albúmina, que es la proteína plasmática más abundante producida por los hepatocitos (Rivadeneyra-Domínguez et al., 2018). Así mismo, se producen lesiones no neoplásicas adicionales (en ratones B6C3F1) como angiectasia y necrosis del hígado (Beland et al., 2015). Se reportó que CYP2E1, un inductor de radicales libres de oxígeno, juega un papel crítico en el daño del ADN inducido por el estrés oxidativo y, está relacionado con hepatocarcinogénesis asociada con etanol (Bradford et al., 2005). También, la inducción de CYP2E1 influye de manera importante sobre la activación de procarcinógenos y la enfermedad hepática progresiva (Gyesi et al., 2019).
Las diferentes dosis del extracto hidroalcohólico de A. muricata (tabla 1) correspondientes a los grupos GE10, GE30 y GE50, mostraron 4,56; 3,22 y 2,37 µg MDA/g hígado, respectivamente, demostrando el efecto antioxidante del extracto a dosis dependiente. Además, se realizó la prueba Tukey con la cual al analizar los resultados entre los pares de grupos CN vs GE10 (p < 0,05) y CP vs GE10 (p > 0,05) se demuestra que GE10 no posee efecto antioxidante; en cambio, al comparar CN vs GE30 (p>0,05) y CP vs GE30 (p < 0,05) sí se evidencia un efecto antioxidante; así mismo, la comparación de CN vs GE50 (p < 0,05) y CP vs GE50 (p < 0,05), demuestra diferencias estadísticas significativas, confirmando que GE50 posee mayor actividad antioxidante, ya que disminuye la concentración de MDA por debajo de la concentración de MDA de CN. Los compuestos bioactivos del extracto son los responsables del efecto antioxidante en hígado de ratón. Existen reportes en los que se ha determinado que los compuestos de las hojas son mayormente terpenos, terpenoides, taninos, flavonoides, saponinas, alcaloides, esteroides (Gajalakshmi et al., 2012; Agu y Okolie, 2017; Nugraha et al., 2019) y, otro componente abundante del aceite esencial de la hoja es δ –cadineno (Gyesi et al., 2019). Además, se realizaron ensayos in vitro que demuestran la capacidad antioxidante (capacidad de eliminación de DPPH y, desintoxicación del radical hidroxilo) de extractos de hojas de A. muricata, que es atribuible a flavonoides, alcaloides y fenoles (Agu y Okolie, 2017).
Los resultados encontrados en este estudio (tabla 1) concuerdan con los obtenidos en la investigación de Adewole y Ojewole (2008), en el cual se analizó el hígado de rata diabética (tratada con estreptozotocina) y se utilizó el extracto de hojas de A. muricata, este extracto produjo una disminución del estrés oxidativo. Así mismo, Fernández (2012), determinó el efecto antioxidante del extracto de A. muricata en hígado de conejo tratados con glucosa, obteniendo una disminución en la concentración de MDA. Probablemente los fenoles, compuestos antioxidantes no enzimáticos, contenidos en el extracto etanólico obtenido de las hojas para este trabajo, serían los responsables de la capacidad antioxidante en hígado, específicamente los flavonoides y taninos (Gavamukulya et al., 2014). Se ha mostrado una correlación positiva entre concentración de polifenoles totales y actividad antioxidante (George et al., 2012; Coria-Tellez et al., 2016). Existen trabajos que reportan que el extracto de A. muricata reduce la lipoperoxidación hepática en ratas diabéticas e inhiben la glicación en BSA-fructosa; además, se identificaron varias biomoléculas conocidas por ser antioxidantes potentes como los ácidos clorogénico y cafeico, procianidinas B2 y C1, (epi) catequina, quercetina, quercetina-hexósidos y kaempferol (Benatti et al., 2018).
5. CONCLUSIONES
Se determinó que existe efecto antioxidante del extracto hidroalcohólico de A. muricata L. frente a estrés oxidativo inducido por acrilamida en hígado de ratón, siendo la dosis de 50 mg/Kg pc la que mostró el mayor efecto antioxidante, la cual generó una concentración de 2,37 µg MDA/g de tejido hepático.
6. CONTRIBUCIÓN DE LOS AUTORES
CAV y ACP elaboraron el borrador del artículo. SPM y JAM fueron responsables del cuidado y alimentación de los animales de laboratorio. ACP obtuvo el extracto hidroalcohólico de A. muricata L., indujo el estrés oxidativo en los ratones y dosificó el extracto. Todos los autores participaron en la ejecución del método de TBARS. ACP realizó el análisis estadístico.
7. CONFLICTO DE INTERESES
Los autores declaran que no existe conflicto de interés.
8. REFERENCIAS BIBLIOGRÁFICAS
Adefegha, S., Oyeleye, S., y Oboh, G. (2015). Distribution of phenolic contents, antidiabetic potentials, antihypertensive properties, and antioxidative effects of soursop (Annona muricata L.) fruit parts in vitro. Biochemistry research international, 2015, 347673. https://doi.org/10.1155/2015/347673.
Adewole, S., y Ojewole, J. (2008). Protective effects of Annona muricata Linn. (Annonaceae) leaf aqueous extract on serum lipid profiles and oxidative stress in hepatocytes of streptozotocin-treated diabetic rats. African journal of traditional, complementary, and alternative medicines: AJTCAM, 6(1), 30-41. https://doi.org/10.4314/ajtcam.v6i1.57071.
Agu, K., y Okolie, P. (2017). Proximate composition, phytochemical analysis, and in vitro antioxidant potentials of extracts of Annona muricata (Soursop). Food Science & Nutrition, 5(5), 1029-1036. doi:10.1002/fsn3.498.
Ansar, S., Siddiqi, N., Zargar, S., Ganaie, M., y Abudawood, M. (2016). Hepatoprotective effect of Quercetin supplementation against Acrylamide-induced DNA damage in wistar rats. BMC complementary and alternative medicine, 16(1), 327. https://doi.org/10.1186/s12906-016-1322-7.
Arts, J., Kramer, K., Arndt, S., y Ohl, F. (2014). Sex Differences in Physiological Acclimatization after Transfer in Wistar Rats. Animals: an open access journal from MDPI, 4(4), 693-711. https://doi.org/10.3390/ani4040693.
Barrios, E., Espinoza, M., Leal, U., Ruiz, N., Pinto, V., y Jurado, B. (2011). Bioética y el empleo de animales de experimentación en investigación. Salus, 15(2), 28-34.
Beland, F., Olson, G., Mendoza, M., Marques, M., y Doerge, D. (2015). Carcinogenicity of glycidamide in B6C3F1 mice and F344/N rats from a two-year drinking water exposure. Food and chemical toxicology: an international journal published for the British Industrial Biological Research Association, 86, 104-115. https://doi.org/10.1016/j.fct.2015.09.017.
Benatti, A., Carnevalli, N., Rodrigues, R., Machado, M., da Silva, N., y Salmen, F. (2018). Annona Muricata Linn. Leaf as a source of antioxidant compounds with in vitro antidiabetic and inhibitory potential against α-amylase, α-glucosidase, lipase, non-enzymatic glycation and lipid peroxidation. Biomedicine y Pharmacotherapy, 100, 83-92. doi: 10.1016/j.biopha.2018.01.172.
Bradford B, Kono H, Isayama F, Kosyk O, Wheeler M, Akiyama T, Bleye L, Krausz K, Gonzalez F, Koop D, y Rusyn I. (2005). Cytochrome P450 CYP2E1, but not nicotinamide adenine dinucleotide phosphate oxidase, is required for ethanol-induced oxidative DNA damage in rodent liver. Hepatology, 41(2): 336–344. doi:10.1002/hep.20532.
Contesse B. (2010). Evaluación de la lipoperoxidación in vitro, a través de las reacciones del 3-metil-2-benzotiazolidon hidrazona (MBTH) y del ácido tiobarbitúrico (TBARS). Tesis de titulación. Universidad de Chile.
Coria-Tellez, A., Montalvo-Gonzalez, E., Yahia, E., y Obledo-Vazquez, E. (2016). Annona muricata: A comprehensive review on its traditional medicinal uses, phytochemicals, pharmacological activities, mechanisms of action and toxicity. Arabian Journal of Chemistry, 11(5): 1-30. doi: 10.1016/j.arabjc.2016.01.004.
Correa, J., Ortiz, D., Larrahondo, J., Sanchez, M., y Pachón, H. (2012). Actividad antioxidante en guanábana (Annona muricata); una revisión bibliográfica. Boletin Latinoamericano y del Caribe de Plantas Medicinales y Aromáticas, 11(2), 111-126.
Delgado, L., Betanzos, G., y Sumaya, M. (2010). Importancia de los antioxidantes dietarios en la disminución del estrés oxidativo. Investigación y Ciencia, 50, 10-15.
Fernández, A. (2012). Efecto antioxidante e hipoglicemiante del extracto hidroalcohólico de las hojas de Annona muricata L. “guanábana” en Oryctolagus cuniculus “conejo” var. New Zeland. Tesis para obtención de título. Universidad Nacional de Trujillo.
Gajalakshmi. S., Vijayalakshmi, S., y Rajeswari, D. (2012). Phytochemical and pharmacological properties of Annona muricata: a review. International Journal of Pharmacy and Pharmaceutical Sciences., 4(2), 3-6.
Gavamukulya, Y., Abou-Elella, F., Wamunyokoli, F., y AEl-Shemy, H. (2014). Phytochemical screening, anti-oxidant activity and in vitro anticancer potential of ethanolic and water leaves extracts of Annona muricata (Graviola). Asian Pac J Trop Med.; 7(Suppl 1): S355-S363. doi: 10.1016/S1995-645(14)60258-3.
George, C., Kumar, D., Rajkumar, V., Suresh, P., y Ashok, K. (2012). Quantitative assessment of the relative antineoplastic potential of the n-butanolic leaf extract of Annona muricata Linn. In normal and immortalized human cell lines. Asian Pacific Journal of Cancer Prevention: APJCP, 13: 699-704. doi:http://dx.doi.org/10.7314/APJCP.2012.13.2.699.
Gyesi, J., Opoku, R., y Borquaye, L. (2019). Chemical Composition, Total Phenolic Contet, and Antioxidant Activities of the Essential Oils of the Leaves and Fruit Pulp of Annona muricata L. (Soursop) from Ghana. Biochemistry research international, 2019, 4164576. https://doi.org/10.1155/2019/4164576.
Halliwell, B., y Chirico, S. (1993). Lipid peroxidation: it´s mechanism, measurement and significance. American Journal of Clinical. Nutrition, 57(5suppl), 715S-725S. doi: 10.1093/ajcn/57.5.715S
Instituto Nacional de Salud. (2008). Guía de manejo y cuidado de animales de laboratorio: ratón. Recuperado de: https://repositorio.ins.gob.pe/xmlui/bitstream/handle/INS/117/CNPB-0002.pdf?sequence=3&isAllowed=y.
Kahkeshani, N., Saeidnia, S., y Abdollahi, M. (2015). Role of antioxidants and phytochemicals on acrylamide mitigation from food and reducing its toxicity. Journal of food science and technology, 52(6), 3169–3186. https://doi.org/10.1007/s13197-014-1558-5.
Leiva S, Gayoso G, y Chang L. (2018). Annona muricata L. "guanábana" (Annonaceae), una fruta utilizada como alimento en el Perú prehispánico. Arnaldoa.; 25(1): 127-140.
Li, S., Hong, M., Tan, H., Wang, N., y Feng, Y. (2016). Insights into the Role and Interdependence of Oxidative Stress and Inflammation in Liver Diseases. Oxidative medicine and cellular longevity, 2016, 4234061. https://doi.org/10.1155/2016/4234061.
Li, S., Tan, H., Wang, N., Zhang, Z., Lao, L., Wong, C., y Feng, Y. (2015). The Role of Oxidative Stress and Antioxidants in Liver Diseases. International journal of molecular sciences, 16(11), 26087-26124. https://doi.org/10.3390/ijms161125942.
Liguori, I., Russo, G., Curcio, F., Bulli, G., Aran, L., Della-Morte, D., Gargiulo, G., Testa, G., Cacciatore, F., Bonaduce, D., y Abete, P. (2018). Oxidative stress, aging, and diseases. Clinical interventions in aging, 13, 757–772. https://doi.org/10.2147/CIA.S158513
LoPachin, R., y Gavin, T. (2012). Molecular mechanism of acrylamide neurotoxicity: lessons learned from organic chemistry. Environmental health perspectives, 120(12), 1650–1657. https://doi.org/10.1289/ehp.1205432.
Moghadamtousi, S. Z., Kadir, H. A., Paydar, M., Rouhollahi, E., y Karimian, H. (2014). Annona muricata leaves induced apoptosis in A549 cells through mitochondrial-mediated pathway and involvement of NF-κB. BMC complementary and alternative medicine, 14, 299. https://doi.org/10.1186/1472-6882-14-299.
Nugraha, A., Damayanti, Y., Wangchuk, P., y Keller, P. (2019). Anti-infective and anti-cancer properties of the Annona species: their ethnomedicinal uses, alkaloid diversity, and pharmacological activities. Molecules (Basel, Switzerland), 24(23), 4419. https://doi.org/10.3390/molecules24234419.
Poma, E., Requis, E., Gordillo, G., y Fuertes, C. (2014). Estudio fitoquímico y actividad antiinflamatoria de la Annona muricata L. (guanábana) de Cuzco. Ciencia e Investigación, 14(2), 29-33.
Rivadeneyra-Domínguez, E., Becerra-Contreras, Y., Vázquez-Luna, A., Díaz-Sobac, R., y Rodríguez-Landa, J. (2018). Alterations of blood chemistry, hepatic and renal function, and blood cytometry in acrylamide-treated rats. Toxicology reports, 5, 1124–1128. https://doi.org/10.1016/j.toxrep.2018.11.006.
Rollin B. (2009). Ethics and euthanasia. The Canadian veterinary journal = La revue veterinaire canadienne, 50(10), 1081-1086.
Saha, S., Lee, S., Won, J., Choi, H., Kim, K., Yang, G., Dayem, A., y Cho, S. (2017). Correlation between Oxidative Stress, Nutrition, and Cancer Initiation. International journal of molecular sciences, 18(7), 1544. https://doi.org/10.3390/ijms18071544.
Saldaña-Balmori Y, Ramirez-González H, y Delgadillo-Gutiérrez H. (2003). Acción de algunos antiinflamatorios no esteroideos sobre la lipoperoxidación hepática inducida por etanol. Revista Cubana de Investigaciones Biomédicas, 22(1), 16-24.
Sánchez-Rodríguez, M., y Mendoza-Núñez, V. (2019). Oxidative Stress Indexes for Diagnosis of Health or Disease in Humans. Oxidative medicine and cellular longevity, 2019, 4128152. https://doi.org/10.1155/2019/4128152.
Singh, A., Kukreti, R., Saso, L., y Kukreti, S. (2019). Oxidative Stress: A Key Modulator in Neurodegenerative Diseases. Molecules (Basel, Switzerland), 24(8), 1583. https://doi.org/10.3390/molecules24081583.
Statistical tools for high-throughput data analysis. (25 de noviembre del 2020). Shapiro-Wilk test of normality. http://www.sthda.com/english/rsthda/shapiro-wilk.php
Sumner, S., MacNeela, J., y Fennell, T. (1992). Characterization and quantitation of urinary metabolites of [1, 2, 3-13c] acrylamide in rats and mice using carbon-13 nuclear magnetic resonance spectroscopy. Chemical Research in Toxicology, 5(1), 81–89. doi:10.1021/tx00025a014.
Torres, P., Aguilar, J., Rodríguez, A., y Pretel, O. (2007). Efecto de Mirabilis jalapa L. frente a radicales libres inducidos por Escherichia coli en Rattus rattus variedad albinus. Revista de Biología.; 10: 53-58.
Vasavada, N. (2016). One-way ANOVA (ANalysis of VAriance) with post-hoc Tukey HSD (Honestly Significant Difference) Test Calculator for comparing multiple treatments. https://astatsa.com/OneWay_Anova_with_TukeyHSD/.
Vit, P., Santiago, B., y Pérez-Pérez E. (2014). composición química y actividad antioxidante de pulpa, hoja y semilla de guanábana Annona muricata L. Interciencia,39(5), 350-353.
Zatroch, K., Knight, C., Reimer, J., y Pang, D. (2017). Refinement of intraperitoneal injection of sodium pentobarbital for euthanasia in laboratory rats (Rattus norvegicus). BMC veterinary research, 13(1), 60. https://doi.org/10.1186/s12917-017-0982-y.
Citar como:
Aspajo-Villalaz, C.; Pajuelo-Mendoza, S.; Morales-Aniceto, J.; Calderón-Peña, A. 2020. Efecto antioxidante del extracto hidroalcohólico de Annona muricata L. frente a estrés oxidativo inducido por acrilamida en hígado de ratón. REBIOL 40(2): 133-140. DOI: http://dx.doi.org/10.17268/rebiol.2020.40.02.01.