Artículo Original
BIOACUMULACIÓN DE METALES PESADOS EN TRES ESPECIES DE PECES BENTÓNICOS DEL RÍO MONZÓN, REGIÓN HUÁNUCO
BIOACCUMULATION OF HEAVY METALS IN THREE BENTONIC FISH SPECIES FROM MONZON RIVER, HUANUCO REGION
Edmer Rosales Ortega 1, Marcelo Cotrina Doria 2, Glauco Valdivieso Arenas 2, Francisco Sales Dávila 2, Elmis García Zare 3, Elizabeth S. Ordoñez 1
1 Laboratorio de Carnes, Facultad de Ingeniería en Industrias Alimentarias, Universidad Nacional Agrarias de la Selva (UNAS), Huánuco, Tingo María - Perú.
2 Dirección de Investigación en Ecosistemas Acuáticos, Instituto de Investigaciones de la Amazonia Peruana IIAP – Huánuco, Tingo María - Perú.
3 Departamento Académico de Estadística, Universidad Nacional de Trujillo.
*Autor para correspondencia: gvaldivieso@iiap.gob.pe
Recibido: 15 de noviembre, 2019. Aceptado: 6 de junio, 2020
RESUMEN
Los peces bentónicos de los ríos amazónicos presentan mayor acumulación de metales pesados debido a su hábito alimenticio; estos representan un riesgo para la salud pública si son consumidas en grandes cantidades por la población. El objetivo de este estudio fue determinar la concentración de cadmio, plomo y cobre en las especies de peces boquichico (Prochilodus nigricans), carachama (Chaetostoma sp) y julilla (Parodon buckleyi). Se muestrearon 12 ejemplares por especie en tres puntos de muestreo del río Monzón. La cuantificación se realizó con un espectrofotómetro de absorción atómica de llama, previa digestión ácida de las muestras de músculo, hígado, sedimento y agua. Los resultados muestran que, en las tres especies, la mayor acumulación de los tres metales se presentó en el hígado; mientras, que en el músculo se determinó concentraciones promedio de cadmio de 1,62 ppm en julilla; 1,59 ppm en carachama y 0,73 ppm en boquichico. Así mismo, se encontró concentraciones promedio de plomo de 5,09 ppm en carachama y 0,61 ppm en boquichico y no se determinó en julilla. Además, concentraciones promedio de cobre de 2,78 ppm en julilla; 2,44 ppm en boquichico y 2,41 ppm en carachama. Se concluye que la mayor bioacumulación se presenta en el hígado; las tres especies acumulan cadmio y cobre en músculo; carachama y boquichico acumulan plomo en músculo; y la especie con mayor concentración de cadmio y cobre en músculo es julilla.
Palabras Claves: detritívoro, bioindicador, metales en ictiofauna
ABSTRACT
The benthic fishes from the Amazon river have a greater accumulation of heavy metals due to their eating habits. They represent a risk to public health if they are consumed in large quantities by the human population. The purpose of this study is to determine the concentration of cadmium, lead, and copper in the following fish species: boquichico (Prochilodus nigricans), carachama (Chaetostoma sp) and julilla (Parodon buckleyi). Twelve specimens per specimen were captured in three samples from the Monzon river, the quantification was made with a flame atomic absorption spectrophotometer, after acid digestive muscle, liver, sediment and water. The results show that three species have big quantitive of accumulation of the three metals inside of the liver. However, inside of the muscle cadmium concentrations are 1.62 ppm in julilla, 1.59 ppm in carachama and 0.73 ppm in boquichico. Also, the average lead concentrations were 5.09 ppm in carachama, 0.61 ppm in boquichico. In contrast, it was not determined in julilla. In addition, average copper concentrations were 2.78 ppm in julilla; 2.44 ppm in boquichico and 2.41 ppm in carachama. It concluded that the greatest bioaccumulation occurs in the liver, and all of the three species accumulated cadmium and copper inside their muscle; carachama and boquichico accumulated lead inside their muscle; and the species with the highest concentration of cadmium and copper inside their muscle is julilla.
Keywords: detritivorous, bioindicator, metals in ichthyofauna
DOI: http://dx.doi.org/10.17268/rebiol.2020.40.01.08
1. INTRODUCCIÓN
Los ríos de la selva del Perú son abundantes fuentes de recursos hidrobiológicos, que permiten al poblador rural obtener diferentes especies de peces para su dieta alimenticia con alto valor proteico; sin embargo, en las últimas décadas, en el valle del Monzón, se ha observado una disminución del recurso pesquero, causada por las inadecuadas prácticas agrícolas, arrojo de residuos sólidos domiciliarios y residuos de combustibles, que en su conjunto contienen elementos tóxicos y son vertidos a los afluentes del río Monzón (Paredes et al., 2010). Los metales pesados son tóxicos no solo por sus características químicas, sino por concentraciones en las que pueden presentarse y más importante aún, el tipo de compuesto o metabolito que forman; así mismo, las interacciones entre los metales y sus efectos tóxicos pueden complicar las enfermedades ya existentes. Así, por ejemplo, el cadmio interfiere con el zinc, cobre, hierro, manganeso y calcio; mientras que el cobre interactúa con el hierro, molibdeno, azufre y zinc, el plomo con el calcio, interfiriendo en los procesos metabólicos en la que suplantan a estos elementos hasta llegar a células, tejidos, órganos y huesos, causando anomalías y enfermedades en el organismo humano (Londoño et al., 2016).
La presencia de metales pesados como cadmio, plomo y cobre en los ambientes acuáticos representan un serio problema ambiental y riesgo de salud para los moradores, ya que estos metales pesados se adhieren a los sedimentos que sirven de alimento a peces bentónicos, que succionan los detritos y perifitón, adherido al sedimento del fondo de los cauces, que llevarían a la bioacumulación de estos metales pesados en diferentes tejidos del pez, principalmente músculo e hígado, haciendo que su consumo sea perjudicial para la salud humana (Panebianco, 2011).
Un ejemplo de la afectación de los metales pesados en la salud pública se reporta en Madre de Dios, donde se observó concentraciones de mercurio en el tejido de los peces con más de un tercio de los peces carnívoros (cuyas presas son peces bentónicos) que exceden la norma internacional de salud de 0,5 mg/kg. Este estudio demuestra que las comunidades ubicadas cientos de kilómetros aguas abajo de la actividad minera, están en riesgo de exposición al mercurio, debido a su dieta que excede el cuerpo aceptable (Diringer et al., 2014); así mismo, en Colombia reportaron concentraciones de metales que sobrepasaron los límites permitidos por la Organización Mundial de la Salud. Se evidenciaron efectos genotóxicos posiblemente asociados a la presencia de los metales en la sangre. Se encontraron asociaciones significativas (p < 0,05) entre la presencia de mercurio y de cadmio, el daño en el ADN, con lo que sugieren que el perjuicio genético registrado en pobladores de la región de La Mojana, puede estar asociado a la presencia de los metales estudiados en las muestras de sangre (Calao y Marrugo, 2015). Por lo tanto, es necesario realizar estudios de la bioacumulación de metales pesados en peces de consumo humano a fin de establecer políticas de prevención y mitigación.
Entre los peces de mayor consumo en el valle del Monzón, encontramos las especies bentónicas: el boquichico (Prochilodus nigricans), carachama (Chaetostoma sp) y julilla (Parodon buckleyi). El boquichico tiene la boca terminal con labios a modo de ventosa, con dientes córneos movibles e implantados en los labios que le permiten alimentarse del perifitón, así como obtener su alimento del detrito (Rada et al., 2006). La carachama posee una boca que funciona como un órgano de succión, tanto para alimentarse como para adherirse fuertemente a los trozos de madera sumergida u otros substratos del fondo (Ortega et al., 2000). La julilla se encuentra en ríos grandes y en pequeñas quebradas, sitios de aguas rápidas o lentas, pero con substratos duros como gravas, rocas o arenas gruesas, es una especie bentónica que se alimenta de perifitón y pequeños insectos acuáticos que captura entre las piedras (Maldonado et al.,2005).
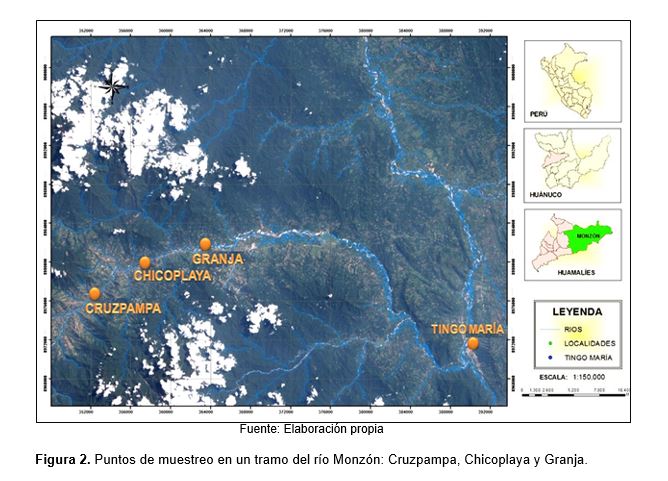
El conocimiento de los niveles de contaminación por metales pesados permitiría la toma de decisiones adecuadas en el campo de la salud, el medio ambiente y en el plano social que impacta positivamente en la realidad de nuestra población. Es por ello, el objetivo fue determinar la concentración de los metales pesados cadmio, plomo y cobre en hígado y músculo de las especies de peces boquichico (Prochilodus nigricans), carachama (Chaetostoma sp) y julilla (Parodon buckleyi) que habitan en el río Monzón, sector de los caseríos: Cruzpampa, Chicoplaya y Granja.
2. MATERIALES Y MÉTODOS
Captura de material Biológico
El material biológico consistió en tres especies de peces bentónicos del río Monzón, boquichico (Prochilodus nigricans), carachama (Chaetostoma sp) y julilla (Parodon buckleyi) (Fig. 1). Para la captura se determinaron 03 puntos en un tramo del río Monzón: Cruzpampa (18L0352414-UTM8976626), Chicoplaya (18L0357412-UTM8979664) y Granja (18L0363789-UTM8981595), ubicados en la zona de ceja de selva, en el distrito de Monzón, provincia de Huamalies, región Huánuco (Fig. 2). Para la obtención de los especímenes se procedió a la pesca realizándose desde la 01:00 am hasta las 06:00 am. En cada punto de muestreo se capturaron 4 individuos por cada especie, siendo un total de 12 ejemplares por especie a lo largo del río, durante las fechas 13/07/2013 y 01/08/2013. Así mismo, se colectaron las muestras de agua superficial en frascos herméticos y los sedimentos fueron obtenidos en la superficie de las piedras.

Extracción de muestras
Las muestras de músculo se tomaron de la sección anterior del pez, entre la aleta pectoral y la aleta dorsal del lado izquierdo del cuerpo; para ello, se realizó un corte aproximado de 5 cm x 4 cm. Para retirar el hígado se realizó un corte en la parte ventral del pez, se lavó la muestra con agua destilada retirando los restos de sangre. Las muestras de tejidos fueron conservadas a -20ºC. Así también, se realizó la colecta de 18 muestras de sedimento consistente en 100g de detritos (5cm profundidad) y perifitón adherido a rocas. Además, 18 muestras de 650 ml de agua superficial de las orillas y del punto medio del cauce del río.
Análisis de bioacumulación de cadmio, plomo y cobre
Se utilizó el método de extracción por digestión ácida para muestras biológicas (Granada y Escobar, 2012). Para el análisis de muestras de músculo se pesó 1 gramo, se adicionó 4 ml de HNO3 y 1 ml de H2SO4, se colocó en digestión a 90°C por 3 horas; luego se enfrió a temperatura ambiente, se añadió 0,5 ml de H2O2 por 30 minutos sin agitar y finalmente se filtró y almacenó. Para las muestras de hígado se pesó 0.5 gramos, se adicionó 2 ml de HNO3 y 1 ml de H2SO4 y se siguió el mismo procedimiento que el anterior. Para el análisis de muestras de sedimento se procedió a secar las muestras, triturarlas pesando 1 gramo, luego se adicionó 9 ml de HNO3 y 3 ml de H2SO4 y se siguió el mismo procedimiento que el anterior y para el análisis de muestras de agua se colocó 150 ml, se adicionó 2 ml de HNO3 y 5 ml de H2SO4, posteriormente se colocó a 90°C por 3 horas hasta quedar en el 20% del volumen inicial y después se procedió con el procedimiento anterior. La lectura de las concentraciones de cobre, cadmio y plomo se realizó con un espectrofotómetro de absorción atómica de llama en el laboratorio de Análisis de Suelos y Química de la Universidad Nacional Agraria de la Selva.
Análisis estadístico en sedimento y agua
Los resultados del contenido de metales en sedimento y agua fueron analizados mediante el diseño completo al azar (DCA), con la prueba de Tukey p < 0,05, para ello se utilizó el programa SAS versión 9,1. La finalidad es determinar la diferencia significativa en las concentraciones de metales entre los tres puntos de muestreo, y la posible influencia en las concentraciones de los metales en los peces que son objeto del estudio.
3. RESULTADOS
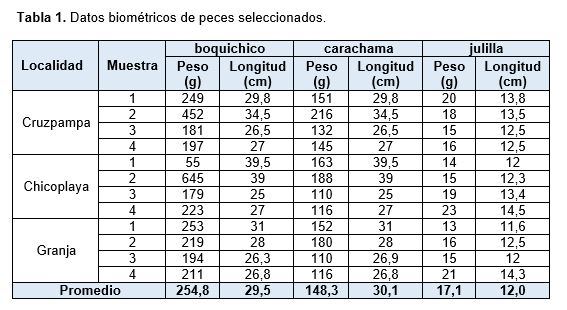
En boquichico, la longitud total promedio de las tres localidades muestreadas fue 29,5 cm; el peso promedio fue 254,8 g. En carachama, la longitud total promedio de las tres localidades muestreadas fue 30,1 cm; el peso promedio fue 148,3 g. En julilla, la longitud total promedio de las tres localidades muestreadas fue 12,0 cm; el peso promedio fue 17,1 g (Tabla 1).
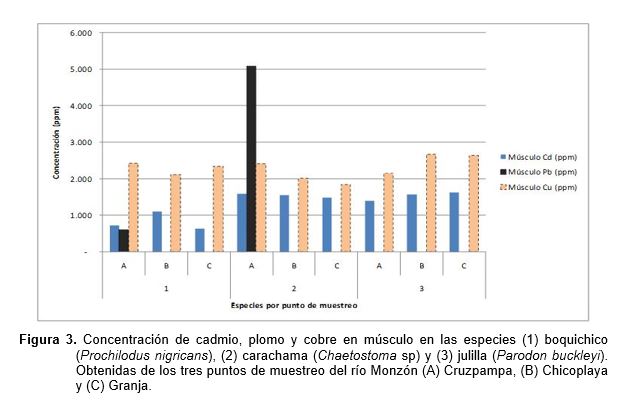
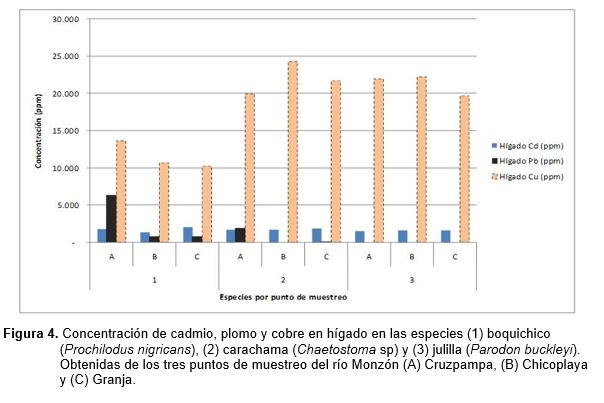
Los resultados del contenido de cadmio (Cd), plomo (Pb) y cobre (Cu) en músculo e hígado de las tres especies en estudio (1=boquichico, 2=carachama y 3=julilla) en las diferentes localidades (A=Cruzpampa, B=Chicoplaya y C=Granja) se presentan en las figuras 3 y 4. Donde se puede apreciar que: i. el hígado presenta la mayor concentración de cadmio en la especie boquichico con 2,11 ± 0,12 ppm, seguido por carachama con 1,91 ± 0,09 ppm y julilla con 1,63 ± 0,09 ppm; todos en el punto C., ii. el hígado presenta la mayor concentración de cobre en la especie carachama con 24,23 ± 1,2 ppm, seguido por julilla con 22,21 ± 1,7 ppm ambos en el punto B y boquichico con 13,64 ± 0,9 ppm en el punto A. iii. el músculo presenta la mayor concentración de cadmio en julilla con 1,62±0,08 ppm en el punto C, seguido por carachama con 1,59 ± 0,17 ppm en el punto A y boquichico con 1,11 ± 0,04 ppm en el punto B., iv) El contenido de cadmio en músculo de boquichico varia en las tres localidades, de 0,63 a 1,11 ppm., v) las concentraciones de plomo fueron mayores en la especie carachama con 5,08 ± 0,15 ppm y en boquichico con 0,61 ± 0,02 ppm, ambos en el punto A; el hígado presenta la concentración de plomo en la especie de boquichico con 6,34 ± 0,24 ppm, seguido por carachama con 1,92 ± 0,05 ppm ambos en el punto A. En julilla no se registró plomo en musculo ni hígado. vi) el músculo presenta la mayor concentración en la especie julilla con 2,67 ± 0,20 ppm en el punto B, seguido por boquichico con 2,43 ± 0,16 ppm y carachama con 2,41 ± 0,15 ppm ambos en el punto A.
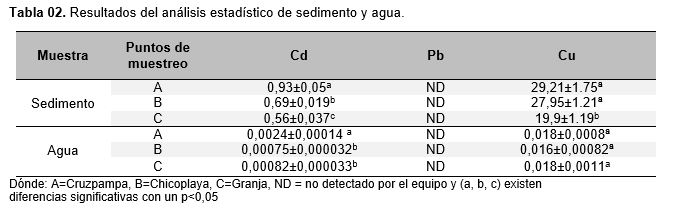
La Tabla 2, muestra los resultados de sedimento y agua. En ellas, la mayor concentración de cadmio se registró en el punto de muestreo A con 0,93 ± 0,05 ppm, con respecto al punto B con 0,69 ± 0,019ppm y C con 0,56 ± 0,037ppm; el cobre tuvo una mayor concentración en el punto A con 29,21 ± 1,75ppm, en comparación al punto B con 27,95 ± 1,21ppm y C con 19,9 ± 1,19ppm. En el agua la mayor concentración de cadmio se registró en el punto A con 0,0024 ± 0,00014 ppm, con respecto a los puntos B con 0,00075 ± 0,000032 ppm y C con 0,00082 ± 0,000033 ppm; el cobre registro una mayor concentración en el punto A con 0,018 ± 0,0008ppm y C con 0,018 ± 0,0011ppm, en comparación al punto B con 0,016 ± 0,00082ppm. En el sedimento y agua, el plomo no fue detectado al momento de la lectura, posiblemente porque los valores estuvieron por debajo del límite de detección del equipo.
4. DISCUSIÓN
La toxicidad para los peces depende entre otros factores del contenido de calcio en el agua, cuanto mayor es la concentración de calcio, menor será el efecto tóxico del cadmio sobre los peces (Argota et al., 2012). Cabe resaltar que los puntos de muestreo confluyen aguas provenientes del distrito de Monzón y localidad de Chaupiyacu y escorrentías provenientes de áreas agrícolas; se puede encontrar metales pesados debido al transporte atmosférico a gran escala de contaminantes por diferentes actividades humanas; así mismo, el uso de una gran cantidad de productos agrícolas como los pesticidas y plaguicidas generan una contaminación con estos metales (Frías et al., 2010). Los resultados obtenidos en la presente investigación, indicaron la presencia de contaminantes donde los peces boquichico, carachama y julilla registraron acumulación de los metales pesados cadmio, plomo y cobre en sus órganos de estudio: hígado y músculo.
Con respecto al contenido de cadmio en hígado, fue mayor en boquichico, seguido por carachama y julilla en el punto C. La acumulación de cadmio en el riñón e hígado depende de la intensidad, tiempo de exposición y del estado óptimo de la función de excreción renal (Mancera y Álvarez, 2006); también se reporta que el cadmio primero es transportado hacia el hígado por la sangre; allí es unido a proteínas para formar complejos que son transportados hacia los riñones (Hermoso y Márquez, 2005). El cadmio elige como órgano de concentración mayor el riñón, pero también en menor cantidad en hígado, branquias y como último el músculo (Cousillas, 2003). Es por ello, que al igual que otros metales (plomo y cobre) se registró la concentración mayor en hígado con respecto al músculo.
El contenido de cadmio en músculo en boquichico, en ciudades como Iquitos, Puerto Maldonado y Pucallpa se reportan concentraciones menores que van de 0,1 a 1,5 ppm (Salas et al., 2009; García y Alva, 2013) y se reporta para la misma especie en el río Guasare - Venezuela 0,85 a 3,4 ppm (Salazar, 2009), siendo mayor el contenido de cadmio encontrado en la presente investigación. De acuerdo a los resultados del presente estudio, el contenido de cadmio en julilla fue mayor comparado con reportes que van de 0,001 a 0,08 ppm Cd en peces procedentes de cuencas de las regiones Ucayali y Loreto (Pezo et al., 1992; Salas et al., 2009).
Las concentraciones de cadmio en músculo, estuvieron comprendidas entre 0,63 ± 0,07 a 1,62 ± 0,08 ppm, comparando estos resultados con las normas permitidas de diferentes lugares podemos apreciar que los valores encontrados están por encima de lo permitido para consumo humano, tal como lo indica el límite máximo de 0,05 a 0,1 ppm peso fresco (Sánchez et al., 2010), la concentración máximos en Chile 0,05 ppm y en Venezuela 0,5 ppm (Pezo et al., 1992), asimismo, el límite permisible 0,1 ppm se puede apreciar que el resultado encontrado es superior (FAO, 2003). Estas concentraciones altas de este metal pueden provocar en los sistemas biológicos una competencia con el zinc, el cobre y el calcio por los sitios de unión de estos elementos en las macromoléculas (Salazar, 2009). Ello indica que, a nivel bioquímico, el cadmio puede unirse a los grupos SH de proteínas, enzimas y otros componentes celulares, alterando su estructura y sus funciones. Este metal puede afectar el metabolismo energético de la célula, desacoplando la fosforilación oxidativa mitocondrial (Frías et al., 2010).
Con respecto a las concentraciones de plomo encontrados en músculo e hígado, fue menor con respecto a los otros metales. Esto se debe a que, la mayor concentración del plomo se registra en huesos, lo que sugiere que el plomo presente en el agua puede penetrar a través de piel y las branquias (ambos tejidos en contacto directo con el agua), el mismo autor afirma que en branquias no se registró este metal, posiblemente porque puede estar pasando directamente a la sangre, donde es transportado a los huesos (Lozada, 2007). También, manifiesta que no detectó en músculo, branquias y vísceras; únicamente se registró en piel y huesos, exhibiendo la mayor concentración en huesos, la presencia de Pb en la piel y huesos, se debe a su sustitución en la ruta metabólica por el Ca. Es por eso que se registró en boquichico y carachama, pero no hubo presencia de este metal en julilla. La concentración máxima encontrada fue de 0,612 ppm lo que concuerda con las concentraciones de plomo en reportadas entre 0,02 y 2,634 en cuencas hidrográficas de los ríos Marañon y Amazonas (Salas et al., 2009), además de valores superiores que fueron reportados entre 7,15 a 10,29 en ejemplares capturados en el río Guasare (Salazar, 2009).
En carachama registramos una concentración máxima de 5,088 ppm de plomo en músculo mientras que se encuentra reportes de valores menores a 0,025 ppm en peces capturados en Ucayali y de 0,453 a 0,853 en las cuencas del Marañon y Ucayali. Para el caso de la julilla podemos indicar que no se detectó este metal en el músculo, posiblemente por la cantidad que existe es muy pequeña; sin embargo, existe información de plomo sobre esta especie, se reportó en julilla del río Nanay 0,5220 ppm, en Ucayali 0,01 ppm y Amazonas 0,0013 ppm (Pezo et al., 1992), y se indica el rango de 0,02 a 0,13 ppm de Iquitos y Puerto Maldonado (Salas et al., 2009).
De los resultados obtenidos, se determina que el contenido de plomo supera al límite permitido en el punto A, que indica la presencia de impactos ambientales y los posibles riesgos para los consumidores de pescados, en el punto C se encuentra por debajo del límite establecido, el plomo se acumula en los cuerpos de los organismos acuáticos y organismos del suelo y estos experimentarán efectos en su salud por envenenamiento (Hermoso y Márquez, 2005). El plomo puede afectar a varios órganos, causando sintomatologías diferentes y los niños son más sensibles que los adultos. Aunque una sola dosis puede causar problemas de toxicidad, es mucho más común que el envenenamiento por plomo sea causado por una exposición continua a bajas concentraciones (Frías et al., 2010).
Con respecto a las concentraciones de cobre en músculo de julilla, se reportan contenidos de 0,29 ppm en Puerto Maldonado y en la Amazonia, de 0,58 a 0,79 ppm (Salas et al., 2009); ello indica que nuestros valores registrados superan dichos contendidos de cobre en los tres puntos de muestreo evaluados. El menor contenido de cobre se registró en la especie carachama en el punto C con 1,833 ppm, lo que aduce que estamos por debajo de la norma oficial mexicana, que indica cantidad del cobre en protección de vida acuática el límite máximo 6 ppm (Secretaría de Gobernación de México, 2017). Con respecto al cobre en hígado, se registraron las concentraciones más altas siendo hasta 13,6 ppm en boquichico 24,2 ppm en carachama y 22,2 en julilla, contrastando con valores que reportan en trucha arcoíris de 164-379 ppm peso seco (Spiess, 2010), asimismo, investigadores realizaron un ordenamiento de las concentraciones observándose que la mayor está en el hígado (254 ppm Cu) y las branquias (114 ppm Zn) (Zorrilla, 2011), por lo que concluye que el órgano con mayor acumulación es el hígado, tal como se corrobora los resultados obtenidos.
La contaminación por metales pesados resulta ser peligrosa por tres características principales: toxicidad, persistencia y bioacumulación; a determinadas concentraciones, en el agua o en los sedimentos, la toxicidad implica la muerte por envenenamiento de las especies que habitan el medio (Quintero et al., 2010). Para el caso del agua, no se detectó plomo, posiblemente porque los valores estuvieron por debajo del límite de detección del equipo; se encontró 0,004 ppm en el río Santa y considera que el límite máximo del plomo en agua es 0,2 ppm (Romero et al., 2010). Según el análisis realizado la concentración de metales en agua está por debajo de los reportes de otras investigaciones, que reportaron cobre en agua entre 3,5 a 11,6 ppm en Venezuela (Toledo et al., 2000), en distintos países del mundo se encuentran en un rango de Cu de 5,7 a 20,7 ppm en agua (Murillo et al., 2013).
En sedimento, el metal que se encontró en mayor concentración fue el cobre en los tres puntos de muestreo variando de 19.9 a 29.21 ppm, la concentración de cobre obtenida en la investigación se encuentra dentro del rango reportado en otras investigaciones de cuencas hidrográficas, valores de 7,30 a 8,01 ppm de cobre en Venezuela (Toledo et al., 2000), y se menciona valores más altos de 36,6 ppm (Andrade, 1993). Los resultados de contenido de cobre en sedimento se relacionan directamente con el contenido de cobre encontrado en músculo e hígado de los peces. Además, existe diferencia significativa entre los puntos de muestreo siendo el punto c (sector granja) la que difiere de los otros dos puntos (aguas arriba) con lo que se ve un descenso que puede indicar que la fuente o fuentes de contaminación de este metal se encuentran más cercano al punto a (cruzpampa).
5. CONCLUSIONES
Las especies de peces boquichico (Prochilodus nigricans), carachama (Chaetostoma sp) y julilla (Parodon buckleyi) registraron acumulación de cadmio y cobre en músculo e hígado, siendo mayor la acumulación en hígado.
Las especies carachama (Chaetostoma sp) y boquichico (Prochilodus nigricans), acumularon plomo en músculo e hígado, no detectando este metal en julilla (Parodon buckleyi).
El boquichico (Prochilodus nigricans) presentó mayor acumulación de plomo en hígado y una menor acumulación en músculo.
La carachama (Chaetostoma sp) presentó mayor acumulación de plomo en músculo y una menor acumulación en hígado.
La especie con mayor concentración de cadmio y cobre en músculo e hígado es la julilla (Parodon buckleyi).
6. REFERENCIAS BIBLIOGRÁFICAS
Andrade, H. (1993). Libro Resúmenes XIII Jornadas Ciencias del Mar. Viña del Mar. Chile 1(1): 45-46.
Argota, G., Argota, H., Larramendi, D., Mora, Y., Fimia R., y Lannacone, J. (2012). Histología y química umbral de metales pesados en hígado, branquias y cerebro de Gambusia punctata (Poeciliidae) del río Filé de Santiago de Cuba. Rev. REDVET., Cuba. 12(5): 11-13.
Calao, C., y Marrugo, J. (2015). Efectos genotóxicos asociados a metales pesados en una
población humana de la región de La Mojana, Colombia, 2013. Biomédica 2015;35(Supl.2):139-51.
Cousillas, A. (2003). Evaluación y manejo de riesgos de la contaminación por Metales Tóxicos. Tesis Doctor en Toxicología e Higiene Ambiental. Buenos Aires, Argentina. Universidad de la República. 98pp.
Diringer, S., Feingold, B., Ortiz, E., Gallis, J., Araujo-Flores, J., Berky, A., Pan, W., y Hsu-Kim, H. (2014). River transport of mercury from artisanal and small-scale gold mining and risks for dietary
mercury exposure in Madre de Dios, Peru. Environ Sci Process Impacts. 2015 Feb;17(2):478-87.
FAO. (2003). Revisión del estado mundial de la acuicultura. Rev. 2. Roma, Italia. 95pp.
Frías, G., Osuna, I., Izaguirre, G., Aguilar, M., y Voltolina, D. (2010). Cadmio y plomo en organismos de importancia comercial de la zona costera de Sinaloa, México: 20 años de estudios. CICIMAR Oceánides, México. 25(2): 121-134.
García, D., y Alva, M. (2013). Contenido de metales pesados en pescados comercializados en Iquitos, Nauta y Requena. Rev. Ciencia amazónica. Iquitos, Perú. 3(1): 33-42.
Granada, N., y Escobar, D. (2012). Análisis y cuantificación de metales pesados (Pb, Cd, Ni y Hg) en agua, sedimentos y bioacumulación en la especie Rhandia wagne (barbudo) del río cauca en el municipio de la Virginia. Tesis Químico Industrial. Pereira, Colombia. Universidad Tecnológica de Pereira 82pp.
Hermoso, D., y Márquez, M. (2005). Evaluación de las concentraciones de metales pesados en tejidos de peces del río Catatumbo y sus afluentes. Tesis Ing. Químico. Maracaibo, Venezuela. Universidad Rafael Urdaneta. 58 pp.
Londoño, L., Londoño, P., y Muñoz, F. (2016). Los riesgos de los metales pesados en la salud humana y animal. Rev.Bio.Agro vol.14 no.2 Popayán Jul./Dec. 2016. 145-153 pp.
Lozada, J. (2007). Determinación de metales pesados en Cyprinus carpio en la laguna de Metztitlán, Hidalgo, México. Tesis licenciatura. Hidalgo, México. Universidad Autónoma del Estado de Hidalgo. 76pp.
Maldonado, J., Ortega, A., Usma, J., Galvis, G., Villa, F., Vásquez, L., Prada, S., y Ardila, C. (2005). Peces de los Andes de Colombia. Instituto de Investigación de Recursos Biológicos. Alexander Von Humboldt.1ra. ed. Bogotá D.C. Colombia. 346 pp.
Mancera, N., y Álvarez, R. (2006). Estado del conocimiento de las concentraciones de mercurio y otros metales pesados en peces dulceacuícolas de Colombia. Red de Rev. Científicas de América Latina. Bogotá, Colombia. 11(1): 3-23.
Murillo, V., Aroca, G., Duarte, C., Oyarzo, C., Oyarzún, M., Pinilla E., y Vera, R. (2013). Determinación y evaluación de los componentes presentes en las pinturas anti-incrustantes utilizadas en la acuicultura, sus efectos y la acumulación en sedimentos marinos de la región de Los Lagos. Instituto de Fomento Pesquero, Valparaíso (Chile). Informe técnico n°1. 257 pp.
Ortega, A., Murillo, O., Pimienta, C., y Sterling, E. (2000). Los peces del alto Cauca, riqueza ictiológica del Valle del Cauca. Ed. Imagen Corporativa. Cali, Colombia. 69pp.
Panebianco, M. (2011). Análisis de los niveles de metales pesados (Pb, Cu, Cr, Zn, Ni y Cd) y aspectos reproductivos del delfín franciscana (Pontoporia blainvillei). Tesis Doctoral Ciencias biológicas. Buenos Aires, Argentina. Universidad de Buenos Aires. 191pp.
Paredes, R., Álvarez, C., y Sandoval, D. (2010). Hidrobiología. Instituto de Investigaciones de la Amazonía Peruana. Iquitos, Perú. Informe técnico n°1. 88 pp.
Pezo, R., Paredes, H., y Bedayán, N. (1992). Determinación de metales pesados bioacumulables en especies ictiológicas de consumo humano en la Amazonia Peruana. Folia Amazónica. Iquitos, Perú. 4(2): 171-181.
Quintero, L., Agudelo, E., Quintana, Y., Cardona, G., y Osorio, F. (2010). Determinación de indicadores para la calidad de agua, sedimentos y suelos, marinos y costeros en puertos colombianos. Rev. Gestión y ambiente. Medellín. 13(3): 51-57.
Rada, O., Valle, D., Cabrera, C., Naola, D., y Tamariz, H. (2006). Cultivando peces amazónicos; Ministerio de producción. San Martin. 43-47.
Romero, A., Flores, S., y Pacheco, W. (2010). Estudio de la calidad de agua de la cuenca del río Santa. Rev. Instituto de Investigaciones. 13(25): 61-69.
Salas, A., Barriga, M., Albrecht, M., Chu, F., y Ortega, H. (2009). Información nutricional sobre algunos peces comerciales de la Amazonía peruana. Instituto Tecnológico Pesquero del Perú. Boletín de investigación n°9. 64 pp.
Salazar, R. (2009). Estado de conocimiento de las concentraciones de cadmio, mercurio y plomo en organismos acuáticos de Venezuela. Rev. REDVET, 10(11):1-16.
Sánchez, H., Dávila, E., Babilonia, E., y Rafael, R. (2010). Informe de evaluación sobre la presencia de petróleo en los ríos Amazonas y Marañón. Instituto de Investigaciones de la Amazonía Peruana. 17 pp.
Secretaría de Gobernación de México. (2017). Límites máximos permisibles de contaminantes en las descargas de aguas residuales en aguas y bienes nacionales. (en línea): http://www.dof.gob.mx/nota_detalle.php?codigo=5510140&fecha=05/01/2018.
Spiess, A. (2010). Determinación de elementos traza (Pb, Cd, Cu, Mn, Zn, Fe y As) en Trucha Arcoiris (Oncorhynchus mykiss) mediante espectrofotometría de absorción atómica en la X yXIV regiones de Chile. Tesis Químico Farmacéutico. Valdivia, Chile. Universidad Austral de Chile. 92 pp.
Toledo, J., Lemus, M., y Chung, K. (2000). Cobre, cadmio y plomo en el pez (Cyprinodon dearborni), sedimentos y agua en dos lagunas de Venezuela. Rev. Biol. Trop. 48(1): 225-231.
Zorrilla, M. (2011). Estado del arte sobre la presencia de metales pesados en tejidos y agallas de peces. Tesis Administrador del Medio Ambiente y de los Recursos Naturales. Santiago de Cali, Chile. Universidad autónoma de occidente. 63 pp.