Artículo Original
ACTIVIDAD LARVICIDA DE Bacillus thuringiensis H-14 var. israelensis Y Beauveria bassiana SOBRE Aedes aegypti
LARVICIDAL ACTIVITY OF Bacilllus thuringiensis H-14 var. israelensis AND Beauveria bassiana ON Aedes aegypti
1Neyde Rebaza-Sánchez; 2Gina Zavaleta-Espejo; 2Willian Blas-Cerdán; 2José Saldaña-Jiménez, 2Juan Pedro-Huaman
1 Hospital EsSalud Almanzor Asenjo Aguina Chiclayo-Lambayeque
2 Universidad Nacional de Trujillo
Autor para correspondencia: neyde_385@hotmail.com
Recibido: 20 de mayo, 2020. Aceptado: 7 de junio, 2020
RESUMEN
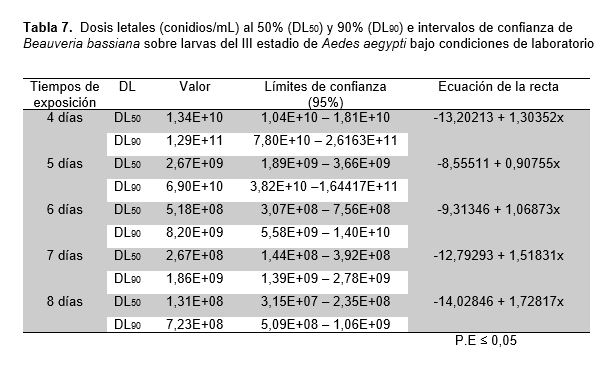
En el presente trabajo se evaluó la actividad larvicida de Bacillus thuringiensis H-14 var. israelensis y Beauveria bassiana sobre larvas del III estadio de Aedes aegypti, bajo condiciones de laboratorio, además se determinó la dosis letal media (DL50) y máxima (DL90). Se realizaron los bioensayos con doce grupos experimentales y dos grupos control, con tres repeticiones, utilizando 25 larvas del III estadio de A. aegypti en 100 mL de agua destilada por cada unidad experimental. Se utilizaron seis grupos experimentales con B. thuringiensis H-14 var. israelensis, a las concentraciones de 670; 1683; 4247; 10619; 26673; 67000 esp/mL y un grupo control; obteniéndose una mortalidad del 50% a las 8 horas y del 100% a las 24 horas. Con B. bassiana se utilizaron seis grupos experimentales a las concentraciones de 4x108; 1x109; 2,5x109; 6,3x109; 1,6x1010; 4x1010 conidios/mL y un grupo control; obteniéndose una mortalidad del 50% a los 7 días y del 100% a los 9 días. Mediante la dosis letal media (LD50) y máxima (DL90) se demostró que tanto B. thuringiensis H-14 var. israelensis como B. bassiana presentan mayor mortalidad en relación directa a la concentración e inversamente al tiempo. Se concluye que B. thuringiensis H-14 var. israelensis y B. bassiana a las diferentes concentraciones utilizadas en los bioensayos, presentó una alta actividad larvicida en A. aegypti bajo condiciones de laboratorio.
Palabras claves: entomopatógeno, mortalidad, control biológico, hongo, bacteria
ABSTRACT
The fact of this reasearch is the larvicidal activity of Bacillus thuringiensis H-14 var. israelensis and Beauveria bassiana on Aedes aegypti, under laboratory conditions. The average lethal dose (DL50) and maximun (DL90) was also determined. Biogical testings were used with twelve experimental groups and two control groups, with three replications, using 25 A. aegypti larvae in 100 mL of distilled water for each experimental unit. Six experimental groups with B. thuringiensis H-14 var. israelensis, at concentrations of 670; 1683; 4247; 10619; 26673; 67000 esp / mL and a control group; obtaining a mortality of 50% at 8 hours and 100% at 24 hours. With B. bassiana six experimental groups were used at concentrations of 4x108; 1x109; 2.5x109; 6.3x109; 1.6x1010; 4x1010 conidia/mL and a control group; obtaining a mortality of 50% at 7 days and 100% at 9 days. Using the mean lethal dose (LD50) and maximum (DL90), it was shown that both B. thuringiensis H-14 var. israelensis like B. bassiana present higher mortality in direct relation to concentration and inversely to time. In coclussion, B. thuringiensis H-14 var. israelensis and B. bassiana at the different concentrations used in the biological testings shows high larvicidal activity in A. aegypti under laboratory conditions.
Keywords: entomopathogen, mortality, biological control, fungus, bacteria.
DOI: http://dx.doi.org/10.17268/rebiol.2020.40.01.07
1. INTRODUCCIÓN
Las enfermedades cuyos agentes etiológicos son transmitidos por mosquitos vectores, se encuentran entre las principales que afectan a los humanos (Word Health Organization, 2014). En este contexto el virus del dengue es transmitido por la hembra del mosquito A. aegypti, que al alimentarse de la sangre de una persona infectada lo porta en su organismo e inicia la cadena de transmisión de la enfermedad (Duong et al., 2015). El ciclo biológico de este vector tiene dos etapas bien diferenciadas, la fase acuática con huevo, larva y pupa, y la fase aérea con el adulto o imago. A. aegypti es un mosquito doméstico por excelencia, vive en recipientes que acumulan agua por largo tiempo (Valdéz, 2009). En el departamento de La Libertad, las condiciones climáticas, el crecimiento urbano no planificado, la falta de saneamiento ambiental son factores propicios para la proliferación de este mosquito (Guerrero, 2018; Merino, 2019).
Durante muchos años se ha utilizado productos químicos para bajar los niveles de infestación de A. aegypti, tales como insecticidas organofosforados, piretroides, entre otros (Mendoza-Ledesma et al., 2015). En ese sentido el uso irracional de estos productos químicos ha contaminado el medio ambiente, debido a su efecto residual prolongado (Gallegos,1995; Gómez y Cáceres, 2010). En Brasil, Argentina, México, Cuba, entre otros se usa insecticidas entomopatógenos de hongos y bacterias, considerándose una alternativa para reemplazar a los plaguicidas químicos (Rodas, 2016). Existen controladores biológicos como hongos que presentan tales cualidades como: Beauveria, Metarhizium y Paecilomyces y bacterias como Bacillus thuringiensis (Dong et al., 2012; Soares-da Silva et al., 2015).
B. thuringiensis (Bti) fue descrita por el científico japonés Shigetane Ishiwata en 1900, pero fue investigada en el año 1911 por el bacteriólogo Berliner. El bacilo fue usado por primera vez para el control de insectos a finales de 1920. En 1977 Golbert y Margalit aislaron una cepa de B. thuringiensis en Israel, que fue identificada por De Barjac en 1978 y clasificada como serotipo H-14 var. israelensis que afecta de forma muy específica a las larvas de mosquitos de las especies A. aegypti, Anopheles albimanus y Culex quinquefasciatus (Galán, 1993). B. thuringiensis es el agente microbiano más utilizado en el control de vectores usado por más de 30 años y no ha mostrado resistencia en las poblaciones de mosquitos en diferentes regiones del mundo (Bravo et al., 2011; Stalinski et al., 2016). Bti es una bacteria gram positiva que genera toxinas muy específicas contra A. aegypti, las mismas que actúan por ingestión. En su proceso de esporulación produce cristales paraesporales formados por la glicoproteína delta-endotoxina (Chandrashekhar et al., 2014). Después de la ingestión del cristal biocida, las condiciones de pH y la presencia de enzimas proteolíticas en la porción intestinal de las larvas, hidroliza el cristal, dando lugar a la formación de una sustancia tóxica que desintegra el intestino medio de la larva ocasionándole la muerte (Da Costa et al., 2010). Trabajos realizados en Florida con B. thuringiensis H-14 mostraron una efectividad del 55% de mortalidad de A. aegypti (Pruszynski et al., 2017).
Beauveria bassiana, es un organismo eucariótico heterótrofo que parasita a varios insectos (Miranpuri y Khachatourians, G. 1991), pertenece a la clase Hyphomycete, división Deuteromicetes, es un hongo entomopatógeno (Echevarría, 2006). El ataque de este hongo sobre el insecto huésped se da principalmente por contacto y se realiza en diferentes etapas divididas en: adherencia, germinación, diferenciación y penetración (Kouassi, 2001). Alcalde et al. (2014) demostró la efectividad biocida de B. bassiana sobre larvas del III estadio de A. aegypti al quinto día de aplicación con un LC50 de 3,6x106 conidios/mL. Diversas investigaciones han demostrado su efectividad biológica en el combate de este insecto, a concentraciones de 1x107, 1x108 y 1x 109 bajo condiciones de laboratorio, con 80% de humedad y 27°C de temperatura, obteniendo elevados índices de mortalidad (Mwamburi et al., 2009; García-Munguía et al., 2011).
Es importante que los controladores biológicos vayan introduciéndose dentro de los programas de control de A. aegypti, ya que para reducir los índices aédicos se usa hasta la fecha el insecticida organofosforado temephos (Abate) para las fases larvarias y las cipermetrinas para los adultos, productos que se acumulan en el medio ambiente y además mata a otras formas de vida que se encuentran en la cadena alimenticia generando un desequilibrio en el ambiente (Montada et al., 2006; Guzmán y Cabrejos, 2017). Cabe recalcar que el vector del Dengue está mostrando resistencia a los productos químicos usados en el Perú y en otros lugares del mundo (Bisset et al., 2016). Por tal motivo es que el presente trabajo tuvo como objetivo evaluar la actividad larvicida de B. thuringiensis H-14 var. israelensis y B. bassiana sobre A. aegypti; así como también determinar la DL50 (dosis letal media) bajo condiciones de laboratorio.
2. MATERIALES Y MÉTODOS
OBTENCIÓN Y MANTENIMIENTO DE LARVAS III DE A. aegypti:
Se trabajó con larvas de A. aegypti que fueron colectadas de barriles revestidos de cemento y baldes de plástico de viviendas positivas al vector del Distrito de Laredo, Provincia de Trujillo, Departamento de La Libertad; estas fueron colectadas con goteros de plástico y colocados en frascos de plástico hasta su traslado al laboratorio Biología (MINSA, 2017).
CRIANZA DE Aedes aegypti:
En laboratorio, las larvas fueron colocadas en recipientes de plástico de 40x28X5 cm con 1 L de agua potable declorada, y fueron alimentadas durante todos los estadios con “alimento de peces” bien triturado previa esterilización (Zavaleta, 2010). El agua se cambió cada dos o tres días dependiendo de la descomposición orgánica, hasta que las larvas alcanzaron el estadio de pupa. Las pupas fueron colocadas en una jaula para adultos, las hembras (hematófagas) fueron alimentadas a la exposición cutánea de un cobayo por unos 30 minutos; y los machos (fitófagos) fueron alimentados con glucosa al 10 %. Se acondicionó un vaso descartable pequeño con agua potable declorada, donde se colocó papel filtro adherido a las paredes, sobre el cual las hembras realizaron la oviposición aproximadamente entre 50 y 100 huevos por hembra (Pérez et al., 2004). Después de obtener un número suficiente fueron sumergidos en agua potable hasta obtener las larvas de III estadio que fueron utilizadas en los bioensayos.
PREPARACIÓN DEL CULTIVO DE B. thuringiensis H-14 var. israelensis:
La cepa de B. thuringiensis H-14 var. israelensis se obtuvo de la Universidad Cayetano Heredia perteneciente al lote Nº 91509 del Instituto Pasteur de Paris – Francia.
Reactivación de la cepa: Se tomó una asada del cultivo obtenido en el medio TPH (Triptosa fosfato) y se sembró por el método de agotamiento en medio agar NYSMA para la esporulación, luego se incubó a 30ºC por 24 horas. Se realizó el control microbiológico mediante la coloración Gram y verde de malaquita modificado (Ventosilla et al., 2000). Para el reaislamiento se seleccionó una colonia típica y se tomó una asada de esta y se procedió como en el caso anterior.
Siembra en el medio Agar Nysma: Para la siembra se tomó una asada de una colonia típica de B. thuringiensis H- 14 var. israelensis y se hizo una suspensión en 1ml de solución salina estéril y se homogenizó por 3 minutos. De este homogenizado se extrajo 100 uL y se hicieron 3 diluciones con solución salina estéril, la última dilución se sembró en seis placas por desplazamiento superficial y colocado a estufa por 30ºC durante 96 horas. Cada 24 horas se hizo el control microbiológico (coloración Gram y verde de malaquita modificado) (Vandekar y Dulmage, 1982).
Cosecha de B. thuringiensis H-14 var. israelensis: Concluido el tiempo de incubación se realizó la cosecha, en tubos cónicos estériles. Para el primer lavado se agregó 10 mL de solución salina estéril y se centrifugó a 3500 r.p.m. por 25 minutos, para los dos lavados siguientes se realizó el mismo procedimiento que para el primer lavado. Finalmente, la cosecha se inactivó a 75ºC por 15 minutos y se realizó los respectivos controles microbiológicos y toxicológicos. El resto se selló y guardó a 4ºC hasta su posterior uso (Ventosilla et al., 2000).
Dosificación del inóculo: Del lavado obtenido se hicieron 8 diluciones, que fueron sembradas en medio Agar NYSMA para el conteo de colonias, determinándose la concentración madre y de la cual se obtuvo las diferentes concentraciones que fueron usadas en el bioensayo (Vargas et al, 2001).
INOCULACIÓN DE LAS CONCENTRACIONES DE B. thuringiensis H-14 var. israelensis SOBRE LAS LARVAS DE III ESTADIO DE A. aegypti
Para el bioensayo de capacidad biocida se utilizarón 525 larvas de A. aegypti de III estadio de desarrollo, las que se repartieron en vasos de plástico de 250 mL de capacidad, cada vaso con 25 larvas y 100mL de agua destilada. Se trabajó por triplicado 7 grupos, de los cuales seis fueron experimentales y el séptimo fue el grupo control. A los experimentales se les adicionó una suspensión de B. thuringiensis H-14 var. israelensis a las concentraciones de 670; 1683; 4227; 10619; 26673 y 67000 esp/mL respectivamente. Al grupo control no se le adicionó la suspensión bacteriana. A los siete grupos se mantuvo a las mismas condiciones ambientales de temperatura y humedad relativa, las lecturas fueron realizadas a las 2, 4, 6, 8,12 y 24 horas (Zavaleta, 2010).
PREPARACIÓN DEL CULTIVO DE Beauveria bassiana:
El cultivo de B. bassiana Uchisa-Perú fue proporcionada por el laboratorio de Biología Celular de la Facultad de Ciencias Biológicas, Universidad Nacional de Trujillo.
Siembra de la Cepa de B. bassiana: Se tomó esporas del cultivo y se sembró en 6 frascos de vidrio estériles con medio Agar Papa Dextrosa, estos fueron incubados a 27 °C, por ocho días hasta observar la formación de colonias características de B. bassiana (Lucero et al., 2004).
Cosecha del hongo: A los 8 días, de los 6 frascos de vidrio sembrados, se realizó la cosecha, la que fue colocada en una suspensión de Tween 80 al 0.1% (Gerónimo-Torres et al., 2016).
Dosificación del inóculo: A partir de esta suspensión se hicieron diluciones seriadas y con un microscopio de luz (40x) más la cámara Neubauer, se realizó el recuento de los conidios infectivos por mililitro a fin de calcular la concentración de la suspensión madre (Gerónimo-Torres et al., 2016).
INOCULACIÓN DE LAS CONCENTRACIONES DE B. bassiana SOBRE LAS LARVAS DE III ESTADIO DE A. aegypti.

INDICADORES DEL EFECTO DE B. thuringiensis H-14 var. israelensis y de B. bassiana SOBRE LAS LARVAS DE A. aegypti
Las larvas que fueron afectadas por B. thuringiensis H-14 var. israelensis presentaron color negruzco, deshidratadas y no tuvieron movimiento (Federici, 1982). Las larvas que fueron afectadas por B. bassiana presentaron color pardo oscuro, disminución en la movilidad y alimentación, desecación del tejido, y momificación (Anderson et al., 1989).

ANÁLISIS ESTADÍSTICO:
Con los datos obtenidos se calculó los estimadores estadísticos como la media, varianza, error estándar, análisis de regresión para determinar la relación entre las concentraciones de B. thurigiensis H-14 var. israelensis y de B. bassiana, en la mortalidad de larvas de Aedes aegypti, así como también se realizó el análisis de varianza y la comparación de promedios mediante la Prueba de Comparación Múltiple de Duncan con una PEI ≤ 0.05 para determinar la existencia de diferencias significativas (Calzada, 1994). Se utilizó el software libre R para realizar el análisis estadístico con una PE≤0.05.
3. RESULTADOS
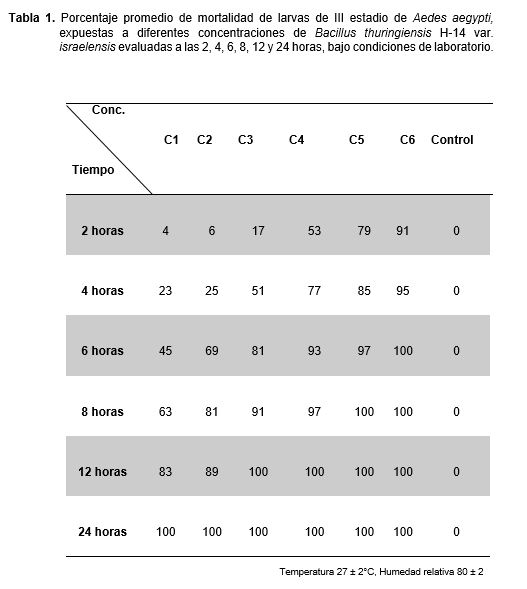
En la Tabla 1, se presenta el porcentaje promedio de mortalidad de larvas del III estadio de A. aegypti expuestas a diferentes concentraciones de B. thuringiensis H-14 var. israelensis evaluadas a las 2, 4, 6, 8, 12 y 24 horas. Se observó que a las 2 horas el mayor porcentaje de mortalidad de larvas fue a la concentración de 67000 esp/mL y a las 4 horas el porcentaje de mortalidad fue mayor al 50% en las concentraciones 4227; 10619; 26673; 67000 esp/mL; y a las 24 horas el porcentaje de mortalidad de larvas fue de 100% en las seis concentraciones mientras que en el control no murió ninguna larva.

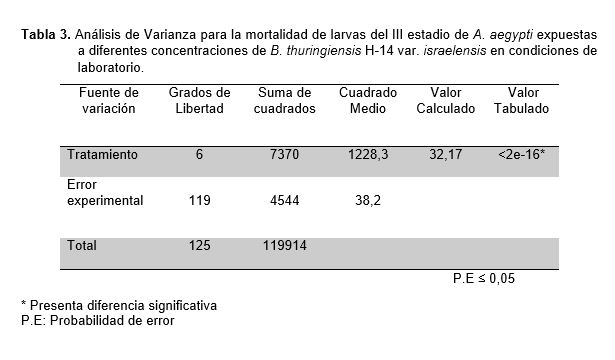
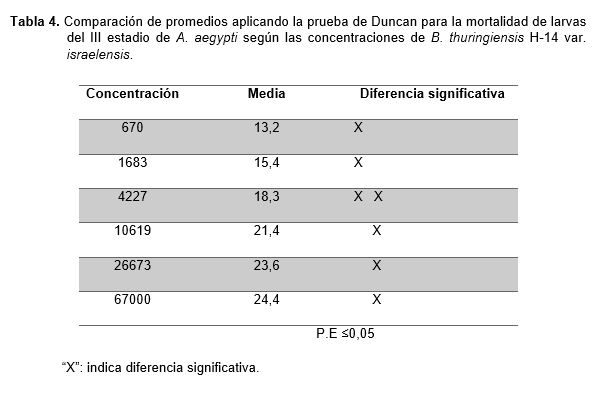
Se demostró la existencia de diferencias significativas a través del análisis de varianza para la mortalidad del III estadio larval de A. aegypti a diferentes concentraciones de B. thuringiensis H-14 var. israelensis, tal como se demuestra en la Tabla 3, a través de la comparación de los promedios aplicando la prueba de Duncan (Tabla 4).
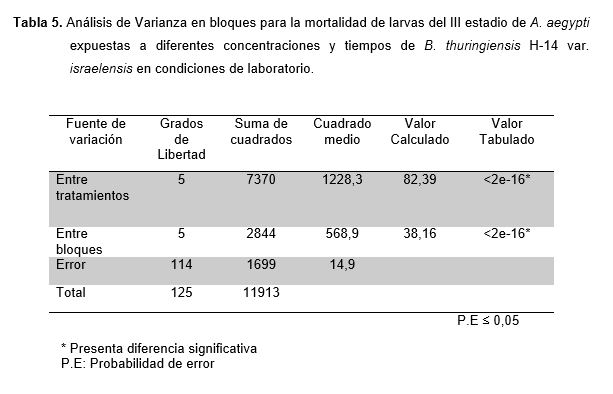
En la Tabla 5, se observa el Análisis de Varianza en Bloques para la mortalidad de larvas de A. aegypti expuestas a diferentes concentraciones y tiempos de exposición de B. thuringiensis H-14 var. israelensis en condiciones de laboratorio, el cual demostró presentar diferencias significativas entre bloques (tiempos) y en los tratamientos (concentración).

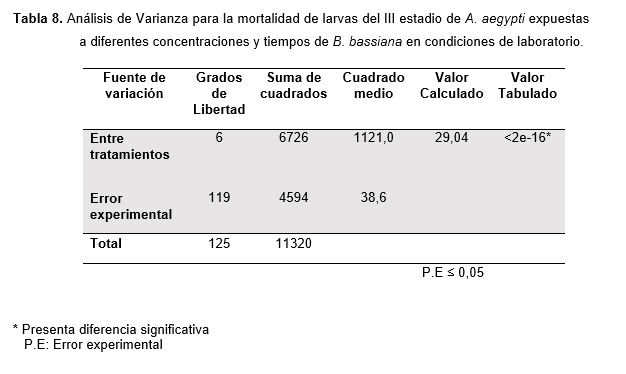
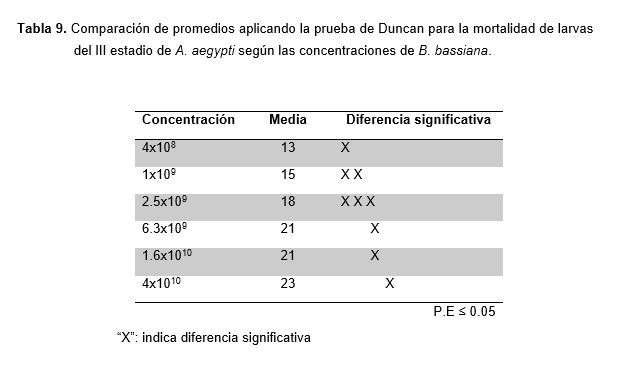
El Análisis de Varianza para la mortalidad de larvas del III estadio de A. aegypti expuestas a diferentes concentraciones de B. bassiana bajo condiciones de laboratorio demostró presentar diferencias significativas entre los tratamientos (concentración) como se demuestra en la Tabla 8, a través de la comparación de los promedios aplicando la prueba de Duncan (Tabla 9).
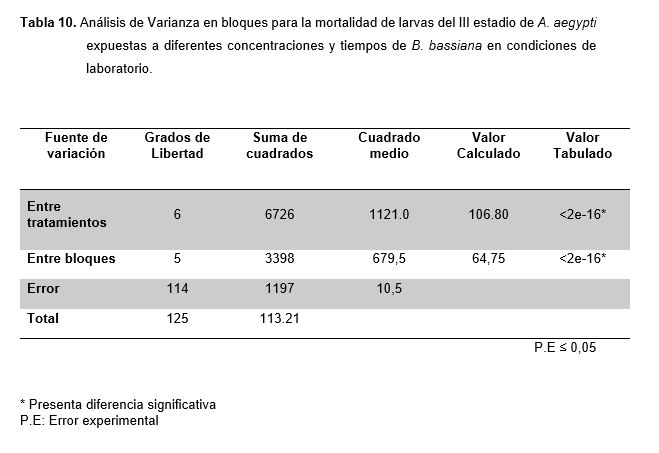
En la Tabla 10, se observa el Análisis de Varianza en Bloques para la mortalidad de larvas de A. aegypti expuestas a diferentes concentraciones y tiempos de exposición de B. bassiana en condiciones de laboratorio, el cual demostró presentar diferencias significativas entre bloques (tiempos) y en los tratamientos (concentración).


4. DISCUSIÓN
Al evaluar la actividad larvicida de Bacillus thuringiensis H-14 var. israelensis (Bti) en A. aegypti, se encontró que las diferentes concentraciones de Bti y tiempos de exposición ocasiona una mortalidad significativa sobre las larvas del III estadio (Tabla 1), en la misma tabla se observa que a mayor concentración del Bti mayor es la mortalidad larval producida, resultados concordantes con Lee y Zairi (2006), quienes demostraron una reducción de más del 80% de Aedes en los contenedores tratados en condiciones de campo en Malasia. La muerte masiva de las larvas del III estadio de A. aegypti a las 24 horas, en el mismo sentido Couch (1980), señala que altas mortalidades larvales de mosquitos se producen entre las 24 y 48 horas de realizadas las aplicaciones. Los resultados obtenidos en la investigación se encuentran dentro de los límites establecidos del tiempo de mortalidad.

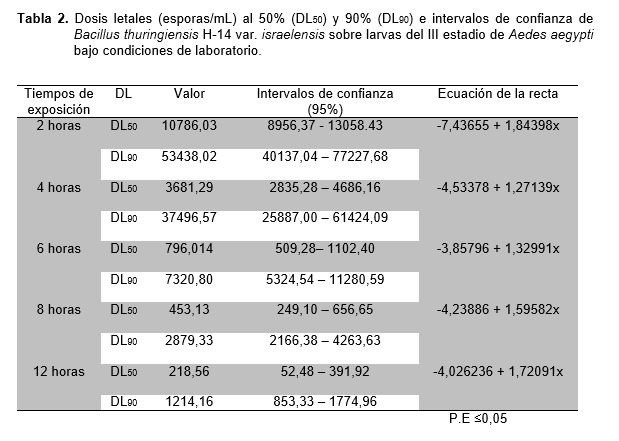
Con respecto a los resultados obtenidos se observa que el número de larvas muertas de A. aegypti se va incrementando hasta el sexto tratamiento en cada repetición y dentro de cada concentración, este comportamiento distinto indicado con sus promedios fue confirmados por el análisis de varianza (Tabla 3), para identificar la existencia de diferencias significativas entre los tratamientos. Sin embargo, a pesar de ser un método riguroso es muy genérico y sensible a las diferencias que se puedan presentar por lo menos en un par de tratamientos, ante ello se aplicó la prueba de comparación de promedios de Duncan (Tabla 4). Estas diferencias que existen entre todos los tratamientos se deberían a la cantidad de cristales ingeridos por las larvas de acuerdo a la concentración, pues a mayor concentración, mayor es la cantidad de cristales, desencadenándose su acción tóxica y provocando la muerte de las larvas (Percy y Fast, 1986). El cristal proteico de (Bti) evidenciado con la coloración verde de malaquita modificado demostró ser efectivo contra las larvas del III estadio de A. aegypti. Sin embargo, nuestros resultados demostraron que la eficiencia del (Bti) aplicado en menor concentración se vio reducido durante las primeras horas como lo menciona (Becker et al., 1992). Según estudios realizados en laboratorio demuestran que las larvas de Aedes y Culex necesitan temperaturas óptimas que oscilan entre 28 y 30 ºC para aumentar su efectividad y por lo tanto su metabolismo (Delnat et al., 2019).
Cuando se trabaja con más de una variable y se desea comprobar si una de ellas ejerce un efecto en el comportamiento de la otra es necesario aplicar un diseño experimental en bloques completos al azar, en nuestro trabajo comprobamos que la variable tiempo de exposición influye en la actividad larvicida del Bti (Tabla 5), tal como lo reporta en su investigación Chandrashekhar et al., (2014) a mayor tiempo de exposición el porcentaje de mortalidad larval es alta, llegando al 100% a las 24 horas.
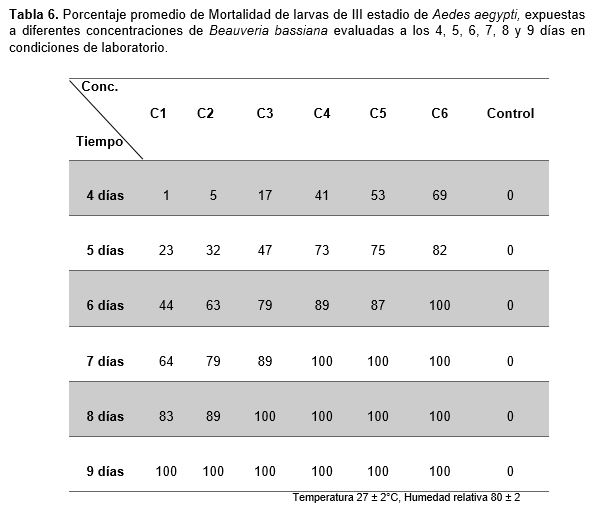
En la Tabla 6, se observa que el porcentaje promedio de mortalidad de larvas de A. aegypti a la aplicación de B. bassiana se da a partir de los 4 días y está en relación directa al tiempo y a la concentración, pues a mayor tiempo de exposición a las concentraciones aumenta la mortalidad de larvas de A. aegypti, resultados similares a los obtenidos por Miranpuri y Khachatourians, (1991), quienes encontraron una gran efectividad de B. bassiana, contra este insecto. Esta efectividad se debe a los conidios de B. bassiana pues estos son retenidos por contacto en la superficie de la cutícula hasta formar los túbulos germinales que facilitan la diseminación del hongo a través del hemocele (Deshpande, 1999), alterando sus funciones fisiológicas, así como, el deterioro de sus órganos hasta producirle parálisis y finalmente la muerte en un lapso entre 4 y 12 días (Ishii et al., 2015), corroborando los resultados obtenidos, encontrándose dentro de los límites establecidos del tiempo de mortalidad.

De los resultados obtenidos para B. bassiana se observa que el número de larvas muertas de A. aegypti va incrementando hasta el sexto tratamiento en cada repetición y dentro de cada concentración, este comportamiento variado en sus promedios fue confirmado por el análisis de varianza donde se determinó la existencia de diferencias significativas entre los tratamientos (Tabla 8), ante ello se aplicó la prueba de comparación de promedios de Duncan (Tabla 9). Según el Análisis de Varianza en bloques realizados para B. bassiana (Tablas 10), muestran que el nivel de variación tiempo afecta el comportamiento de los tratamientos, puesto que este es un ser vivo parasito facultativo cuyo proceso infectivo de las esporas pasa por cuatro etapas que se completan en un lapso de 4 a 12 días hasta que se produce la muerte del hospedero (Kuoassi, 2001), por lo tanto el efecto que producen los conidios de B. bassiana depende del tiempo que transcurra, así como también de la concentración y de la cepa utilizada.
El cultivo de B. bassiana Uchisa-Perú, utilizada en esta investigación es normalmente empleada para matar especímenes del orden lepidóptera, y al ser probada sobre larvas de A. aegypti mostró ser un excelente larvicida, aun cuando el cultivo utilizado no es específico para especies del orden díptera. Esto corrobora los resultados reportados por Maniania y Fargues (1984); Feng y Jhonson (1990), quienes encontraron que la especificidad de los aislados de hongos (Hyphomycetes) entomopatógenos no es estrecha y que el insecto hospedero de origen, no tiene influencia significativa con la virulencia, en este grupo de hongos.
Existen varios factores que regulan la virulencia en un hongo entomopatógeno, la germinación, el equipo enzimático, la capacidad de penetración y el de vencer los mecanismos de resistencia, por parte de los hemocitos del insecto, así como la producción de metabolitos tóxicos, son algunos de ellos (Pelizza et al., 2020). Del mismo modo por parte del insecto, la especie, la raza, momento de su ciclo biológico, estado fisiológico y algunos factores físicos como la temperatura y la humedad relativa, modifican la expresión de la virulencia (Maniania y Fargues, 1984). Por lo tanto, B. bassiana requiere de una temperatura óptima para su crecimiento de 27±2 °C y de una humedad relativa de 80% ± 2, factores que podrían afectar la expresión de su virulencia.
En la presente investigación los resultados obtenidos, evidencian el alto potencial el uso de entomopatógenos, para el control de A. aegypti, siendo una alternativa para implementar en la lucha contra los vectores e ir reemplazando a los insecticidas químicos que alteran y permanecen en el medio ambiente, sobre todo porque algunos insectos han desarrollado resistencia. Por lo tanto, se propone el uso tanto (Bti) y B. bassiana como una alternativa al control de A. aegypti, principal transmisor de dengue en la provincia de Trujillo.
5. CONCLUSIONES
Bacillus thuringiensis H-14 var. israelensis y B. bassiana presentó una alta actividad larvicida sobre A. aegypti bajo condiciones de laboratorio.
La más alta concentración (esp/mL) de B. thuringiensis H-14 var. israelensis presentó un mayor porcentaje de mortalidad de larvas del III estadio de A. aegypti en el menor tiempo de exposición.
La más alta concentración (conidios/mL) de B. bassiana presentó un mayor porcentaje de mortalidad de larvas del III estadio de A. aegypti en el menor tiempo de exposición.
6. REFERENCIAS BIBLIOGRÁFICAS
Alcalde, J., Roldán, J., Saravia, V., y Collantes, L. (2014). Efecto Biocida de diferentes concentraciones de Metarhizium anisopliae ccb-le302 y Beauveria Bassiana CCB-LE265 sobre larvas III de Aedes aegypti. UCV - Scientia 6(1): 33-40.
Anderson, T., Hajek, A., Roberts, D., Preisler, H., y Robertson, J. (1989). Colorado potato beetle (coleoptera: Chrysomelidae): effects of combinations of Beauveria bassiana, with insecticides. Journal of Econ. Entomol 82 (1): 83-89.
Becker, N., Zgomba, M., Ludwing, M., Petric, D., y Rettich, F. (1992). Factors influencing the activity of Bacillus thuringiensis var israeliensis treatments. J Am Mosq Control Assoc. 8(3): 285-289.
Bisset, J., Rodríguez, M., Hurtado, D., Hernández, H., Valdéz, V., y Fuentes, I. (2016). Resistencia a insecticidas y sus mecanismos bioquímicos en Aedes aegypti del municipio Boyeros en los años 2010 y 2012 Revista Cubana de Medicina Tropical 68(1): 82-94.
Blas, W., Zavaleta, G., Blas, W., y Meléndez, D. (2017). Efecto biocida de Bacillus thuringiensis H-14 var. israelensis mutante sobre larvas III de Aedes aegypti bajo condiciones de laboratorio. REBIOL 37(2): 14 -21.
Bravo, A., Likitvivatanavong, S., Gill, S., y Soberón, M. (2011). Bacillus thuringiensis: A story of a successful bioinsecticide. Insect Biochemistry and Molecular Biology Volumen 41(7): 423-431.
Calzada, J. (1994). Modelos estadísticos para la investigación. Lima – Perú: 447.
Chandrashekhar, P., Hemant, B., y Satish, P. (2014). Evaluation of Different Culture Media for Improvement in Bioinsecticides Production by Indigenous Bacillus thuringiensis and their Application against Larvae of Aedes aegypti. Scientific World Journal Volumen 2014: 1-6.
Couch, T. (1980). Mosquito pathogenicity of Bacillus thuringiensis var israelensis. Developments in Industrial Microbiology. 9(4)22-27.
Da Costa, J., Rossi, J., Marucci, S., Alves, E., Volpe, H., Ferraudo, A., y Lemos, M. (2010). Atividade Tóxica de Isolados de Bacillus thuringiensis a Larvas de Aedes aegypti (L.) (Diptera: Culicidae. Neotropical Entomology 39(5):757-766.
Daniel, J., Silva, A., Nakagawa, D., Medeiros, L., Carvalho, M., Tavares, L., Abreud, L., y Rodrigues, E. (2017). Larvicidal Activity of Beauveria bassiana Extracts against Aedes aegypti and Identification of Beauvericins. J. Braz. Chem. vol.28 no.6: 1003-1013.
Delnat, V., Tran, T., Janssens, L., y Stoks, R. (2019). Daily temperature variation magnifies the toxicity of a mixture consisting of a chemical pesticide and a biopesticide in a vector mosquito. Science of The Total Environment Vol 659: 33-40.
Deshpande, M. (1999). Mycopesticide production by fermentation: potential and challenges. Crit. Rev. Microbiol. 25: 229-243.
Dong, Y., Morton, J., Ramírez, J., Souza-Neto, J., y Dimopoulos, G. (2012). The entomopathogenic fungus Beauveria bassiana activate toll and JAK-STAT pathway-controlled effector genes and anti-dengue activity in Aedes aegypti. Insect Biochemistry and Molecular Biology 42: 126-132.
Duong, V., Lambrechtsb, L., Paul, R., Ly, S., Srey, R., Long, K., Huy, R., Tarantola, A., Scott, T., Sakuntabhai, A., y Buchy, P. (2015). Asymptomatic humans transmit dengue virus to mosquitoes. PNAS vol. 112, Núm. 47: 14688–14693.
Echeverría, F. (2006). Caracterización biológica y molecular de aislamientos del hongo entomopatógeno Beauveria bassiana (Bálsamo) Vuillemin 2006. Instituto Tecnológico de Costa Rica, Costa Rica.
Federici, A. (1982). Site of action of the delta-endotoxin of Bacillus thuringiensis in mosquito and blackfly larvae. In: Basic biology of microbial larvicides of vector of human diseases. Special program for research and training in tropical diseases. Geneva, Switzerland: UNDP/WORLD BANK/WHO; p. 37-47.
Feng, M., y Jhonson, J. (1990). Relative virulence, of si isolates of Beauveria bassiana on Diuraphis noxia. Environ. Entomol.19, 785 – 790.
Galán, L. (1993). Seleccion de cepas nativas y de extractos de fermentacion de Bacillus thuringiensis contra Trichoplusia ni (Hubner) Heliothis virescens (Fabricius) (Lepidóptera: Noctuidae). (Tesis doctoral). Universidad Autónoma de Nuevo León, México.
Gallegos, I. (1995). Respuesta hematológica del bagre de canal Ictalurus punctatus (Rafinesque, 1818) a exposiciones subletales CL50 96 hrs. del insecticida organofosforado Abate (temephos) en condiciones de laboratorio. (Tesis de maestría). Universidad Autónoma de Nuevo León, México.
García-Munguía, A., Garza-Hernández, J., Rebollar-Tellez, E., Rodríguez-Pérez, M., y Reyes-Villanueva, F. (2011). Transmission of Beauveria bassiana from male to female Aedes aegypti mosquitoes. Parasites & Vectors 2011, 4:24.
Gerónimo-Torres, J., Torres-De La Cruz, M., De La Cruz-Perez, M., Pérez-De La Cruz, M., De La Cruz-Pérez, A., Ortiz-García, F., y Cappello-García, S. (2016). Caracterización de aislamientos nativos de Beauveria bassiana y su patogenicidad hacia Hypothenemus hampei, en Tabasco, México, Revista Colombiana de Entomología 42 (1): 28-35.
Gómez, M., y Cáceres, J. (2010). Toxicidad por insecticidas organofosforados en fumigadores de Campaña contra el Dengue, estado Aragua, Venezuela, año 2008. Boletín de Malariología y Salud Ambiental Vol. L, Nº 1, enero-julio.
Guerrero, M. (2018). Relación entre la Gestión en Promoción de la Salud y las Prácticas de Prevención del Dengue en las familias de Pueblo Viejo -2018. (Tesis de maestría). Universidad César Vallejo, Trujillo-Perú.
Guzmán, J., y Cabrejos, K. (2017). Evaluación de la resistencia del temephos (abate) y efectividad del regulador de crecimiento pyriproxyfen (pyrilarv 0.5 %) en poblaciones de Aedes aegypti de Olmos y Tumán. Lambayeque. (Tesis de pregrado). Universidad Pedro Ruíz Gallo, Perú.
Ishii, M., Takeshita, J., Ishiyama, M., Tani, M., Koike, M., y Aiuchi, D. (2015). Evaluation of the pathogenicity and infectivity of entomopathogenic hypocrealean fungi, isolated from wild mosquitoes in Japan and Burkina Faso, against female adult Anopheles stephensi mosquitoes. Fungal Ecology 15: 39-50.
Kouassi, M. (2001). Les possibilités de la lutte microbiologique emphase sur le champignon entomopathogène B. bassiana. Universidad de Québec, Montreal, Canada. Vertigo. La revista en ciencias ambientales de la web. 2(2).
Lee, Y., y Zairi, J. (2006). Susceptibility of Laboratory and Field-Collected Aedes Aegypti and Aedes albopictus to Bacillus thuringiensis Israelensis H-14. J Am Mosq Control Assoc 22(1):97-101.
Lucero, M., Peña, L., y Bacca, T. (2004). Evaluación de la actividad biocontroladora de Beauveria bassiana y Metarhizium anisopliae sobre larvas de Ancognatha scarabaeiodes (Coleoptera: Scarabaeidae). Revista Corpoica Vol 5 N°1: 43-48.
Maniania, N. y Fargues, J. (1984). Specificitedes Hyphomycetes enthomopatogenes pour les larves de lepidopteros Noctuidae. Entomophaga. 1984. 29: 451 – 464.
Mendoza-Ledesma, M., Rodríguez-Ramírez, A., Penilla-Navarro, M., y Vásquez-Martínez, G. (2015). Compatibilidad de hongos entomopatógenos e insecticidas organofosforados para el control de Aedes aegypti (Diptera: Culicidae). Entomología Mexicana Vol. 2: 229-234.
Merino, G. (2019). Relación entre la Gestión en Promoción de la Salud y las Prácticas de Prevención del Dengue en las familias de Pueblo Viejo -2018. (Tesis de segunda especialidad). Universidad Nacional de Trujillo, Perú.
MINSA. (2017). Programa de entrenamiento en salud pública diri¬gido a personal del servicio militar voluntario: Vigilan¬cia y Control Vectorial. Guía del practicante. Ministerio de Salud. Instituto Nacional de Salud. Lima. 64 p.
Miranpuri, G., y Khachatourians, G. (1991). Infection sites of the entomopathogenic fungus Beauveria bassiana in the larvae of the mosquito Aedes aegypti. Entomol. exp. appl. 59: 19-27.
Montada, D., Zaldívar, J., Figueredo, D., Suárez, S., y Leyva, M. (2006). Eficacia de los tratamientos intradomiciliarios con los insecticidas cipermetrina, lambdacialotrina y clorpirifos en una cepa de Aedes aegypti. Rev Cubana Med Trop 58(2):148-54.
Mwamburi, L., Laing, M., y Miller, R. (2009). Interaction between Beauveria bassiana and Bacillus thuringiensis var. israelensis for the control of house fly larvae and adults in poultry houses. Poultry Science 88:2307–2314.
Pelizza, S., Medina, H., Ferreri, N., Elíades, L., Pocco, M., Stenglein, S., y Lange, C. (2020). Virulence and enzymatic activity of three new isolates of Beauveria bassiana (Ascomycota: Hypocreales) from the South American locust Schistocerca cancellata (Orthoptera: Acrididae). Journal of King Saud University-Science Volumen 32, issue 1: 44-47.
Penata, Z., Nakagoshi, N., Suharjono, y Setyowati, F. (2013). Toxicity studies for indigenous Bacillus thuringiensis isolates from Malang city, East Java on Aedes aegypti larval. Asian Pac J Trop Biomed 2013; 3(2): 111-117.
Percy, J., y Fast P.G. (1986). Bacillus thuringiensis cristal toxina studies of its effect on silword. Invertebrate Patholgy 41(1): 96-98.
Pérez, O., Rodríguez, J., Bisset, J., Leyva, M., Díaz, M., Fuentes, O., Ramos, F., Gonzales, R., y García I. (2004). Manual de indicaciones técnicas para insectarios Editorial Ciencias Médicas. La Habana. Cuba.
Pruszynski, C., Hribar, L., Micke, R., y Leal, A. (2017). A Large Scale Biorational Approach Using Bacillus thuringiensis israeliensis (Strain AM65-52) for Managing Aedes aegypti Populations to Prevent Dengue, Chikungunya and Zika Transmission. https://doi.org/10.1371/journal.pone.0170079.
Rodas, V. (2016). Efecto de combinaciones de Gliocladium virens e insecticidas químicos sobre Aedes aegypti vector de dengue y Chikungunya”. (Tesis de maestría). Instituto Nacional de Salud Pública, México.
Soares-da Siva, J., Soares, V., Litaiff-Abreu, E., Polanczyk, R., y Tadei, W. (2015). Isolation of Bacillus thuringiensis from the state of Amazonas, in Brazil, and screening against Aedes aegypti (Diptera, Culicidae). Revista Brasileira de Entomología 59: 1-6.
Stalinski, R., Laporte, F., Tetreau, G., y Després, L. (2016). Receptors are affected by selection with each Bacillus thuringiensis israelenesis Cry toxin but not with the full Bti mixture in Aedes aegypti. Infection, Genetics and Evolution Volumen 44: (218-227).
Valdéz, N. (2009). Caracterización morfológica y genética de poblaciones urbanas y rurales de Aedes (Stegomyia) aegypti L. (Diptera - Culicidae) ubicadas en localidades endémicas de dengue en Bolivia. (Tesis de pregrado). Universidad Autonoma "Gabriel René Moreno", Santa Cruz, Bolivia.
Vandekar, M., y Dulmage, H. (1982). Guidelines for production of Bacillus thuringiensis SH-14. Edit. UNDP/WORLD BANK/WHO. Special programme for research and training in tropical diseases. Genera. Switzerland.
Vargas, F., Roldán, J., Zavaleta, G., Gil, F., Ampuero, C., Burga, A., Moreno, B., Vergara, C., y Ventosilla, P. (2001). Producción de Bacillus thuringiensis H -14 var. Isrraelensis utilizando “espárrago” y su uso potencial para el control de la malaria en la Libertad – Perú; Revista Peruana de Medicina Experimental; vol18; n3-4: 82-89.
Ventosilla, P., y Chauca, J. (2000). Instructivo para el Control de Calidad de Bioinsecticidas Bacterianos. Instituto de Medicina Tropical Alexander von Humboltd. Universidad Peruana Cayetano Heredia. Perú.
Word Health Organization. (2014). A global brief on vector-borne diseases. WHO/DCO/WHD/2014. Geneva. 56 pp.
Zavaleta, G. (2010). Evaluación de la capacidad biocida de Bacillus thuringiensis H-14 var. israelensis cultivado en sanguaza sobre larvas de Aedes aegypti en el distrito de Laredo La Libertad - Peru, 2008 - 2009. (Tesis doctoral). Universidad Nacional de Trujillo, Perú.