Artículo Original
EFECTO DEL FOLLAJE DE Ricinus communis SOBRE LA NODULACIÓN RADICULAR DE Meloidogyne sp. EN PLANTAS DE TOMATE
EFFECT OF Ricinus communis FOLIAGE ON Meloidogyne sp. ROOT-GALLING IN TOMATO PLANTS
Lizbeth Armas-Mantilla1, Yuli Janeth Barrios-Cárdenas1, Jackson Ivan Briceño-Muñoz1, Iris Alzugaray-Agreda1, Santos Nélida Murga-Gutiérrez1†
1Universidad Nacional de Trujillo
*Autor de correspondencia: ivanj24@hotmail.com
Recibido: 26 de mayo, 2020. Aceptado: 27 de junio, 2020
RESUMEN
El efecto del follaje de Ricinus communis “higuerilla” sobre la nodulación radicular inducida por Meloidogyne sp. en plantas de tomate var. dominator fue determinado en un nethouse, con el objetivo de proporcionar una alternativa ecológica para el control de este patógeno. Se prepararon tres concentraciones, 10, 20 y 30% (v/v), de follaje de R. communis e inocularon en suelo franco-arenoso esterilizado contenido en macetas. Cada concentración incluyó 10 réplicas y un grupo control (sin enmienda) fue establecido. En cada maceta se sembró una plántula de tomate, y 48 horas post-siembra se inoculó 3000 huevos de Meloidogyne sp. en la base del tallo. El número de nódulos radiculares fue determinado ocho semanas después de la infección. A pesar que todas las plantas desarrollaron nódulos; el número de nódulos en las concentraciones 20 y 30% fue significativamente menor al grupo control (p < 0,05). Mientras, las plantas expuestas a 10% de enmienda no exhibieron diferencias significativas con el grupo control. El follaje de R. communis aplicado como enmienda orgánica al 20 y 30% en suelo de cultivo de tomate limita la nodulación radicular inducida por Meloidogyne sp, sugiriendo su implementación en control de este nematodo.
Palabras claves: Control biológico, enmienda orgánica, nódulos radiculares.
ABSTRACT
The effect of Ricinus communis foliage on the root-knot induced by Meloidogyne sp. in tomato plants var. dominator was determinado under nethouse conditions for providing an ecological alternative in the control of this pathogen. Three concentrations (10, 20 and 30%) of R. communis amendment were prepared and inoculated into sterilized potted sandy loam soil. Each concentration was constituted by 10 replicates and a control group (without amendment) was established. A tomato seedling was sown in each pot, and 48 hours after sowing, 3000 eggs of Meloidogyne sp. at the base of the stem. The number of root nodules was determined eight weeks after infection. Although, all the plants developed nodules; the number of nodules in the 20 and 30% concentrations was significantly lower than the control group (p < 0.05). Meanwhile, plants exposed to 10% amendment did not show significant differences with the control group. The foliage of R. communis applied as an organic amendment at 20 and 30% in tomato cultivation soil limits the root nodulation induced by Meloidogyne sp, which suggests its implementation in control of this nematode.
Keywords: Biologic control, organic amendment, root-knot
DOI: http://dx.doi.org/10.17268/rebiol.2020.40.01.05
1. INTRODUCCIÓN
Los nematodos son sistemas biológicos con una plasticidad funcional considerable, lo que les ha permitido asociarse casi con cualquier otra forma de vida y ambiente. El parasitismo en los nematodos y, específicamente, su capacidad para infectar raíces de cultivos susceptibles han sido uno de los temas que mayor interés ha despertado en la comunidad científica (López-Pérez et al.,2011). Especies de nematodos asociados al género Meloidogyne están entre los que más estragos han causado en los cultivos de importancia económica en todo el mundo (Jones et al.,2013 y Ralmi et al.,2016).
Varios estudios se han realizado sobre el control de este nematodo parásito, los que en su mayoría se enfocaron en la identificación y la eliminación de fuentes de infestación (López-Pérez et al.,2011). Estrategias de control biológico para suprimir este nematodo (Chen et al., 1994; Pérez y Lewis, 2002 y Manzanilla-López et al.,2013) incluyen la rotación de cultivos (McSorley y Dickson, 1995; Ko y Schmitt, 1996 y Fortnum et al., 2001) y el empleo de vegetales con propiedades antagónicas potenciales. Entre los fitoconstituyentes de estas plantas se encuentran metabolitos secundarios tóxicos para el nemátodo (Da R Costa et al., 2003; Meyer et al.,2006; Oka et al.,2006; Oka et al., 2007; Tsay et al.,2004; Ritzinger y McSorley, 1998).
El control biológico basado en inóculos de fuente vegetal incluye diversas especies como: Artemisia vulgaris (Da R Costa et al.,2003), Azadirachta indica (McSorley, 2011), Allium sativum (Jardim, I. N et al. 2020), Crotalaria juncea (Jardim, I. N. et al. 2020), Tagetes minuta (McSorley, 1999), Tagetes erecta (Zhou et al., 2010) y Ricinus comunis (McSorley, 1999). Las especies de Ricinus constituyen un grupo de antagonistas potenciales con crecimiento rápido, que han sido comúnmente usados en el control de varios géneros de nematodos parásitos (Franco-Navarro et al., 2002). Un estudio previo demostró el potencial de Ricinus para inducir resistencia contra Meloidogyne al interferir en la formación de nódulos radiculares (McSorley, 1999). Esta evidencia motivó posteriores investigaciones como comprobar la independencia de la acción nematicida de Ricinus de la actividad microbiana del suelo, obteniéndose como resultado una interacción no significativa (Mashela y Nthangeni, 2002). El efecto nematicida de Ricinus fue también evaluado in vitro cuando fueron aplicados extractos acuosos, obtenidos de las hojas, en individuos juveniles de M. incognita (Arboleda et al., 2010). Otro estudio evaluó el potencial Ricinus comunis en el control y manejo de Spodoptera litura en tabaco (Nicotiana tabacum L.) bajo condiciones de invernadero (Zhou et al., 2010), lo que comprueba el potencial biotecnológico de este recurso vegetal en condiciones in vitro e in vivo.
El tomate es una de las hortalizas más cultivada en todo el mundo y debido a su alto valor comercial, cualidades organolépticas y valor nutricional, su cultivo y producción se mantiene en aumento. En el Perú, las zonas productoras están ubicadas en su mayoría en el litoral del país y son explotadas para este fin a lo largo del año. Las zonas de Chancay, Huaral y Cañete tienen cosechas en la temporada de verano en los meses diciembre-marzo y durante la temporada de otoño e invierno La Libertad, Lambayeque y Piura (Córdoba, 2016). En la región La Libertad, ubicada en el litoral norte del Perú, es uno de las regiones con mayor producción de tomate anualmente. En el 2017 la producción alcanzó 6013 toneladas y en marzo del 2018 la productividad aumentó a 119.8 %. La variedad Dominator es una de las más cultivadas, debido a su buena cobertura de frutos y capacidad de producir alto rendimiento (INEI, 2018a y INEI,2018b). Sin embargo, el cultivo tomate implica varios desafíos, como la susceptibilidad a patógenos recurrentes. El nematodo M. incognita es uno de los parásitos que más daños causa al cultivo de esta especie vegetal, el cual perjudica grandes extensiones de sembríos, reduce la producción y consecuentemente afecta la economía de los agricultores.
Por lo expuesto, en el presente trabajo se investigó el efecto de R. communis aplicado como enmienda orgánica al 10, 20 y 30% (v/v) sobre la nodulación radicular inducida por Meloidogyne sp. en plantas de tomate var. dominator cultivadas en un nethouse.
2. MATERIALES Y MÉTODOS
Muestras biológicas.
Huevos de Meloidogyne sp. fueron aislados de plantas de tomate infectadas con el nematodo según Taylor y Sasser, 1978. Brevemente, las plantas fueron colectadas de campos cultivo del distrito de Moche (La Libertad, Perú). El sistema radicular fue separado del resto de la planta y lavado con agua estéril. Las raíces colectadas fueron cortadas en segmentos de 2 cm y lavadas con hipoclorito de sodio 0.5% por 3 min, en agitación manual. La suspensión fue filtrada a través de dos tamices, la primera con malla 200 (aberturas de 0.074 mm) y la segunda con malla 500 (aberturas de 0.028 mm). La suspensión de huevo resultante del segundo tamiz se lavó con una corriente lenta de agua fría de grifo y se almacenaron en un recipiente de vidrio de un litro. El aislamiento e identificación de los huevos de Meloidogyne sp. se realizó en el laboratorio de Helmintología parasitaria de la facultad de Microbiología y Parasitología, facultad Ciencias Biológicas de la Universidad Nacional de Trujillo.
El modelo vegetal utilizado para este estudio fue plántulas de tomate var. dominator, de aproximadamente dos meses, obtenidas del vivero ALABAMA (Lima, Perú). Las plantas de R. communis fueron cultivadas en el campus de la Universidad Nacional de Trujillo y colectadas tres meses post siembra.
El substrato de cultivo estuvo constituido por una mezcla de suelo fértil y arena en proporción 1:1, de textura franco arenosa. El experimento se realizó en un nethouse construído en el campus de la Universidad Nacional de Trujillo.
Diseño experimental
Se establecieron cuatro grupos de estudio; tres experimentales y un control, con 10 réplicas por grupo. Cada réplica estaba constituida por una maceta conteniendo 1 kg de substrato de cultivo esterilizado. El substrato fue autoclavado a 121°C por 30 min y secado a temperatura ambiente por 24 horas. Antes de incorporar el substrato en las macetas, este fue mezclado con fragmentos (0.5 mm de diámetro) de follaje fresco de R. communis para obtener concentraciones de 10, 20 y 30% (v/v). En el grupo control no se aplicó enmienda. Las macetas fueron humedecidas a capacidad de campo por dos días y se sembró una plántula de tomate.
Inoculación de Meloidogyne sp.
Los huevos de Meloidogyne sp. fueron suspendidos en buffer fosfato (pH 7,0), el conteo de los huevos se realizó en tres muestras de un mililitro cada una y luego se ajustó para inocular 3000 huevos por planta. El inóculo fue aplicado 48 horas después de transferir las plantas a las macetas para asegurar la aclimatización de las plántulas al sistema nethouse.
Evaluación del efecto del follaje de R. communis sobre la nodulación de Meloidogyne sp.
Las plantas de tomate fueron colectadas ocho semanas después de la inoculación. Las raíces fueron separadas del todo el sistema vegetal y lavadas con agua destilada e hipoclorito de sodio al 0,5%. El número de nódulos inducidos por Meloidogyne sp. se determinó en cada réplica con ayuda de un estereoscopio.
Análisis estadístico.
El diseño experimental fue completamente al azar con 10 repeticiones por tratamiento. Los datos obtenidos se analizaron estadísticamente mediante el ANOVA y las medias se compararon mediante la prueba de Duncan (p≤ 0,05).
3. RESULTADOS
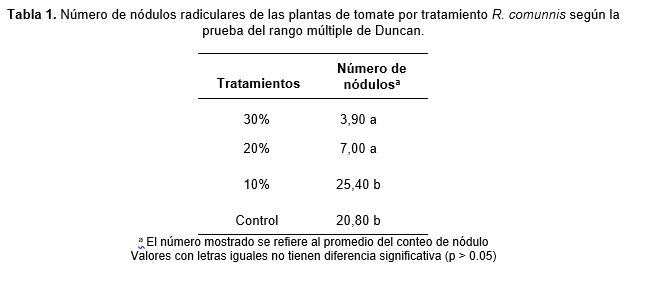
Las plantas de los cuatro grupos de estudio desarrollaron nódulos en las raíces (Fig. 1), inducidas por la infestación de Meloidogyne sp. El grupo tratado con enmienda de R. communis al 10% no mostró diferencias en el número de nódulos con respecto al grupo control, mientras que los grupos con tratamiento al 20 y 30% mostraron una disminución significativa en el número de nódulos (p‹0,05), según la prueba ANOVA. El promedio de los números de nódulos radiculares en las plantas del grupo con 10% de enmienda (v/v) fue 25,4 (7 – 19), en las de 20% fue 6,9 (0 – 18), en las de 30 %, 3,9 (0-8) y en las del testigo, 20,8 (8-35) (Tabla 1).

4. DISCUSIÓN
Las plantas con y sin tratamiento de enmienda mostraron baja susceptibilidad a la infección por Meloidogyne sp, en relación con otras variedades pertenecientes a esta especie. Por ejemplo, ejemplares de tomate cv. Maya del tipo Saladette infectadas en condiciones de invernadero presentaron un promedio de 467 nódulos por raíz (Cristobal et al., 2010). Aunque el efecto histopatogénico fue menor al esperado, se evidenció el signo característico de la infestación de las raíces; además, de los síntomas en el sistema aéreo de las plantas como la disminución del crecimiento y deficiencias nutricionales (López-Pérez et al.,2011). El uso de enmiendas orgánicas induce el crecimiento y viabilidad de las plantas haciéndolas más resistentes a la infección por nematodos. Algunos estudios sugieren que inducen la resistencia al estrés ocasionada por factores abióticos y bióticos incluyendo la infección por nematodos. Una de las posibles causas de la resistencia a la infección por nematodos sería la alteración de la relación de auxina-citoquina de las plantas tratadas.
Los constituyentes específicos de las enmiendas orgánicas involucrado en la resistencia no han sido totalmente identificados. Aunque estudios reportaron que los extractos de Ascophyllum nodosum contienen betainas las cuales reducen la infección de Meloidogyne sp. en plantas de tomate. Las betainas funcionan como fuente de nitrógeno para las plantas ayudándoles a incrementar su contenido de clorofila, y les sirven como un osmolito y un soluto compatible que alivia el estrés osmótico (Oka, 2010). Las enmiendas orgánicas inducen el desarrollo de mayor biomasa de raíces las cuales ayudan a la planta para adquirir nutrientes y poder resistir temporadas de elevada densidad de nematodos (McSorley et al., 2011). Las enmiendas orgánicas liberan componentes nematotóxicos como ácidos orgánicos, componentes nitrogenados o varios metabolitos secundarios durante su descomposición. Los cuales pueden cambiar las propiedades fisicoquímicas en el suelo (pH, salinidad, conductividad eléctrica, concentraciones de oxígeno y CO2, potencial redox) o propiedades físicas (densidad, porosidad, retención del agua del suelo) estos cambios pueden afectar negativamente el comportamiento de los nematodos como la eclosión de sus huevos, movimiento o supervivencia (Thoden et al., 2011). La susceptibilidad de la planta para ser infectada por fitonemátodos está determinada por mecanismos de regulación genética, los cuales determinan la resistencia de la planta a la infección del patógeno (Schaff et al., 2007).
En el estudio no se encontraron diferencias significativas en el número de nódulos inducidos por Meloidogyne en las plantas de tomate entre el grupo control y el grupo tratado con la enmienda al 10%. El número de nódulos radiculares inducidos por Meloidogyne fue menor en las plantas de tomate cuyo suelo de cultivo tenía fragmentos de follaje de R. communis en concentraciones de 20 y 30%; lo que indicaría que esta enmienda tiene efecto antagónico en el desarrollo nodular de Meloidogyne. La infección de las plantas por este parásito está sujeto a la concentración del tratamiento, pues al aplicar una menor concentración del follaje de R. communis la generación de nódulos fue semejante al grupo control. Este efecto es concordante con los resultados de estudios realizados por otros autores quienes han descrito dicho efecto nematicida de R. communis aplicado como extractos de hojas, tallos y raíces en condiciones de laboratorio, invernadero y campo (Gao et al., 2011). Por otro lado, la variabilidad de eclosión de huevos en Melodoygine puede ser una limitación para determinar el efecto de Ricinus sobre la nodulación inducida por este parásito (Karssen y Moens, 2006), desde que una disminución en el número de nódulos podría también deberse a la no eclosión de huevos. Sin embargo, el uso de réplicas biológicas (10) y el análisis de homogeneidad de varianza en el test estadístico (ANOVA) usado en este estudio determinaron una regularidad en el número de nódulos en cada tratamiento y permitieron encontrar una relación inversamente proporcional entre el aumento de la concentración de follaje y la disminución del número de nódulos inducidos. El efecto del follaje de Ricinus también pudo haber sido sobre la eclosión de huevos de Melodoygine (Saire, 2017). Otros estudios demostraron el efecto larvicida de R. communis sobre larvas de mosquitos que transmiten patógenos (Sogan et al.,2018). Este efecto larvicida es debido a la presencia del alcaloide llamado ricina, el cual está presente en las hojas de R. communis (Arboleda et al., 2010).
5. CONCLUSIONES
El follaje de R. communis adicionado como enmienda orgánica al suelo de cultivo en concentraciones de 20% y 30% limita la nodulación radicular inducida por Meloidogyne sp. en plantas de tomate var. dominator.
6. REFERENCIAS BIBLIOGRÁFICAS
Arboleda, J., Guzmán, O., y Restrepo, J. (2010). Efecto in vitro de extractos acuosos de higuerilla (Ricinus communis linneo) sobre el nematodo barrenador [Radopholus similis (cobb) thorne]. Agron, 18 (2), 25 – 36.
Chen, S., Dickson, D. W., y Whitty, E. B. (1994). Response of Meloidogyne spp. to Pasteuria penetrans, Fungi, and Cultural Practices in Tobacco. Journal of nematology, 26(4 Suppl), 620–625.
Cristóbal, J., Herrera-Parra, E. Reyes, V., Ruiz, E., Tun, J., y Celis, T. (2010). Glomus intraradices para el control de Meloidogyne incognita (Kofoid & White) Chitwood en condiciones protegidas. Fitosanidad, 14 (1), 25-29.
Córdova, T; Pinasco, R; Pizarro, G; Quiñones, T. (2016). Planeamiento Estratégico del Tomate en el Perú (en línea). Consultado 12 dic. 2018. Disponible en http://tesis.pucp.edu.pe/repositorio/handle/20.500.12404/7519
Da R Costa, S., De A Santos, M. S., y Ryan, M. F. (2003). Effect of Artemisia vulgaris Rhizome Extracts on Hatching, Mortality, and Plant Infectivity of Meloidogyne megadora. Journal of nematology, 35(4), 437–442.
Fortnum, B. A., Lewis, S. A., y Johnson, A. W. (2001). Crop Rotation and Nematicides for Management of Mixed Populations of Meloidogyne spp. on Tobacco. Journal of nematology, 33(4S), 318–324.
Franco-Navarro, F., Cid del Prado-Vera, I., Zavaleta-Mejía, E., y Sánchez-García, P. (2002). Aplicación de enmiendas orgánicas para el manejo de Nacobbus aberransen tomate. Nematropica, 32(2), 113-124.
Gao, Q. Y., Hu, F. L., Zhu, H. H., Liu, M. Q., Li, H. X., y Hu, F. (2011). Control Effects of Ricinus Communis Extracts on Meloidogyne Incognita. The Journal of Applied Ecology, 22(11), 3033-8.
INEI (Instituto Nacional de Estadística e Informática). (2018). Compendio estadístico Perú 2018 .https://www.inei.gob.pe/media/MenuRecursivo/publicaciones_digitales/Est/Lib1635/cap13/cap13.pdf (a).
INEI (Instituto Nacional de Estadística e Informática). (2018). Perú panorama económico departamental.https://www.inei.gob.pe/media/MenuRecursivo/publicaciones_digitales/Est/Lib1531/parte%201.pdf (b).
Jardim, I. N., Oliveira, D.F., Campos, V. P., Silva, G. H. y Souza, P.E. (2020).Garlic essential oil reduces the population of Meloidogyne incognita in tomato plants. European Journal of Plant Pathology, 157, 197–209. https://doi.org/10.1007/s10658-020-02000-1.
Jones, J. T., Haegeman, A., Danchin, E. G., Gaur, H. S., Helder, J., Jones, M. G., Kikuchi, T., Manzanilla-López, R., Palomares-Rius, J. E., Wesemael, W. M., y Perry, R. N. (2013). Top 10 plant-parasitic nematodes in molecular plant pathology. Molecular plant pathology, 14(9), 946–961. https://doi.org/10.1111/mpp.12057.
Karssen, G., y Moens, M. (2006). Root-knot nematodes. In: Perry, R.N. and Moens, M. (eds) Plant Nematology. CAB International, Wallingford, UK, pp. 59–90.
Ko, M. P., y Schmitt, D. P. (1996). Changes in plant-parasitic nematode populations in pineapple fields following inter-cycle cover crops. Journal of nematology, 28(4), 546–556.
López-Pérez, J. A., Edwards, S., & Ploeg, A. (2011). Control of root-knot nematodes on tomato in stone wool substrate with biological nematicides. Journal of nematology, 43(2), 110–117.
Manzanilla-López, R. H., Esteves, I., Finetti-Sialer, M. M., Hirsch, P. R., Ward, E., Devonshire, J., y Hidalgo-Díaz, L. (2013). Pochonia chlamydosporia: Advances and Challenges to Improve Its Performance as a Biological Control Agent of Sedentary Endo-parasitic Nematodes. Journal of nematology, 45(1), 1–7.
Mashela, P., y Nthangeni, M. (2002). Efficacy of Ricinus communis Fruit Meal with and without Bacillus Species on Suppression of Meloidogyne incognita and Growth of Tomato. Journal of phytopathology, 150(7), 365-412.
McSorley, R., y Dickson, D. (1995). Effect of Tropical Rotation Crops on Meloidogyne incognita and Other Plant-Parasitic Nematodes. Journal of nematology, 27(4S), 535–544.
McSorley R. (1999). Host Suitability of Potential Cover Crops for Root-knot Nematodes. Journal of nematology, 31(4S), 619–623.
McSorley R. (2011). Overview of organic amendments for management of plant-parasitic nematodes, with case studies from Florida. Journal of nematology, 43(2), 69–81.
Meyer, S. L., Zasada, I. A., Roberts, D. P., Vinyard, B. T., Lakshman, D. K., Lee, J. K., Chitwood, D. J., y Carta, L. K. (2006). Plantago lanceolata and Plantago rugelii Extracts are Toxic to Meloidogyne incognita but not to Certain Microbes. Journal of nematology, 38(3), 333–338.
Oka, Y., Ben-Daniel, B. H., y Cohen, Y. (2006). Control of Meloidogyne javanica by Formulations of Inula viscosa Leaf Extracts. Journal of nematology, 38(1), 46–51.
Oka, Y., Tkachi, N., Shuker, S., y Yerumiyahu, U. (2007). Enhanced Nematicidal Activity of Organic and Inorganic Ammonia-Releasing Amendments by Azadirachta indica Extracts. Journal of nematology, 39(1), 9–16.
Oka, Y. (2010). Mechanisms of nematode suppression by organic soil amendments—A review. Applied Soil Ecology, 44(2), 101–115.
Pérez, E. E., y Lewis, E. E. (2002). Use of entomopathogenic nematodes to suppress Meloidogyne incognita on greenhouse tomatoes. Journal of nematology, 34(2), 171–174.
Ralmi, N., Khandaker, M., Mat, N. (2016). Occurrence and control of root knot nematode in crops: A review, Australian Journal of Crop Science,10(12),1649-1654.
Ritzinger, C. H., & McSorley, R. (1998). Effect of Castor and Velvetbean Organic Amendments on Meloidogyne arenaria in Greenhouse Experiments. Journal of nematology, 30(4S), 624–631.
Saire, L. (2017). Productos químicos alternativos e ingredientes activos comercialmente nuevos para el control de Meloidogyne incognita en tomate en invernadero. Universidad Nacional Agraria la Molina, Lima, Perú.
Schaff, J., Nielsen, D., Smith, C., Scholl, E., y Bird, D. (2007). Comprehensive transcriptome profiling in tomato reveals a role for glycosyltransferase in Mi-mediated nematode resistance. Plant physiology, 144(2), 1079–1092. https://doi.org/10.1104/pp.106.090241.
Sogan, N., Kapoor, N., Singh, H., Kala, S., Nayak, A., y Nagpal, B. N. (2018). Larvicidal activity of Ricinus communis extract against mosquitoes. Journal of vector borne diseases, 55(4), 282–290. https://doi.org/10.4103/0972-9062.256563.
Taylor, A., Sasser, J. (1978). Biology, identification and control of root-knot nematodes (Meloidogyne species). Raleigh, North Carolina, USA, North Carolina State University Graphics. 111 p.
Thoden, T., Korthals, G., y Termorshuizen, J. (2011). Organic amendments and their influences on plant-parasitic and free-living nematodes: a promising method for nematode management. Nematology(online),13, 133-153.DOI:10.1163/138855410X541834.
Tsay, T. T., Wu, S. T., y Lin, Y. Y. (2004). Evaluation of Asteraceae Plants for Control of Meloidogyne incognita. Journal of nematology, 36(1), 36–41.
Zhou, Z., Chen, Z., & Xu, Z. (2010). Potential of trap crops for integrated management of the tropical armyworm, Spodoptera litura in tobacco. Journal of insect science (Online), 10, 117. https://doi.org/10.1673/031.0