Artículo Original
Caesalpinia spinosa: EFECTO PROTECTOR FRENTE A RADIACIÓN UV EN LA LIPOPEROXIDACIÓN HEPÁTICA EN RATAS Y DETECCIÓN DE FITOCONSTITUYENTES
Caesalpinia spinosa: PROTECTIVE EFFECT AGAINST UV RADIATION IN HEPATIC LIPOPEROXIDATION IN RATS AND DETECTION OF PHYTOCONSTITUENTS
Alberto López S1., Raquel Oré S2 †., Cecilia Miranda V2.
1Laboratorio de Genética, Facultad de Ciencias Biológicas. UNMSM, Lima (Perú); 2Centro de Investigación de Bioquímica y Nutrición “Alberto Guzmán Barron”, Facultad de Medicina Humana, UNMSM, Lima (Perú).
Autor de correspondencia: alopezs@unmsm.edu.pe
Recibido: 20 de abril, 2020. Aceptado: 8 de junio, 2020
RESUMEN
La “tara” es una planta originaria del Perú y que actualmente tiene gran demanda a nivel industrial por sus productos derivados como los taninos y el hidrocoloide. El Perú cuenta con numerosas regiones donde se cultiva este fitorecurso, y en muchas no se ha realizado trabajos bioquímicos ni genéticos que permita caracterizar dichas poblaciones. En el presente trabajo se reporta la presencia de metabolitos secundarios, así como la capacidad protectora de vainas de Caesalpinia spinosa (“tara”) procedentes de tres poblaciones naturales provenientes de la Provincia de Tarma (Departamento de Junín, Perú) frente a radiación UV en la lipoperoxidación hepática en ratas. Los metabolitos secundarios encontrados en diferentes cantidades fueron fenoles y taninos (+++). Para determinar el efecto protector frente al daño oxidativo causado por radiación UV, se utilizó extracto acuoso de vainas de “tara” a partir de una concentración de 50 ug/ml, en la reacción del ácido tiobarbitúrico midiendo la formación del malonaldehído (MDA), se encontró una protección a nivel de tejido hepático en ratas por parte del extracto de “tara”, incluso mayor que la vitamina C utilizado como estándar. Estos resultados podrían aprovecharse para incrementar el valor agregado de este recurso, así como colaborar en la caracterización bioquímica del mismo.
Palabras claves: Caesalpinia, tara, metabolitos, MDA, lipoperoxidación.
ABSTRACT
The "tara" is a native plant from Peru, and currently it has a great industry demand for its products like tannins and hydrocolloid. Peru has numerous regions where this phyto resource is been cultivated. The results of this evaluation show the presence of secondary metabolites, and the protective effect of Caesalpinia spinosa (“tara”) pods from three natural populations at Tarma province (Department of Junin, Peru) against UV radiation inside the liver lipoperoxidation tested in rats. The results show secondary metabolites in different amounts like phenols and tannins (+++). To determined the protective effect against oxidative damage caused by UV radiation, we used aqueous extract of “tara” pods with a concentration of 50 ug/ml, inside of thiobarbituric acid reaction by measuring the formation of malonaldehyde (MDA). Also the results show protection of C. spinosa inside the liver tissue tested in rats that was greater than the vitamin C used as standard. These results could be used to increase more scientific value of this Peruvian natural resource,
Keywords: Caesalpinia, tara, metabolites, MDA, lipoperoxidation.
DOI: http://dx.doi.org/10.17268/rebiol.2020.40.01.02
1. INTRODUCCIÓN
La “tara”, Caesalpinia spinosa (Molina) Kuntze, es una leguminosa originaria del Perú utilizada desde la época prehispánica en la medicina popular, y recientemente tiene una gran demanda en el mercado internacional por los productos derivados que de ella se obtiene. Por la presencia de taninos es usada como materia prima en diversas industrias como la química, de curtientes, tintes, farmacéutica, cerveza, vitivinícola, textil, papelera y otras; del endospermo se obtiene una goma o galactomanano (hidrocoloide) de uso alimenticio, farmacéutico, textil, y cosmetológico (De la Cruz, 2004; Villanueva, 2007). Agapito (1998) refiere que se usa popularmente para faringitis, fiebres, afecciones a la garganta, lavado de heridas y úlceras, y en resfríos. López et al. (1998) refieren que la “tara” contendría taninos, flavonoides y gomas, de allí su uso terapeútico en medicina popular.
En el Perú, la “tara” se encuentra distribuida a lo largo de toda la costa, desde Piura hasta Tacna, y en la sierra en los departamentos de Ancash, Apurímac, Ayacucho,Cajamarca, Cusco, Huánuco, Huancavelica, Junín y Pasco (Dostert et al., 2009), encontrándose entre los 1,500 a 3,100 msnm (Rodriguez, 2008). Es un recurso que tiene gran demanda en el mercado internacional, siendo nuestro país el que produce, más del 90% de tara a nivel mundial, y la mayor cantidad proviene de bosques silvestres (Agraria.pe, 2018). Debido a que las poblaciones silvestres son la fuente para sostener y mejorar las poblaciones cultivadas de las especies, es necesario conocer el comportamiento y las características de las mismas, tanto genéticas, bioquímicas y morfológicas que luego nos permitan caracterizar dichas poblaciones silvestres. Existen algunos trabajos que reportan características de poblaciones de “tara” según el lugar de procedencia, así Villena et al. (2019) identifican 7 morfotipos para poblaciones naturales de Cajamarca; Bonilla et al. (2016), reportan características morfométricas del fruto de “tara” de poblaciones de Yauyos y Ayacucho; López et al. (2013) reportan características citogenéticas de poblaciones no cultivadas de “tara” en Junín; Portal (2010) reporta cinco variedades fenotípicas para poblaciones de Ayacucho. Sin embargo, aún falta realizar, más investigaciones de poblaciones naturales según el lugar de procedencia, que nos permitan entender las características del recurso para mejorar la oferta y la producción.
Actualmente existe un creciente interés en la búsqueda de antioxidantes de origen natural, sobre todo provenientes de plantas medicinales o alimenticias (Doroteo et al., 2013). Durante el metabolismo celular se generan especies reactivas de oxígeno (ERO) así como radicales libres que pueden ser dañinos para la célula; cuando hay un desequilibrio entre la generación de ERO y la capacidad de un sistema biológico de desintoxicar rápidamente los reactivos intermedios o reparar el daño oxidativo celular, se dice que hay estrés oxidativo (González et al., 2017). Este estrés oxidativo es responsable de la lipoperoxidación o peroxidación lipídica, por ello en los últimos años se han incrementado los estudios sobre la acción antioxidante de muchas plantas que pueden ayudar a neutralizar las consecuencias de la lipoperoxidación. La exposición prolongada a radiación UV puede causar lesiones epiteliales, daño al ADN, envejecimiento celular y carcinogénesis (Linos et al, 2009). Existen estudios que indican que la radiación UV está relacionada con la generación de especies reactivas de oxígeno, lo que indicaría que la radiación UV activaría procesos de lipoperoxidación a nivel de membrana (Mackerness et al., 2001) Así mismo, hay reportes que indican que las vainas de “tara” tienen un efecto antioxidante (Avilés et al., 2010), sin embargo, faltan aún estudios sobre sus fitoconstituyentes así como corroborar dicha actividad antioxidante.
El departamento de Junín cuenta con poblaciones naturales de “tara”, que pueden ser explotadas de manera racional y sostenible en beneficio de las comunidades locales. Sin embargo, pese a la importancia y ser considerado como un recurso flora con potencialidad para la región (Gobierno Regional de Junín, 2008), aún no hay estudios sobre las propiedades químicas y bioquímicas que puedan ayudar a caracterizar sus poblaciones con fines de selección y mejora de este recurso en la región. Debido a ello, el objetivo del presente trabajo es identificar los fitoconstituyentes presentes en poblaciones naturales de “tara”, provenientes de las localidades de Picoy, Humancocha y Santa Fe de la Provincia de Tarma (Departamento de Junín), así como determinar el efecto protector del extracto acuoso de “tara” sobre la lipoperoxidación hepática en ratas frente a la radiación UV.
2. MATERIALES Y MÉTODOS
- MATERIAL BOTÁNICO: Las poblaciones muestreadas de “tara”, pertenecen a las localidades de Picoy, (3,000 msnm; Distrito de Acobamba), Tarma (3,100 msnm; Distrito de Tarma) y Santa Fé (2,860 msnm; Distrito de Palca) ubicadas en la provincia de Tarma, perteneciente al Departamento de Junín-Perú. Las vainas recolectadas fueron guardadas en recipientes codificados según la localidad, para transportarlas al laboratorio. Se entregaron muestras al Museo de Historia Natural de la Universidad Nacional Mayor de San Marcos para su identificación y certificación (0152-USM-2011).
- ANIMALES DE EXPERIMENTACIÓN: Se utilizaron 10 ejemplares machos de Rattus rattus var. albinus de peso promedio 220 g, de tres meses de edad, en buen estado de salud. De estos ejemplares se extrajo el hígado. Para el sacrificio de los ejemplares se cumplieron con los protocolos y normas éticas internacionales para la investigación con animales.
- PREPARACIÓN DEL EXTRACTO ACUOSO: Se colectaron vainas de “tara” procedentes de las tres localidades. Las muestras fueron lavadas y secadas a 40°C durante 48 horas; posteriormente fueron molidas y tamizadas para preparar el extracto acuoso, el cual fue filtrado en gasa y papel Whatman, luego las muestras fueron llevadas a una estufa de aire circulante a 40°C por 5 días; lo recuperado se refrigeró a 4°C hasta su uso.
- DETECCIÓN DE METABOLITOS: La detección de metabolitos secundarios se realizó según lo recomendado por Lock (1994) mediante pruebas químicas de caracterización como la reacción de Dragendorff, reacción de Shinoda, prueba de la espuma, reacción del tricloruro férrico, reacción de la gelatina, reacción de Lieberman-Burchard, reacción de la Ninhidrina y reacción de Molish.
- EFECTO REDUCTOR: La capacidad reductora del extracto de “tara” frente al peróxido de hidrógeno se determinó de acuerdo al método de Ruch et al. (1989). Para esta prueba se preparó diluciones del extracto acuoso de “tara” hasta obtener tres concentraciones: Extracto I (10 ug/ml), Extracto II (30 ug/ml), Extracto III (50 ug/ml).
- LIPOPEROXIDACIÓN: Se realizó la extracción del hígado, en solución salina, el cuál fue llevado a irradiar a 265 nm por 30 minutos. Posteriormente, se preparó 0,3 ml de homogenizado de hígado al 10% con buffer fosfato de potasio 50 mM, se añade 0,6 ml de ácido tricloro acético (TCA) al 20% y se colocó en ebullición por 10 minutos, dejándose posteriormente enfriar. Luego se añadió 0,9 ml de ácido tiobarbitúrico (TBA) 0,25 mM y se llevó a baño maría en ebullición por 30 minutos, para posteriormente dejar enfriar.
Para la prueba se utilizó el extracto acuoso III, del cual se preparó tres concentraciones: i) 8 mg/ml; ii) 4 mg/ml y iii) 2 mg/ml. Como estándar se utilizó vitamina C a una concentración de 8 mg/ml.
El homogenizado se repartió equitativamente en cinco tubos de la siguiente manera:
Tubo 1: Homogenizado de hígado
Tubo 2: Homogenizado de hígado + concentración i del extracto acuoso
Tubo 3: Homogenizado de hígado + concentración ii del extracto acuoso
Tubo 4: Homogenizado de hígado + concentración iii del extracto acuoso
Tubo 5: Homogenizado de hígado + estándar vitamina C
En los tubos 2, 3 y 4 se agregó la concentración de extracto acuoso respectiva hasta completar 0,8 ml; finamente se llevan a leer al espectrofotómetro a 535 nm.
3. RESULTADOS
En la tabla 1 se presentan los metabolitos secundarios encontrados según la marcha fitoquímica de Lock.

A partir de los resultados de la marcha fitoquímica, para la prueba de poder reductor se utilizó el extracto acuoso proveniente de la muestra de Picoy, por tener mayor presencia de fenoles y taninos. En dicha prueba de capacidad reductora, se obtuvo que el extracto acuoso I presentó un 13% de reducción del peróxido de hidrógeno, el extracto acuoso II un 12.7% y el extracto acuoso III un 15% tal como se muestra en la figura 1.
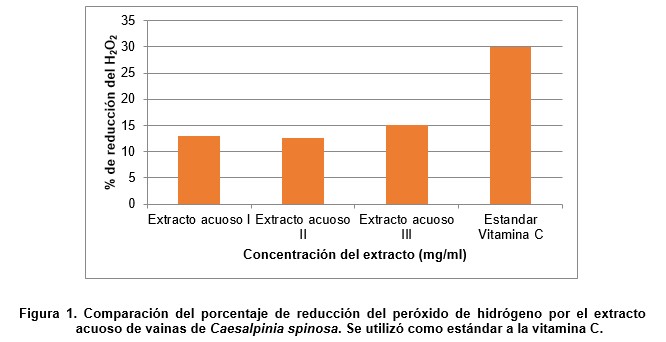
Para la prueba de la lipoperoxidación se optó por utilizar el extracto acuoso III, debido a que fue el que presentó mayor capacidad reductora del peróxido de hidrógeno. Los resultados de las concentraciones del complejo coloreado MDA-TBARS en mol/L se muestran en la tabla 2.

Tubo 1: Homogenizado de hígado; Tubo 2: Homogenizado de hígado + concentración i del extracto acuoso; Tubo 3: Homogenizado de hígado + concentración ii del extracto acuoso; Tubo 4: Homogenizado de hígado + concentración iii del extracto acuoso; Tubo 5: Homogenizado de hígado + estándar vitamina C.
4. DISCUSIÓN
Los preparados fitoterapeúticos de origen natural están cobrando cada vez mayor importancia para el tratamiento médico, por lo que es necesaria la investigación de los fitoconstituyentes de plantas que se utilizan medicinalmente. La “tara” es una planta que ha sido ampliamente usada en medicina tradicional, y se encuentra en varios departamentos de nuestro país, mostrando buena adaptación a diferentes condiciones ambientales, lo que ha generado biovariedades en los diferentes pisos ecológicos (Guevara et al., 2014). Esta adaptación ha permitido establecer que la “tara” presenta plasticidad fenotípica (Cordero, 2015). El conocimiento e identificación de las cualidades bioquímicas según el lugar de procedencia, permitirá caracterizar dicho fitorecurso. En ese marco se presentan los resultados de la tabla 1, donde se señala que en las tres muestras se han identificado presencia de flavonoides, glucósidos, fenoles y taninos, diferenciándose el de la localidad de Picoy la cuál muestra mayor presencia de fenoles y taninos. Existen trabajos previos donde se reportan presencia de compuestos fenólicos y taninos en “tara” (Callohuari et al., 2017; Huachi et al., 2014), sin embargo no hay aún estudios suficientes acerca de la relación entre las propiedades bioquímicas de la “tara” con su lugar de procedencia. Al respecto, algunos autores señalan que tanto la capacidad antioxidante como el contenido de fenoles en las plantas dependen del microambiente y de factores como área geográfica, la altura y radiación (Soto-Dominguez et al., 2012; Muñoz et al., 2007; Bedascarrasbure et al., 2004). Las diferencias encontradas en nuestros resultados de la marcha fitoquímica entre las tres muestras, referente a los fenoles y taninos, estarían concordantes con ello.
Callohuari et al. (2017) reportan una buena capacidad antioxidante del extracto acuoso de vainas de “tara” procedentes de Tacna; en nuestro caso la muestra de extracto acuoso utilizada fue la procedente de Picoy, donde el extracto III presenta mayor poder reductor. Ello estaría en concordancia con lo obtenido por López et al (2011) quienes al comparar la capacidad antioxidante mediante DPPH entre muestras provenientes de las localidades de Picoy y Santa Fé (Provincia de Tarma), reportan buena capacidad antioxidante de las muestras procedentes de Picoy. La utilización de extracto acuoso es el más recomendable para la caracterización química de plantas medicinales (Calixto, 2006) y además por que en la preparación tradicional se suele utilizar el extracto acuoso y así evitar posibles efectos tóxicos potenciales (Bussmann et al., 2011).
En los últimos años se está incidiendo en las investigaciones acerca de la utilización de derivados o extractos de plantas que puedan contrarrestar los efectos de la radiación UV, ya que las propiedades antioxidantes de muchas de ellas otorgarían un efecto protector contra dicha radiación (Fuentes, 2019; Bae et al., 2010). Así, Vernhes et al., (2013) refieren que el extracto acuoso de la planta Phyllanthus orbicularis mostró carácter antioxidante y capacidad protectora frente a radiación UV en ADN plasmídico. Doroteo et al., (2012) utilizan el extracto hidroalcohólico de “tara” en fibroblastos frente a radiacion UV catalogándolo como leve; Campos-Ruiz et al., (2013) reportan buen efecto hepato protector del extracto hidroalcohólico del “mangle” sobre la lipoperoxidación en ratas; Castillo et al., (2010) reportan que el extracto etanólico de “sacha inchi” tiene un buen efecto antioxidante en la lipoperoxidación inducida por Fe++/ascorbato en hígado de ratas. En nuestro caso, a diferencia de Doroteo et al., (2012), se utilizó extracto acuoso de “tara” el cual nos dió buenos resultados, siendo el tubo 2 (tabla 2) el que menor concentración del complejo MDA-TBARS expresa (3.4x10-4 mol/L) y, tal como lo señalan Rodrigo et al., (2011), mayor disminución del complejo marcador de lipoperoxidación indicaría mejor protección antioxidante. A diferencia de los trabajos reportados para “mangle” y “sacha inchi” donde se utiliza extracto alcohólico, el extracto utilizado en nuestra investigación es extracto acuoso de “tara”, el cual ha demostrado tener un buen efecto antioxidante en la lipoperoxidación en hígado frente a radiación UV. Este efecto protector estaría en concordancia con lo mencionado por Carrasco (2009), quien menciona que los fenoles y flavonoides presentes en plantas actuan como absorvedores de radiación UV, previniendo su efecto dañino.
Los resultados obtenidos pueden ayudar a revalorizar y mejorar la oferta de este recurso en la zona; las características antioxidantes de este fitorecurso le brindaría un valor agregado, lo cual según MINAGRI (2017) el darle un valor agregado a la “tara” permitirá a las poblaciones más deprimidas del país tener nuevas oportunidades para mejorar sus ingresos así como una vida más digna.
Así mismo es importante mencionar que, tal como lo recomienda Guevara et al. (2014), se hace necesario evaluar, caracterizar y categorizar las diferentes poblaciones de “tara” que se encuentran en los diferentes pisos ecologicos de nuestro país, ya que corresponderían a diferentes biovariedades. Nuestro trabajo estaría colaborando en ese aspecto.
5. CONCLUSIONES
Se ha identificado flavonoides, glucósidos, compuestos fenólicos y taninos como fitoconstituyentes de vainas de “tara”, procedentes de Tarma, siendo la localidad de Picoy la de mayor presencia de compuestos fenólicos y taninos.
El extracto acuoso de vainas de tara tiene efecto protector antioxidante in vitro, en la lipoperoxidación en hígado de ratas frente a la radiación UV.
6. AGRADECIMIENTOS
Al Consejo Superior de Investigación de la UNMSM por la subvención al proyecto PEM2009B03 del cual deriva la presente publicación. Los coautores quieren además hacer un reconocimiento a la Dra. Raquel Oré con quien se desarrolló el presente trabajo pero que lamentablemente no pudo ver la publicación del mismo por su sensible fallecimiento.
7. REFERENCIAS BIBLIOGRÁFICAS
Agapito T, Sung I. (1998). Fitomedicina:1100 plantas medicinales. Lima. Ed. Isabel.
Agraria.pe Agencia Agraria de Noticias. (2018). Perú produce, más del 90% de la tara a nivel mundial. https://agraria.pe/noticias/peru-produce-mas-del-90-de-la-tara-a-nivel-mundial-16304
Avilés, R., Carrión, J., Huamán, J., Bravo, M.; Rivera, D., Rojas, N., y Santiago J. (2010). Actividad antioxidante, polifenoles totales y contenido de taninos de extractos de tara Caesalpinia spinosa. Rev. Per. Quim. Ing. Quim. Vol. 13 (2): 5 – 11.
Bae, J., Choi, J., Kang, S., Lee, Y., Park, J., y Kang, Y. (2010). Dietary compound ellagic acid alleviates skin wrinkle and inflammation induced by UV-B irradation. Exp. Dermatol. 19 (8): 182-190.
Bedascarrasbure, E., Maldonado, L., Alvarez, A., y Rodriguez, E. (2004). Contenido de fenoles y flavonoides del propoleos argentino. Acta Farm. Boanerense 23(3): 369-72.
Bonilla, H., López, A., Carbajal, Y., y Siles, M. (2016). Análisis de variables morfométricas de frutos de “tara” provenientes de Yauyos y Ayacucho para identificar caracteres agromorfológicos de interés. Scientia Agropecuaria 7(3): 157-164.
Bussmann, R., Malca, G., Glenn, A., Sharon, D., Nilsen B., Parris, B., Dubose, D., Ruiz, D., Saleda, J., Martínez, M., Carillo L., Walker, K., Kuhlman, A., y Townesmith, A. (2011). Toxicity of medicinal plants used in traditional medicine in Northen Peru. J. Ethnopharmacol. 137 (1):121-140.
Calixto, M. (2006). Plantas medicinales utilizadas en Odontología (Parte I). Kiru 3 (2): 80-85.
Callohuari, R., Sandoval, M., y Huamán, O. (2017). Efecto gastroprotector y capacidad antioxidante del extracto acuoso de las vainas de Caesalpinia spinosa “tara” en animales de experimentación. An. Fac. med. 78 (1): 61-66.
Campos-Ruiz, J., y Pretell-Sevillano, O. (2013). Efecto protector del extracto hidroalcohólico de Rhizophora mangle sobre la lipoperoxidación hepática en Rattus rattus var. albinus. Sagasteguiana 1(1):39-44.
Carrasco, L. (2009). Efecto de la radiación ultravioleta-B en plantas. Idesia 27 (3): 59-76.
Castillo, E., Castillo, S., y Reyes, C. (2010). Estudio fitoquímico de Plukenetia volubilis L. y su efecto antioxidante en la lipoperoxidación inducida por Fe3+/ascorbato en hígado de Rattus rattus var. albinus. UCV Scientia 2(1): 11-21.
Cordero, I. (2015). Respuesta ecofisiológica de Caesalpinia spinosa (Mol.) Kuntze a condicionantes abióticos, bióticos y de manejo como referente para la restauración y conservación del bosque de nieblas de Atiquipia (Perú). Tesis Doctoral. Facultad de Ciencias Biológicas, Universidad Complutense de Madrid. 342 p.
De la Cruz, P. (2004). Aprovechamiento integral y racional de la tara Caesalpinia spinosa - Caesalpinia tinctoria. Revista del Instituto de Investigación de la facultad de Ingeniería geológica, minera, metalúrgica y geográfica. 7 (14): 64-73.
Doroteo, VH., Díaz, C., Terry, C., y Rojas, R. (2013). Compuestos fenólicos y actividad antioxidante in vitro de 6 plantas peruanas. Rev. Soc. Quim. Perú 79(1): 13-20.
Doroteo, VH., Terry, C., Diaz C., Vaisberg, A., y Rojas, R. (2012). Compuestos fenólicos y actividades antioxidante, antielastasa, anticolagenasa y fotoprotectora in vitronde Myrciaria dubia (camu camu) y Caesalpinia spinosa (tara). Rev. Soc. Quim. Perú. 78 (4) 254-263.
Dostert, N., Roque, J., Brokamp, G., Cano, A., La Torre, M., y Weigend M. (2009). Factsheet: Datos botánicos de Tara. Lima. Deutsche Gesellschaft für Technische Zusammenarbeit (GTZ) GmbH: Programa Desarrollo Rural Sostenible – PDRS.
Fuentes, J. (2019). Las plantas como fuente de compuestos fotoprotectores frente al daño en el ADN producido por la radiación ultravioleta. Rev. Acad. Colomb. Cienc. Ex. Fis. Nat. 43 (168):550-562.
Gobierno Regional de Junín. Plan de Desarrollo Regional Concertado Junin 2008 – 2015. Junín, (2008). 180 pags.
González, L., Retana, R., y Roldán, E. (2017). Capacidad antioxidante, lipoperoxidación y calidad seminal de individuos jóvenes clinicamente sanos. Revista Iberoamericana de Ciencias. Vol 4 (4): 63-70.
Guevara, JM., Guevara, JC., Guevara D, JM., Bejar, V., Huamán, A., Valencia, E., y Abanto,P. (2014). Evaluación del conocimiento de diferentes biovariedades de Caesalpinia spinosa (tara) frente a cepas de Staphylococcus aureus sensibles y resistentes a oxacilina. An.Fac.med. 75 (2):177-180.
Huachi, L., Macas, A., y Mendez, G. (2014). Biodegradación de los fenoles presentes en el extracto de guarango (Caesalpinia spinosa) y en los colorantes indigo carmín, naranja II y rojo fenol a través de Trametes versicolor y Aspergillus niger. La Granja: Revista de Ciencias de la Vida 20(2): 29-35
Linos, E., Swetter, S., Cockburn, M., Colditz, G., y Clarke, C. (2009). Increasing burden of melanoma in the United States. J. Invest. Dermat 129:1666-1674.
Lock O. (1994). Investigación Fotoquímica; métodos en el estudio de productos naturales. Fondo Editorial Pontificia Universidad Católica del Perú. 2da ed. Lima.
López, A., Oré, R., Miranda, C., Trabucco, J., Orihuela, D., Linares, J., Villafani, Y., Ríos, S., y Siles, M. (2011). Capacidad antioxidante de poblaciones silvestres de “tara” (Caesalpinia spinosa) de las localidades de Picoy y Santa Fe (Provincia de Tarma, departamento de Junín). Scientia Agropecuaria 2: 25-29.
López, A., Siles-Vallejos, M., Orihuela, D., Linares, J., Ríos, S., Villafani, Y., Guevara, M., y Bracamonte, O. (2013). Caracterización citogenética de Caesalpinia spinosa de los distritos de Tarma y Palca (Junín). Rev. Peru. Biol. 20(3) :245-248
López, F., Garró, V., Yrei, V., y Gallardo, T. (1998). Acción antimicrobiana Caesalpinia tintoria (Molina) Kuntze o Tara, de diferentes regiones del Perú. Ciencia e Investigación. Vol. 1. (1): 27-31.
Mackerness, A., John, C., Jordan, B., y Thomas, B. (2001). Early signaling in Ultraviolet-B reponses: distinct roles for different reactive oxygen species and nitric oxide. FEBS Lett 489: 237-242.
MINAGRI. (2017). Perfil técnico Nº1 ABC de la producción y Comercio de tara en el Perú. Ministerio de Agricultura y Riego. Lima, Perú. 6 páginas.
Muñoz, J., Ramos, E., Alvarado-Ortiz, U., y Castañeda, C. (2007). Evaluación de la capacidad antioxidante y contenido de compuestos fenólicos en recursos vegetales promisorios. Rev. Soc. Quim. Perú 73 (3) : 142-149.
Portal, E. (2010). Distribución altitudinal y elaboración de clave dicotómica y pictórica de biotipos de tara (Caesalpinia spinosa). Biológica Huamangensis 1(1) : 1-5.
Rodrigo, M., Valdivieso, R., Suarez, S., Oriondo, R., y Oré,R. (2011). Disminución del daño oxidativo y efecto hipoglicemiante de la maca (Lepidium meyenii Walp) en ratas con diabetes inducida por streptozotocina. An. Fac. med. 72(7) : 7-11.
Rodriguez, M. (2008). Influencia de la temperatura en la germinación de semillas de Caesalpinia spinosa (Molina) Kuntze “taya” de cuatro localidades del Departamento La Libertad, Perú. Arnaldoa 15(1):87 – 100.
Ruch, RJ., Cheng, SJ., y Klauning, JE. (1989). Prevention of cytotoxicity and inhibition of intracelular communication by antioxidant catchins isolated from Chinese green tea. Carcinogenesis 10 (6):1003-1008.
Soto-Dominguez, A., García-Garza, R., Ramirez-Casas, Y., Morán-Martinez, J., y Serrano-Gallardo, L. (2012). El extracto acuoso de orégano (Lippie graveolens HBK) del norte de México tiene actividad antioxidante sin mostrar un efecto tóxico in vitro e in vivo. Int. J. Morphol. 30(3): 937-944.
Vernhes, M., Gonzáles-Pumariega, M., Passaglia, A., Martins, FC. y Sanchez-Lamar, A. (2013). El extracto acuoso de Phyllanthus orbicularis K protege al ADN plasmídico del daño inducido por las radiaciones ultravioletas. Ars. Pharm. 54(1): 16-23.
Villanueva, C. (2007). La Tara, el oro verde de los incas. Lima. Ed. AGRUM. 1° edición. Universidad Nacional Agraria La Molina. 163 pags.
Villena, J., Seminario, J., y Valderrama, M. (2019). Variabilidad morfológica de la “tara” Caesalpinia spinosa (Molina.) Kuntze (Fabaceae), en poblaciones naturales de Cajamarca: descriptores de fruto y semilla. Arnaldoa 26 (2): 555-574.