Efecto sinérgico del Ácido giberélico y del Ácido indolacético en la propagación in vitro de Solanum tuberosum L. ‘‘papa nativa de pulpa de color”.
Synergistic effect of Gibberellic acid and indoleacetic acid in the in vitro propagation of Solanum tuberosum L. ‘‘native potato of colored pulp”.
Eloy Lopéz- Medina 1; José Mostacero- León 1; Armando Efraín Gil- Rivero 1; Angélica López -Zavaleta 1; Anthony J. De La Cruz-Castillo 1; Luigi Villena Zapata 2
1 Laboratorio de Biotecnología del Instituto de Papa y Cultivos Andinos, Universidad Nacional de Trujillo. Av. Juan Pablo II S/N; Ciudad Universitaria, Trujillo – Perú.
2 Universidad Cesar Vallejo. Chimbote, Perú.
*Autor para correspondencia: slopezm@unitru.edu.pe
Recibido: 6 de Agosto, 2019. Aceptado: 2 de Setiembre, 2019.
RESUMEN
La papa es un cultivo ancestral que cuenta con una enorme biodiversidad. Siendo las variedades de “papa nativa de pulpa de color”, las de mayor importancia por poseer genes de resistencia a condiciones ambientales adversar y antioxidantes que ayudan a combatir enfermedades degenerativas e inflamaciones. La biotecnología constituye ser una alternativa para la conservación de tan preciado acervo genético; ante la necesidad de conocer y evaluar el efecto de diferentes hormonas en la propagación in vitro de S. tuberosum L., se tomó como objetivo determinar su efecto sinérgico. Para ello se seleccionaron entrenudos de la variedad ‘‘Cochacina”, para ser sembrados en el Laboratorio de Biotecnología del Instituto de la Papa y Cultivos Andinos. Para la propagación in vitro se utilizó el medio MS 1962 suplementado con diferentes concentraciones de ácido indolacético y ácido giberélico. Se analizó el efecto de estas concentraciones sobre los parámetros altura de plántula, numero de entrenudos y de raíces. El análisis de varianza encontró diferencias significativas, concluyendo que el ácido giberélico y el ácido indolacético a las concentraciones de 0.5 ppm AG3 y 0.1 ppm AIA, ejercen efecto sinérgico en la propagación in vitro S. tuberosum L. ‘‘papa nativa de pulpa de color”.
Palabras claves: Efecto sinérgico, Ácido giberélico, Ácido indolacético, in vitro, papa nativa, pulpa de color.
ABSTRACT
The potato is an ancestral crop that has enormous biodiversity. Being the "native varieties of pulp of color", those of greater importance for own genes of resistance to adverse environmental conditions and antioxidants that help to combat degenerative diseases and inflammations. Biotechnology is the alternative for the conservation of such a precious gene pool; in view of the need to know and evaluate the effect of different hormones on the in vitro propagation of S. tuberosum L., the synergic effect was determined. For this purpose, internodes of the variety "Cochacina" were selected to be planted in the Biotechnology Laboratory of the Institute of Potato and Andean Crops. For the propagation in vitro the MS 1962 medium supplemented with different concentrations of indoleacetic acid and gibberellic acid was used. The effect of these concentrations on seedling height parameters, number of internodes and roots was analyzed. The analysis of variance found significant differences, concluding that gibberellic acid and indolacetic acid at the concentration of 0.5 ppm AG3 and 0.1 ppm AIA, exert synergistic effect on the in vitro propagation of S. tuberosum L. '' native potato of color pulp "
Keywords: Synergistic effect, Gibberellic acid, indoleacetic acid, in vitro, native potato, colored pulp.
DOI: http://dx.doi.org/10.17268/rebiol.2019.39.02.05
2. INTRODUCCIÓN
La papa es el cuarto cultivo más importante en el mundo luego del trigo, maíz y arroz. Siendo China el mayor productor, con 5 millones de hectáreas que representan el 22 % de la producción mundial. En Perú, su cultivo representa el 8% del PBI agropecuario, constituyéndose en la actividad que genera más ingresos para las comunidades Alto Andinas, involucrando 19 departamentos del país (MINAGRI, 2011). El tubérculo de la papa, desde el punto de vista alimenticio ha sido adaptado, incorporado y asimilado según las necesidades alimentarias de las diferentes culturas alrededor del mundo (Bonnett, 2019). Mientras que desde el punto de vista industrial es utilizado para la obtención de aditivos espesantes y estabilizantes (Vargas et al., 2016).
La papa es originaria del altiplano Peruano Boliviano (Spooner y Hetterscheid, 2005). Investigaciones han demostrado que apartir de una especie diploide ¨Solanum phureja¨, se dio origen a más de 5000 variedades, todas reportadas para el Perú (Pumisacho y Sherwood, 2002; Inostroza et al., 2017). Pudiendo agruparse en tres categorías: “variedades comerciales”, “variedades nativas” y “variedades nativas de pulpa de color”. Reportes afirman que un mayor acervo genético se concentra en el Centro y Sur del Perú, sin embargo, el Norte del Perú también concentra una cantidad representativa de 317 variedades nativas, de las cuales 86, son variedades “nativas de pulpa de color” (Gil et al., 2019).
Con el conocimiento de variedades de ‘‘papa nativa de pulpa de color”, su cultivo ha rebrotado en el escenario mundial cambiando su identidad como alimento nutracéutico, que brinda bienestar a sus consumidores y a su vez contribuyen con el tratamiento de ciertas enfermedades (Bonnett, 2019; Rojas et al., 2015; Balbín, 2014). Investigaciones han demostrado que poseen un elevado valor nutricional en antioxidantes y polifenoles, los cuales pueden variar de concentración dependiendo de la variedad (Diez et al, 2013; Giusti et al., 2014; Molina et al., 2015; Suárez, 2014). Corroborándose su alta capacidad de curar y/o aliviar enfermedades gástricas e inflamaciones; además de ayudar a combatir enfermedades degenerativas que favorecen el crecimiento de tumores. Evidencia de ello es la calidad de vida que se refleja en la longevidad de la población andina (Sandoval et al., 2015; Caballero y Gonzáles, 2016; Diez et al., 2013).
Los efectos del cambio climático afectan directamente el rendimiento de los cultivos, ocasionando perjuicios económicos, siendo necesario la adopción de una serie de medidas que impliquen la adaptación de los cultivos frente al cambio climático. Se ha demostrado que las variedades nativas cuentan con una expresión diferencial de genes únicos, que ante condiciones adversas cuentan con mayor estabilidad, infiriéndose la necesidad de la conservación de su germoplasma (Tonconi, 2015; Tirado et al., 2018; Torres et al., 2014). Por otro lado la generación y empleo de plantas in vitro y microtubérculos como semilla pre-básica busca erradicar la producción tradicional de semilla, fomentándose el desarrollo de nuevas plantaciones que optimicen la producción, para beneficio del agricultor (Tapia et al., 2017).
En biotecnología vegetal se hace uso de fitohormonas y fitorreguladores. Siendo la micropropagación, la técnica que tiene como finalidad masificar la producción de plántulas, para alcanzar el objetivo de conservar in vitro el germoplasma de una determinada especie. Las hormonas son catalogadas como reguladores químicos del crecimiento y desarrollo, provocando una respuesta fisiológica en cantidades ínfimas. Pudiendo agruparse en auxinas, giberelinas, citocininas, ácido abscisico y etileno. Las auxinas influyen en el alargamiento celular, formación de pared celular, crecimiento radicular y dominancia apical; siendo las más conocidas, el ácido indol acético (AIA), ácido naftalenacético (ANA) y ácido indolbutírico. Por otro lado, las giberelinas contribuyen con el alargamiento del tallo, inducen a la floración e interrumpen la latencia de semillas; siendo el AG3 el más común (Raven et al., 1992; Vásquez & Vásquez, 2016; Curtis et al., 2008). Investigaciones han demostrado que el empleo de medio de cultivo MS, suplementado con 0.10 mg.L-1 de GA3 y 0.50 mg. L-1 de BAP resultó ser favorable en cuanto a la altura de plántula, número de entrenudos, hojas y brotes axilares. Por otro lado el empleo de medio de cultivo MS (1962) suplementado con Sacarosa al 8%, Manitol al 1.5 %, y Cloruro de clorocolina a 1.5 ppm es favorable para la conservación in vitro del germoplasma de papa (González y Chavarría, 2016; Lopéz, 2012).
El efecto sinérgico entre hormonas busca generar mejores efectos que su aplicación de manera individual, pudiendo ser favorables o desfavorables para el crecimiento y desarrollo de un explante (Gil et al., 2016). Si bien en la actualidad existen numerosas vías para la propagación de papa, son escasos reportes científicos relacionados con la evaluación del efecto sinérgico entre dos hormonas. Ante ello se planteó el objetivo de la investigación de evaluar el efecto sinérgico del ácido giberélico y de ácido indolacético en la propagación in vitro de S. tuberosum L. ‘‘papa nativa de pulpa de color”.
3. MATERIAL Y MÉTODOS
El presente trabajo se realizó en el Laboratorio de Biotecnología del Instituto de la Papa y Cultivos Andinos (IPACA), de la Universidad Nacional de Trujillo. Los tubérculos de papa procedieron del Distrito de Carabamba, Provincia de Julcán, Departamento de La Libertad-Perú.
Selección y siembra en maceta de tubérculos de S. tuberosum L. ‘‘papa nativa de pulpa de color”.
En invernadero se seleccionaron los mejores tubérculos en base a su óptimo estado sanitario, las cuales fueron sembradas en macetas. El sustrato estuvo constituido por una mezcla de compost y tierra agrícola. Se sembró un tubérculo por maceta, previo tratamiento con fungicida Benomil a la dosis de 1% de ingrediente activo. Una vez que emergieron las plántulas, el riego se efectuó una vez por semana.
Preparación de medio de cultivo para evaluar el efecto sinérgico del ácido giberélico y de ácido indolacético en la propagación in vitro de S. tuberosum L. ‘‘papa nativa de pulpa de color”.
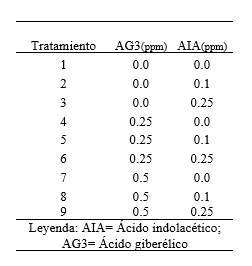
Para la preparación de 200 ml de medio de cultivo MS (1962), en un matraz se midió el volumen de MS (1x) y se suplemento con diferentes concentraciones del ácido giberélico y de ácido indolacético, de acuerdo al tratamiento asignado (Tabla 1); aforándose con agua destilada a 200 ml. En balanza analítica, se pesó el azúcar (3%) y el agar (0.60 %). Luego se calentó el medio de cultivo y cuando estuvo tibio se vertió el azúcar y el agar, una vez homogenizado se procedió a servir 2 ml por cada tubo de ensayo. Se selló con papel metálico la boca de los tubos, para finalmente proceder a empaquetar y esterilizar en autoclave a 120º C, 1 atm de presión por 30 minutos.
Tabla 1. Medio de cultivo MS 1962 suplementado con diferentes concentraciones de ácido indolacético y ácido giberélico para evaluar el efecto sinérgico en la propagación in vitro de S. tuberosum L. ‘‘papa nativa de pulpa de color”.
Siembra in vitro de explantes de S. tuberosum L. ‘‘papa nativa de pulpa de color”.
Se colectaron entrenudos de S. tuberosum L., cuando las plantas madres cultivadas en macetas alcanzaron los 2 meses de edad. La siembra in vitro se realizó en cámara, previa desinfección del área y encendido de los mecheros. Los explantes colectados de la planta madre fueron enjuagados con agua y detergente por 2 minutos. Luego se desinfectaron, primero con alcohol de 70° durante 30 segundos, seguido de 3 enjuagues con agua estéril autoclavada. Y luego con lejía al 2%, durante 3 minutos seguido de 3 enjuagues con agua estéril autoclavada. Se colocaron los explantes dentro de una placa de Petri estéril provista de papel filtro, para eliminar el exceso de humedad. Finalmente, con la ayuda del bisturí los explantes fueron tomados uno por uno y sembrados en sus respectivos tubos. Una vez concluida esta actividad, se rótulo la información referida a la variedad y fecha de siembra. Luego fueron llevados al cuarto de incubación, a una temperatura a 18 °C.
Fotoperiodo 16-8 horas luz oscuridad y humedad relativa del 85% (Lopéz et al., 2019).
Análisis estadístico de plántulas de S. tuberosum L. ‘‘papa nativa de pulpa de color”.
La toma de datos, altura de plántula, número de nudos y número de raíces se realizó a los 20 días después de la siembra. Se utilizó un Diseño en Bloques Completamente al Azar, constituido por 162 unidades experimentales, distribuidos en 9 tratamientos con 3 repeticiones y 6 unidades muestrales por tratamiento. Los resultados obtenidos fueron sometidos al análisis de varianza (ANOVA), empleando el software R, con un nivel de significancia del 95%.
4. RESULTADOS
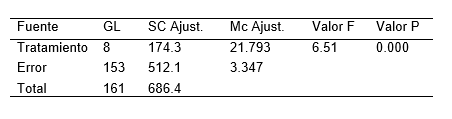
La Tabla 2, resume los resultados promedios de los parámetros altura de plántula, número de nudos y numero de raíces en la micropropagación por nudos de S. tuberosum L. ‘‘papa nativa de pulpa de color”, empleando diferentes concentraciones de ácido giberélico y del ácido indolacético. Pudiéndose resaltar que el tratamiento 8 destaca por presentar mayores resultados en los parámetros evaluados. Por otro lado la Figura 2, ilustra las plántulas in vitro a los 20 días de evaluación. Mientras que la Tabla 3,4 y 5 detalla el análisis de varianza (ANOVA), de la altura, numero de nudos y numero de raíces de plántulas de S. tuberosum L. ‘‘papa nativa de pulpa de color”, a los 20 días de evaluación.


Figura 1. Solanum tuberosum L. ‘‘papa nativa de pulpa de color”. A) Fotografía de la variedad ‘‘Cochacina”. B) Fotografía del cultivo in vitro.

Figura 2. Evaluación a los 20 días, del efecto sinérgico del ácido giberélico y de ácido indolacético en la propagación in vitro de S. tuberosum L. ‘‘papa nativa de pulpa de color”.
Tabla 2. Resultados del efecto sinérgico del ácido giberélico y de ácido indolacético en la propagación in vitro de S. tuberosum L. ‘‘papa nativa de pulpa de color”.
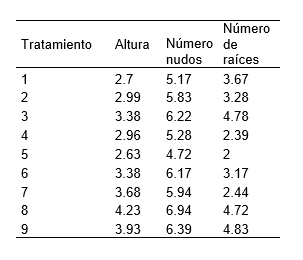
Tabla 3. Análisis de varianza (ANOVA), de la altura de plántulas de S. tuberosum L. ‘‘papa nativa de pulpa de color”, a los 20 días de evaluación.
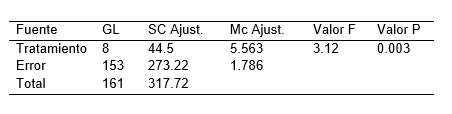
Tabla 4. Análisis de varianza (ANOVA), del número de nudos de plántulas de S. tuberosum L. ‘‘papa nativa de pulpa de color”, a los 20 días de evaluación.
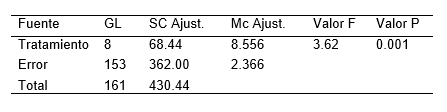
Tabla 5. Análisis de varianza (ANOVA), del número de raíces de plántulas de S. tuberosum L. ‘‘papa nativa de pulpa de color”, a los 20 días de evaluación.
6. DISCUSIÓN
Se evidenció cierta variabilidad entre los tratamientos en cuanto altura, número de entrenudos y raíces, ante el empleó de diferentes concentraciones de ácido giberélico y de ácido indolacético (Tabla 1). Al ser sometidos al análisis de varianza (ANOVA), se corrobora la afirmación de existir diferencias estadísticamente significativas, lo cual es indicador de un notable efecto sinérgico al emplear 2 fitohormonas (Tabla 3; Tabla 4; Tabla 5). Sin embargo, investigaciones de García et al. (2015) afirmar que para la propagación in vitro de S. tuberosum L., no es necesario el empleo de reguladores de crecimiento, basta el medio de cultivo MS (1962) y una buena cantidad de sacarosa de 30 gL-1 (3%). De la misma manera López et al. (2019) y Araque et al. (2018) sostiene que para la multiplicación y mantenimiento de explantes de S. tuberosum L., basta el empleo del medio de cultivo MS (1962) sin reguladores de crecimiento. Pudiendo haber una ínfima diferencia al suplementar el medio de cultivo con 0.02 mg L-1 de ácido naftalenacético (ANA). Mientras que el empleo de 0.05 mg L-1 de AIB garantiza un mayor desarrollo de un sistema radical en el número de raíces (4.87) y la longitud de raíces (8.2 cm). Por otro lado Tacoronte et al. (2017) sostienen que obtuvieron un mayor crecimiento de S. tuberosum L., al incrementar en el medio de cultivo MS (1962) las concentraciones de nitrato de amonio a 1,98 g L-1, nitrato de potasio a 2,28 g L-1 y bajando la sacarosa a 20 gL-1, obteniendo plántulas de 5,82 cm de longitud promedio y con raíces de 3 cm.
La evaluación a los 20 días después de la siembra, nos indica que el tratamiento T8 destacó en la propagación in vitro de S. tuberosum L. ‘‘papa nativa de pulpa de color”. Debido a que los explantes evidenciaron un ligero incremento en cuanto a altura, número de entrenudos y raíces, comparado con el resto de tratamientos (Figura 2; Tabla 2). Sin embargo, investigaciones han demostrado que el empleo de medio de cultivo liquido MS (1962), suplementado con 1 mgL-1 de benciladenina, bajo un fotoperiodo de 8 h luz; brinda mejores resultados en cuanto a longitud de plántulas, pudiendo alcanzar los 18.03 cm (Moreno y Oropeza, 2017).
7. CONCLUSIONES
Se concluye que el ácido giberélico y el ácido indolacético a la concentración de 0.5 ppm AG3 y 0.1 ppm AIA, ejercen efecto sinérgico en la propagación in vitro S. tuberosum L. ‘‘papa nativa de pulpa de color”.
8. AGRADECIMIENTOS
Un agradecimiento especial al Laboratorio de Biotecnología del Instituto de La Papa y Cultivos Andinos (IPACA) de la Universidad Nacional de Trujillo-Perú, por brindarnos las facilidades para llevar a cabo esta investigación en su establecimiento.
9. REFERENCIAS BIBLIOGRÁFICAS
1. Araque, E.; Bohórquez, M.; Pacheco, J.; Correa, L; Urquijo, J.; Castañeda, S.; Pacheco, J. 2018.Propagación y tuberización in vitro de dos variedades de papa. Ciencia en Desarrollo 9(1), 21-31.
2. Bonnett, D.2019. "Resurgencia" y recolonización de la papa. Del mundo andino al escenario alimentario mundial, siglos XVI- XX. Anuario Colombiano de Historia Social y de la Cultura 46(1), 27-57.
3. Balbín, B. 2014. Nutracéutico peruanos que previenen enfermedades. Cultura, Ciencia y Tecnología 5: 9-16.
4. Caballero, L.; Gonzáles, G.2016.Alimentos con efecto anti-inflamatorio. Acta Médica Peruana 33(1), 50-64.
5. Curtis, H.; Barnes, N.; Schnek, A.; Massarini. A. 2008. Biología. 7ma edición. Editorial Médica Panamericana. España.1160 pp.
6. Diez, C.; López, E.; Zavaleta, C.; Rodríguez, M.; Huayanay, J. 2013. Cuantificación de los principios anticancerígenos de la variedad de papa nativa de pulpa de color de la región La Libertad con el fin de procesamiento industrial. Pueblo continente 24(2) ,425-431.
7. García, L.; Rodríguez, M.; La O., M.; Pérez, M.; Alvarado, Y.; De Feria, M. ; Veitía, N., Mirabal1, D.; Castillo, J. 2015. Propagación in vitro de variedades cubanas de Solanum tuberosum L. ‘Yuya’, ‘Marinca’, ‘Grettel’ e ‘Ibis’. Biotecnología Vegetal 15 (2), 75 – 83.
8. Gil, E.; Lopéz, E.; Lopéz, A. 2016. Efecto sinérgico del ácido indolacético, ácido giberélico y 6-bencilaminopurina en la propagación in vitro de “papaya” Carica papaya L. (Caricaceae). Arnaldoa 23 (2), 577 – 586.
9. Gil, E.; Lopéz, E.; Mostacero, J.; De la Cruz, J. (2019). Papas nativas con potencial antioxidante, cultivadas en el norte del Perú. Boletín Latinoamericano y del Caribe de Plantas Medicinales y Aromáticas 18 (3), 289-324.
10. Giusti, M.; Polit, M.; Ayvaz, H.; Tay, D.; Manrique, I. 2014. Characterization and Quantitation of Anthocyanins and Other Phenolics in Native Andean Potatoes. Journal of Agricultural and Food Chemistry 62, 4408- 4416
11. González, D.; Chavarría, M. 2016. Microtuberización del cultivar de papa (Solanum tuberosum L.) Banba en Biorreactores Económicos de Inmersión Temporal. Tesis de pregrado. Universidad Nacional Agraria. Managua, Nicaragua. 36 pp.
12. Inostroza, J.; Méndez, P.; Espinoza, N.; Acuña, I.; Navarro, P.; Cisternas, E.; Larraín, P. 2017. Manual del cultivo de papa en Chile. Editorial del Instituto de Investigaciones Agropecuarias (INIA). Santiago, Chile. 144 pp.
13. Lopéz, S. 2012. In vitro conservation of germplasm of native potato of color-pulp from Region La Libertad, Perú. REBIOL 1(32), 11- 15.
14. Lopéz, S., Mostacero, J., Gil., E., Lopéz., A. y De la Cruz., J. (2019). Efecto del ácido giberélico y del ácido indolacético en la micropropagación in vitro de Solanum tuberosum var. Maria Reiche. Rebiol, 39(1), 1-9.
15. MINAGRI.2011. La papa nuestra de cada día. Editorial del Ministerio de Agricultura. Lima, Perú. 13 pp.
16. Molina, Y.; Rabe, G.; Rodríguez, M.; Cerón, M.; Garnica. A. 2015. Contenido de antioxidantes en papas criollas nativas (Solanum tuberosum L. grupo Phureja), en proceso de precocción y congelación. Revista Alimentos Hoy 36 (23), 31-41.
17. Moreno, M.; Oropeza, M. 2017.Efecto de las hormonas vegetales y el fotoperiodo en la producción de microtubérculos de papa (Solanum tuberosum L.). Revista Colombiana de Biotecnología 19 (2) ,29-38.
18. Pumisacho, M.; Sherwood, S. 2002. El cultivo de la papa en Ecuador. Editorial del INIAP. Quito, Ecuador. 231 pp.
19. Raven, P.; Evert, R.; Eichhorn S. 1992. Biología de las plantas. Editorial Reverte S. A. Barcelona, España. 773 pp.
20. Rojas, S.; Lopera, J.; Uribe, A.; Correa, S.; Perilla, N.; Marín, J. 2015. Consumo de nutracéuticos, una alternativa en la prevención de las enfermedades crónicas no transmisibles. Revista Biosalud 14(2), 91-103.
21. Sandoval, M.; Tenorio, J.; Tinco, A.; Loli, R.; Calderón, S.2015. Efecto antioxidante y citoprotector del tocosh de Solanum tuberosum ‘papa’ en la mucosa gástrica de animales de experimentación. Anales de la Facultad de Medicinan 76(1) ,15-20.
22. Spooner, D.; Hetterscheid, W. 2005. Origins, evolution, and group classification of cultivated potatoes. In: Darwin's Harvest: New Approaches to the Origins, Evolution, and Conservation of Crops. Motley, T., Zerega, N., y Cross, H. (eds). pp. 285-307. Colombia University Press, New York.
23. Suárez, S.; Ale, N.; Trabucco, J.; Sanabria, O. 2014. Polifenoles, micronutrientes minerales y potencial antioxidante de papas nativas. Revista de la Sociedad Química del Perú 80(2), 108-114.
24. Tacoronte, M.; Vielma, M.; Olivo, A.; Chacín, N. 2017. Efectos de nitratos y sacarosa en la propagación in vitro de tres variedades de papa nativa. Revista Colombiana de Biotecnología 19(2), 63-73.
25. Tapia, M.; Lorenzo, C.; Mosqueda, O.; Escalona, M. 2017. Obtención de microtubérculos y minitubérculos como semilla pre-básica en tres cultivares peruanos de papa. Biotecnología Vegetal 17(3), 161-169.
26. Tirado, R.; Roberto, L.; Mendoza, J. 2018. Interacción genotipo × ambiente en rendimiento de papa (Solanum tuberosum l.) con pulpa pigmentada en Cutervo, Perú. Chilean Journal of Agricultural & Animal Science (ex Agro-Ciencia) 34(3), 191-198.
27. Tonconi, J. 2015. Producción agrícola alimentaria y cambio climático: un análisis económico en el departamento de Puno, Perú. Idesia 33(2), 119-136.
28. Torres, Y.; Lozano, R.; Merino, C.; Orjeda, G.2014. Identificación de genes relacionados a sequía en papas nativas empleando RNA-Seq. Revista Peruana de Biología 20(3), 211 – 214.
29. Vargas, G.; Martínez, P.; Velezmoro, C. 2016. Propiedades funcionales de almidón de papa (Solanum tuberosum) y su modificación química por acetilación. Scientia Agropecuaria 7 (3), 223-230.
30. Vásquez, R.; Vásquez, R.2016. Temas selectos de biología 2. 2da Edición. Grupo Patria S.A. México. 152 pp.