AISLAMIENTO Y EVALUACIÓN DE LA ACTIVIDAD CELULOLÍTICA DE BACTERIAS RIZOSFÉRICAS DEL DISTRITO DE BAGUA, AMAZONAS
ISOLATION AND EVALUATION OF CELLULOLYTIC ACTIVITY OF RHIZOBACTERIA FROM BAGUA DISTRICT, AMAZONAS
Juan Carlos Alvarado-Ibáñez 1, Ronald Omar Estela-Urbina 1, Yelka Martina López-Cuadra 1, Nemesio Santamaría-Baldera 1, Rómulo Mori-Zavaleta 1, Mayra Karina Gutiérrez-Araujo 2
1 Universidad Nacional Intercultural “Fabiola Salazar Leguía” de Bagua
2 Universidad Nacional de Trujillo
*Autor de correspondencia: jalvarado@unibagua.edu.pe
Recibido: 2 de Setiembre, 2019. Aceptado: 30 de Noviembre, 2019.
RESUMEN
La celulosa es el carbohidrato más abundante en la naturaleza, y una fuente importante de carbono utilizada como materia prima en biotecnología para la obtención de productos de interés económico como el etanol. Los microorganismos con actividad celulolítica se encuentran en la naturaleza asociados a los cultivos vegetales, por tanto este trabajo de investigación tuvo como objetivo aislar y determinar la actividad celulolítica de los cultivos bacterianos obtenidos de la rizósfera de cuatro cultivos y dos suelos eriazos del distrito de Bagua, Amazonas. Se obtuvo 124 aislamientos bacterianos del rizoplano de Theobroma cacao, Coffea arabica, Carica papaya y Manihot esculenta y 16 cultivos a partir de los suelos eriazos. El suelo de origen de las rizobacterias se caracterizó por ser de textura franco-limosa principalmente, y pH variable entre 6.30 y 7.90. Las muestras de suelo se diluyeron en diluciones seriadas la décimo en agua peptonada al 0.1% hasta 10-5 y fueron sembradas en agar Carboximetilcelulosa (CMC) al 1% e incubadas a 35ºC por 48 h. Luego se resembró en agar CMC 1% y se seleccionaron colonias que presentaban mayores halos de hidrólisis mediante la prueba con rojo de congo, estas colonias seleccionadas luego fueron resembradas por puntura por triplicado, determinando su halo neto de hidrólisis promedio de cada una de ellas, seleccionando 8 cultivos con mayor actividad celulolítica de las cuales el 100% pertenecen a suelos rizosféricos. Es así como se demuestra la presencia de cultivos bacterianos con gran actividad celulolítica en los suelos rizosféricos de los cultivos de importancia económica del distrito de Bagua, Amazonas.
Palabras clave: Cultivos bacterianos, actividad celulolítica, celulasas.
ABSTRACT
Cellulose is the most abundant carbohydrate in nature, and an important source of carbon used as a raw material in biotechnology to obtain products of economic interest such as ethanol. Microorganisms with cellulolytic activity are found in nature associated with plant crops, so this research was aimed at isolating and determining the cellulolytic activity of bacterial cultures obtained from the rhizosphere of four crops and two eroded soils of the Bagua district, Amazonas region. 124 bacterial isolates were obtained from rhizoplane of the Theobroma cacao, Coffea arabica, Carica papaya and Manihot esculenta and 16 cultures were obtained from the eroded soils. The soil of origin of the rhizobacteria was characterized by being mainly loamy, and variable pH between 6.30 and 7.90. The soil samples were diluted in serial dilutions the tenth in 0.1% peptonated water from 10-1 to 10-5 and seeded in 1% carboxymethylcellulose agar (CMC) and incubated at 35 ° C for 48 h. It was then reseeded in 1% CMC agar and colonies that had greater hydrolysis halos were selected by means of the Congo red test, these selected colonies were then reseeded in triplicate puncture, determining their average net hydrolysis halo of each of them, selecting 8 crops with greater cellulolytic activity of which 100% belong to rhizospheric soils. This is how the presence of bacterial cultures with great cellulolytic activity is demonstrated in the rhizospheric soils of economically important crops in the district of Bagua, Amazonas region.
Keywords: Bacterial cultures, cellulolytic activity, cellulases.
DOI: http://dx.doi.org/10.17268/rebiol.2019.39.02.04
1. INTRODUCCIÓN
Estructuralmente, la celulosa es un carbohidrato compuesto de unidades de glucosa unidas en una larga cadena lineal por enlaces en los átomos de carbono 1 y 4 de la molécula de azúcar. La celulosa existe en las plantas superiores, en las algas, en muchos tipos de hongos y en los quistes de algunos protozoarios. El polisacárido está localizado en la pared celular donde se encuentra como unidades submicroscópicas de forma alargada conocidas como micelas. A su vez, estas micelas se arreglan en estructuras más grandes, las microfibrillas, las cuales están suficientemente empaquetadas para prevenir la penetración no sólo de enzimas sino de pequeñas moléculas semejantes al agua (Lynd et al., 2002).
La celulosa es un importante constituyente de las plantas superiores y probablemente el compuesto orgánico más abundante en la naturaleza. Debido a que gran parte de la vegetación que pasa a formar parte del suelo es celulosa, la descomposición de este carbohidrato tiene una importancia muy especial en el ciclo biológico del carbono, consecuentemente los microorganismos del suelo que catabolizan la hidrólisis del material vegetal (40-60% de residuos de plantas) influencian el flujo de energía desde éste hasta la formación de CO2 y su liberación a la atmósfera (Alexander, 1980; Alcivar y Vera, 2013).
Las moléculas de glucosa se unen entre sí a través de los enlaces β-1,4-glucosídico, para así formar cadenas de longitud enorme que dan lugar a las moléculas de celulosa. Las moléculas resultantes de la polimerización de la glucosa, con fórmula empírica (C6H10O5)n, son altamente resistentes e insolubles en agua (Gaitán y Lara, 2007), la celulosa tiene una estructura lineal o fibrosa donde los diversos puentes de hidrógeno entre los grupos hidroxilo, que se establecen entre diferentes cadenas yuxtapuestas de glucosa, dando lugar a fibras de mayores dimensiones llamadas microfibrillas que conforman la pared celular de las células vegetales, donde este representa aproximadamente el 50 por ciento del peso seco las plantas (Gracia, 2012).
En la hidrólisis de la celulosa es indispensable la presencia de enzimas, siendo tres las más destacadas:, la exo β-1,4 celobiohidrolasa, endo β-1,4 glucanasa (β-1,4 glucano glucanohidrolasa) y la β-1,4 glucosidasa (Zhang et al., 2006), donde la endo β-1,4 glucanasa hidroliza aleatoriamente los enlaces β-1,4 glucosídicos intramoleculares expuestos de cadenas de celulosa para producir con ello oligosacáridos de diversas longitudes (celodextrinas), la exo β-1,4 celobiohidrolasa cliva los extremos no reductores del sustrato produciendo unidades de celobiosa o glucosa y por último la β1,4 glucosidasa, termina el proceso hidrolítico transformando los fragmentos de celobiosa a glucosa o quitando glucosa desde los extremos no reductores de diminutos celoligosacáridos (Gaitán y Lara, 2007).
Los microorganismos encargados de la degradación de la celulosa, principal componente de la pared celular de las plantas incluyen bacterias, hongos y actinomycetes, aerobios, anaerobios, mesofílicos y termofílicos, los cuales cuentan con la maquinaria enzimática necesaria para dicho propósito, por tal razón, su aislamiento e identificación representa un importante recurso para lograr la disminución del impacto ambiental y la generación de un sustrato fermentable cuya utilidad podría estar en la producción de etanol, obtención de ácidos orgánicos, edulcorantes, productos farmacéuticos y alimentos, entre otros (Gaitán y Lara, 2007).
Como las bacterias y hongos del suelo son los microorganismos mayormente involucrados en el reciclaje del material vegetal, cambios en el número de estos pueden indicar modificaciones en el contenido de materia orgánica del suelo. Cuando esto se corrobora con otros indicadores ecológicos (biomasa y diversidad de especies encontradas) se obtiene información acerca del estado del suelo y su productividad (Hendricks et al., 1995). Como resultado, se ha prestado gran atención a los organismos que participan en la descomposición de esta sustancia (Alexander, 1980).
El mecanismo ampliamente aceptado para explicar la hidrólisis enzimática de la celulosa involucra la acción enzimática de tres enzimas: la endo β-1,4 glucanasa (β-1,4 glucano glucanohidrolasa), la exo β-1,4 celobiohidrolasa y la β-1,4 glucosidasa (Lymar, et al., 1995; Zhang et al., 2006). La endo β- 1,4 glucanasa hidroliza aleatoriamente los enlaces β-1,4 glucosídicos intramoleculares accesibles de cadenas de celulosa para producir oligosacáridos de varias longitudes. La exo β-1,4 celobiohidrolasa cliva los extremos no reductores del sustrato generando unidades de celobiosa o glucosa y por último la β-1,4 glucosidasa, completa el proceso hidrolítico convirtiendo los fragmentos de celobiosa a glucosa o removiendo glucosa desde los extremos no reductores de pequeños celoligosacáridos (Lymar, et al., 1995; Zhang et al., 2006).
Los microorganismos degradadores de celulosa incluyen hongos y bacterias, aerobios y anaerobios, mesofílicos y termofílicos que ocupan una variedad de habitats (Aubert, 1988). Entre los hongos celulolíticos se destacan: Trichoderma reesei, Phanerochaete chrysosporium, Fusarium solani, Penicillum funiculosum, Trichoderma koningii, Sporotrix sp., Alternaria sp., Geotrichum sp., Rhizoctonia sp., Trametes sp., Paecilomyces sp., Mucor sp., Cladosporium sp., Bulgaria sp., Chaetomium sp., Helotium sp., Aspergillus sp. Las bacterias celulolíticas más abundantes y conocidas son las aerobias entre las cuales se pueden citar: Cellulomonas sp., Microbispora bispora, Thermomonospora sp., Cytophaga sp., Corynebacterium sp., Vibrio sp., Bacillus sp., Pseudomonas sp., Thermobifida sp. Además, se encuentran algunos anaerobios como: Acetivibrio cellulolyticus, Butirivibrio sp., Bacteroides cellulosolvens, Bacteroides succinogenes, Clostridium cellulovorans, Clostridium thermocellum, Ruminococcus albus, Ruminococcus flavefaciens (Lynd et al., 2002). Entre los actinomicetes se destacan: Streptomyces drozdowiczii, Streptomyces cellulolyticus (Semedo et al., 2004; Grigorevski et al., 2005; Li, 1997), Themomonospora curvata, Thermomonospora chromogena, Thermomonospora alba y Thermomobifida fusca (Ramírez y Coha, 2003).
La tasa a la cual se metaboliza la celulosa está dada por varios factores del medio ambiente, y los suelos que varían en sus características físicas y químicas poseen marcadas diferencias en su capacidad celulolítica. Los principales factores del medio ambiente que afectan la transformación son el nivel de nitrógeno disponible, la temperatura, aireación, humedad, pH, la presencia de otros carbohidratos y la proporción relativa de lignina en los restos vegetales (Alexander, 1980).
Este estudio está orientado a aislar, seleccionar y evaluar las bacterias con mayor actividad celulolítica autóctonos del distrito de Bagua, aislados de suelos rizosféricos de cultivos de Theobroma cacao, Coffea arabica, Carica papaya y Manihot esculenta y dos suelos eriazos siendo la celulosa el polisacárido más abundante que podría ser utilizado como fuente de carbono para la elaboración de productos biotecnológicos como el etanol, biocombustibles, entre otros.
2. MATERIAL Y MÉTODOS
Material de estudio: Para el aislamiento de bacterias celulolíticas, se procesó como muestras el suelo de la rizósfera de Theobroma cacao, Coffea arabica, Carica papaya y Manihot esculenta del distrito de Bagua y dos suelos eriazos entre los meses de agosto y octubre el año 2018. Las muestras de suelo rizosférico procesadas fueron obtenidas considerando en las primeras horas del día, registrando la temperatura media, la humedad relativa, el contenido de materia orgánica en suelo y el pH del suelo. De cada parcela con las especies vegetales antes mencionadas, se seleccionó 20 plantas al azar, y se obtuvo muestras de suelo rizosférico de 500 g cada una, a una profundidad aproximada de 20 cm, colocándolas en bolsas plásticas de primer uso para ser codificadas con los datos necesarios Las muestras se mantuvieron a temperatura de refrigeración hasta su procesamiento en el Laboratorio de Biología y Biotecnología de la UNIFSLB.
Aislamiento primario de microorganismos celulolíticos. Luego de homogenizar la muestra, se pesó 10 g de suelo, cada muestra se mezcló con 90 ml de agua peptonada 0.1% (p/v). Posteriormente se realizó diluciones seriadas desde 10-1 a 10-5 en agua peptonada al 0.1% (p/v). A partir de las diluciones preparadas se realizó la siembra en superficie en agar Carboximetilcelulosa (CMC) al 1% (p/v). Las placas de Petri se incubaron a 35°C por 7 días. Transcurrido el tiempo de incubación se adicionó rojo de congo al 1% (p/v), como revelador a las colonias presentes en los medios, luego de quince minutos se retiró el exceso y se adicionó NaCl 0.1M, dejando reposar por quince minutos más, para luego identificar las colonias con actividad celulolítica (Teather y Wood, 1982).
Aislamiento secundario de microorganismos celulolíticos. A partir de los microorganismos que se obtuvieron en el aislamiento primario se realizó repiques en agar CMC al 1% (p/v) de las colonias que presentaron mayor actividad celulolítica, llevando a incubación y revelado bajo las mismas condiciones del aislamiento primario.
Conservación de cultivos. Los cultivos seleccionados fueron sometidos a tinción de Gram y una vez definidas sus características microscópicas se procedió a obtener cultivos axénicos en agar CMC 1% (p/v). Se llevaron a cabo suspensiones de cada cultivo puro en caldo celulosa al 1% (p/v) (composición igual a agar celulosa excepto agar) igualando la concentración al tubo 1 del patrón de Mac. Farland (3*108 cel/ml). Estas suspensiones se mezclaron con glicerol a una concentración final de 25% (v/v), posteriormente las suspensiones celulares fueron distribuidas en tubos eppendorf, cada uno conteniendo un volumen de un mililitro que luego fueron almacenados a – 20ºC (Poutou et al., 1994).
3. RESULTADOS
Los resultados del estudio aislamiento y evaluación de la actividad celulolítica de bacterias rizosféricas del distrito de Bagua, Amazonas, mostraron la variedad de formas bacterianas existentes en la zona con capacidad celulolítica.
Se obtuvieron 124 aislamientos bacterianos con actividad celulolítica a partir de la rizósfera de Theobroma cacao, Coffea arabica, y Manihot esculenta y 16 aislamientos a partir de suelos eriazos. Luego de la evaluación de la actividad celulolítica se seleccionaron a 8 cultivos con mayor actividad celulolítica registrando valores hasta de 6.4 mm, los cuales fueron purificados y conservados en microtubos para su identificación posterior.
Tabla 1. Origen, halo de hidrólisis y caracterización de las bacterias con mayor actividad celulolítica aisladas
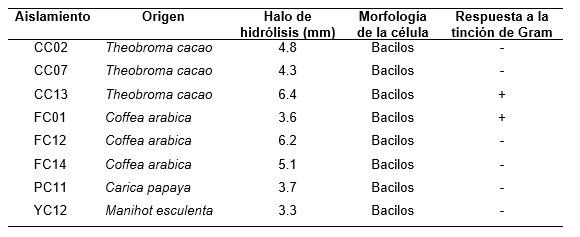

Figura 1. Halo de hidrólisis de los cultivos bacterianos puros aislados de los cultivos vegetales del distrito de Bagua, Amazonas.
4. DISCUSIÓN
La selección de las bacterias celulolíticas se determinó por los halos de hidrólisis en Agar Carboximetilcelulosa. Esta determinación se fundamentó en la capacidad del colorante Rojo de Congo para adherirse a la carboximetilcelulosa coloreando el medio de cultivo de un color rojo, al ser degradado este sustrato por las enzimas celulasas éste no se adquiere y se forma un color amarillento lo cual indica la disgregación del polímero (Lynd et al., 2002; Malherbe y Cloete, 2002).
De los ocho aislamientos seleccionados, solo dos de ellos reaccionaron al Gram positivamente, los demás fueron Gram negativos, lo cual concuerda con la diversidad de bacterias reportadas en los cuales se reporta como celulolíticos a bacilos Gram negativos y Gram positivos que podrían pertenecer a Cytophaga sp., Corynebacterium sp., Vibrio sp., Pseudomonas sp., Actinomycetes, Bacillus sp., Cellulomonas sp., Microbispora sp., Thermomonospora sp., los cuales han sido reportados con actividad celulolítica (Lynd, et al., 2002, Semedo et al., 2004), quienes aislaron diez cepas de actinomicetos en dos humedales. En el presente trabajo no es posible poder identificar el género ni especie de las bacterias aisladas con mayor actividad celulolítica.
Algunos estudios evidencian la ocurrencia y abundancia de microorganismos celulolíticos en su hábitat natural, en estrecho contacto con las plantas, determinado por factores físicos, químicos y ambientales (Sylvia et al., 2005), lo cual concuerda con la mayor actividad celulolítica asociados a la rizósfera de las plantas en comparación con los aislados bacterianos de los suelos eriazos del distrito de Bagua, Amazonas, determinando que la materia orgánica en abundancia tiene una influencia en la microbiota de estas bacterias (Semedo et al., 2004).
La diversidad de microorganismos celulolíticos en los suelos de cultivo se debió principalmente a la menor disponibilidad de carbono (celulosa), de nitrógeno y fósforo, que entre los elementos que componen los sustratos son los macronutrimentos fundamentales para el desarrollo microbiano, además el contenido de celulosa en los bosques y tierras de cultivo depende de la clase de vegetación o cultivo, de la peridiocidad del mismo y época del año, y en los suelos agrícolas, de la incorporación de los residuos de cosecha, práctica que puede ser muy esporádica o simplemente no efectuarse (Lymar et al., 1995).
5. CONCLUSIONES
Se aisló y seleccionó cultivos bacterianos con gran actividad celulolítica a partir de suelos de la rizósfera de Theobroma cacao, Coffea arabica, y Manihot esculenta cultivadas en el distrito de Bagua, Amazonas.
No se seleccionó cultivos bacterianos con actividad celulolítica a partir de suelos eriazos del distrito de Bagua, Amazonas.
6. REFERENCIAS BIBLIOGRÁFICAS
Alcivar, M. y Vera, V. (2013). Aislamiento de bacterias celulolíticas a diferentes profundidades en plantación de teca (Tectona grandis) y pechiche (Vitex gigantea) (Tesis de maestría). Escuela Superior Politécnica Agropecuaria de Manabí "MANUEL FÉLIX LÓPEZ". Ecuador.
Alexander, M. (1980). Introduccion a la microbiologia del suelo. México: AGT Editor, S.A.
Aubert, J. (1988). Biochemistry and Genetics of Cellulose degradation. USA. Academic press.
Gaitan, D. y Lara, C. (2007). Aislamiento y evaluación de microorganismos celulolíticos a partir de residuos vegetales frescos y compost generados en un cultivo de crisantemo (Dendranthema grandiflora) (Tesis de maestría. Pontificia Universidad Javeriana. Colombia.
Gracia, C. (2012). Ecología Forestal: Estructura, Funcionamiento y Producción de las masas forestales. España.
Grigorevski, A., Nascimento, R., Bonb, E., y Coelho, R. (2005). Streptomyces drozdowiczii cellulase production using agro-industrial by-products and its potential use in the detergent and textile industries. Enzyme and Microbial Technology, 37, 272–277.
Hendricks, C., Doyle, J., y Hugley, B. (1995). A New Solid Medium for Enumerating Cellulose-Utilizing Bacteria in Soil. Appl. Environ. Microbiol, 61, 2016-2019.
Li, X. (1997). Streptomyces cellulolyticus sp. nov., a New Cellulolytic Member of the Genus Streptomyces. International journal of systematic bacteriology, 47, 443-445.
Lymar, E., Li, B., y Renganathan, V. (1995). Purification and Characterization of a cellulose-binding β-glucosidase from cellulose degrading cultures of Phanaerochaete chrysosporium. Appl. Environmental Microbial, 8, 2976-2980.
Lynd, L., Weimer, P., Zyl, H., y Pretorius, I. (2002). Microbial cellulose utilization: Fundamentals and Biotechnology. Microbiology and Molecular Biology Reviews, 16, 577-583.
Malherbe, S., y Cloete, T. (2002). Lignocellulose Biodegradation: Fundamentals and applications. Re/Views in Environmental Science & Bio/Technology, 1, 105-114.
Poutou, R., Amador, E., y Candelario, M. (1994). Banco de células primario (BCP): Caracterización y papel en la producción de proteínas recombinantes. Centro de Ingeniería Genética y Biotecnología Aplicada. Sociedad Iberoamericana de Biotecnología, 11, 55-59.
Ramirez, P., y Coha, J. (2003). Degradación enzimática de celulosa por actinomicetos termófilos: Aislamiento, caracterización y determinación de la actividad celulolítica. Rev. Perú. Biol, 10, 67-77.
Semedo, L., Gomes, C., Lindares, A., Duarte, G., Nascimento, R., Rosado, A., Pinheiro, M., Margis, R., Silva, K., Alviano, C., Manfio, G., Soares, M., Lindares, L., y Coelho, R. (2004). Streptomyces drozdowiczii sp. nov., a novel cellulolytic streptomycete from soil in Brazil. Journal of Systematic and Evolutionary Microbiology, 54, 1323-1328.
Sylvia, D.P., Hartel, J., Fuhrmann y Zuberer, D. (2005). Principles and applications of soil microbiology. USA. 2da. edi. Prentice Hall-Inc.
Teather, R., y Wood, P. (1982). Use of congo red – polysaccharide interaction in enumeration and characterization of cellulolytic bacteria from the bovine rumen. Appl Environ. Microbiol, 43, 777-780.
Zhang, Y., Himmel, M., y Mielenz, J. (2006). Outlook for cellulase improvement: Screening and selection strategies. Biotechnology Advances, 24, 452-481.