Efecto de la 6- Bencilaminopurina y del médio de cultivo MS (1962) en el establecimiento in vitro de Prosopis pallida (Willd.) Kunth
Effect of 6- Benzylaminopurine and the culture medium MS (1962) on the in vitro establishment of Prosopis pallida (Willd.) Kunth
Diego José Campos León 1, Claudia Cristina Chávez Alcántara 1, Segundo Eloy Lopéz Medina 1, José Mostacero- León 1, Armando Efraín Gil- Rivero 1; Angélica Lopéz -Zavaleta 1; Anthony J. De La Cruz-Castillo 1
1 Laboratorio de Biotecnología del Instituto de Papa y Cultivos Andinos, Universidad Nacional de Trujillo. Av. Juan Pablo II S/N; Ciudad Universitaria, Trujillo – Perú.
*Autor para correspondencia: slopezm@unitru.edu.pe
Recibido: 2 de Setiembre, 2019. Aceptado: 10 de Noviembre, 2019.
RESUMEN
Prosopis pallida (Willd.) Kunth, es el principal símbolo de los bosques secos del norte del Perú, catalogándose como especie de importancia ecológica, al contribuir con el crecimiento y desarrollo de especies autóctonas de animales. Sin embargo, por su importancia económica constituye ser una especie amenazada al obtenerse leña que es comercializada por los pobladores aledaños. Siendo necesario la obtención de protocolos de propagación que permitan la producción masiva de plántulas con fines de reforestación, siendo la propagación in vitro una buena alternativa. Ante ello se propuso como objetivo determinar el efecto de la 6- Bencilaminopurina y del medio de cultivo MS (1962), en el establecimiento in vitro de P. pallida (Willd.) Kunth. El trabajo experimental se desarrolló en el Laboratorio de Biotecnología del Instituto de papa y Cultivos Andinos. Donde se preparó diferentes concentraciones de medio de cultivo MS (1962), suplementado con diferentes concentraciones de 6- Bencilaminopurina. Se aplicó un diseño de bloques completos al azar. Se concluye que T4, constituido por 1/2 MS (1962) y 0.00 ppm BAP es el mejor en lo referente a longitud, mientras que T7, constituido por un 1/3 MS (1962) y 0.00 ppm BAP es el mejor en lo referente al número de raíces de P. pallida (Willd.) Kunth.
Palabras claves: Establecimiento in vitro, Prosopis pallida, 6- Bencilaminopurina.
ABSTRACT
Prosopis pallida (Willd.) Kunth, is the main symbol of dry forests in northern Peru, being classified as a species of ecological importance, contributing to the growth and development of native species of animals. However, due to its economic importance, it constitutes a threatened species when obtaining firewood that is commercialized by the surrounding inhabitants. It is necessary to obtain propagation protocols that allow the mass production of seedlings for reforestation purposes, with in vitro propagation being a good alternative. In view of this, it was proposed to determine the effect of 6- benzylaminopurine and the MS culture medium (1962), in the in vitro establishment of P. pallida (Willd.) Kunth.The experimental work was developed in the Biotechnology Laboratory of the Andean Potato and Crops Institute. Where different concentrations of MS culture medium (1962) were prepared, supplemented with different concentrations of 6- benzylaminopurine. A randomized complete block design was applied. It is concluded that T4, consisting of 1/2 MS (1962) and 0.00 ppm BAP is the best in terms of length, while T7, consisting of 1/3 MS (1962) and 0.00 ppm BAP is the best in concerning the number of roots of P. pallida (Willd.) Kunth.
Keywords: In vitro establishment, Prosopis pallida, 6- Benzylaminopurine.
DOI: http://dx.doi.org/10.17268/rebiol.2019.39.02.03
1. INTRODUCCIÓN
Prosopis pallida (Willd.) Kunth “algarrobo” pertenece a la familia Fabaceae (Trópicos, 2019), es un árbol perennifolio de hasta 20 metros de altura y es el símbolo principal de los bosques secos del norte del Perú. Representa una gran importancia económica para la región puesto que su madera es empleada para la construcción y combustible, mientras que sus frutos son utilizados para la elaboración de algarrobina, harina de algarrobo, entre otros productos (Dostert et al., 2012; MINAM, 2011; Rivera, 2018). Por otro lado desempeña un rol importante en los ecosistemas, ya que por ser una leguminosa cuenta con el potencial de recuperar la fertilidad y productividad de los suelos (Aguilera, 2014; Rivera, 2018).
Los métodos de propagación de P. pallida (Willd.) Kunth, son sexual por semillas y asexual por esquejes. Las semillas necesitan un tratamiento pre-germinativo conocido como escarificación (Galera, 2000). Por otro lado la germinación es baja, lo que denota las limitaciones de este proceso para su propagación masiva (Zárate et al., 1997). Mientras que la propagación por esquejes es muy ineficiente, por las dificultades del desarrollo del sistema radicular. Siendo la técnica de micropropagación in vitro una interesante alternativa para la propagación asexual de la especie, por su alta tasa de multiplicación (Caravia, 2013).
La micropropagación in vitro garantiza la obtención de plantas de manera rápida, libre de patógenos y en numerosas cantidades, esto contribuye con la pronta recuperación de un ecosistema forestal (Farjon, 2013). Es importante resaltar que es importante el empleo de plantas madres en buen estado sanitario, para reducir la incidencia de microorganismos patógenos y así obtener una respuesta inmediata del explante. Los tejidos vegetales a cultivar deben proceder de plantas tiernas, para reducir la carga viral y lograr la homogeneidad necesaria en las plántulas in vitro (Cantillo et al., 2011; De Feria et al., 2008). Un medio de cultivo es la combinación de nutrientes y agua, que puede ser suplementado con algún regulador de crecimiento (Ponce, 2014). Los requerimientos nutritivos para un cultivo in vitro varían con el genotipo de la especie (Martínez et al., 2015; Rivera, 2018). El medio MS (1962), es comúnmente empleado en los cultivos de tejidos vegetales (Jaramillo, 2008). El medio MS es considerado rico en sales, pues contiene altas concentraciones de iones amonio, nitrato y cloro. Sin embargo, contiene bajas concentraciones de Ca, PO4, Mg+ y Cu++ Generalmente el cultivo in vitro de plantas leñosas, requiere medios con menor cantidad de sales minerales. Sin embargo, el medio MS (1962), podría ser efectivo a una mayor dilución (Cassells & Curry, 2001; Martínez et al., 2015; Lloyd & McCown, 1981; McCown, 1981).
Los medios de cultivo son suplementados con reguladores de crecimiento, como las auxinas y giberelinas. Las Citoquininas son empleadas para inducir el crecimiento de brotes en muchas especies de plantas, ya que se encargan de promover la división celular y promover la expansión celular (Zárate et al., 1997; Ascón & Talón, 2013; Boeri, 2015; Roca & Mroginski 1991). Siendo la 6- Bencilaminopurina (BAP), una citoquinina cuya composición química deriva de la adenina. Cuya función es promover el crecimiento, división y elongación de las células. Además de promover la germinación y de regular el crecimiento de las raíces e inhibir el proceso de envejecimiento de las hojas (Basail et al., 2015; Cotelo, 2016; Taiz & Ziegler, 2014). Ante la necesidad de mayor conocimiento en esta área, se propuso como objetivo determinar el efecto de la 6- Bencilaminopurina y del medio de cultivo MS (1962), en el establecimiento in vitro de P. pallida (Willd.) Kunth.
2. MATERIAL Y MÉTODOS
Colecta y registro de la especie
La planta P. pallida (Willd.) Kunth, provino del jardín botánico de la Universidad Nacional de Trujillo (UNT), en el distrito de Trujillo, provincia de Trujillo, departamento de la Libertad. Se seleccionaron los frutos (vainas) del algarrobo, las cuales fueron colocadas en bolsas previamente etiquetadas y trasportadas a Laboratorio de Biotecnología del Instituto de la Papa y Cultivos Andinos. Una rama florífera fue depositada en el Herbario Truxillense (HUT) con código 59728.
Selección de semillas y escarificación
De los frutos (vainas) seleccionados, se obtuvieron semillas. Se seleccionaron 800 semillas de P. pallida (Willd.) Kunth, las cuales se sumergieron en agua de caño, dejándolas por 24h. Pasado dicho periodo de tiempo se descartó las semillas hinchadas, quedándonos con las semillas con el epicarpio intacto. Se escarificó por el método mecánico, empleando una lija número 250, produciendo una ligera abrasión a nivel del epicarpio de la semilla. Las semillas escarificadas fueron colocadas en un recipiente con agua por 72 h, hasta observar la emergencia de la radícula.
Preparación del sustrato y siembra en sustrato
En un balde se preparó el sustrato que consistió en una mezcla de arena fina y humus de lombriz, en proporción 1:1. Posteriormente en cada celda del germinador se colocó el substrato, dejando un espacio de 1cm para colocar la semilla, sembrándose en total 500 semillas. A partir del tercer día, se registró la emergencia de las plántulas.
Preparación del medio de cultivo
Se preparó el medio de cultivo, empleando diferentes concentraciones de MS (1962) y de 6-Bencilaminopurina (Tabla1). Una vez preparado los medios de cultivo, estos fueron autoclavados a 120oC y a 1 atm de presión por 20 minutos. Se aplicó un diseño de bloque completo al azar con tres repeticiones, nueve tratamientos y ocho unidades muéstrales por tratamiento
Siembra de explantes
Se emplearon explantes de P. pallida (Willd.) Kunth, a los cinco días de germinación. Estos fueron colocados en un vaso de precipitación de 250 ml que contenía agua de caño para retirar los residuos de arena. Se preparó hipoclorito de sodio a una concentración de 2% y alcohol de 70°.Luego, se desinfesto la cámara de flujo laminar con hipoclorito de sodio, además de encender 2 mecheros. Los explantes fueron lavados con alcohol al 70° por 30 segundos, seguido de cinco enjuagados con agua destilada estéril. Luego fueron lavados con hipoclorito de sodio al 2% por dos minutos, seguido de 5 enjuagues con agua destilada estéril. Finalmente se procedió a sembrar los brotes en sus respectivos medios de cultivo. Para finalmente transportarlos al cuarto de incubación, con un fotoperiodo de 16-8 horas luz oscuridad, 18 oC de temperatura y humedad relativa de 85%.
Evaluación y análisis estadístico
Se observó la evolución de los explantes hasta la evaluación final, la cual se realizó a los 15 días, después del establecimiento in vitro. Con una pinza curva punta fina se extrajo la plántula de cada frasco y con la ayuda de una hoja milimetrada se midió la longitud de plántula y de raíz, además de contabilizarse el número de raíces. Para determinar la significancia estadística de los tratamientos, se empleó la prueba estadística del análisis de varianza (ANOVA) y la prueba de Tukey, además de determinar el error estándar y el coeficiente de correlación.
3. RESULTADOS
En el análisis de varianza de la longitud de las plántulas de P. pallida (Willd.) Kunth “algarrobo”, se evidenció diferencias estadísticamente significativas (Tabla 2). La Tabla 3, ilustra los resultados de la prueba de Tukey (α= 0.05), indicando la presencia de dos grupos homogéneos. El primer grupo está conformado por los tratamientos T8, T3, T9, T6, T7, T2 y T5, el segundo grupo lo conforma los tratamientos T7, T2, T5, T1, y T4.
Los intervalos de las medias del grupo uno es de 0.26 a 0.47 cm y del grupo dos es de 0.36 a 0.55 cm. La Figura 3, ilustra el gráfico de barras de la prueba de Tukey (α= 0.05), para la variable longitud de la plántula. El grupo homogéneo con mayor media para la longitud de plántula, estuvo conformado por lo tratamientos T7, T2, T5, T1 y T4, observándose que el tratamiento T4 es el que mayor media referente a la longitud de plántula.
Para el análisis de varianza del número de raíces de las plántulas de P. pallida (Willd.) Kunth “algarrobo”, se encontró diferencias estadísticamente significativas (Tabla 4). Indicándose la presencia de tres grupos homogéneos (Tabla 5), el primer grupo está conformado por los tratamientos T3, T2, T9, T6, T5 y T8, el segundo grupo lo conforma el tratamiento T1 y el tercer grupo está formado por los tratamientos T4 yT7. Las medias del grupo uno es de cero y del grupo dos es de 1.13 cm mientras que el grupo tres presenta un intervalo entre 2.29 a 2.46 cm. La Figura 4, ilustra el gráfico de barras de la prueba de Tukey (α= 0.05), para la variable número de raíces. El grupo homogéneo con mayor media para el numero de raíces estuvo conformado por los tratamientos T4 y T7, si bien es cierto que el tratamiento T7 no es estadísticamente diferentes dentro del grupo tres, pero presento una diferencia significativa con respecto del resto.
Para el análisis de varianza en la longitud de las raíces de las plántulas de P. pallida (Willd.) Kunth “algarrobo”, se encontró diferencias estadísticamente significativas (Tabla 6). Mientras que la Tabla 7, ilustra los resultados de la prueba de Tukey (α = 0.05), indicando la presencia de dos grupos homogéneos. El primer grupo está conformado por los tratamientos T5, T6, T8, T2, T3, y T9 y el segundo grupo lo conforma los tratamientos T1, T7 y T4. Los intervalos de las medias del grupo uno es igual a cero y del grupo dos es de 0.07 a 0.12 cm. Mientras que la Figura 5, ilustra el gráfico de barras de la prueba de Tukey (α= 0.05). El grupo homogéneo con mayor media para la longitud de raíz de las plántulas estuvo conformado por los tratamientos T1, T7 y T4. Si bien el tratamiento T7 no es estadísticamente diferentes entre el grupo dos, pero si presenta diferencia significativa con respecto a los tratamientos del grupo uno.
Tabla 1. Tratamientos resultantes de la combinación de las concentraciones del 6- Bencilaminopurina de 0.00; 0.25 y 0.50 ppm y del medio basal MS(1962) al 1, al 1/2 y al 1/3, realizado en el Laboratorio de Biotecnología del Instituto de la Papa y Cultivos Andinos-UNT.
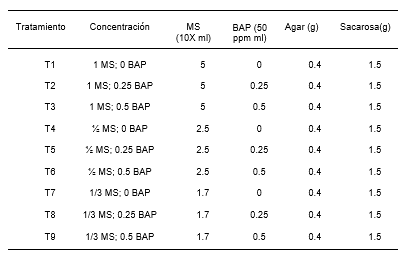
Tabla 2. Análisis de varianza para la longitud de plántula en el establecimento in vitro de Prosopis pallida (Willd.) Kunth.
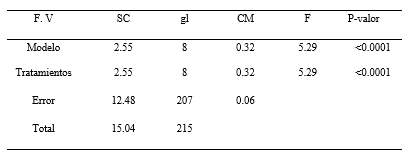
Tabla 3. Test de Tukey de la longitud de plántula en el establecimiento in vitro de Prosopis pallida (Willd.) Kunth.
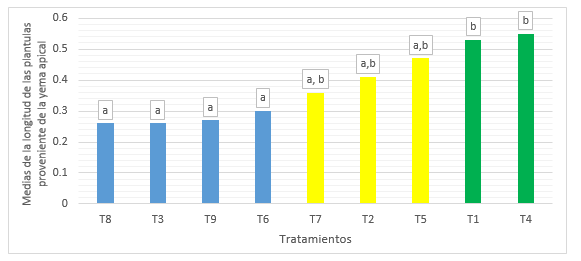
Figura 3. Grafica de barras para el test de Tukey de la variable longitud de plántula en el establecimiento in vitro de Prosopis pallida (Willd.) Kunth.
Tabla 4. Análisis de varianza del número de raíces en el establecimiento in vitro de Prosopis pallida (Willd.) Kunth.
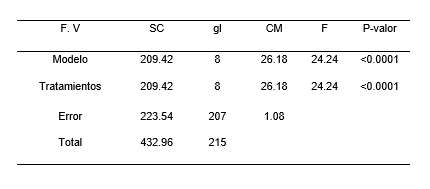
Tabla 5. Test de Tukey del número de raíces en el establecimiento in vitro de Prosopis pallida (Willd.) Kunth.
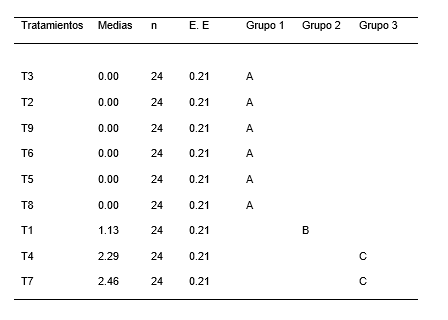
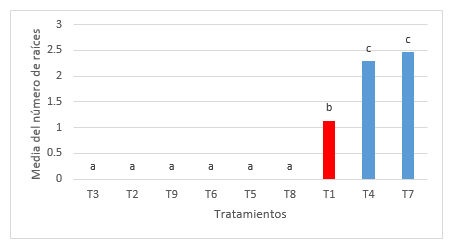
Figura 4. Grafica de barras para el test de Tukey de la variable número de raíces en el establecimiento in vitro de Prosopis pallida (Willd.) Kunth.
Tabla 6. Análisis de varianza de la longitud de la raíz en el establecimiento in vitro de Prosopis pallida (Willd.) Kunth.
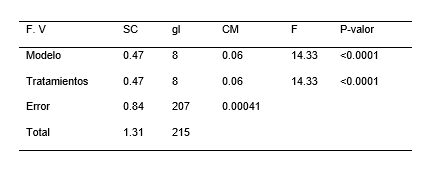
Tabla 7. Test de Tukey de la longitud de raíz en el establecimiento in vitro de Prosopis pallida (Willd.) Kunth.
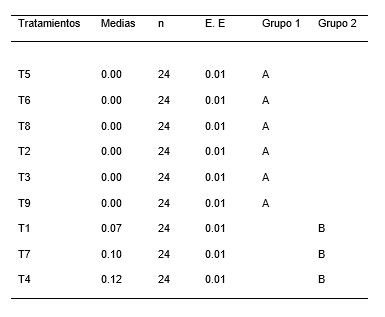
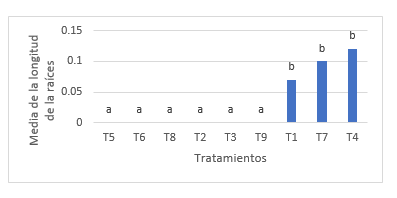
Figura 5. Grafica de barras para el test de Tukey de la variable longitud de raíz en el establecimiento in vitro de Prosopis pallida (Willd.) Kunth.


Figura 6. Evaluación del efecto de la 6- Bencilaminopurina y del médio de cultivo MS (1962) en el establecimiento in vitro de Prosopis pallida (Willd.) Kunth. A) Ilustración del diseño experimental y B). Plántula de Prosopis pallida (Willd.) Kunth. A los 15 días de siembra.
4. DISCUSIÓN
El análisis de varianza para la longitud de la plántula en el establecimiento in vitro de P. pallida (Willd.) Kunth, presenta diferencias significativas para las diferentes concentraciones del 6- Bencilaminopurina y del medio MS (1962), esto es indicador del notable efecto de la fitohormona y del medio de cultivo en la longitud de plántula, mientras que la prueba de Tukey identifico que T4 es el mejor, al obtenerse la mayor longitud de plántula. Estos resultados concuerdan con las investigaciones de Rivera (2018) y Caravia (2013), quienes sostienen que para la propagación in vitro de plantas leñosas y recalcitrantes como es el caso de Prosopis pallida (Willd.) Kunth, es mejor usar la mitad de las concentraciones del medio MS (1962), debido a que las altas concentraciones de iones amonio, nitrato, cloruro molibdato generan toxicidad en las plántulas de P. pallida (Willd.) Kunth (Martínez et al., 2015; Zegarra, 2014; Rivera, 2018). Por otro lado, Rivera (2018), sostiene que solo con MS (1962) es posible la propagación in vitro de P. pallida, debido a la presencia de auxinas en las yemas apicales.
En el análisis de varianza para el número de raíces de las plántulas en el establecimiento in vitro de P. pallida (Willd.) “algarrobo” (Tabla 4), presentó diferencias significativas. Sin embargo, la prueba de Tukey (α = 0.05), indicó que el tratamiento T7, es el mejor. Se obtuvo mayor número de raíces en los tratamientos T1, T4 y T7 (Tabla 5 y Figura 4), debido a que no se les adicionó la 6-bencilaminopurina, cuya función es promover la división celular, retardando el crecimiento de raíces. Por lo tanto, el uso de MS a 1, ½ y 1/3 resultan favorables para el número de raíces sin adicionar BAP (Caravia, 2013; Rivera, 2018)
Por otro lado, en el análisis de varianza longitud de la raíz P. pallida (Willd.) “algarrobo”, se obtuvo diferencias estadísticamente significativas (Tabla 6). La prueba de Tukey (α = 0.05), demostró que el tratamiento T4 es el mejor, comprobándose que en ausencia de la 6-bencilaminopurina hay incremento de la longitud de raíces, debido a que no se generan inhibidores en la diferenciación, formación y elongación de las raíces. Antecedentes han demostrado que el medio de cultivo MS (1962), al ½ y al ⅓ presentan resultados favorables para este factor, sin necesidad de añadir fitorreguladores. Sin embargo, diversas investigaciones han demostrado mejores resultados en la longitud de raíces, se obtienen empleando bajas concentraciones de la auxina IBA el cual es catalogado como el enraizante por excelencia (Botti, 1992; Caravia, 2013).
5. CONCLUSIONES
Se concluye que T4, constituido por 1/2 MS (1962) y 0.00 ppm BAP es el mejor en lo referente a longitud, mientras que T7, constituido por un 1/3 MS (1962) y 0.00 ppm BAP es el mejor en lo referente al número de raíces de P. pallida (Willd.) Kunth.
6. REFERENCIAS BIBLIOGRÁFICAS
1. Aguilera, R. (2014). Algarrobo tropical (Prosopis pallida) recurso biológico estratégico para la sostenibilidad del bosque tropical seco caso: comunas provincia de Santa Elena – Ecuador. DELOS, 20 (7), 1- 10.
2. Ascón, J & Talón, M. (2013). Fundamentos de Fisiología Vegetal. 2da edición. Barcelona, España: Editorial McGRAW-HILL. 669 p.
3. Basail, M., Medero, V., Robaina, A., Torres, Y., López, J., Santos, A., Rayas, A., Bauta, M., Rodríguez, D., Beovidez, Y. & Gutiérrez Y. (2015). Determinación del medio de cultivo para la propagación in vitro del clon de malanga Xanthosoma spp., ´México-8´ y su generalización en las biofábricas. III Simposio de Raíces y Tubérculos Tropicales, Plátanos, Bananos y Papaya.
4. Boeri, P. (2015). ¿Cómo se nutren las plantas de probeta? In Sharry, S., Adema, M., Abedini, W. Plantas de probeta: manual para la propagación de plantas por cultivo de tejidos in vitro. Buenos Aires: Ed. Facultad de Ciencias Agrarias y Forestales. 241p.
5. Botti, C. (1992). Seminario sobre la producción de plantas in vitro. Quito, EC. PROEXANT.
6. Cantillo, A., Igarza, R., & Castro J, Ochoa, A. (2011), Propagación in vitro de plantas de Pinus cubensis Griseb. Biotecnología vegetal, 11(1), 3 -13.
7. Caravia, E. (2013). Evaluación de medios de cultivo para la micropropagación de algarrobo tropical (Prosopis pallida) HBK Quito, Pichincha. Tesis pregrado. Universidad central del Ecuador. 91 pp.
8. Cassells, A. & Curry, R. (2001). Oxidative stress and physiological, epigenetic and genetic variability in plant tissue culture: implications for micropropagators and genetic engineers. Plant Cell Tissue and Organ Culture, 64, 145-157.
9. Cotelo, M. (2016). Propiedades de la bencilaminopurina para el control de Botrytis cinerea en judía: actividad fungicida e inducción de resistencia. Tesis pregrado. Universidade da Coruña. 24 pp.
10. De Feria, M., Chávez, M., Barbón, R., La O, M., Pérez , M., Jiménez, F., Quiala ,E & Agramonte, D. (2009). Multiplicación in vitro de plantas de Pinus caribaea var. caribaea. Biotecnología vegetal, 9(4): 217-224.
11. Dostert, N., Roque, J., Cano, A., La Torre, M., Weigend, M. (2012). Hoja botánica: Algarrobo. Proyecto Perú Diverso. Cooperación Alemana al Desarrollo. Lima, Perú: Ed. Giacomotti Comunicación Gráfica. 16 pp.
12. Farjon, A. (2003). The remaining diversity of conifers. Acta Horticulturae, 615(615), 75-89
13. Galera, F. (2000). Las especies del género Prosopis (Algarrobos) de America Latina con especie énfasis en aquellas de interés económico. Córdoba, Argentina: Ed. Talleres Gráficos de Graziani Gráfica. Disponible en: http://www.fao.org/3/ad314s/AD314S00.htm
14. Jaramillo Palacios, P. A. (2008). Establecimiento del cultivo in vitro de Polylepis microphylla como futura estrategia de conservación de la especie en la provincia de Chimborazo. Universidad de las Fuerzas Armadas Especiales. Tesis pregrado. 117 pp.
15. Lloyd, G. & McCown B. (1981).Commercially feasible micropropagation of mountain laurel, Kalmia latifolia, by the use of shoot tip culture. Proceedings of the International Plant Propagators Society, 30, 421-427.
16. Martínez, Y; Rodríguez, M; Colinas, M; Villegas, O; Castillo, A; Alia, I. (2015). Efectos de las sales |inorgánicas del medio de cultivo en el crecimiento de pascuita (Euphorbia leucocephala Lotsy). Revista Fitotecnia Mexicana, 38(4), 369-374.
17. McCown, BH (1981). Medio de plantas leñosas (WPM): una formulación de nutrientes minerales para microcultivos para especies de plantas leñosas. Horticultural Science, 16, 453
18. MINAM (2011). El Perú de los bosques. Lima. Programa Nacional de Conservación de Bosques para la Mitigación del cambio climático. Peru – Lima: Ed. Ministerio del Ambiente. 73pp.
19. Ponce, F. (2014). Evaluación del efecto de bencilaminopurina y ácido indolbutírico en la propagación in-vitro de segmentos nodales de Manikara bidentata (Quinilla Colorada). Tesis pregrado. Universidad Nacional de Ucayali. 55 pp.
20. Rivera, J. C. (2018). Micropropagación de Prosopis pallida (Humb. & Bompl. Ex Wild.) Kunth a partir de yemas apicales. Tesis pregrado. Universidad Nacional Agraria La Molina. 131 pp.
21. Roca, W., Mroginski, L. (1991). Cultivo de tejidos en la agricultura, fundamentos y aplicaciones. Cali, Colombia: Ed. CIAT. 970 pp.
22. Taiz, L. & Ziegler, E. (2014). Plant physiology and development, 6th edition. USA: Ed. Sinauer Associates. 761 pp.
23. Trópicos. (2019). Prosopis pallida (Humb. & Bonpl. Ex Willd.) Kunth. Missouri Botanical Garden. Disponible en: http://www.tropicos.org/Name/13032112 [Acceso 8 Mayo 2019].
24. Zárate, R., Cantos, M., & Troncoso, A. (1997). Efecto de diferentes reguladores de crecimiento en la inducción de brotes múltiples y enraizamiento de Atropa baetica. Sevilla- España: Ed. Junta de Andalucía. 471 pp.
25. Zegarra, K. (2014). Establecimiento in vitro de yemas y efecto de reguladores de crecimiento ANA y BAP en la Micropropagación de Polylepis rugulosa (Queñua) de Zonas Altoandinas de Arequipa. Tesis pregrado. Universidad Católica de Santa María. 116p.