¿Cuándo apareció el sistema nervioso? Enfoque evolutivo en metazoos no vertebrados
When did the nervous system emerge? Evolutionary focus on non-vertebrate metazoans
Anthony Leon 1
1 SARS International Centre for Marine Molecular Biology.
Thormøhlens Gate 55, 5008 Bergen. Noruega.
Autor para correspondencia: Anthony.Leon@uib.no
Recibido: 1 de mayo, 2019 Aceptado: 19 de junio, 2019
RESUMEN
El inicio de la era genómica y la invención de técnicas moleculares vanguardistas han revolucionado la genética en el transcurso de las últimas décadas. Estos avances científicos han permitido revelar mecanismos desconocidos que controlan la diferenciación celular y el desarrollo de estructuras novedosas y originales en diversos organismos a lo largo de su historia evolutiva. Una de dichas estructuras es el sistema nervioso, el cual está presente en todos los animales excepto en esponjas y placozoos. La aparición de esta estructura significó un gran salto evolutivo dentro del filo Metazoo, y su amplia diversificación en cada grupo animal ha sido materia de debate en los últimos años. En este artículo, se discuten los posibles orígenes del sistema nervioso.
Palabras clave: Bilaterales, células neurales, ctenóforos, metazoos, sistema nervioso.
ABSTRACT
The beginning of the new genomic era and the emergence of cutting-edge molecular tools have revolutionized genetics over the past decades. These scientific breakthroughs have allowed to eveal unknown developmental mechanisms in cell differentiation and the emergence of novel structures in several organisms throughout their evolutionary history. One of such structures is the nervous system, which is present in all animals excepting sponges and placozoans. The emergence of this structure meant a great evolutionary leap inside the Metazoan phylum, and its wide diversification in each animal clade has been a subject of debate during the last years. In this article, the putative origins of the nervous system are discussed.
Keywords: Bilaterians, ctenophores, metazoans, nervous system, neural cells.
1. EL ÚLTIMO ANCESTRO COMÚN DE LOS ANIMALES
La expansión de datos genómicos en diversos grupos animales ha permitido construir topologías filogenéticas robustas que apoyan la hipótesis de un origen común de todas las especies animales modernas a partir de un último ancestro común (LCA - “last common ancestor”). De hecho, se cree que los primeros animales han evolucionado hace al menos 600 millones de años y que el LCA de los animales fue multicelular. Dicho estado de multicelularidad podría haber aparecido como una simple organización clonal a partir de organismos unicelulares. Sin embargo, estos primeros organismos con complejidad multicelular tuvieron que haber pasado por drásticos cambios en su composición genética para dar lugar a la aparición de tipos celulares específicos que les facilitaran adaptarse al medio ambiente (Brunet & King, 2017).
Algunos de estos cambios condujeron al surgimiento de células sensoriales en organismos primitivos que permitieron la exploración y conquista de sus respectivos hábitats. En este contexto, no se puede negar que no solo la adquisición de dichas células sensoriales, sino también la formación de sistemas sensoriales complejos constituye un logro clave en la historia evolutiva de los animales (Wray Gregory A., 2015). Sin embargo, eso nos trae algunas preguntas: ¿Cuándo aparecieron las primeras células y circuitos sensoriales? y ¿Cómo se organizaron dichos circuitos en la mayoría de eu-metazoos?
Para responder esto, diversos estudios han ayudado a comprender la historia evolutiva del sistema nervioso a partir de células sensoriales/neurales. De hecho, podemos seguirle la pista al origen de las primeras células neurales hasta antes de la separación entre cnidarios y bilaterales, e incluso postular que el repertorio genético necesario para la formación y desarrollo de dichas células podrían haber estado presente en organismos anteriores a estos filos (Wray Gregory A., 2015). A pesar de esto, se sabe aún muy poco sobre la aparición y evolución de las primeras células neurales en animales no-bilaterales.
2. APARICIÓN DE LAS PRIMERAS CÉLULAS SENSORIALES
La adquisición de células neurales es un evento crucial en la evolución de los metazoos, y posiblemente tuvo su origen con la aparición y divergencia de las primeras células sensoriales que permitieron a los animales encontrar comida, reproducirse o evadir hábitats poco convenientes.
Se conoce que las células animales sensoriales más simples se encuentran en las larvas de los poríferos (esponjas), las cuales no solo son sensibles a la luz, sino también a otros estímulos. Las esponjas constituyen un grupo animal primitivo, si se les compara con los eu-metazoos, ya que no poseen sistema nervioso. Sin embargo, ellas cuentan con otros sistemas sensoriales como es el caso de la demosponja Amphimedon queenslandica, cuya larva presenta un tipo específico de célula epitelial (célula matraz) que es capaz de convertir los estímulos externos en señales internas que inducen el asentamiento y metamorfosis durante su desarrollo (Nakanishi et al., 2015). Aparte de esto, estas células también exhiben expresión de marcadores pro-neurales como AmqbHLH y miembros de la vía de señalización Delta-Notch. Dichas características se asemejan a lo que se observa en neuronas sensoriales presentes en larvas de cnidarios y bilaterales (Nakanishi et al., 2015; Richards et al., 2008; Liebeskind et al., 2016), y sugieren un origen común entre las células sensoriales de los poríferos y las células neurales de los eu-metazoos.
A diferencia de los poríferos, los cnidarios han sido históricamente considerados como los metazoos más tempranos en haber desarrollado un sistema nervioso. Ellos poseen un sistema nervioso difuso que consiste en redes nerviosas extendidas principalmente en el epitelio. Sin embargo, algunos de ellos como las medusas han desarrollado sistemas sensoriales que muestran regionalización neural. Algunos autores han propuesto que los aros neurales presentes en estas medusas constituyen un tipo de sistema nervioso central. Dicha observación sugiere que la aparición de un sistema nervioso central rudimentario pudo incluso suceder antes de la separación con los bilaterales (Garm et al., 2007). Adicionalmente, el repertorio genético que controla la formación del sistema nervioso tanto en cnidarios como en bilaterales es sumamente conservado, sugiriendo que dicho repertorio ya estaba presente en el ancestro común de cnidarios y bilaterales (Watanabe et al., 2009).
3. POSICIÓN FILOGENÉTICA DE LOS CTENÓFOROS
Así como los cnidarios, los ctenóforos también poseen una red epitelial de nervios. Debido a la similitud morfológica entre ambos grupos, fueron clásicamente ubicados dentro de un mismo filo llamado Celenterada por más de un siglo. Sin embargo, estos grupos son muy diferentes a nivel genómico y, hoy en día, la posición filogenética de los ctenóforos aún se encuentra en debate. De hecho, las publicaciones antiguas optaban por localizarlos junto a los cnidarios y bilaterales en un solo grupo, mientras que las más recientes sugieren que los ctenóforos constituyen el grupo animal más antiguo (incluso precedente a los poríferos) y, en consecuencia, hermano de todo el resto de los metazoos. Dicha revelación expone dos posibilidades: el sistema nervioso existía en el último ancestro común de los animales y se perdió en los poríferos y placozoos; o los ctenóforos junto al ancestro de cnidarios y bilaterales adquirieron sistemas nerviosos de manera independiente (Figura 1- estrella azul y verde respectivamente) (Liebeskind et al., 2016; Ryan, 2014; Moroz, 2015).
La posibilidad que los ctenóforos hayan desarrollado un sistema nervioso de manera convergente a los bilaterales y cnidarios constituye un escenario evolutivo no parsimonioso. De hecho, al comparar los genomas de especies representativas de los filos porífera y placozoo (que no poseen sistemas nerviosos) junto a los ctenóforos, se puede concluir que la mayoría de los componentes moleculares del sistema nervioso están conservados en todos estos animales (tales como canales iónicos dependientes de voltaje y proteínas especializadas SNARE, que median la función vesicular sináptica). Incluso Trichoplax adhaerens, el único miembro del filo placozoo presenta genes que codifican neurotransmisores y proteínas sinápticas. En conclusión, estos datos sugieren que el sistema nervioso apareció una vez, y luego se simplifico anatómicamente en los poríferos y placozoos (Jorgensen, 2014).
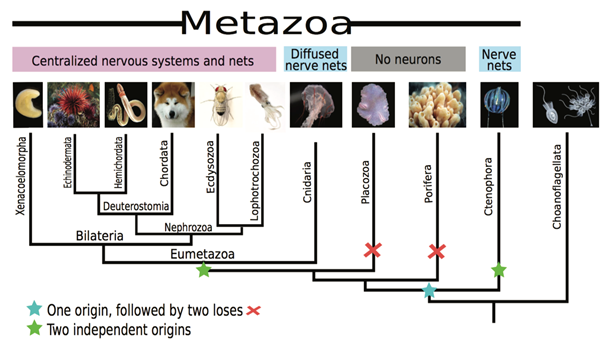
Figura 1. Origen del sistema nervioso. Representación filogenética simplificada del filo Metazoo. Las estrellas muestran las dos hipótesis sobre el origen del sistema nervioso considerando a los Ctenóforos como grupo animal más antiguo. (Modificado a partir de Liebeskind et al, 2016; y Moroz, 2015)
El debate sobre el origen del sistema nervioso continuara, considerando que nuevos proyectos de secuenciamiento incrementaran la cantidad de datos genómicos en especies de diversos filos a fin de obtener una mejor comprensión sobre la aparición de esta estructura en los animales.
4. CENTRALIZACIÓN DEL SISTEMA NERVIOSO
A diferencia del difuso escenario evolutivo en metazoos tempranos (cnidarios y ctenóforos), es ampliamente aceptado que el ancestro común de los bilaterales ya presentaba un sistema nervioso. De hecho, se cree que dicho sistema estaba condensado (centralizado o central) en una cuerda media ventral, la cual seria una característica ancestral de todos los bilaterales. En este contexto, Alain Ghysen señaló que “el sistema nervioso central estaría compuesto por una combinación de circuitos elementales verificados, muchos de los cuales ya habrían estado desarrollados en nuestros ancestros urbilaterales” (Ghysen, 2003). Sin embargo, nuevos estudios sugieren que la organización de un sistema nervioso centralizado ha evolucionado múltiples veces dentro de los bilaterales, y no solo una vez. Se ha revelado que algunos grupos, como los xenacoelomorfos y espiralados, no comparten la misma base genética que orquesta el desarrollo del sistema nervioso central (a diferencia de la mayoría de bilaterales). Por tal motivo, es posible que las similitudes morfológicas en el desarrollo de todos los sistemas nerviosos centralizados podría ser el resultado de varios eventos evolutivos convergentes (Martín-Durán et al., 2018; Albertin & Ragsdale, 2018).
Incluso si este evento pudo haber sucedido independientemente en varios grupos animales, no se puede negar que la adquisición de un sistema nervioso central involucro la formación de regiones neuroanatómicas dependientes de mecanismos genéticos conservados a lo largo de la evolución de los animales bilaterales. Por ejemplo, el plan organizacional de los cordados está establecido por un modelado anteroposterior/dorsoventral, y caracterizado por la expresión de marcadores genéticos conservados (Albuixech-Crespo et al., 2017). No obstante, grupos cercanos a los cordados, como los equinodermos y hemicordados, muestran profundas diferencias en comparación a los primeros, haciendo difícil predecir la estructura del sistema nervioso del ancestro común de los deuterostomados (Holland, 2015).
De hecho, el sistema nervioso en equinodermos adultos es distante morfológicamente al de los cordados ya que las neuronas se encuentran dispersas formando una red organizada en nódulos e interconectada a nudos adyacentes y nervios radiales. Además, estas cuerdas nerviosas no expresan genes Hox durante su desarrollo, lo que se asume ser una característica compartida dentro del filo Cordata (Arenas-Mena et al., 2000; Burke et al., 2006). Por otro lado, en los hemicordados -a pesar de compartir afinidades morfológicas con los cordados- no existe evidencia robusta que confirme si una de sus cuerdas neurales (sea la dorsal o ventral) es homologa a la cuerda neural dorsal de los cordados, o si ambas evolucionaron independientemente (Lowe et al., 2003; Holland et al., 2013). Toda esta información contribuye a complicar el paisaje evolutivo del origen del sistema nervioso central en los bilaterales.
A lo largo de la evolución, los animales se han diversificado a partir de ancestros comunes. Sin embargo, gran parte del repertorio genético dedicado a la formación de células neurales es esencialmente el mismo en la mayoría de dichas especies. Gracias a nuevas tecnologías, se ha logrado acceder a información genómica en modelos no-convencionales y complementar lo conocido previamente en vertebrados. Estos estudios comparativos no solo han permitido identificar los principales actores que impulsan la identidad neural en células animales, sino también ha profundizado nuestro conocimiento sobre el origen del sistema nervioso y su desarrollo en cada grupo animal moderno.
5. CONCLUSIÓN
La aparición y evolución del sistema nervioso constituye una gran incógnita dentro de la biología evolutiva del desarrollo y, a pesar del incremento de avances científicos en las últimas décadas, aun esconde misterios por resolver. Consensualmente se postulaba que los primeros metazoos solo poseían células sensoriales que les permitían sobrevivir a su hábitat, sin embargo, la relocalización de los ctenóforos en la base del filo Metazoo sugiere que el ancestro de todos los animales ya poseía un sistema nervioso. Esta nueva construcción filogenética también apoya la simplificación morfológica de los grupos Porífera y Placozoo, así como la subsecuente pérdida del sistema nervioso en ambos grupos.
6. REFERENCIAS BIBLIOGRÁFICAS
1. Albertin, C. B., & Ragsdale, C. W. (2018). More than one way to a central nervous system. Nature, 553(7686), 34. Retrieved July 5, 2019, from http://www.nature.com/articles/d41586-017-08195-4
2. Albuixech-Crespo, B., López-Blanch, L., Burguera, D., Maeso, I., Sánchez-Arrones, L., Moreno-Bravo, J. A., Somorjai, I., et al. (2017). Molecular regionalization of the developing amphioxus neural tube challenges major partitions of the vertebrate brain. PLOS Biology, 15(4), e2001573. Retrieved July 5, 2019, from https://journals.plos.org/plosbiology/article?id=10.1371/journal.pbio.2001573
3. Arenas-Mena, C., Cameron, A. R., & Davidson, E. H. (2000). Spatial expression of Hox cluster genes in the ontogeny of a sea urchin. Development, 127(21), 4631–4643. Retrieved July 5, 2019, from https://dev.biologists.org/content/127/21/4631
4. Brunet, T., & King, N. (2017). The Origin of Animal Multicellularity and Cell Differentiation. Developmental Cell, 43(2), 124–140. https://doi.org/10.1016/j.devcel.2017.09.016.
5. Burke, R. D., Angerer, L. M., Elphick, M. R., Humphrey, G. W., Yaguchi, S., Kiyama, T., Liang, S., et al. (2006). A genomic view of the sea urchin nervous system. Developmental Biology, 300(1), 434–460. https://doi.org/10.1016/j.ydbio.2006.08.007.
6. Garm, A., Poussart, Y., Parkefelt, L., Ekström, P., & Nilsson, D.-E. (2007). The ring nerve of the box jellyfish Tripedalia cystophora. Cell and Tissue Research, 329(1), 147–157. https://doi.org/10.1007/s00441-007-0393-7.
7. Ghysen, A. (2003). The origin and evolution of the nervous system. The International Journal of Developmental Biology, 47(7–8), 555–562. https://doi.org/10.1387/ijdb.14756331.
8. Holland, L. Z. (2015). The origin and evolution of chordate nervous systems. Philosophical Transactions of the Royal Society B: Biological Sciences, 370(1684). Retrieved July 5, 2019, from https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4650125/
9. Holland, L. Z., Carvalho, J. E., Escriva, H., Laudet, V., Schubert, M., Shimeld, S. M., & Yu, J.-K. (2013). Evolution of bilaterian central nervous systems: A single origin? EvoDevo, 4(1), 27. Retrieved July 5, 2019, from https://doi.org/10.1186/2041-9139-4-27
10. Jorgensen, E. M. (2014). Animal Evolution: Looking for the First Nervous System. Current Biology, 24(14), R655–R658. Retrieved July 5, 2019, from http://www.sciencedirect.com/science/article/pii/S0960982214007520
11. Liebeskind, B. J., Hillis, D. M., Zakon, H. H., & Hofmann, H. A. (2016). Complex Homology and the Evolution of Nervous Systems. Trends in ecology & evolution, 31(2), 127–135. Retrieved July 5, 2019, from https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4765321/
12. Lowe, C. J., Wu, M., Salic, A., Evans, L., Lander, E., Stange-Thomann, N., Gruber, C. E., et al. (2003). Anteroposterior patterning in hemichordates and the origins of the chordate nervous system. Cell, 113(7), 853–865. https://doi.org/10.1016/S0092-8674(03)00469-0.
13. Martín-Durán, J. M., Pang, K., Børve, A., Lê, H. S., Furu, A., Cannon, J. T., Jondelius, U., et al. (2018). Convergent evolution of bilaterian nerve cords. Nature, 553(7686), 45–50. Retrieved July 5, 2019, from https://www.nature.com/articles/nature25030
14. Moroz, L. L. (2015). Convergent evolution of neural systems in ctenophores. Journal of Experimental Biology, 218(4), 598–611. Retrieved July 5, 2019, from https://jeb.biologists.org/content/218/4/598
15. Nakanishi, N., Stoupin, D., Degnan, S. M., & Degnan, B. M. (2015). Sensory Flask Cells in Sponge Larvae Regulate Metamorphosis via Calcium Signaling. Integrative and Comparative Biology, 55(6), 1018–1027. https://doi.org/10.1093/icb/icv014.
16. Richards, G. S., Simionato, E., Perron, M., Adamska, M., Vervoort, M., & Degnan, B. M. (2008). Sponge genes provide new insight into the evolutionary origin of the neurogenic circuit. Current biology: CB, 18(15), 1156–1161. https://doi.org/10.1016/j.cub.2008.06.074.
17. Ryan, J. F. (2014). Did the ctenophore nervous system evolve independently? Zoology, 117(4), 225–226. Retrieved July 5, 2019, from http://www.sciencedirect.com/science/article/pii/S0944200614000555
18. Watanabe, H., Fujisawa, T., & Holstein, T. W. (2009). Cnidarians and the evolutionary origin of the nervous system. Development, Growth & Differentiation, 51(3), 167–183. https://doi.org/10.1111/j.1440-169X.2009.01103.x.
19. Wray Gregory A. (2015). Molecular clocks and the early evolution of metazoan nervous systems. Philosophical Transactions of the Royal Society B: Biological Sciences, 370(1684), 20150046. Retrieved July 5, 2019, from https://royalsocietypublishing.org/doi/full/10.1098/rstb.2015.0046