Efecto del ácido giberélico y del ácido indolacético en la micropropagación in vitro de Solanum tuberosum var. Maria Reiche
Effect of gibberellic acid and indoleacetic acid on the in-vitro micropropagation of Solanum tuberosum var. Maria Reiche
*Eloy Lopéz- Medina 1; José Mostacero- León 1; Armando Efraín Gil- Rivero 1; Angélica Lopéz -Zavaleta 1; Anthony J. De La Cruz-Castillo 1
1 Laboratorio de Biotecnología del Instituto de Papa y Cultivos Andinos, Universidad Nacional de Trujillo. Av. Juan Pablo II S/N; Ciudad Universitaria, Trujillo – Peru.
*Autor para correspondencia: slopezm@unitru.edu.pe
Recibido: 4 de Abril, 2019. Aceptado: 4 de Julio, 2019.
RESUMEN
La papa es un cultivo de origen andino de importancia nutricional y económica para los agricultores. La existencia de más de 5000 variedades ha catalogado al Perú como el centro de origen y de diversidad de la papa, tal es así que existen variedades específicas para un determinado uso culinario. Siendo Maria Reiche, una variedad óptima para el procesamiento que cuenta con un enorme potencial para las condiciones de costa. La biotecnología vegetal constituye una herramienta esencial para optimizar la producción apartir de un germoplasma in vitro libre de patógenos; ante la necesidad de conocer el efecto de diferentes fitorreguladores, se propuso determinar el efecto del ácido giberélico y del ácido indolacético en la micropropagación in vitro de Solanum tuberosum var. Maria Reiche. La investigación se desarrolló en el Laboratorio de Biotecnología del Instituto de la Papa y Cultivos Andinos, donde se micropropagó entrenudos a partir de plantas madre de la variedad Maria Reiche. Para ver el efecto del ácido indolacético y ácido giberélico, se preparó medio de cultivo MS (1962) suplementado con diferentes concentraciones de estos fitorreguladores. Pasados 20 días se evaluó la altura de plántula, número de entrenudos y número de raíces. Al ser analizados estadísticamente no se encontró diferencias significativas, se concluye que S. tuberosum var. Maria Reiche, puede propagarse in vitro sin la necesidad de fitorreguladores.
Palabras claves: Ácido giberélico, ácido indolacético, micropropagación, Solanum tuberosum.
ABSTRACT
Potato is an Andean crop of nutritional and economic importance for farmers. The existence of more than 5000 varieties has cataloged Peru as the center of origin and diversity of the potato. So that there are specific varieties for a specific culinary use. Maria Reiche for example is an optimum variety for processing that has enormous potential for coastal conditions. Plant biotechnology is an essential tool to optimize the production of pathogen free in vitro germplasm; In view of the need to know the effect of different phytoregulators, it was proposed how to determine the effect of gibberellic acid and indoleacetic acid on the in vitro micropropagation of Solanum tuberosum var. Maria Reiche The research was developed in the Biotechnology Laboratory of the Institute of the Potato and Andean Crops, where internodes from mother plants of the Maria Reiche variety were micropropagated. To see the effect of indoleacetic acid and gibberellic acid, MS culture medium (1962) supplemented with different concentrations of these phytoregulators was prepared. After 20 days the plantlet height, number of internodes and roots were evaluated. When analyzed statistically, no significant differences were found, so that it can be concluded that S. tuberosum var. Maria Reiche, can spread in vitro without the need for phytoregulators.
Keywords: Gibberellic acid; indoleacetic acid; micropropagation; Solanum tuberosum.
1. INTRODUCCIÓN
El Perú, con 28 de los 32 climas que tiene el mundo, es un escenario en el cual se ha dado un largo proceso de domesticación de especies vegetales y su evolución a través del tiempo, las condiciones en las cuales han ocurrido estos procesos han conllevado a que muchas de estas especies exhiban una alta plasticidad genética. Consecuencia de ello es una alta diversidad genética, distribuida en los diferentes pisos ecológicos. Siendo la papa un cultivo que cuenta con especies silvestres, nativas y mejoradas. Las más de 5000 variedades cultivadas por el poblador andino, constituyen ser la base de su seguridad alimentaria. Debido a que las denominadas “variedades nativas”, han sido catalogadas como alimentos nutracéuticos por la presencia de antioxidantes. Constituyendo ser un acervo genético invaluable, dada la necesidad de mejoramiento de la producción, productividad, calidad, resistencia a plagas y enfermedades, propiedades culinarias y potencial de adaptación al cambio climático (CIP & FEDECH, 2006; Mendoza & Mosquera, 2011; Diez et al., 2013; Gil et al 2019).
En nuestro país, el cultivo de la papa abarca 19 departamentos, con una producción de 260,000 ha/año; cuyo consumo per cápita fue de 89 Kg en el 2017, proyectándose para el 2021 llegar a los 100 kg. (Ministerio de Agricultura, 2011; Agraria, 2019). De las 70 variedades modernas liberadas por Ministerio de agricultura e INIA, tanto para consumo en fresco como para procesamiento, las variedades para consumo fresco han tenido mayor difusión y por tanto mayor uso, siendo las variedades para procesamiento relativamente desconocidas, tal es el caso de las variedades Costanera, Desértica, Tacna, primavera, Reiche, entre otras. La variedad Reiche, está adaptada a condiciones de costa, tuberiza a temperaturas altas, su periodo vegetativo es de 90 días, su producción es de 30 toneladas por hectárea, soporta salinidad, es inmune a los virus PVX y PVY, presenta alto contenido de materia seca, bajo contenido de azúcares reductores, lo cual facilita las labores culinarias al consumir una baja cantidad de aceite en la fritura y al no quemarse (Vásquez, 2003).
Una buena producción de papa, tanto en cantidad como en calidad, está en función de los tubérculos-semillas utilizados. Los cuales deben poseer buenas condiciones genéticas, físicas, fisiológicas y sanitarias. El sistema Biotecnológico, en sus fases de laboratorio, invernadero y campo, garantizan que los tubérculos semillas producidos tengan las características deseadas. A nivel de laboratorio, la micropropagación de un buen material es indispensable, entendiéndose por micropropagación, como el conjunto de técnicas que buscan producir masivamente plántulas in vitro bajo condiciones asépticas y con el manejo de los factores ambientales. El medio de cultivo Murashige y Skooog (1962), es el medio en el cual responden la mayoría de especies cultivadas in vitro. Haciéndose uso de fitohormonas y/o reguladores de crecimiento, los cuales estimulan, inhiben, retardan o regulan cualquier proceso fisiológico en las plantas; clasificándose en auxinas, giberelinas, citocininas, ácido abscisico y etileno (Kessel, 2008; Ábdelnour & Vincent, 1994; Beltrán & Roca, 1984).
El ácido indolacético (AIA), es una auxina que promueve el alargamiento celular al actuar sobre las paredes celulares, al mismo tiempo estimula la división celular a concentraciones muy bajas. Mientras que el ácido giberélico (AG3), es una giberelina que está relacionado con el alargamiento de los entrenudos y el crecimiento de plantas. Siendo importante considerar que la actividad de las fitohormonas puede acelerarse (sinergismo) o retardarse (antagonismo) al ser añadida independiente o complementaria con otras fitohormonas (Salisbury & Ross, 1984; Ortega, 2000; Rojas et al., 2004; Su et al., 2011; Curtis et al., 2008; Campbell et. al, 2001).
Ante la necesidad de obtener masivamente plántulas in vitro, el presente trabajo de investigación tuvo como objetivo de investigación determinar el efecto del ácido giberélico y del ácido indolacético en la propagación in vitro por nudos de Solanum tuberosum var Reiche.
2. MATERIAL Y MÉTODOS
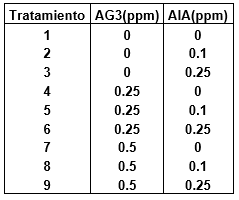
El material biológico estuvo constituido por plántulas in vitro de S. tuberosum L. Var. Reiche, procedente del banco de germoplasma del Laboratorio de Biotecnología del Instituto de la Papa y Cultivos Andinos (IPACA), de la Universidad Nacional de Trujillo. Se utilizó el medio basal de MS (1962), suplementado con sacarosa al 3%, agar 0.8% y diferentes concentraciones de reguladores de crecimiento (Tabla 1). Los medios fueron preparados de acuerdo a los tratamientos en tubos de ensayo. Una vez tapados con papel platino, se llevados a esterilizar en autoclave a 120oC y a 1 atm de presión por 20 minutos. La siembra se realizó en la cámara aséptica, previa esterilización del ambiente, utensilios y materiales adjuntos. Luego se procedió a sembrar los nudos en sus respectivos medios de cultivo. Para finalmente transportarlos al cuarto de incubación, con un fotoperiodo de 16-8 horas luz oscuridad, 18 oC de temperatura y humedad relativa de 85%.
Se empleó un diseño completamente aleatorizado, con 9 tratamientos y 7 repeticiones por tratamiento. La evaluación se realizó a los 20 días, tomando como parámetros la altura de plantas, número de nudos y número de raíces. Los datos obtenidos fueron sometidos al análisis de varianza.
3. RESULTADOS
Tabla 1. Medio de cultivo MS 1962 suplementado con diferentes concentraciones de fitohormonas para evaluar el efecto del ácido giberélico y del ácido indolacético en la micropropagación in vitro de Solanum tuberosum var. Maria Reiche, durante 20 días.
La tabla 2, resume los resultados promedios de los parámetros altura de plántula, número de nudos y numero de raíces en la micropropagación por nudos de S. tuberosum L. var. Maria Reiche, empleando diferentes concentraciones de ácido giberélico y del ácido indolacético. Pudiéndose resaltar que el tratamiento 7 destaca por presentar mayor resultados en los parámetros evaluados. Por otro lado la Figura 1, ilustra las plántulas in vitro a los 20 días de evaluación. Mientras que la Figura 2, ilustra diferentes gráficos de cajas, observándose cierta variabilidad en lo resultados promedios evaluados de S. tuberosum var. Maria Reiche.
Tabla 2. Promedio de los tratamientos de las combinaciones del ácido giberélico y del ácido indolacético en los parámetros: Altura de plántula, número de nudos y numero de raíces en la micropropagación por nudos de Solanum tuberosum L. var. Maria Reiche.
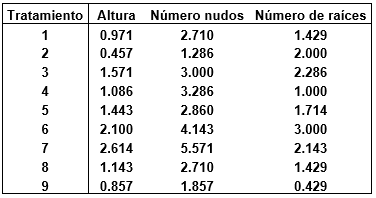
Figura 1. Plántulas in vitro a los 20 días, obtenidas en tratamientos resultantes de las combinaciones del ácido giberélico y del ácido indolacético en la micropropagación por nudos de Solanum tuberosum L. var. Maria Reiche.
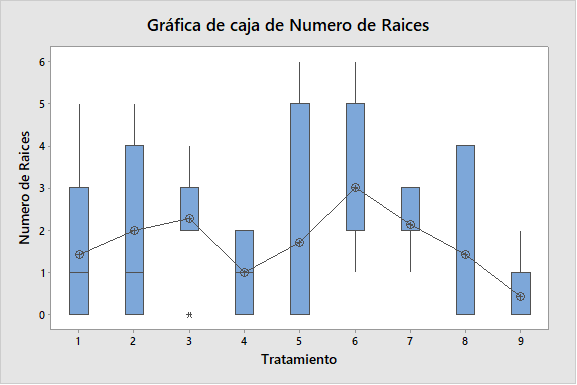
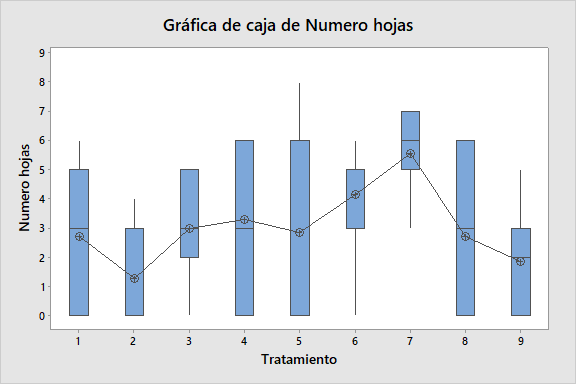
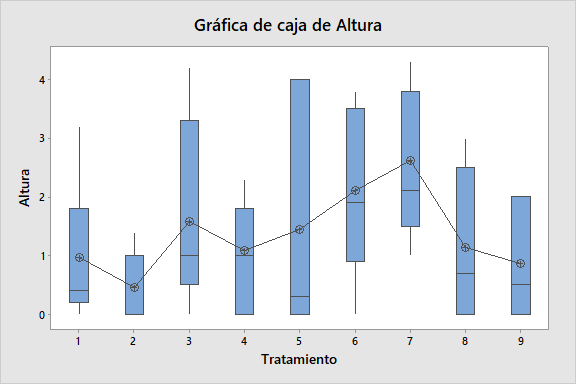
Figura 2. Gráfico de cajas, para demostrar el efecto del ácido giberélico y del ácido indolacético para altura de plántula, número de nudos y número de raíces en la micropropagación por nudos de Solanum tuberosum var. Maria Reiche.
4. DISCUSIÓN
La micropropagación es una técnica de propagación clonal, para la generación de una descendencia uniforme, con plantas genéticamente idénticas (Castillo, 2004).Respecto al parámetro altura de plántula de S. tuberosum L. var María Reiche (Tabla 2), el tramiento 7, constituido por 0.5 ppm de AG3 manifestó una mayor altura promedio. Al hacer una comparación de medias con el método LSD de Fisher (Figura 2), se llegó a la conclusión de que al menos un par de medias son distintas para el factor altura de plántula. Sin embargo todos los tratamientos al ser analizados estadísticamente, según el análisis de varianza no se encontraron diferencias significativas, debido a que el valor-P, fue mayor que 0,05; con un nivel confianza del 95,0%. De ello se infiere que a las concentraciones empleadas, el efecto del ácido indolacético como promotor del crecimiento celular y del ácido giberélico como promotor del crecimiento de plántulas intactas y alargamiento de entrenudos son relativamente muy débiles (Figura 1 y 2), debido probablemente al fenómeno de habituación o a la intromisión de fitohormonas, sintetizados de manera natural por las plántulas in vitro de S. tuberosum L. var María Reiche (Salisbury & Ross, 1984; Lopéz et al., 2017). Investigaciones de Araque et al., 2018, corroboran los resultados obtenidos al concluir que para la micropropagación de S. tuberosum L., el empleo de medio de cultivo MS + 0,02 mg L-1 de ANA y MS sin reguladores es adecuado en la producción de brotes de apariencia uniforme, vigorosos, de mayor grosor y longitud promedio, debido a que el cultivo in vitro de S. tuberosum L., no es exigente de fitohormonas y fitorreguladores. De la misma manera Lopéz, 2012, afirma que para la micropropagación in vitro de variedades nativas de S. tuberosum L., basta el medio de cultivo MS (1962), suplementado con ácido giberélico a la concentración de 0,25 ppm (Lopéz, 2012).Por otro lado García et al., 2015, afirma que para la micropropagación de S. tuberosum L. basta medio de cultivo MS (1962), suplementado con 100 mg l-1 de mio-inositol. Además de demostrar la existencia de diferentes repuestas de los explantes, en relación al factor altura dependiendo del genotipo de la variedad. Sin embargo Tacoronte et al., 2017, afirma que al aumentar las concentraciones de nitrato de amonio a 1,98 g L-1, nitrato de potasio 2,28 g L-1y disminuir la sacarosa a 20 g L-1, se alcanza una longitud superior a los 5,82 cm.
Referente al número de nudos y número de raíces (Tabla 2 y Figura 1), el tratamiento 7, constituido por 0.5 ppm de AG3, manifestó un mayor número de nudos; mientras que el tratamiento 6, constituido por 0.25 ppm de AG3 y 0.25 ppm de AIA, manifestó un mayor número de raíces. Todos los tratamientos al ser analizados estadísticamente, según el análisis de varianza no se encontraron diferencias significativas, debido a que el valor-P, fue mayor que 0,05; con un nivel confianza del 95,0%. Sin embargo al hacer una comparación de medias con el método LSD de Fisher, se llegó a la conclusión de que al menos un par de medias son distintas para el factor número de nudos y número de raíces, lo cual se ve representado en el gráfico de Cajas (Figura 2). Es importante considerar que investigaciones han demostrado que un mejor desarrollo radical se obtienen al emplear 0.05 mg L-1 de AIB. Ya que el ácido indolbutírico (AIB) es catalogado como el enraizante por excelencia en biotecnología vegetal (Araque et al., 2018). Sin embargo, en la actualidad se ha demostrado que cultivos líquidos y los Sistemas de Inmersión Temporal permiten obtener mayor calidad de plántulas de S. tuberosum L., el cual está vinculado a los factores altura, número de entrenudos y raíces (Igarza, 2012).
5. CONCLUSIONES
Se concluye que el efecto del ácido giberélico y el ácido indolacético es relativamente débil en la micropropagación de S. tuberosum var. Maria Reiche, pudiendo propagarse in vitro sin la necesidad de estos fitorreguladores.
6. REFERENCIAS BIBLIOGRÁFICAS
1. Ábdelnour, E., & Vincent, E. 1994.Conceptos básicos del cultivo de tejidos vegetales. Costa Rica: CATIE S.A. 38 pp.
2. Agraria. (2019). Agencia Agraria de Noticias. Disponible en: http://agraria.pe/
3. Araque, E., Bohórquez, M., Pacheco, J., Correa, L., Urquijo, J., Castañeda., S., Pacheco., J. (2018).
4. ropagación y tuberización in vitro de dos variedades de papa. Ciencia en Desarrollo, 9(1), 21-31.
5. Beltrán, J. & Roca, W. 1984. EL cultivo de meristemas para la conservación de germoplasma de yuca in vitro. Colombia: CIAT. 41pp.
6. Campbell, N., Mitchel, L. & Reece, J. 2001. Biología: Conceptos y relaciones. (3era ed.). México: Ed. Pearson Educación. 809 pp.
7. Castillo, A. (2004). Propagación de plantas por cultivo in vitro: una biotecnología que nos acompaña hace mucho tiempo. Las Brujas, Uruguay: AR-VITRO, INIA. 8 pp.
8. CIP & FEDECH. (2006). Catálogo de variedades de papa nativa de Huancavelica-Perú. 1era ed. Lima-Perú: Editorial Metrocolor S.A. 208 pp.
9. Curtis, H., Barnes, N., Schnek, A. & Massarini, A. 2008. Biología. (7ma ed.). España: Ed. Médica Panamericana. 1160 pp.
10. Diez, C., López, E., Zavaleta, C., Rodríguez, M. & Huayanay, J. (2013). Cuantificación de los principios anticancerígenos de la variedad de papa nativa de pulpa de color de la región La Libertad con el fin de procesamiento industrial. Pueblo continente, 24(2) ,425-431.
11. García, L., Rodríguez, M., La., M., Pérez, M., Alvarado, Y., De Feria, M., Veitía, N., Miraba, D., Castillo, J. (2015). Propagación in vitro de variedades cubanas de Solanum tuberosum L. ‘Yuya’, ‘Marinca’, ‘Grettel’ e ‘Ibis’. Biotecnología Vegetal, 15(2): 75 - 83.
12. Gil, E., Lopéz, E., Mostacero, J. & De la Cruz, J. (2019). Papas nativas con potencial antioxidante, cultivadas en el norte del Perú. Boletín Latinoamericano y del Caribe de Plantas Medicinales y Aromáticas ,18 (3), 289-324.
13. Igarza, J., Agramonte, D., Alvarado, Y., de Feria, M. & Pugh .T. (2012) Empleo de métodos biotecnológicos para la producción de semilla de papa. Biotecnología vegetal ,12 (1): 3-24.
14. Kessel, A. 2008. Aplicación de técnicas biotecnológicas en frutales, una vía valiosa para el rescate y la conservación de estas especies. Cultivos Tropicales, 29(3): 27-37.
15. Lopéz, S. 2012. In vitro conservation of germplasm of native potato of color-pulp from Region La Libertad, Perú. REBIOL, 1(32):11- 15.
16. Lopéz, S., Lopéz, A. & De la Cruz, J. (2017). Efecto del ácido giberélico en la propagación in vitro de Stevia rebaudiana (Bertoni) Bertoni, “estevia”. Arnaldoa, 24 (2): 599- 608.
17. Mendoza, H & V. Mosquera. (2011) Selección de variedades de papa. Disponible en: http s:// www.researchgate.net/publication/308786084_Seleccion_de_Variedades_de_Papa
18. Ministerio de Agricultura. (2011). La papa nuestra de cada día. Lima, Perú: Editorial MINAGRI. 13 pp.
19. Vásquez, E. 2003. Influencia de los Factores Ambientales en la Predicción del Comportamiento de los Clones de Papa para la Costa del Perú. Universidad Nacional Agraria La Molina. Tesis ingeniero Agrónomo.102 pp.
20. Ortega, C. 2000. Evaluación de fitohormonas y abonos foliares para mejorar el amarre de frutos de tomate en árbol (Cyphomandra betacea Sendt) cultivar punto amarillo. Tababela-Pichincha. Tesis ingeniero agrónomo. Universidad central del Ecuador.
21. Rojas, S., García, J. & Alarcón. M. 2004. Propagación asexual de plantas. Colombia: Ed. Corpoica. 55 pp.
22. Salisbury, F. & C. Ross. 1984. Planth Physiology. Third edition. Wasworth publisshing company. California. U.S.A
23. Su, Y., Liu, Y. & Zhang, X. 2011. Auxin– Cytokinin Interaction Regulates Meristem Development. Molecular Plant 4(4): 616–625.
24. Tacoronte, M., Vielma, M., Olivo, A., Chacín, N. (2017). Efectos de nitratos y sacarosa en la propagación in vitro de tres variedades de papa nativa. Revista Colombiana de Biotecnología, 19(2): 63-73