Actividad antifúngica de aceites esenciales sobre Fusarium oxysporum asociado a aguacate (Persea americana Mill.)
Antifungal activity of essential oils against Fusarium oxysporum associated with avocado (Persea americana Mill.)
Edgar López López1*; Evelyn Alessandra Vázquez Ballesteros2; Ana Pamela Fuerte Aguilar2;
Blanca Estela Gómez Luna2; Reyna Nallely Sánchez González2; Manuel Alejandro Cano Domínguez3;
Anareli Quintero Jiménez2*
1 Universidad Tecnológica de Mineral de la Reforma. Camino Providencia - La Calera 1000, Ex Hacienda Chavarría, Mineral de la Reforma, Hidalgo, México.
2 Universidad de Guanajuato Departamento de Ingeniería Agroindustrial, División de Ciencias de la Salud e Ingenierías, Campus Celaya-Salvatierra, Programa de Ingeniería en Biotecnología, Av. Mutualismo Esq. Prolongación Río Lerma S/N, Celaya, México.
3 Universidad Autónoma Chapingo, Departamento de Fitotecnia, Campus Central, Km. 38.5 Carretera México, Texcoco Chapingo, Texcoco, México.
ORCID de los autores
E. López-López: https://orcid.org/0000-0002-5125-8883 E. A, Vázquez Ballesteros: https://orcid.org/0009-0002-4026-2788
A- P. Fuerte Aguilar: https://orcid.org/0009-0002-0120-602X B. E. Gómez Luna: https://orcid.org/0000-0001-6345-0461
R. N. Sánchez González: https://orcid.org/0009-0008-0651-122X M. A. Cano Domínguez: https://orcid.org/0009-0003-1238-438X
A. Quintero Jiménez: https://orcid.org/0000-0001-7206-8045
RESUMEN
El presente estudio evaluó la actividad antifúngica de aceites esenciales de Cinnamomum verum, Tagetes lucida y Syzygium aromaticum frente a Fusarium oxysporum aislado de aguacate (Persea americana Mill.). Los aceites fueron aplicados a concentraciones de 1,0%, 0,5%, 0,1%, 0,05% y 0,01% mediante el método de difusión en agar, con cuatro repeticiones por tratamiento. Se midió el crecimiento micelial diario durante siete días y se calculó el porcentaje de inhibición y el área bajo la curva de crecimiento. Los resultados mostraron diferencias significativas (p ≤ 0,05) entre tratamientos, siendo el aceite de C. verum el más eficaz, con una inhibición superior al 70 % a 1,0% de concentración. Los aceites de T. lucida y S. aromaticum presentaron efectos moderados, con reducciones del crecimiento micelial de hasta 60%. Los ensayos de fitotoxicidad en callos de P. americana indicaron la ausencia de daño visible, excepto un leve amarillamiento con C. verum a 1,0%. Estos resultados evidencian el potencial de los aceites esenciales como alternativas biotecnológicas sostenibles para el manejo de F. oxysporum en el cultivo de aguacate.
Palabras clave: Aceites esenciales; Fusarium oxysporum; Persea americana; Inhibición micelial; Tagetes.
ABSTRACT
This study evaluated the antifungal activity of essential oils from Cinnamomum verum, Tagetes lucida and Syzygium aromaticum against Fusarium oxysporum isolated from avocado (Persea americana Mill.). The oils were tested at concentrations of 1.0%, 0.5%, 0.1%, 0.05% and 0.01% using the agar diffusion method, with four replicates per treatment. Mycelial growth was measured daily for seven days, and the inhibition percentage and area under the growth curve were calculated. Significant differences (p ≤ 0.05) were observed among treatments, with C. verum being the most effective, achieving over 70% inhibition at 1.0% concentration. T. lucida and S. aromaticum showed moderate antifungal effects, with mycelial growth reductions up to 60%. Phytotoxicity assays on P. americana calli revealed no visible damage, except for slight yellowing with C. verum at 1.0%. These findings highlight the potential of essential oils as sustainable biotechnological alternatives for the management of F. oxysporum in avocado cultivation.
Keywords: Essential oils; Fusarium oxysporum; Persea americana; mycelial inhibition; Tagetes.
1. Introducción
El aguacate (Persea americana Mill.) es uno de los frutales de mayor importancia económica en México, considerado el principal productor y exportador mundial (Cruz et al., 2020). Sin embargo, la productividad del cultivo se ve limitada por diversas enfermedades fúngicas que afectan tanto al sistema radicular como a los frutos, entre las cuales destaca Fusarium oxysporum, agente causal de marchitez vascular, que ocasiona pérdidas significativas en viveros y plantaciones comerciales (Corona et al., 2025). Este patógeno, además de reducir el vigor y desarrollo del árbol, puede sobrevivir en el suelo por largos periodos formando clamidosporas resistentes, lo que dificulta su control mediante prácticas convencionales (Zakaria, 2023).
El manejo químico con fungicidas sintéticos ha sido la estrategia más utilizada para controlar a Fusarium, pero su uso prolongado genera resistencia en los patógenos, toxicidad ambiental y riesgos a la salud humana (Islam et al., 2024). Ante esta problemática, la búsqueda de alternativas sostenibles ha impulsado el estudio de metabolitos naturales derivados de plantas, particularmente los aceites esenciales, debido a su amplio espectro de actividad biológica, biodegradabilidad y bajo impacto ecológico (Rodríguez et al., 2020).
Los aceites esenciales son mezclas complejas de compuestos volátiles, principalmente monoterpe-nos, sesquiterpenos y fenilpropanoides, respon-sables de la actividad antimicrobiana observada frente a diversos fitopatógenos (Acero et al., 2025). Se ha demostrado que su modo de acción incluye alteraciones en la permeabilidad de membranas, desnaturalización de proteínas y disrupción de enzimas respiratorias, lo que conduce a la inhibición del crecimiento micelial y esporulación (Camargo et al., 2021). Diversos estudios han documentado la eficacia de aceites esenciales de canela (Cinnamomum verum), clavo (Syzygium aromaticum) y Tagetes spp. contra hongos del género Fusarium, destacando la acción del eugenol, el cinamaldehído y los terpenos sulfurados como compuestos respon-sables de la inhibición fúngica (Cepeda et al., 2023).
En México, el género Tagetes representa un recurso vegetal de gran interés biotecnológico por su abundancia y composición rica en compuestos volátiles bioactivos como limoneno, ocimeno y tagetona. Investigaciones recientes han reportado su potencial antimicrobiano y antifúngico frente a hongos agrícolas de importancia económica, incluyendo Fusarium oxysporum y Colletotrichum gloeosporioides (Behera et al., 2025). Por su parte, el aceite esencial de clavo, rico en eugenol, y el de canela, con alto contenido de cinamaldehído, han mostrado elevada eficacia en bioensayos in vitro, logrando inhibiciones superiores al 70% en crecimiento micelial a concentraciones bajas (Calo et al., 2015;). No obstante, a pesar de los avances en el estudio de aceites esenciales con potencial antifúngico, aún existen pocos reportes enfocados específica-mente en cepas de F. oxysporum asociadas al cultivo de aguacate, así como en la evaluación paralela de la posible fitotoxicidad que estos compuestos pueden ejercer sobre tejidos vegetales. Evaluar estos aspectos resulta esen-cial para considerar su aplicación práctica en sistemas agrícolas reales.
Por lo anterior, el presente trabajo tuvo como objetivo evaluar la actividad antifúngica de aceites esenciales de Tagetes, canela y clavo sobre F. oxysporum aislado de aguacate (P. americana Mill.), mediante bioensayos de difusión en agar en diferentes concentraciones, complementando con pruebas de fitotoxicidad en callos cultivados in vitro. Esta investigación busca aportar evidencia científica que sustente el uso de aceites esenciales como una alternativa biotecnológica viable para el manejo sostenible de enfermedades fúngicas en el cultivo de aguacate.
2. Metodología
2.1 Material vegetal
El material vegetal consistió en hojas sanas y maduras de Tagetes lucida Cav. recolectadas en mayo de 2024 en la localidad de Mineral de la Reforma, Hidalgo, México (20.1011° N, 98.7000° O; 2,400 msnm). Las muestras fueron identificadas y verificadas taxonómicamente en la Universidad Tecnológica de Mineral de la Reforma. Como aceites comparativos se utilizaron aceites esenciales de canela (Cinnamomum verum J. Presl) y clavo (Syzygium aromaticum L.). Los hongos fitopatógenos fueron identificados morfológica y microscópicamente como F. oxysporum, agente causal de marchitez vascular en aguacate (Persea americana Mill.).
Las hojas de T. lucida fueron lavadas con agua destilada y desinfectadas con una solución de hipoclorito de sodio al 1% durante 2 min, enjuagándose tres veces con agua destilada estéril. Posteriormente se secaron a temperatura ambiente (25 ± 2 °C) y se sometieron a destilación por arrastre con vapor en un equipo tipo Clevenger durante tres horas, siguiendo la metodología descrita por Pavela & Benelli (2016). El aceite obtenido se separó, deshidrató con sulfato de sodio anhidro y se almacenó en frascos ámbar a 4 °C hasta su uso. El rendimiento del aceite se calculó como la relación entre el volumen obtenido (mL) y el peso del material vegetal seco (g).
2.2 Obtención y mantenimiento del aislamiento fúngico
El aislamiento de F. oxysporum se realizó a partir de raíces infectadas de aguacate, desinfectadas con hipoclorito de sodio al 2% y sembradas en medio papa-dextrosa-agar (PDA; Difco Labora-tories). Las colonias desarrolladas se subcultiva-ron tres veces para obtener cultivos puros, verifi-cando la morfología típica del género Fusarium mediante observación de macro-conidios y microconidios (Leslie & Summerell, 2006). Los cultivos se conservaron en PDA inclinado a 4 °C hasta su empleo en los bioensayos.
2.3 Bioensayo de actividad antifúngica
La actividad antifúngica de los aceites esenciales se evaluó mediante el método de difusión en agar descrito por Balouiri et al. (2016), con modifica-ciones. Se prepararon emulsiones acuosas de los aceites a concentraciones de 1,0%, 0,5%, 0,1%, 0,05% y 0,01% (v/v), utilizando Tween 80 al 0,1% como agente emulsionante. Como control nega-tivo se empleó agua destilada con Tween 80, y como control positivo se utilizó Microdyn® (cloruro de benzalconio al 0,13%).
En cajas Petri de 90 mm de diámetro se vertieron 15 mL de medio PDA estéril y, una vez solidifi-cado, se depositó un disco de papel filtro estéril (6 mm de diámetro) impregnado con 10 µL de cada emulsión. En el centro de cada caja se colocó un disco (6 mm) de micelio activo de F. oxysporum de siete días de crecimiento. Las placas se incubaron a 27 ± 1 °C en oscuridad, y se midió diariamente el diámetro de la colonia en dos ejes perpendiculares durante siete días, expresando el resultado como promedio en milímetros (mm). El porcentaje de inhibición del crecimiento micelial (%I) se calculó con la fórmula %I = [(Dc − Dt)/Dc] × 100, donde Dc corresponde al diámetro prome-dio del testigo y Dt al diámetro del tratamiento como lo semana Salazar et al. (2012).
2.4 Ensayo de fitotoxicidad in vitro
Para verificar posibles efectos citotóxicos de los aceites sobre tejidos vegetales, se utilizaron callos de P. americana cultivados en medio B5 de Gamborg suplementado con 2 mg L⁻¹ de picloram. Se colocaron 200 mg de tejido por caja Petri, y se asperjaron 1 mL de las emulsiones de aceites en las mismas concentraciones utilizadas en el bioensayo antifúngico. Las cajas se mantuvieron a 25 ± 1 °C con fotoperiodo de 16 h luz/8 h oscuridad. Después de siete días se registraron cambios en color, textura y necrosis para evaluar la fitotoxicidad, considerando como no fitotóxicos los tratamientos sin alteraciones visibles.
2.5 Diseño experimental y análisis estadístico
El experimento se estableció bajo un diseño completamente al azar con arreglo factorial 3×5 (tres aceites esenciales y cinco concentraciones) más un testigo, con cuatro repeticiones por tratamiento. La variable respuesta fue el crecimiento micelial (mm) medido diariamente y el porcentaje de inhibición calculado al séptimo día.
Los datos se sometieron a un análisis de varianza (ANOVA) de dos vías (aceite, concentración y su interacción) utilizando el paquete estadístico SAS® versión 9.4 (SAS Institute Inc., Cary, NC, USA). Cuando se detectaron diferencias significativas (p ≤ 0,05), se aplicó la prueba de comparación de medias de Tukey al mismo nivel de significancia. Se verificaron los supuestos de normalidad y homogeneidad de varianzas mediante las pruebas de Shapiro–Wilk y Levene, respectivamente. Adicionalmente, se estimó el área bajo la curva de crecimiento (AUGC) para cada tratamiento como una medida integrada del desarrollo micelial en el tiempo, siguiendo la metodología de Jeger & Viljanen-Rollinson (2001).
3. Resultados y discusión
3.1 Aislamiento e identificación de F. oxysporum
El aislamiento fúngico obtenido a partir de raíces de aguacate presentó características morfoló-gicas típicas de F. oxysporum, con micelio algodonoso de color blanco que viró poste-riormente a tonalidades rosadas, lo cual coincide con lo reportado por Hurtado et al. (2021), quienes aislaron F. oxysporum de diferentes cultivares de aguacate y presentando la morfología inicial blanco algodonosa que posteriormente cambió a una coloración de rosado a violeta con el paso del tiempo. Se observaron macroconidios falcados de tres a cinco septos, microconidios ovalados y clamidosporas de pared gruesa, lo que confirmó su identidad taxonómica de acuerdo con las descripciones de Leslie & Summerell (2006). Este aislamiento fue utilizado en los bioensayos posteriores para la evaluación de la actividad antifúngica de los aceites esenciales.
3.2 Crecimiento micelial en condiciones control
Durante la incubación, el testigo sin aceite esen-cial presentó un crecimiento micelial continuo, alcanzando un diámetro promedio de 78,75 mm al séptimo día. La colonia mostró una morfología homogénea, con micelio denso y abundante producción de esporas, semejante a lo reportado por Chakrapani et al. (2023), quienes mencionan que este hongo típicamente forma colonias con morfología homogénea, micelio denso y abun-dante producción de esporas bajo condiciones óptimas de laboratorio, como temperaturas entre 23 – 27 °C y pH ligeramente ácido (5 – 6). Este valor sirvió como referencia para determinar el grado de inhibición del crecimiento micelial en los tratamientos con aceites esenciales.
3.3 Efecto de los aceites esenciales sobre el crecimiento micelial
Los tratamientos con aceites esenciales de T. lucida, canela y clavo provocaron una reducción significativa en el crecimiento de F. oxysporum, dependiendo del tipo de aceite y la concentración aplicada. En general, las concentraciones de 1,0% y 0,5% inhibieron de manera evidente el crecimiento del hongo, mientras que las concentraciones inferiores (0,05% y 0,01%) mostraron efectos menores, lo cual es coincidente con lo reportado por Amoozegaran et al. (2022) concentraciones de 0,5% pueden ser efectivas en ciertas formulaciones, pero para un efecto fungicida directo y completo, suelen requerirse concentraciones de 1% o superiores, depen-diendo del aceite esencial específico y el método de aplicación. Los valores promedio del crecimiento micelial diario de F. oxysporum bajo las distintas concentraciones y tipos de aceites esenciales se presentan en la Tabla 1. Se observó una reducción progresiva del crecimiento conforme aumentó la concentración, siendo más pronunciada con el aceite esencial de C. verum.
En la Figura 1 se ilustran las curvas de crecimiento micelial promedio de F. oxysporum a lo largo de siete días para cada tratamiento. Se observó que el aceite esencial de canela fue el más efectivo, reduciendo drásticamente el desarrollo del micelio desde el segundo día, esto posiblemente debido a componentes en el aceite como lo puede ser el cinamaldehido, reportado por tener alta actividad antifúngica incluso a bajas concentraciones (Hong et al., 2021; Lee et al., 2022; Yuan et al., 2024). El aceite de Tagetes mostró un efecto intermedio, y el de clavo una inhibición menor, aunque significativamente distinta del control.
Tabla 1
Crecimiento micelial promedio (mm) de F. oxysporum en presencia de aceites esenciales durante siete días de incubación
Table 1
Average mycelial growth (mm) of F. oxysporum in the presence of essential oils during seven days of incubation
Aceite esencial | Concentración (%) | Día 1 | Día 3 | Día 5 | Día 7 | Crecimiento final (mm ± EE) |
Control | 0 | 12,5 | 48,3 | 68,4 | 78,8 | 78,75 ± 1,6 a |
C. verum | 1 | 3,4 | 7,8 | 15,1 | 17,2 | 17,25 ± 0,9 e |
C. verum | 0,5 | 4,5 | 9,3 | 19,6 | 23,1 | 23,12 ± 1,0 de |
C. verum | 0,1 | 8,9 | 21,4 | 32,5 | 42,7 | 42,65 ± 1,3 c |
C. verum | 0,05 | 10,1 | 27,8 | 39,1 | 49,8 | 49,78 ± 1,5 c |
C. verum | 0,01 | 12 | 34,6 | 48,7 | 60,2 | 60,18 ± 1,2 b |
T. lucida | 1 | 5,1 | 13,9 | 24,4 | 30,4 | 30,40 ± 1,4 cd |
T. lucida | 0,5 | 6,8 | 17,5 | 29,2 | 35,9 | 35,90 ± 1,6 cd |
T. lucida | 0,1 | 9,5 | 24,3 | 36,1 | 48,1 | 48,05 ± 1,5 c |
T. lucida | 0,05 | 11,2 | 31,8 | 45,7 | 54,6 | 54,63 ± 1,8 bc |
T. lucida | 0,01 | 12,3 | 39,6 | 53,2 | 62,5 | 62,50 ± 1,7 b |
S. aromaticum | 1 | 4,9 | 11,2 | 20,8 | 26,1 | 26,12 ± 1,3 d |
S. aromaticum | 0,5 | 5,6 | 15,8 | 26,9 | 33,5 | 33,52 ± 1,6 cd |
S. aromaticum | 0,1 | 8,7 | 23,1 | 35,6 | 47,8 | 47,80 ± 1,9 c |
S. aromaticum | 0,05 | 10,3 | 29,5 | 43,2 | 52,4 | 52,43 ± 2,0 bc |
S. aromaticum | 0,01 | 12,1 | 38,4 | 50,1 | 61,7 | 61,65 ± 1,7 b |
Letras diferentes en la misma columna indican diferencias significativas (p ≤ 0.05; prueba de Tukey). EE: error estándar.
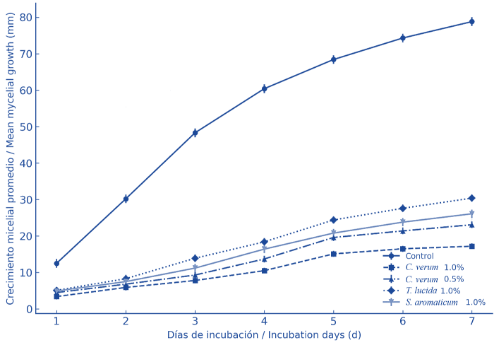
Figura 1. Crecimiento micelial promedio de F. oxysporum durante siete días de incubación en presencia de aceites esenciales de C. verum, T. lucida y S. aromaticum a distintas concentraciones.
3.4 Análisis estadístico del crecimiento micelial
El análisis de varianza (ANOVA) de dos vías mostró diferencias altamente significativas (p ≤ 0,05) entre los tratamientos, tanto para el tipo de aceite como para la concentración, además de una interacción significativa entre ambos factores. Es decir, tanto el tipo de aceite como la concentración, así como su interacción, influyeron significativamente (p ≤ 0,05) en el crecimiento micelial de F. oxysporum. La prueba de compa-ración de medias de Tukey (p ≤ 0,05) reveló que los tratamientos con aceite esencial de canela al 1,0% y 0,5% presentaron los menores valores de crecimiento micelial promedio, con reducciones superiores al 70% respecto al control.
El aceite de T. lucida presentó una inhibición intermedia, con valores de 45% a 60% en las concentraciones de 1,0% y 0,5%, mientras que el aceite de clavo mostró valores promedio de inhibición cercanos al 52%. Estos resultados reflejan la influencia combinada de la composición química y la concentración del aceite en la actividad antifúngica. Este efecto inhibitorio obtenido con T. lucida puede deberse a la presencia de su compuestos fenólicos y terpenoides en su aceite esencial dentro de los que se pueden destacar estragol (metil chavicol), metileugenol, anetol tal como lo reportan diversos autores quienes atribuyen el efecto fitotóxico a estos componentes (Hernández et al., 2020; Monzote et al., 2020; Torres et al., 2022).
3.5 Inhibición del crecimiento micelial
El porcentaje de inhibición (%I) calculado al séptimo día de incubación permitió confirmar las diferencias entre tratamientos (Tabla 2).
Tabla 2
Porcentaje de inhibición (%I) del crecimiento micelial de F. oxysporum al séptimo día
Table 2
Percentage of inhibition (%I) of mycelial growth of F. oxysporum on the seventh day
Aceite esencial | Concentración (%) | Inhibición promedio (% ± EE) |
C. verum | 1,00 | 78,3 ± 1,2 a |
C. verum | 0,50 | 70,6 ± 1,4 b |
C. verum | 0,10 | 45,8 ± 1,6 c |
T. lucida | 1,00 | 61,5 ± 1,3 b |
T. lucida | 0,50 | 54,4 ± 1,8 c |
S. aromaticum | 1,00 | 57,8 ± 1,5 c |
S. aromaticum | 0,50 | 52,2 ± 1,6 c |
Control | — | 0,0 ± 0,0 d |
Letras diferentes indican diferencias significativas (p ≤ 0,05; prueba de Tukey).
Los resultados mostraron que el aceite esencial de canela alcanzó los valores más altos de inhibición, seguido por los de T. lucida y S. aromaticum. En la Figura 2 se muestran los porcentajes promedio de inhibición para cada aceite y concentración, en donde se puede apreciar que el aceite de canela registró el mayor valor con 78,3% de inhibición al 1,0%, seguido del aceite de T. lucida con 61,5% y del aceite de clavo con 57,8%. En concentraciones inferiores a 0,1%, los efectos antifúngicos no fueron significativa-mente diferentes del control.
Estos resultados son consistentes con reportes previos que destacan la elevada actividad antifúngica de los aceites esenciales de canela y clavo, debido a sus componentes mayoritarios como cinamaldehído y eugenol, respectivamente, los cuales desorganizan la membrana celular e interfieren en la síntesis de ergosterol tal como lo reportan Liu et al. (2024) quienes demostraron el cinamaldehído presenta una potente actividad antifúngica contra una amplia variedad de hongos patógenos y de deterioro alimentario, mientras que Biernasiuk et al. (2022) afirman que el eugenol provoca daño en la integridad de la membrana, aumento de la permeabilidad, estrés oxidativo y, finalmente, muerte celular . En contraste, el aceite de T. lucida ejerce una acción moderada asociada a sus monoterpenos limoneno, ocimeno y tagetona, que alteran la permeabilidad de la membrana sin provocar una desintegración total del micelio (Amoozegaran et al., 2022).
3.6 Análisis de la curva de crecimiento integrada (AUGC)
El cálculo del área bajo la curva de crecimiento (AUGC), mostrado en la Tabla 3, corroboró las diferencias detectadas en el ANOVA, evidencian-do un efecto inhibitorio sostenido en los trata-mientos con aceite esencial de canela. Los tratamientos con aceite de canela al 1,0% y 0,5% presentaron los valores más bajos (p ≤ 0,05), evidenciando un efecto inhibitorio sostenido a lo largo del tiempo. Los tratamientos con T. lucida y clavo también redujeron el área de crecimiento respecto al control, aunque en menor grado.
Estos resultados concuerdan con observaciones de otros estudios que atribuyen la eficacia antifúngica de los aceites esenciales al daño acumulativo sobre la membrana fúngica y a la alteración en el equilibrio osmótico del micelio durante los periodos prolongados de exposición, como lo reportado por Wu et al. (2023), quienes realizaron estudios morfológicos y ultraestruc-turales para demostrar que aceites como el de orégano provocan daño severo en la morfología del micelio y la integridad de la membrana celular, lo que lleva a la pérdida de permeabilidad y, finalmente, a la muerte celular por acumulación de especies reactivas de oxígeno y peroxidación lipídica.
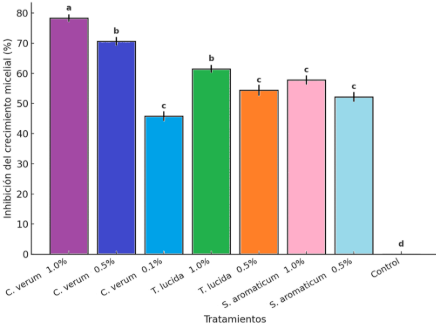
Figura 2. Porcentaje de inhibición del crecimiento micelial (%I) de F. oxysporum en respuesta a distintas concentraciones de aceites esenciales.
Figure 2. Percentage of inhibition of mycelial growth (%I) of F. oxysporum in response to different concentrations of essential oils.
Tabla 3
Área bajo la curva de crecimiento (AUGC) de F. oxysporum en presencia de aceites esenciales
Table 3
Area under the growth curve (AUGC) of F. oxysporum in the presence of essential oils
Aceite esencial | Concentración (%) | AUGC (mm·día ± EE) |
C. verum | 1,00 | 68,5 ± 2,1 e |
C. verum | 0,50 | 83,2 ± 2,4 de |
T. lucida | 1,00 | 95,7 ± 2,3 d |
S. aromaticum | 1,00 | 98,1 ± 2,7 d |
Control | — | 245,6 ± 3,8 a |
Letras diferentes indican diferencias significativas (p ≤ 0,05; prueba de Tukey).
3.7 Ensayo de fitotoxicidad en callos de P. americana
Los callos de aguacate tratados con las emul-siones de aceites esenciales no presentaron necrosis ni pérdida de turgencia durante los siete días de exposición (Figura 3), salvo un ligero amarillamiento en el tratamiento con canela al 1,0%, considerado como respuesta fisiológica leve (Herrera et al., 2024), quienes afirman que esta característica es dada por la activación de enzimas relacionadas con los mecanismos de defensa del fruto, ayudan a mantener la firmeza y retrasar el oscurecimiento de la piel. Las observa-ciones microscópicas mostraron que la textura y coloración del tejido permanecieron normales en los tratamientos con T. lucida y clavo, indicando ausencia de efectos tóxicos severos.
3.8 Consideraciones generales y comparación con estudios previos
La actividad antifúngica confirma el potencial de estos aceites esenciales como agentes naturales de control para F. oxysporum. Los resultados son comparables con los reportados por Rodríguez et al. (2020), quienes destacaron la eficacia de los aceites de canela y Tagetes contra diversas especies de Fusarium. La ausencia de fitoto-xicidad en los callos de P. americana respalda la hipótesis de que estos aceites pueden ser seguros para su uso en tejidos vegetales, siempre que se mantengan concentraciones adecuadas.
Estos resultados demuestran que los aceites esenciales de origen vegetal pueden representar una alternativa al uso de fungicidas sintéticos.
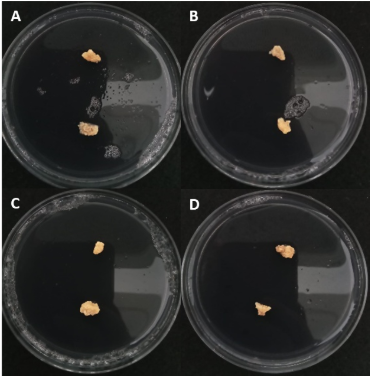
Figura 3. Efecto del tratamiento en callos embriogénicos de aguacate con extractos vegetales: Control (A); T. lucida 1% (B); C. verum (C); S. aromaticum (D). Tiempo de aplicación: 15 días.
Figure 3. Effect of treatment on embryogenic avocado calluses with plant extracts: Control (A); T. lucida 1% (B); C. verum (C); S. aromaticum (D). Application time: 15 days.
4. Conclusiones
Los resultados obtenidos demostraron que los aceites esenciales de C. verum, T. lucida y S. aromaticum ejercieron una actividad antifúngica significativa frente a F. oxysporum aislado de aguacate (P. americana Mill.), reduciendo de manera notable el crecimiento micelial en comparación con el control. El aceite esencial de C. verum mostró la mayor eficacia, con inhibiciones superiores al 70% a concentraciones de 1,0% y 0,5%, seguido por T. lucida y S. aromaticum, cuyos efectos fueron moderados pero consistentes. Los análisis de varianza confir-maron diferencias significativas entre aceites y concentraciones, y el cálculo del área bajo la curva de crecimiento evidenció un efecto inhi-bitorio sostenido en el tiempo. Por otra parte, los ensayos de fitotoxicidad en callos de P. americana indicaron la ausencia de daños morfológicos o necrosis, salvo un leve amarillamiento superficial con C. verum al 1,0%, lo que sugiere una buena compatibilidad biológica con el tejido vegetal. En conjunto, los resultados respaldan el potencial de estos aceites esenciales como alternativas biotecnológicas viables y ecológicamente seguras para el control de F. oxysporum en el cultivo de aguacate, recomendándose estudios posteriores en condiciones in vivo y la caracterización de los compuestos activos responsables de la actividad antifúngica.
Referencias bibliográficas
Acero, J., De Jesús, T., Delgado, W. A., Alcántara, J. S., Soto, M., & Gil, E. (2025). Efecto antimicrobiano de tres aceites esenciales de la familia Lamiaceae para el control Ralstonia solanacearum. Revista Tecnología en Marcha, 28(3)54-68. https://doi.org/10.18845/tm.v38i3.7511
Amoozegaran, A., Dehghan, H., Homami, S., & Hashemi, S. (2022). Efficacy of an edible coating, containing thyme essential oil, to control Fusarium oxysporum and the quality of tomato fruits. Journal of Food Measurement and Characterization, 16, 3760 - 3767. https://doi.org/10.1007/s11694-022-01424-z
Balouiri, M., Sadiki, M., & Ibnsouda, S. K. (2016). Methods for in vitro evaluating antimicrobial activity: A review. Journal of pharmaceutical analysis, 6(2), 71-79. https://doi.org/10.1016/j.jpha.2015.11.005
Behera, S. K., Kalita, H. C., Borah, S., Ram, K., & Kumar, A. (2025). Efficacy of Botanicals as Biocontrol Agents Against Leaf Spot and Blossom Blight Pathogen of Marigold: A First Report from Longleng District of Nagaland, India. Journal of Advances in Biology & Biotechnology, 28(1), 892-904. https://doi.org/10.9734/jabb/2025/v28i11945
Biernasiuk, A., Baj, T., & Malm, A. (2022). Clove Essential Oil and Its Main Constituent, Eugenol, as Potential Natural Antifungals against Candida spp. Alone or in Combination with Other Antimycotics Due to Synergistic Interactions. Molecules, 28. https://doi.org/10.3390/molecules28010215
Calo, J. R., Crandall, P. G., O'Bryan, C. A., & Ricke, S. C. (2015). Essential oils as antimicrobials in food systems–A review. Food control, 54, 111-119. https://doi.org/10.1016/j.foodcont.2014.12.040
Camargo, Y., Zambrano, G., Ortega, M., Gutierrez, D. J., & Yepes, J. A. (2021). Actividad antifúngica in vitro del aceite esencial de Swinglea glutinosa Merr sobre Colletotrichum sp. patógeno de mango (Mangifera indica L.). Revista Colombiana de Biotecnología, 23(1), 62-71. https://doi.org/10.15446/rev.colomb.biote.v23n1.88025
Cepeda, D. F., Ascari, J., De Oliveira, M. S., Antonioli, G., Barcellos, T., Anholeto, L. A., & Nunes, P. H. (2023). Effect of Tagetes minuta essential oil on the central nervous system of unfed Rhipicephalus sanguineus sensu lato ‘tropical lineage’ticks. Experimental and Applied Acarology, 91(4), 697-714. https://doi.org/10.1007/s10493-023-00867-3
Chakrapani, K., Chanu, W., Sinha, B., Thangjam, B., Hasan, W., Devi, K., Chakma, T., Phurailatpam, S., Mishra, L., Singh, G., Khoyumthem, P., & Saini, R. (2023). Deciphering growth abilities of fusarium oxysporum f. sp. pisi under variable temperature, pH and nitrogen. Frontiers in Microbiology, 14. https://doi.org/10.3389/fmicb.2023.1228442
Corona, M. D. C., Garcia, H. G., Arzate, A. M., Norman, T. H., & Lamus, V. (2025). Impacto y perspectivas de control del complejo Fusarium, asociado a la marchitez en agave y otros cultivos. Tropical and Subtropical Agroecosystems, 28(1). http://dx.doi.org/10.56369/tsaes.5564
Cruz, D. F., Caamal, I., Pat, V. G., Gómez, A. A., & Espinoza, L. E. (2020). Posicionamiento internacional del aguacate (Persea americana) producido en México. Revista Mexicana de Agronegocios, 47, 561-570. https://doi.org/10.22004/ag.econ.308712
Hernandez, A., González, M., Narváez, F., Pérez, G., Rivero, F., & Aguilar, M. (2020). Role of β-Caryophyllene in the Antinociceptive and Anti-Inflammatory Effects of Tagetes lucida Cav. Essential Oil. Molecules, 25. https://doi.org/10.3390/molecules25030675
Herrera, J., Ramos, S., Bautista, S., Velázquez, R., Rayón, E., Martínez, E., & Gutiérrez, P. (2024). Chitosan and GRAS substances: An alternative for the control of neofusicoccum parvum in vitro, elicitor and maintenance of the postharvest quality of avocado fruits. Horticulturae, 10(7), 687. https://doi.org/10.3390/horticulturae10070687
Hong, Z., Talib, K., Mujtaba, K., Dabin, H., Yahya, F., Congying, Z., & Fukai, W. (2021). Antifungal potential of cinnamon essential oils against Phytophthora colocasiae causing taro leaf blight. Chemical and Biological Technologies in Agriculture, 8. https://doi.org/10.1186/s40538-021-00238-3
Hurtado, G., Arroyo, W., Lema, Á., Cho, K., Pazos, A., & Flor, F. (2021). Colonization of Fusarium oxysporum transformed with the red fluorescence protein gene (tdTomato) mediated by Agrobacterium tumefaciens in roots of two avocado cultivars. Research, Society and Development, 10(2), e22010212554. https://doi.org/10.33448/rsd-v10i2.12554
Islam, T., Danishuddin, Tamanna, N. T., Matin, M. N., Barai, H. R., & Haque, M. A. (2024). Resistance mechanisms of plant pathogenic fungi to fungicide, environmental impacts of fungicides, and sustainable solutions. Plants, 13(19), 2737. https://doi.org/10.3390/plants13192737
Jeger, M. J. & Viljanen-Rollinson, S. L. H. (2001). The use of the area under the disease-progress curve (AUDPC) to assess quantitative disease resistance in crop cultivars. Theoretical and Applied Genetics, 102(1), 32-40. https://doi.org/10.1007/s001220051615
Lee, J., Seo, S., Huh, M., Lee, S., & Park, I. (2020). Reactive oxygen species mediated-antifungal activity of cinnamon bark (Cinnamomum verum) and lemongrass (Cymbopogon citratus) essential oils and their constituents against two phytopathogenic fungi. Pesticide biochemistry and physiology, 168, 104644. https://doi.org/10.1016/j.pestbp.2020.104644
Leslie, J. F., & Summerell, B. A. (2006). The Fusarium laboratory manual. John Wiley & Sons.
Liu, W., Wang, T. & Su, E. (2024). Insights into the antifungal activity and mechanisms of cinnamon components against Aspergillus flavus and Penicillium citrinum. Food research international, 197, 115291 . https://doi.org/10.1016/j.foodres.2024.115291
Monzote, L., Gutiérrez, Y., Machín, L., Staniek, K., Scull, R., Satyal, P., Gille, L., & Setzer, W. (2020). Antileishmanial Activity and Influence on Mitochondria of the Essential Oil from Tagetes lucida Cav. and Its Main Component. Scientia Pharmaceutica, 88(3), 31. https://doi.org/10.3390/scipharm88030031
Pavela, R., & Benelli, G. (2016). Essential oils as ecofriendly biopesticides? Challenges and constraints. Trends in plant science, 21(12), 1000-1007. https://doi.org/10.1016/j.tplants.2016.10.005
Rodríguez, A., Torres, S., Domínguez, A., Romero, A., & Silva, M. (2020). Extractos vegetales para el control de Fusarium oxysporum, Fusarium solani y Rhizoctonia solani, una alternativa sostenible para la agricultura. Abanico agroforestal, 2, 1-13. https://doi.org/10.37114/abaagrof/2020.7
Salazar, E., Hernández, R., Tapia, A., & Gómez, L. (2012). Identificación molecular del hongo Colletotrichum spp., aislado de banano (Musa spp) de la altura en la zona de Turrialba y determinación de su sensibilidad a fungicidas poscosecha. Agronomía Costarricense, 36(1), 53-68. https://doi.org/10.15517/rac.v36i1.9964
Torres, R., Moreno, A., García, Y., Hernandez, T., Delgado, G., & Espinosa, F. (2022). Tagetes lucida Cav. essential oil and the mixture of its main compounds are antibacterial and modulate antibiotic resistance in multi‐resistant pathogenic bacteria. Letters in Applied Microbiology, 75. https://doi.org/10.1111/lam.13721
Wu, T., Zhang, B., Luo, X., Li, A., Zhang, S., An, J., Zhang, Z., & Liu, Y. (2023). Antifungal efficacy of sixty essential oils and mechanism of oregano essential oil against Rhizoctonia solani. Industrial Crops and Products, 191(Part A), 115975. https://doi.org/10.1016/j.indcrop.2022.115975
Yuan, X., Cao, D., Xiang, Y., Jiang, X., Liu, J., Bi, K., Dong, X., Wu, T., & Zhang, Y. (2024). Antifungal activity of essential oils and their potential synergistic effect with amphotericin B. Scientific Reports, 14. https://doi.org/10.1038/s41598-024-82380-0
Zakaria, L. (2023). Fusarium species associated with diseases of major tropical fruit crops. Horticulturae, 9(3), 322. https://doi.org/10.3390/horticulturae9030322