Eficiencia en la utilización de fósforo en maíces nativos cultivados en Andosoles del Centro de México
Efficiency in the use of phosphorus in native maize cultivated in Andosols of Central Mexico
Jeannette S. Bayuelo Jiménez1 *
1 Instituto de Investigaciones Agropecuarias y Forestales, Universidad Michoacana de San Nicolás de Hidalgo, km 9, Carretera Morelia-Zinapécuaro. Tarímbaro. Michoacán, C.P. 58800. México.
ORCID del autor:
J. S. Bayuelo Jiménez: https://orcid.org/0000-0002-6253-4126
RESUMEN
La eficiencia en el uso de fósforo (P) está regulada por la forma en que la planta adquiere y utiliza el recurso en condiciones restrictivas. Se evaluó el proceso de acumulación, partición y removilización de materia seca y P en maíz y su relación con la eficiencia en la utilización de P (EUtP). Se cultivaron seis genotipos de maíz de maduración precoz y tardía en un suelo ácido, con una reducida (25 kg P2O5 ha-1) (BP) y adecuada (50 kg P2O5 ha-1) (AP) fertilización fosforada. El estudio identificó variabilidad genotípica para EUtP. Los genotipos de maduración tardía presentaron alta acumulación de materia seca y P en órganos vegetativos, pero una menor removilización de asimilados a la semilla en desarrollo, en BP. Al contrario, los genotipos precoces mantuvieron una constante acumulación y partición de materia seca entre órganos y alta removilización de P hacia la semilla, en BP y AP. Independientemente de la dosis, los genotipos precoces removieron mayor biomasa (22 %) y P (21 %) del vástago a la semilla en comparación con los tardíos (18 y 15 %). Una óptima partición de materia seca en la planta y una mayor partición de P hacia tejidos jóvenes y activos incrementan la EUtP, en suelos ácidos.
Palabras clave: Zea mays; fósforo; patrón de acumulación; partición; removilización.
ABSTRACT
Phosphorus use efficiency is controlled by the manner in which the plant acquires and utilizes the nutrient under limiting conditions. This study evaluated biomass and P accumulation, partitioning, and remobilization processes, and their relationship with P utilization efficiency (PUTE) in maize. Three early and three late maturing maize genotypes were grown on a P-deficient soil, with limited (25 kg P2O5 ha-1) and optimal (50 kg kg P2O5 ha-1) P fertilization. The study identified genotypic variation among the tested maize genotypes for PUTE. Under P deficiency environments, late maturing genotypes showed the greatest amount of dry matter and P in vegetative organs and a less remobilization of biomass to grain. In contrast, early maturing genotypes maintained unchanged proportion of biomass and P partitioning into various organs and a higher P remobilization to grain, at both P levels. Regardless of P application rate, biomass and P remobilization to the grain was higher in early maturing genotypes (22 y 21 %) than in late ones (18 y 15 %). Greater variation on PUTE was linked to an enhanced dry matter partitioning in the plants and a higher proportion of P allocated into young and active tissue, under P-limited acid soils.
Keywords: Zea mays; phosphorus; accumulation pattern; partitioning; remobilization.
1. Introducción
Se estima que, a nivel mundial, más del 40 % de la superficie cultivable tiene deficiencia de fósforo (P) (Schneider, 2019). En los sistemas agrícolas modernos, la alta aplicación de fertilizante químico derivado de roca fosfórica - un recurso finito y no renovable - resarce esta carencia e incrementa la productividad agrícola a expensas de una disminución de la calidad del suelo (Brindaban et al., 2020; Cong et al., 2020; Zou et al., 2022). En los sistemas agrícolas tradicionales, la inadecuada o inexistente aplicación de fertilizante sintético propicia la extracción continua de P del suelo y la pérdida de su calidad (Brindaban et al., 2020). Diversas estrategias de manejo como la fertilización de precisión y el reciclaje de P proveniente de residuos domésticos, agrícolas e industriales pueden incrementar la eficiencia en su uso y reducir el agotamiento de las reservas de roca fosfórica (Schneider et al., 2019; Guo et al., 2025). Otra valiosa estrategia que mejora el uso de las reservas de P y el rendimiento de los sistemas agrícolas consiste en el aprovecha-miento de la variación genética de los cultivos para adquirir, utilizar y reciclar eficientemente el P (EUP) (Irfan et al., 2020; Raboy, 2020; Zou et al., 2022). Un cultivo más eficiente en su uso es aquel que adquiere más P de formas potencialmente menos lábiles en el suelo, recicla el P interno (removilización), incrementa la eficiencia foto-sintética para sustentar una adecuada producción y partición de materia seca y P entre sus diferentes órganos y prioriza su utilización metabólica antes de almacenarlo en la semilla como ácido fítico (Abbas et al., 2018; Cong et al., 2020). Este compuesto (myo-inositol hexa-kisfosfato IP6), es una forma de P no disponible para el hombre y animales monogástricos (Raboy, 2020); además, tiene actividad antinutricional, debido a su habilidad de conformar compuestos insolubles con nutrientes (zinc, hierro y calcio) y proteínas que, bajo condiciones fisiológicas no son asimilables por el organismo (Cong et al., 2020).
En suelos con una limitada biodisponibilidad de P, el cultivo regula la removilización de materia seca y P para asegurar una adecuada absorción y asimilación del carbono (C) (Brown et al., 2019; Barman et al., 2025); sin embargo, el ciclaje interno de P y C también ocurre durante el periodo reproductivo y es crítico para mantener la EUP (Cong et al., 2020; Zou et al., 2022). Durante este lapso, el cultivo regula la eficiencia en la utilización fisiológica de sus reservas, mediante la removilización gradual de la materia seca y P acumulado en hojas y tallos hacia la semilla en desarrollo (Brown et al., 2019; Irfan et al., 2020) y la absorción de P durante el llenado del grano (Wang et al., 2020; Barman et al., 2025). La contribución de ambas fuentes, sin embargo, depende del cultivo y las condiciones de creci-miento, especialmente cuando prevalece una deficiencia de P y el tejido vegetal senesce (Abbas et al., 2018). Diversos autores señalan que el P removilizado de los órganos vegetativos a la semilla representa entre 25 y 30 % del total contenido en la planta (Xie et al., 2018). En maíz, el tallo moviliza entre 50 a 76 % del P hacia el grano en desarrollo, mientras que las hojas contribuyen entre 30 y 44 % (Wang & Ning, 2019; Wang et al., 2020; Barman et al., 2025); además, el proceso de removilización se asocia con la senescencia foliar, la cual suministra el P (~ 50 %) necesario para los órganos reproductivos en crecimiento (Abbas et al., 2018). El incremento de la eficiencia interna de P depende de la producción de biomasa y su partición durante la semilla en desarrollo (Abbas et al., 2018; Guo et al., 2025). Una disminución de la disponibilidad de P afecta el crecimiento, la fotosíntesis, la fijación y exportación de C entre órganos de la planta (Mo et al., 2019; Irfan et al., 2020). El reciclaje de P y la partición de C son determinantes en la eficien-cia fisiológica y responsables de las diferencias inter e intraespecíficas del aprovechamiento interno de P (Xie et al., 2018). De manera particular, en el maíz nativo de Michoacán, México existe variabilidad genética para la eficiente utilización de P en suelos ácidos (Bayuelo-Jiménez & Ochoa-Cadavid, 2018), pero se desconocen los patrones de acumulación y removilización de biomasa y P que regulan la eficiencia en su utilización interna, particularmente durante la etapa reproductiva. Por ello, se evaluó la dinámica de acumulación, partición y remo-vilización de materia seca y P en maíz nativo y su relación con la eficiente utilización interna del nutriente en un Andosol. La hipótesis plantea que una mayor acumulación de materia seca y un adecuado reciclaje interno del fósforo (remo-vilización) adquirido, propiciará una mayor eficiencia fisiológica de P en ambientes con una reducida biodisponibilidad del nutriente.
2. Metodología
2.1 Germoplasma, sitio de estudio y condicio-nes de crecimiento
El estudio incluyó seis genotipos de maíz: tres genotipos de maduración precoz (de 83 a 85 d; Tzu-7, Cimmuy-1 y Macho-1) y tres tardíos (de 87 a 96 d; Corupo-99, DP × Tromba y Macho-5) de reconocida eficiencia en el uso de P (Bayuelo-Jiménez & Ochoa-Cadavid, 2018) y provenientes del Programa de Mejoramiento del Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias (INIFAP) situado en el centro de Michoacán, México. El clima de la zona es templado subhúmedo con lluvias en verano [C (w2) (w)]; a una altura de 2100 msnm y precipitación media anual de 1100 mm (INEGI, 2017). El suelo es de origen volcánico (Andosol) con alta adsorción de fosfatos (> 80 %) debido a la presencia de materiales no cristalinos (alófano, imogolita y ferredoxina) (Soil Survey Staff, 1999). En general, el uso del suelo es de naturaleza forestal y agrícola (INEGI, 2017).
El estudio se realizó en el municipio de Pátzcuaro (19° 23’ LN y 101° 25’ LO), Michoacán, México, en condiciones de temporal durante el periodo junio-diciembre de 2023. Se eligió un diseño de bloques completos al azar con tratamientos dispuestos en parcelas divididas replicado tres veces. La dosis de P correspondió a la parcela principal y las variedades a las subparcelas, aleatorizadas en las mismas. Los surcos de 6 m de longitud por variedad, constituyeron la unidad experimental. Las semillas, separadas entre sí a 25 cm, se sembraron a 6 cm de profundidad. En cada unidad experimental, se suministró P2O5 proveniente de superfosfato triple, con una dosis reducida (25 kg ha-1) y otra óptima (50 kg ha-1). La fuente de nitrógeno (urea), por otro lado, se adicionó a la siembra y floración con una dosis de 60 kg N ha-1 cada una.
2.2 Componentes de eficiencia en la utilización de fósforo
Durante el crecimiento vegetativo y reproductivo, se muestrearon tres plantas por nivel de P por genotipo. En la etapa vegetativa, las muestras se obtuvieron de la sexta (V6), octava (V8) y décima segunda hoja madura (V12). En la etapa reproductiva, provinieron de la panícula (VT), estigmas visibles (R1), ampolla (R2), lechosa (R3), dentada (R5) y madurez fisiológica (R6). Se obtuvo el peso seco de órganos vegetativos (raíz y vástago) y reproductivos (espiga y semilla) de muestras deshidratadas a 60 ºC por 72 h. Submuestras de 70 mg del tejido molido de cada órgano, se calcinaron en una mufla (CEM®, MAS-7000, USA) a 500 ºC por 10 h. Las cenizas se digirieron con HCl 100 mM y filtraron con papel Whatman No. 1 para luego evaluar la concen-tración de P inorgánico (mg P g-1) por el método colorimétrico de Murphy & Riley (1962).
El P acumulado en cada órgano (mg g-1) se obtuvo a partir de la multiplicación de la concentración de P y el peso seco. La removilización de materia seca (g por planta) y P (mg por planta) se estimó como la diferencia de materia seca o P contenido en el vástago entre R1 (estigma visible) y R6 (madurez fisiológica) (Zhang et al., 2022). La contribución de materia seca removida a la semilla (%) se calculó como la relación entre la materia seca movilizada del vástago y la materia seca acumulada en la semilla (Zhang et al., 2022). Similarmente, se utilizó la relación entre el P movilizado del vástago y el contenido de P en semilla para estimar la contribución de P removido a la semilla (%) (Zhang et al., 2022). La eficiencia en la utilización de P (EUtP) (g PS mg-1 P) de raíz, vástago y semilla se obtuvo mediante la relación del peso seco total y P total acumulado en la planta (Fageria, Baligar & Li, 2008). El índice de cosecha (IC) se estimó dividiendo el peso seco de la semilla entre el peso seco total de la planta. Además, se utilizó la relación entre el P acumulado en semilla y el contenido de P total para estimar de acumulación de P (IAP).
2.3 Análisis estadístico
Se realizaron pruebas de F mediante proce-dimiento GLM de SAS (SAS, 2011) para verificar las diferencias significativas entre cada una de las variables incluidas. Para la comparación de las diferencias identificadas con el análisis de varianza, se utilizó la prueba protegida DMS (Diferencia mínima significativa) de Fisher (SAS, 2011). Además, se realizó un análisis de correlación de Pearson entre la eficiencia en la utilización de P y componentes.
3. Resultados y discusión
3.1 Acumulación, partición y removilización de materia seca
La deficiencia de fósforo (BP) no afectó la acumulación y partición de materia seca total de la planta (p ≤ 0,001) (Figura 1), similar a lo señalado en maíz (Zhang et al., 2022; Barman et al., 2025) con similar proporción de biomasa asig-nada entre órganos vegetativos y reproductivos durante la ontogenia del cultivo. Las diferencias en la materia seca total acumulada, se debieron al tipo de madurez de los genotipos estudiados (Figura 1). De la etapa vegetativa V6 a V8, los genotipos precoces (Tzu-7, Cimmyt-1 y Macho-1) acumularon más biomasa (0,33 a 0,78 g planta-1) que los genotipos tardíos (Corupo-99, DP × Tromba y Macho-5) (0,33 a 0,61 g planta-1) (Datos no mostrados). Por el contrario, éstos últimos exhibieron una alta acumulación de materia seca en el vástago (de 43% a 23%) durante la etapa reproductiva (VT a R5). En los genotipos precoces, el peso seco del vástago varió de 85 a 159 g planta-1 y en los genotipos tardíos, de 123 a 196 g planta-1 (Figura 1). El peso seco de la raíz incrementó de 21 a 33 g planta-1 y 28 a 51 g planta-1, respectivamente. Por el contrario, el peso seco de la semilla no difirió entre grupos de madurez y dosis de P a la madurez fisiológica (Tabla 1). En los genotipos precoces, el 20% y 19% de la biomasa removilizada al grano derivó de la materia seca del vástago acumulada en R1, mientras que, en genotipos tardíos, la proporción fue menor (18% y 15%), en AP y BP. Las evidencias señalan que el mantenimiento de la actividad fotosintética aún después de que ocurre la floración (R1), asegura una mayor absorción de P, acumulación de materia seca y rendimiento (Zhang et al., 2022; Li et al., 2022). Una eficiente adquisición de P antes y después de la floración es determinante para regular la utilización del nutriente durante el crecimiento de los órganos vegetativos y reproductivos (Yuang et al., 2024). Similarmente, una eficiente movilización de los fotosintatos producidos y los carbohidratos almacenados en órganos vegetativos es esencial durante el llenado del grano (Fan et al., 2023).
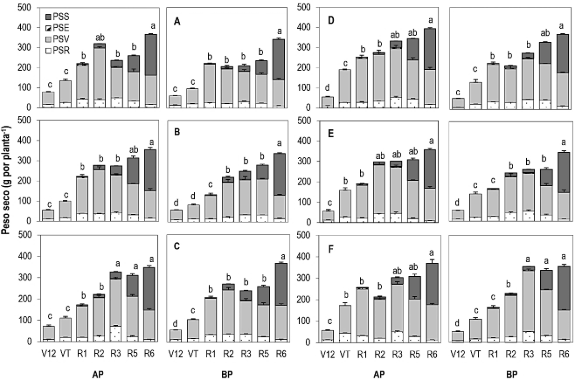
Figura 1. Peso seco de la raíz (PSR), vástago (PSV), espiga (PSE) y semilla (PSS) en maíz precoz (A: Tzu-7, B: Cimmyt-1, C: Macho-1) y tardío (D: Corupo-99), E: DP × Tromba, F: Macho-5) cultivado con reducida (BP) y óptima fertilización (AP) fosforada (25 y 50 kg P2O5 ha-1). Las letras sobre las barras indican diferencias significativas entre etapas fenológicas para el peso seco total (Prueba DMS protegida de Fisher, p ≤ 0,05). La barra representa el error estándar (n = 3).
Tabla 1
Peso seco e índice de cosecha a madurez fisiológica en maíz cultivado con diferente dosis de fósforo en Pátzcuaro, Michoacán.
| | Peso seco de semilla | | Peso seco de vástago | | Peso seco total | Índice de cosecha |
| | g por planta-1 |
Genotipo | Madurez | BP | AP | | BP | AP | | BP | AP | BP | AP |
Tzu-7 | Precoz | 201,0a | 204,3a | | 130,9b | 147,6b | | 343,5b | 366,9b | 0,59a | 0,56a |
Cimmyt-1 | Precoz | 204,9a | 203,7a | | 113,6c | 136,5b | | 366,7a | 355,1b | 0,61a | 0,57a |
Macho-1 | Precoz | 195,4a | 199,3a | | 129,3b | 137,4b | | 337,8b | 347,6c | 0,58a | 0,57a |
Corupo-99 | Tardío | 188,0b | 201,6a | | 165,1a | 174,5a | | 367,6a | 393,5a | 0,51b | 0,51b |
DP × Tromba | Tardío | 199,4a | 190,7a | | 134,3b | 159,0b | | 344,4b | 359,1b | 0,58a | 0,53a |
Macho-5 | Tardío | 203,4a | 193,8a | | 138,0b | 164,3a | | 354,3b | 369,8b | 0,57a | 0,52a |
DMS 0,05 fósforo | 12.5 | 11,3 | | 7,5 | 9,2 | | 14,9 | 17,6 | 0,11 | 0,12 |
DMS 0,05 genotipos | 8.8 | 9,3 | | 11,1 | 11,7 | | 10,5 | 11,1 | 0,02 | 0,03 |
DMS 0,05 precocidad | 5.5 | 5,9 | | 23,1 | 24,7 | | 10,3 | 11,8 | 0,21 | 0,19 |
Medias con letras iguales en cada columna, no son estadísticamente diferentes (Prueba DMS Protegida de Fisher, p ≤ 0,05).
3.1 Acumulación, partición y removilización de fósforo
A diferencia de la biomasa, las plantas mostraron un patrón diverso de acumulación de P (Figura 2). Durante el desarrollo de la semilla (de R1 a R5), las plantas acumularon más P en ambientes de AP que en condiciones limitantes (BP). En etapa de ampolla (R2), la mayor acumulación de P se registró en el vástago de los genotipos precoces (296 y 340 mg por planta), mientras que, en los de maduración tardía sucedió en etapa lechosa (R3) (360 y 384 mg por planta) (Figura 2). Similar-mente, en los genotipos precoces, el vástago removilizó una mayor proporción de P a la semilla (24% y 21%) en comparación a los tardíos (18% y 15%) en AP y BP. Los resultados demostraron que el vástago suministró el P necesario para el desarrollo de la semilla. El incremento en la acumulación de P en la semilla (de 528 a 1008 mg por planta) ocurrió a expensas de un decremento en el contenido P en el vástago (de 302 a 111 mg por planta). Este patrón, sin embargo, no difirió entre grupos de precocidad a madurez fisiológica. El IAP en la semilla fue de 90% en genotipos precoces y de 87% en genotipos tardíos (Tabla 2). Según Zhang et al. (2022) y Barman et al. (2025), los cereales movilizan entre 40% y 80% del P contenido en órganos vegetativos, lo que corrobora, en parte, la proporción alcanzada en estos órganos. Otro aporte importante (19% al 50%) proviene del tejido senescente (Abbas et al., 2018; Guo et al., 2025). O bien, del P absorbido en condiciones limitantes (Brindaban et al., 2020; Wang et al., 2020).
Los resultados revelan que la diferencia en la proporción de P distribuido entre los órganos obedece a los requerimientos del cultivo y las condiciones de crecimiento (El Mazlouzi et al., 2022; Wang et al., 2020). De tal forma que la deficiencia de P en el suelo puede modificar los patrones de acumulación y distribución entre los órganos vegetativos de la planta (Zhang et al., 2022). Por ejemplo, en condiciones de BP, las raíces de frijol (Phaseolus vulgaris L.) son capaces de retener hasta el 80% del P adquirido, mientras que, en condiciones óptimas (AP), la acumulación disminuye a 20% (Snapp & Lynch, 1996). Lo anterior puntualiza que la raíz prioriza la retención de C y P cuando la disponibilidad en el ambiente externo es limitante y es necesario mantener su funcionalidad en fases críticas del desarrollo.
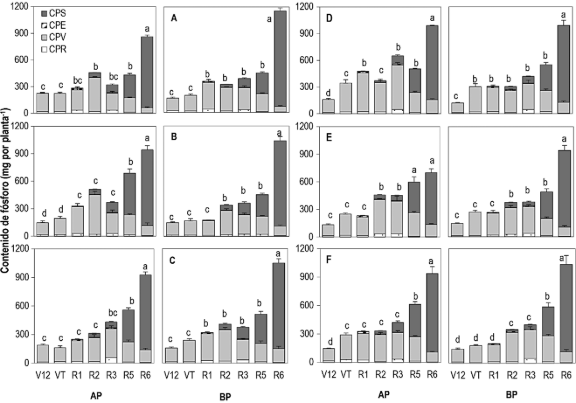
Figura 2. Contenido de fósforo en raíz (PSR), vástago (PSV), espiga (PSE) y semilla (PSS) en maíz precoz (A: Tzu-7, B: Cimmyt-1, C: Macho-1) y tardío (D: Corupo-99), E: DP × Tromba, F: Macho-5) cultivado con reducida (BP) y óptima fertilización (AP) fosforada (25 y 50 kg P2O5 ha-1). Las letras sobre las barras indican diferencias significativas entre etapas fenológicas para el contenido total de fósforo (Prueba DMS protegida de Fisher, p ≤ 0,05). La barra representa el error estándar (n = 3).
Tabla 2
Concentración, contenido e índice de acumulación de fósforo (IAP) a madurez fisiológica en maíz cultivado con diferente dosis de fertilización fosforada en Pátzcuaro, Michoacán
| | | Concentración de fósforo | | Contenido de fósforo | | IAP |
Genotipos | Tipo | | Semilla | | Vástago | | Semilla | | Vástago | | Semilla |
| mg g-1 | | | mg planta-1 |
| BP | AP | | BP | AP | | BP | AP | | BP | AP | | BP | AP |
Tzu-7 | Precoz | | 5,4a | 3,9a | | 0,48c | 0,36c | | 1094a | 800a | | 62,2c | 53,7d | | 94,2a | 92,3a |
Cimmyt-1 | Precoz | | 4,5b | 4,1a | | 0,90a | 0,80ab | | 927b | 826a | | 102,6bc | 109,0c | | 89,2b | 87,7b |
Macho-1 | Precoz | | 4,6b | 3,9a | | 0,91a | 0,97a | | 901b | 787a | | 104,6bc | 133,5b | | 89,2b | 88,4b |
Corupo-99 | Tardío | | 4,6b | 4,1a | | 0,74b | 0,86a | | 862b | 831a | | 122,2a | 150,7a | | 87,2b | 84,1b |
DP × Tromba | Tardío | | 3,8c | 2,9b | | 0,76b | 0,85a | | 833b | 561b | | 102,5bc | 135,1b | | 87,6b | 80,2c |
Macho-5 | Tardío | | 4,5b | 4,3a | | 0,83a | 0,64b | | 916b | 828a | | 113,8b | 105,7c | | 88,4b | 88,3b |
DMS 0,05, fósforo | | 0,42 | 0,48 | | 0,05 | 0,07 | | 111 | 123 | | 13,6 | 14,6 | | 0,2 | 0,3 |
DMS 0,05, genotipos | | 0,29 | 0,31 | | 0,08 | 0,09 | | 78 | 82 | | 9,6 | 10,1 | | 1,4 | 1,3 |
DMS 0,05, precocidad | | 0,32 | 0,33 | | 0,14 | 0,14 | | 71 | 75 | | 20,5 | 20,9 | | 2,9 | 3,3 |
| | | | | | | | | | | | | | | | | | |
Medias con letras iguales en cada columna, no son estadísticamente diferentes (Prueba DMS Protegida de Fisher, p ≤ 0,05).
3.3 Adquisición y partición de fósforo
La movilización de la reserva de P acumulado en la semilla es crucial durante las primeras etapas de crecimiento del maíz (Raboy, 2020). En etapa de plántula, la concentración de P varía de 2,9 a 4,5 mg g-1 (Nadeem et al., 2011). Dicho valor es similar a la reserva de P (> 5,0 mg g-1) obtenida durante el desarrollo de la cuarta (V4) y sexta (V6) hoja (datos no mostrados). La alta concentración de P en raíz (2,4 a 3,3 mg g-1) y vástago (2,9 a 4,5 mg g-1) es una señal de la eficiencia de la raíz para adquirir el P del suelo y del vástago para utilizarlo. En etapas avanzadas del crecimiento (V12 y VT), la concentración de P en el vástago decreció (de 4,3 a 2,7 mg g-1 en AP y de 4,2 a 3,2 mg g-1 en BP) debido a la disminución en su absorción y movilización hacia hojas jóvenes y órganos repro-ductivos en crecimiento. Durante el crecimiento reproductivo, la concentración de P en la espiga varió de 2,8 a 1,6 mg g-1 en AP y de 2,5 y de 3,1 a 1,6 mg g-1 en BP. En semilla, la concentración fue de 1,4 a 3,9 mg g-1 en AP y de 1,4 a 4,8 mg g-1. A madurez fisiológica, la concentración de P en semilla se distinguió por variaciones según la precocidad y dosis de P: de 4,9 y 4,0 mg g-1 en genotipos precoces y de 4,4 y 3,7 mg g-1 en genotipos tardíos, en BP y AP. Ambas concen-traciones dentro del valor crítico (2,4 a 6,4 mg g-1) reportado para maíz (Nadeem et al., 2011).
3.4 Eficiencia en la utilización del fósforo
La EUtP varió entre etapas fenológicas, precocidad y ambientes de P (Figura 3). En etapa VT, los genotipos precoces Tzu-1 y Cimmyt-1 mostraron la mayor EUtP en raíz (0.14 y 0.16 PSR mg-1 P) en AP. Lo contrario sucedió para EUtP del vástago, con una mayor proporción de P (55 y 44%) en R1 y R3. Macho-1 fue el más eficiente (53 y 43 PSV mg-1 P) seguido de Cimmyt-1 (de 0.54 a 0.38 PSR mg-1 P) (Figura 3). Interesantemente, en etapas R1 a R3, el genotipo tardío, DP x Tromba, exhibió la mayor EUtP en raíz en BP (de 0.54 a 48 PSR mg-1 P). En madurez fisiológica, se obtuvo la misma EUtP de la semilla (de 0.29 a 0.33 g PSS mg-1 P) en BP y AP.
La EUtP indica la cantidad de materia seca acumulada por la planta por unidad de P adquirido (Fageria, Baligar & Li, 2008). Este componente está subordinado a la partición de materia seca que se destina a la semilla (IC), el P que se distribuye hacia la semilla (IAP), la concentración de P en la semilla (PiS) y el peso seco total (PST) (Cong et al., 2020). Un incremento de la EUtP, depende de un mayor IC o IAP, o bien de la reducción en la PCi o PST. En este estudio, la EUtP de la semilla se asoció mayormente con IAP (r = -0.63*) y PiS (r = -0.85**) pero no con el IC (r = 0.27) y PST (r = 0.26) en BP. El IAP es la proporción de P total que se particiona a la semilla (Fageria, Baligar & Li, 2008). La correlación entre la EUtP e IAP en BP (r = -0.63*) señala la ineficiencia del cultivo para utilizar internamente el P adquirido en una mayor producción de grano. Por el contrario, la correlación entre el contenido de P en el vástago e IC (r = -0.65*; r = -0.41*), el contenido total de P y peso seco de la semilla (r = - 0.27, r = 0.50*) y el contenido de P en vástago e IAP (r = -0.66*; r = -0.72**) en BP y AP, evidencia la eficiencia en la utilización del nutriente para el crecimiento del vástago en detrimento de la semilla (Tabla 1). Además, la correlación negativa entre la EUtP y PiS (r = -0.85**) indicó que, la EUtP disminuye conforme se incrementa la concentración de P en la semilla (Bayuelo-Jiménez & Ochoa-Cadavid, 2018). Este hallazgo es importante debido a que, durante el desarrollo de la semilla, la demanda por C y P se intensifica (Zhang et al., 2022; Guo et al., 2025).
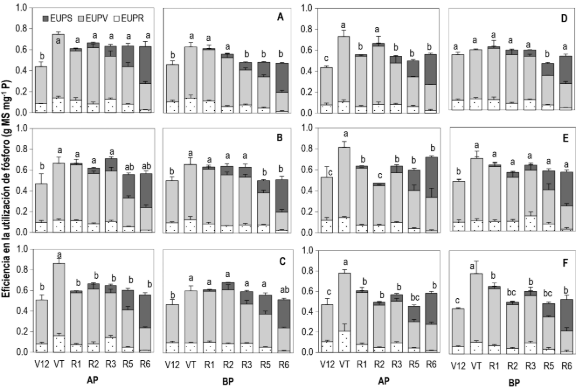
Figura 3. Eficiencia de la utilización de fósforo en raíz (EUP R), vástago (EUP V) y semilla (EUP S) en maíz precoz (A: Tzu-7, B: Cimmyt-1, C: Macho-1) y tardío (D: Corupo-99), E: DP × Tromba, F: Macho-5) cultivado con reducida (BP) y óptima fertilización (AP) fosforada (25 y 50 kg P2O5 ha-1). Las letras sobre las barras indican diferencias significativas entre etapas fenológicas para el contenido total de fósforo (Prueba DMS protegida de Fisher, p ≤ 0,05). La barra representa el error estándar (n = 3).
Una alta concentración de P en la semilla, sin embargo, puede tener repercusiones desfavo-rables en la nutrición humana y la calidad del suelo (Schneider et al. 2019). El ácido fítico promueve la deficiencia de micronutrientes (Zn y Fe) en la dieta humana y eutrofiza el suelo (Raboy, 2020). A la fecha, se ha explorado la variación genotípica en la concentración de ácido fítico en maíz (Raboy, 2020; Salazar-Mejía & Bayuelo-Jiménez, 2024) y la modificación de los procesos que regulan el transporte y la partición de P a la semilla en cereales (Raboy, 2020; Wang et al., 2024) como estrategias para reducir la acumulación del compuesto. El incremento de la removilización del P absorbido entre los diferentes órganos de la planta constituye un importante mecanismo que mejora la eficiencia interna del nutriente, particularmente en las últimas etapas de crecimiento y cuando la biodisponibilidad de P en el suelo es reducida (Brown et al., 2019; El Mazlouzi et al., 2022). Durante la etapa repro-ductiva, los genotipos tardíos produjeron mayor biomasa en el vástago en comparación a los precoces (Tabla 1), lo que se atribuye a un incremento en la removilización de P hacia nuevos sitios de crecimiento (hojas jóvenes y espigas) (Brown et al., 2019; Irfan et al., 2020) y al enriquecimiento de P en el vástago y la raíz (Bayuelo-Jiménez & Ochoa-Cadavid, 2018). El hecho de priorizar la removilización de P al vástago (tallo + hojas) favorece la eficiencia en la utilización del nutriente y prolonga la capacidad fotosintética del follaje y, consecuentemente, el periodo de captura de carbono requerido durante el desarrollo de la semilla (Assuero et al., 2004; Wang & Ning, 2019).
4. Conclusiones
La madurez del cultivo reguló la dinámica de acumulación, partición y removilización de materia seca y P en maíz. La maduración tardía favoreció la acumulación de materia seca en órganos vege-tativos (raíz + vástago) y reproductivos (espiga + semilla), pero redujo la removilización de materia seca del vástago al grano en desarrollo (15%). Por el contrario, la adquisición y acumulación de P durante el desarrollo de la semilla constituyó entre 82% y 88% del P total contenido en el grano. Esta proporción cubrió la demanda parcial de P y el remanente se movilizó del vástago (de 18% a 22%). En los genotipos precoces, la acumulación y partición de materia seca (20%) y P (19%) del vástago a la semilla en crecimiento no se modificó con las dosis de P, pero fue suficiente para suplir su demanda. En condiciones restrictivas de P, el cultivo regula la eficiencia interna del nutriente mediante una mayor partición de materia seca y removilización gradual de P hacia tejidos jóvenes y activos (vástago + raíz) durante el llenado del grano. Por el contrario, la aplicación de una dosis óptima de fertilización fosforada, favorece la acumulación de materia seca y P en el vástago, pero socava la eficiencia interna del nutriente al incrementar la acumulación de P en el grano.
La deficiencia de P en el suelo, la escasez de roca fosfórica y el alto costo del fertilizante impone una fuerte restricción a la producción agrícola presente y futura. Es necesario, por tanto, fortalecer el ciclaje de P en el suelo e identificar cultivos eficientes en el uso del recurso. Lo anterior, mediante la inclusión de cuatro estrategias que propicien: (i) eficiencia en la adquisición de P, eficiencia en el uso fotosintético de P, eficiencia en la utilización interna del nutriente y disminución en la concentración de ácido fítico en la semilla. Un incremento en la distribución de P en la planta se lograría a través de una efectiva removilización de P de tejidos senescentes y reduciendo la partición de P hacia la semilla. Estos cambios, a su vez, podrían incrementar el uso fotosintético de P en el tejido foliar y mejorar el estado nutricional del cultivo y rendimiento del grano. Los genotipos de maíz eficientes a P son, por tanto, un recurso genético imprescindible para reducir el uso de fertilizante e incrementar la calidad de la semilla en suelos ácidos con alta deficiencia de P.
Agradecimientos
El estudio fue financiado por la Coordinación de Investigación Científica de la Universidad Michoacana de San Nicolás de Hidalgo. 6.11/2023-2024.
Referencias bibliográficas
Abbas M., Shah, J. A., Irfan, M., & Memon, Y. (2018). Remobilization and utilization of phosphorus in wheat cultivars under induced phosphorus deficiency. Journal of Plant Nutrition, 41, 1512-1523. https://doi.org/10.1080/01904167.2018.1458871
Assuero S. G., Mollier, A., & Pellerin, S. (2004). The decrease in growth of phosphorus-deficient maize leaves is related to lower cell production. Plant Cell & Environment, 27, 887-8985. https://doi.org/10.1111/j.1365-3040.2004.01194.x
Bayuelo-Jiménez, J. S., & Ochoa-Cadavid, I. (2018). Interacción Genotipo x Ambiente para Eficiencia en el Uso de Fósforo en Maíz Nativo de la Meseta Purhépecha. Revista Fitotecnia Mexicana, 41(1), 39-47. https://doi.org/10.35196/rfm.2018.1.39-47
Barman, A., Pooniya, V., Zhiipao, R. R., Biswakarma, N., Kumar, D., Das, K., ... & Dutta, S. (2025). Pre-and post-anthesis dry matter and nutrient accumulation, partitioning, remobilization and crop productivity of maize under the long-term integrated crop management practices. European Journal of Agronomy, 164, 127527. https://doi.org/10.1016/j.eja.2025.127527
Brindabran P. S., Dimkpa., C. O., & Pandey, R. (2020). Exploring phosphorus fertilizers and fertilization strategies for improved human and environmental health. Biology and Fertility of Soils, 56, 299-317. https://doi.org/10.1007/s00374-019-01430-2
Brown H. E., Hunth., N. I., Holzworth, D. P., Teixeira., E. I. Wang., R. F. Zyskowski, E., & Zheng, B. (2019). A genetic approach to modelling, allocation and redistribution of biomass to and from plant organs. in silico Plants, 1(1). diy004, https://doi.org/10.1093/insilicoplants/diy004
Cong W. F., Suriyagoda., L. D. B., & Lambers, H. (2020). Tightening the phosphorus cycle through phosphorus-efficient crop genotypes. Trends in Plant Science, 25, 967-975. https://doi.org/10.1016/j.tplants.2020.04.013
El Mazlouzi, M., Morel, C., Robert, T., Chesserom, C., Salon, C., Cornu, J., & Mollier, A. (2022). The dynamics of phosphorus uptake and remobilization during the grain development period in durum wheat plants. Plants, 11(8). 1006. https://doi.org/10.3390/plants11081006
Fan, P., Ming, B., Evers, J. B., Li, Y., Li, S., Xie, R., & Anten, N. P. (2023). Nitrogen availability determines the vertical patterns of accumulation, partitioning, and reallocation of dry matter and nitrogen in maize. Field Crops Research, 297, 108927. https://doi.org/ 10.1016/j.fcr.2023.108927
Fageria N. K., Baligar, V. C., & Li, Y. C. (2008). The role of nutrient efficient plants in improving crop yields in the twenty first century. Journal of Plant Nutrition, 31, 1121-1157. https://doi.org/10.1080/01904160802116068
Guo, H. L., Tian, M. Z., Ri, X., & Chen, Y. F. (2024). Phosphorus acquisition, translocation, and redistribution in maize. Journal of Genetics and Genomics, 52, 287-296. https://doi.org/10.1016/j.jgg.2024.09.018
Instituto Nacional de Estadística, Geografía e Informática (INEGI). (2017). Anuario estadístico y geográfico de Michoacán de Ocampo. México: INEGI.
Irfan M., Aziz, T., Maqsood, M., Bilal, H. M., Siddique, K. H. M., & Xu, M (2020). Phosphorus (P) use efficiency in rice is linked to tissue-specific biomass and P allocation patterns. Scientific Reports, 10, 4278. https://doi.org/10.1038/s41598-020-61147-3
Li, R., Hu, D., Ren, H., Yang, Q., Dong, S., Zhang, J., … & Liu, P. (2022). How delaying post-silking senescence in lower leaves of maize plants increases carbon and nitrogen accumulation and grain yield. J. Crop Science, 10(3), 853–863. https://doi.org/10.1016/j.cj.2021.11.006.
Mo, Q., Li, Z. A., Sayer, E. J., Lambers, H., Li, Y., Zou, B. I., … & Wang, F. (2019). Foliar phosphorus fractions reveal how tropical plants maintain photosynthetic rates despite low soil phosphorus availability. Functional Ecology, 33(3), 503-513. https://doi.org/10.1111/1365-2435.13252
Murphy J., & Riley, J. (1962). A modified single solution method for the determination of phosphate in natural waters. Analytical Chemical Acta, 27, 31-36. https://doi.org/10.1016/S0003-2670(00)88444-5
Nadeem M., Mollier, A., Morel, C., Vives, A., Prud´Homme, L., & Pellerin, S. (2011). Relative contribution of seed phosphorus reserves and exogenous phosphorus uptake to maize (Zea mays L.) nutrition during early growth stages. Plant and Soil, 346, 231-244, https://doi.org/10.1007/s11104-011-0814y
Raboy, V. (2020). Low phytic acid crops: observations based on four decades of research. Plants-Basel, 53, 27-36. https://doi.org/10.3390/plants9020140
Salazar-Mejía, S.G., & Bayuelo-Jiménez, J.S. (2024). Estrategia para optimizer la reserva de fósforo en el suelo: Un estudio basado en la diversidad de maíces nativos de México y selección de genotipos. Scientia Agropecuaria, 15(3), 349-359. https://doi.org/10.17268/sci.agropecu.2024.026
SAS. (2011). SAS User's Guide: Statistics. SAS. Institute, Inc. Cary, North Carolina, USA.
Schneider K. D., Martens, J. R. T., Zvomuya, F., Reid, D. K., Fraser, T. D., Lynch, D. H., O´Halloran, I., & Wilson, H. F. (2019). Options for improved phosphorus cycling and use in agriculture at the field and regional scales. Journal of Environmental Quality, 48, 1247-1264. https://doi.org/10.2134/jeq2019.02.0070
Snapp, S. S. & Lynch, J. P. (1996). Phosphorus distribution and remobilization in bean plants as influenced by phosphorus nutrition. Crop Science, 36, 929-935. https://doi.org/10.2135/cropsci1996.0011183X003600040019x
Soil Survey Staff. (1999). Soil Taxonomy: a basic system of soil classification for making and interpreting soil survey. Agriculture Handbook 436. 2nd edition. Natural Resources Conservation Service. United Department of Agriculture. Washington, DC.
Wang, F., Cui, P. J., Tian, Y., Huang, Y., Wang, H. F., Liu, F., & Chen, Y. F. (2020). Maize ZmPT7 regulates Pi uptake and redistribution which is modulated by phosphorylation. Plant Biotechnology Journal, 18, 2406e2419. https://doi.org/10.1111/pbi.13414
Wang, C., & Ning, P. (2019). Post-silking phosphorus recycling and carbon partitioning in maize under low and high phosphorus inputs and their effects on grain yield. Frontiers in Plant Science, 10, 784. https://doi.org/10.3389/fpls.2019.00784
Xie, X., Li, R., Zhang, Y., Shen, S., & Bao, Y. (2018). Effect of elevated [CO2] on assimilation, allocation of nitrogen and phosphorus by maize (Zea mays L.) Communications in Soil Science and Plant Analysis, 49, 1032-1044. https://doi.org/10.1080/00103624.2018.1448413
Yuan, M., Wu, G., Wang, J., Liu, C., Hu, Y., Hu, R., ... & Sun, Y. (2024). Blended controlled-release nitrogen fertilizer increases rice post-anthesis nitrogen accumulation, translocation and nitrogen-use efficiency. Frontiers in Plant Science, 15, 1354384. https://doi.org/10.3389/fpls.2024.1354384.
Zhang W. H. Li., Zhang, J., Shen, J., Brown, H., & Wang, E. (2022). Contrasting patterns of accumulation, partitioning, and remobilization of biomass and phosphorus in a maize cultivar. The Crop Journal, 10, 254-261. https://doi.org/10.1016/j.cj.2021.02.014
Zou, T., Zhang, X., & Davidson, E.A. (2022). Global trends of cropland phosphorus use and sustainability challenges. Nature 611, 81e87. https://doi.org/10.1038/s41586-022-05220-z