Elaboración de un filtrante de hojas secas de Borago officinalis L. “borraja”, determinación de su contenido de polifenoles y capacidad antioxidante
Preparation of a filter from dried leaves of Borago officinalis L. “borage”, determination of its polyphenol content and antioxidant capacity
Teresita de Jesús Chiroque-Reyes1 *; Oscar Pedro Santisteban-Rojas1; César Máximo Fuertes-Ruitón2; Scila Reategui-Sanchez1; Raul German Pizarro-Cabrera1
1 Universidad Nacional Mayor de San Marcos, Facultad de Química e Ingeniería Química. Lima, Perú.
2 Universidad Nacional Mayor de San Marcos, Facultad de Farmacia y Bioquímica. Lima, Perú.
ORCID de los autores:
RESUMEN
Esta investigación buscó obtener las condiciones ideales de secado de las delicadas y frágiles hojas de borraja, elaborar un filtrante y determinar el contenido poli fenólico total y la capacidad antioxidante en la infusión del filtrante. Para ello, se deshidrataron las hojas frescas de borraja. Se prepararon infusiones de hojas frescas enteras y cortadas, hojas secas enteras y molidas (filtrante). Todas las infusiones contenían el equivalente a 1 g hoja seca en 250 mL de infusión. La concentración de polifenoles totales se determinó con el reactivo de Folin Ciocalteau, expresando los resultados en equivalente de ácido gálico. La capacidad antioxidante se determinó mediante los métodos DPPH y ABTS expresando resultados en su equivalente Trolox. Los resultados de polifenoles totales en infusiones de hojas frescas (enteras y cortadas), secas enteras y en filtrante fueron 9,60, 28,08, 26,59 y 10,75 mg ácido gálico/g hoja seca, respectivamente. La capacidad antioxidante frente al radical DPPH fueron 19,27 (hoja fresca entera), 58,56 (hoja fresca en trozos o cortada), 39,06 (hoja seca entera) y 13,83 (filtrante) mg Trolox/g hoja seca. La capacidad antioxidante frente al radical ABTS fueron 13,85 (hoja fresca entera), 53,74 (hoja fresca en trozos o cortada), 55,37 (hoja seca entera) y 21,78 (filtrante) en mg Trolox/g hoja seca. El filtrante cumplió con la normativa microbiológica y recibió una valoración sensorial positiva, sugiriendo su viabilidad comercial. Se concluye que el filtrante de hojas secas molidas de borraja es una fuente accesible y manejable de antioxidantes, con potencial para su comercialización.
Palabras clave: Borago officinalis L.; DPPH; ABTS; polifenoles totales; infusión; filtrante.
ABSTRACT
This research sought to obtain the ideal drying conditions for the delicate and fragile borage leaves, to develop a filter and to determine the total polyphenolic content and antioxidant capacity in the filter infusion. To do this, fresh borage leaves were dehydrated. Infusions of fresh whole and cut leaves, whole and ground dried leaves (filter) were prepared. All infusions contained the equivalent of 1 g of dry leaf in 250 mL of infusion. The concentration of total polyphenols was determined with the Folin Ciocalteau reagent, expressing the results in gallic acid equivalent. The antioxidant capacity was determined by the DPPH and ABTS methods, expressing results in their Trolox equivalent. The results of total polyphenols in infusions of fresh leaves (whole and cut), whole dried leaves and in filter were 9.60, 28.08, 26.59 and 10.75 mg gallic acid/g dry leaf, respectively. The antioxidant capacity against the DPPH radical was 19.27 (whole fresh leaf), 58.56 (fresh leaf in pieces or cut), 39.06 (whole dry leaf) and 13.83 (filter) mg Trolox/g dry leaf. The antioxidant capacity against the ABTS radical was 13.85 (whole fresh leaf); 53.74 (fresh leaf in pieces or cut), 55.37 (whole dry leaf) and 21.78 (filter) in mg Trolox/g dry leaf. The filter complied with the microbiological regulations and received a positive sensory evaluation, suggesting its commercial viability. It is concluded that the filter of ground dried borage leaves is an accessible and manageable source of antioxidants, with potential for commercialization.
Keywords: Borago officinalis L.; DPPH; ABTS; total polyphenols; infusion; filter.
1. Introducción
Borraja, Borago officinalis L., pertenece a la familia botánica de las Boraginaceae Juss., género Borago L., especie Borago officinalis L. Tiene múltiples nombres comunes, entre ellos, borago, lengua de buey o de vaca, borrajo y borraja como se le conoce en nuestro país. La borraja es originaria de Europa. del norte de África y Sudamérica, en nuestro país crece en la zona andina de la región Piura, Junín y Huancavelica entre 10 - 3500 msnm.
En Perú, los habitantes de las zonas andinas y sus descendientes siguen utilizando borraja como planta medicinal para afecciones bronquiales entre otras. Es de conocimiento público que los habitantes de las ciudades costeras y centros urbanos se encuentran en la búsqueda de productos naturales que les ayuden a mantener la salud, disponibles y accesibles para su consumo, borraja contiene nutrientes y otros metabolitos secundarios. Diversas investigaciones sostienen que las hojas de borraja contienen sustancias con propiedades antioxidantes, tales como, vitamina E: 2,86 mg/100 g borraja cruda, ácido ascórbico (vitamina C) 35 mg/100 g, provitamina A, equivalente a 210 µg retinol (0,21 mg), taninos 3% y polifenoles.
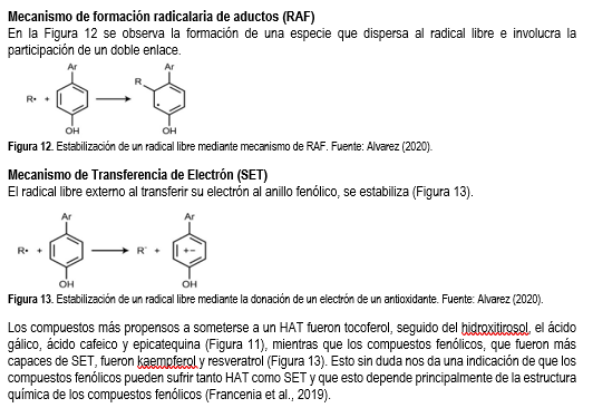
La presente investigación buscó determinar el contenido de polifenoles y la capacidad antioxi-dante en un filtrante de un gramo de hojas secas de borraja empleando los reactivos adecuados para determinar esta actividad y así sustentar científicamente su beneficio ante un potencial consumo humano, los reactivos fueron Folin Ciocalteu, que es específico para determinar polifenoles, DPPH y ABTS, adecuados para determinar compuestos antioxidantes en general, por su propiedad de anular a estos radicales libres (tocoferoles, polienos, ácido ascórbico, etc.) por eso presentamos la composición de estos reactivos y los mecanismos de las especies químicas involucradas en esta investigación. Empleamos al ácido rosmarínico (Bandonien & Murkovic, 2002) como prototipo, los flavonoides, quercetina, rutina, carotenos, ácidos grasos insaturados como el ácido gamma linolénico. A continuación, presentamos los fundamentos de las determinaciones.
Método de Folin Ciocalteu
El reactivo está compuesto por una mezcla de wolframato sódico y molibdato sódico en ácido fosfórico (Figura 1).
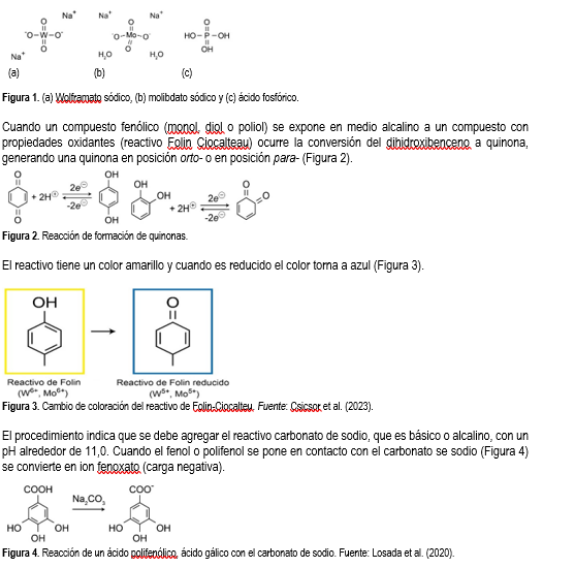

Carotenoides
Los carotenoides presentes en las hojas de borraja reaccionan como agentes antioxidantes a través de los tres mecanismos: el primero es el SET, el segundo por la formación de un aducto y el tercero por HAT. Generalmente, las propie-dades antioxidantes de los carotenoides están vinculadas a su alta capacidad para donar electrones. El β-caroteno reacciona con el NO2• a través de SET (Francenia et al., 2019).
Una investigación sobre la reactividad de los carotenoides con los radicales fenoxi mostraron que el orden de reactividad: licopeno > β-caroteno > zeaxantina > luteína > equinenona >Astaxantina (Francenia et al., 2019).
2. Metodología
Las hojas de muchos vegetales contienen además de nutrientes, sustancias antioxidantes. En la presente investigación realizamos la siguiente metodología de trabajo.
2.1. Sustancias químicas y reactivos
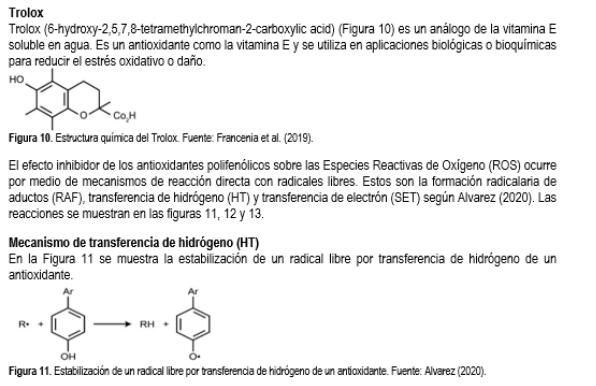
2,2 difenil-1-picril hidrazilo (DPPH), ácido 2,2'-azino-bis(3-etilbenzotiazolina-6-sulfónico)(ABTS), ácido 6-hidroxi-2,5,7,8- tetrametil-chroman-2-carboxílico (Trolox), reactivo de Folin Ciocalteu, ácido gálico, carbonato de sodio y etanol.
2.2. Materia vegetal, curvas de secado y prepa-ración de las muestras
La adecuación de la muestra fue realizada a partir de 20 kg de la planta de borraja procedente de las zonas altoandinas de la región Huancavelica, mediante la selección visual previa. Luego de lavarse, seleccionarse y separase, las hojas secadas a diferentes temperaturas obteniendo las curvas de secado en base seca y húmeda que se observan en las figuras 19 y 20.
2.2.1. Curvas de secado de hojas frescas de borraja
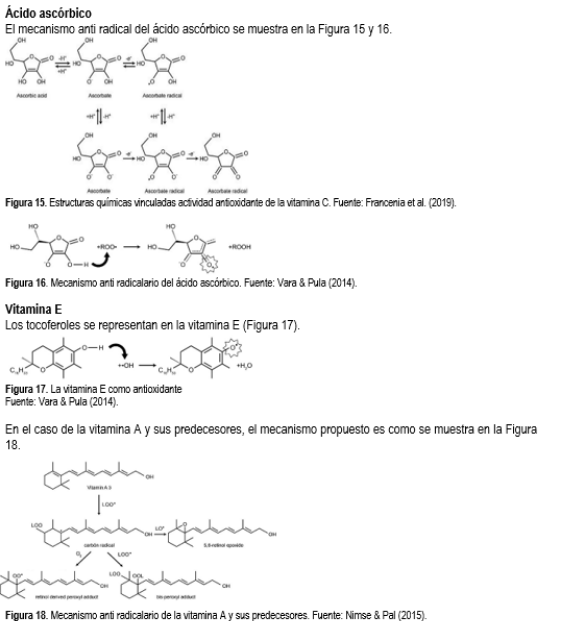
La Figura 19 muestra la variación de la humedad en kg de agua por kg de sólido seco en función al tiempo a diferentes temperaturas (40, 45, 50, 55 y 60 °C). Todas las temperaturas evidenciaron una disminución significativa del contenido de hume-dad en la primera hora. Esta reducción es más pronunciada a temperaturas más altas. A las 5 horas, el contenido de humedad tiende a cero lo que nos indica que casi se ha secado completa-mente. Se concluye que el proceso de secado es más rápido a temperaturas más altas (50, 55 y 60 °C) que a temperaturas bajas (40 y 45 °C).
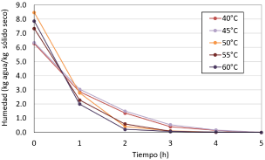
Figura 19. Variación del peso, humedad en base seca y en el producto en función al tiempo y la temperatura.
La Figura 20 muestra la disminución de la humedad en kg de agua por kg de producto en función al tiempo a diferentes temperaturas (40, 45, 50, 55 y 60 °C).
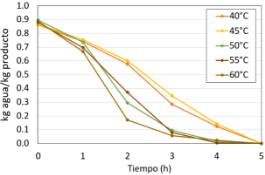
Figura 20. Variación del peso, humedad en base húmeda y en el producto en función al tiempo y la temperatura.
Se evidencia una significativa disminución del contenido de agua en la primera hora en todas las temperaturas evaluadas. A las 2 h, a las temperaturas de 50, 55 y 60 °C disminuyeron su contenido de humedad de forma más rápida. La reducción del agua era más acentuada a temperaturas altas. A las 5 horas, el contenido de humedad tiende a cero lo que nos indica que casi se ha secado completamente. Se concluye que el proceso de secado es más rápido a temperaturas más altas (50, 55 y 60 °C) que a temperaturas bajas (40 y 45 °C). El aumento de temperatura hace que el proceso de secado en un producto sea más rápido.
2.2.2. Variación del color en función al tiempo a diferentes temperaturas
La Figura 21 muestra la variación de la luminosidad en función al tiempo a diferentes temperaturas. Se puede observar que, durante el periodo evaluado, de 5 h, los valores de la luminosidad presentan fluctuaciones en todas las temperaturas evaluadas.
Además, no se puede distinguir una tendencia clara de aumento o disminución de la luminosidad a lo largo del tiempo para ninguna de las temperaturas.
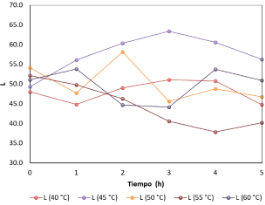
Figura 21. Variación de la luminosidad de las hojas de borraja en función al tiempo y temperatura de secado.
En el tiempo inicial (0), todas las temperaturas comienzan con valores de luminosidad aproximados a 50, excepto a 40 °C que está ligeramente más abajo. La temperatura de 45 °C muestra el pico más alto entre 2 horas y 3 horas, alcanzando valores aproximados de 65 de luminosidad. La temperatura de 50 °C muestra el pico más alto a las 2 horas, aproximadamente 55 L.
Por otro lado, las temperaturas de 40, 55 y 60 °C no muestran picos significativos. Además, a 55 y 60 °C se presentaron los valores más bajos a lo largo de las 5 h.
La temperatura de 45 °C obtuvo valores de luminosidad más altos y estables en el periodo de 5 h. Al parecer está temperatura sería la temperatura óptima para mantener la luminosidad en el proceso de secado, mientras que, 60 °C y 55 °C provocan disminuciones significativas e inestabilidad en la luminosidad. Los resultados se pueden utilizar para optimizar las condiciones de los procesos que dependen del mantenimiento de una luminosidad alta como el secado.
La Figura 22 muestra que el valor de “a” en el tiempo inicial fueron diferentes, siendo 50 °C el que tuvo el valor más negativo, seguido por las temperaturas de 60, 55, 45 y 40 °C. Lo que significa que las hojas a 50 °C empezaron con el color verde que, en las otras temperaturas, sin embargo; también es la que mostró un cambio muy significativo, subiendo a valores menos negativos. Los valores de a menos negativos a t = 5 h fueron más negativos a 40, 60, 45, 50 y 55 °C. Estos resultados sugieren que la temperatura afecta significativamente el comportamiento del valor de a.
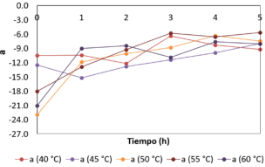
Figura 22. Variación de “a” en las hojas de borraja en función al tiempo y temperatura de secado.
El Figura 23 muestra el parámetro b en función al tiempo a diferentes temperaturas (40, 45, 50, 55 y 60 °C). Del gráfico se puede observar que la temperatura afecta la estabilidad en el tiempo del parámetro b.
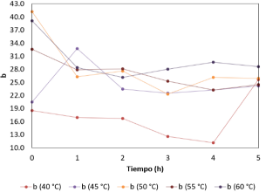
Figura 23. Variación de “b” en las hojas de borraja en función al tiempo y temperatura de secado.
A las 5 h, los valores del parámetro b de todas las temperaturas evaluadas convergen entre sí con valores que oscilan entre 22,000 y 31,000. Las temperaturas altas (45, 50, 55 y 60 °C) mostraron mayor fluctuación que a temperaturas bajas (40 °C), pero lograron la estabilidad más rápido.
2.2.3. Elaboración del filtrante
Luego de evaluar el porcentaje de humedad y el color, determinamos que la temperatura de secado sería 45 °C, luego se trituró, tamizó, envasó y selló.
2.2.4. Preparación de las muestras
Para la determinación del porcentaje de humedad, de la muestra fresca, se aplicó el Método AOAC 925.10 (1990) y, estableciendo algunas modifica-ciones a la metodología, descrita por Aumasa et al. (2023), las infusiones fueron obtenidas a partir de: 1. Hojas frescas enteras y cortadas y 2. Hojas secas enteras y molidas (filtrante). Para determinar el tiempo óptimo de extracción de los componentes de las hojas y que la mayor concentración de éstos pase a la infusión se realizó una prueba con el filtrante considerando cuatro tiempos diferentes de reposo: 2,5, 5,0, 10,0 y 12,5 minutos, de donde se obtuvo el tiempo de reposo que se empleó para las demás infusiones. Para ello, el filtrante elaborado fue colocado en un beaker de 250 mL, se añadió agua a 95 °C; y se dejó en reposo durante los tiempos previamente establecidos. Luego, la muestra fue trasvasada en una fiola de 250 mL, enfriada en un baño de agua fría; y finalmente se enrasó. La muestra preparada fue utilizada inmediatamente para su deter-minación química.
2.3. Contenido de polifenoles totales
Siguiendo la Metodología de Mohajer et. al. (2016) con ligeras modificaciones, se realizaron las lecturas de Absorbancia en un Espectrofotómetro UV-vis a 760 nm, el contenido de polifenoles fue expresado como ácido gálico.
Se colocó en un tubo de reacción 40 µL del reactivo Folín-Ciocalteu y una mezcla formada por 100 µL de la muestra con 860 µL de agua bidestilada. Después de agitar, en un vórtex por 30 segundos, fueron incorporados 100 µL de carbonato de sodio al 20%, más 900 µL de agua bidestilada y se dejó reposar durante 30 minutos.
2.4. Actividad antioxidante
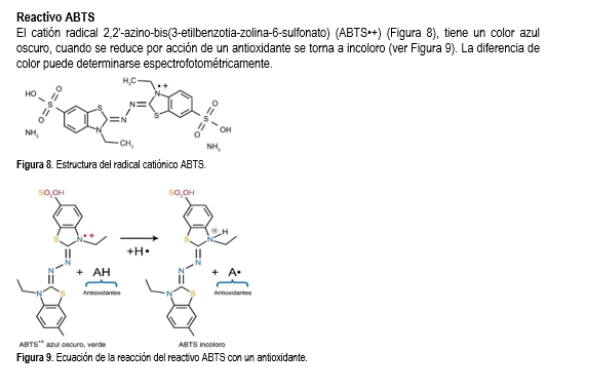
Considerando ligeras modificaciones a los métodos de Blois (1958) y Mohajer et al. (2016), para la determinación del DPPH y a los reportados por Re et al. (1999) y Ciriano et al. (2009) para el método ABTS. Para ambas mediciones ha sido necesario el uso de un espectrofotómetro UV-Vis y el estándar Trolox.
2.4.1. Método DPPH
La solución de trabajo fue obtenida mediante la dilución de un mL de la solución madre de radicales DPPH, disueltos en etanol (concen-tración de 0,004 g/100 mL), con alcohol. La dilución fue realizada hasta obtener la absorbancia de 0,80 ± 0,02 a 517 nm. En los siguientes 30 minutos, fueron mezclados 1 mL de esta solución de trabajo con 1 mL de muestra. El porcentaje de inhibición fue registrado como la disminución de la absorbancia y el cálculo fue realizado aplicando la siguiente fórmula:
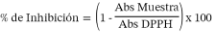
2.4.2. Método ABTS
Se inicia al hacer reaccionar una solución de ABTS, 7 mM con una solución de persulfato de potasio 140 mM, para formar el radical cromogénico ABTS•+ el que luego de ser obtenido es conservado en oscuridad durante 16 horas a temperatura ambiente. Luego, para preparar una solución de trabajo, 1 mL de esta solución es diluida con agua hasta obtener una absorbancia de 0,70±0,02 a 734 nm. Durante los siguientes 6 minutos, se mezcla 1 mL de esta solución de trabajo con 1 mL de la muestra. La disminución de la absorbancia se registra como porcentaje de inhibición y para el cálculo fue utilizada la siguiente fórmula:
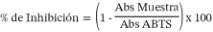
2.5. Análisis microbiológico del filtrante
La presencia de mohos y enterobactereacea fueron evaluados mediante el análisis microbio-lógico del filtrante. Este fue realizado siguiendo la NTS N°071 MINSA/DIGESA-V.01. XVII.2.
2.6. Evaluación sensorial de la infusión del filtrante
Participaron 50 panelistas no entrenados y sin distinción de edad o sexo. La prueba sensorial consistió en dar a cada panelista la infusión y una cartilla de control de los atributos sensoriales considerados: el color, olor y sabor. La escala hedónica considerada fue de 5 puntos.
2.7. Análisis estadístico
Para el análisis estadístico, las lecturas de las muestras se realizaron por triplicado para los análisis Folin Ciocalteu, DPPH y ABTS y al aplicar el programa de Excel 2021, los datos fueron expresados como media ± desviación estándar.
3. Resultados y discusión
3.1. Determinación de la humedad
En el presente estudio se encontró que la humedad de las hojas frescas fue 88,067%.
3.2. Contenido de polifenoles totales
La Tabla 1 muestra el promedio de Eq. ác. gálico (µg/mL) de las infusiones de hojas frescas enteras y en cortadas (trozos), las cuales son 38,40±1,19 Eq. ác. gálico (µg/mL) y 112,32±0,00 Eq. ác. gálico (µg/mL) respectivamente. El contenido de polifenoles totales en la infusión de hojas secas enteras fue 106,34±0,74 µg/mL Eq. ác. gálico. Por último, se muestra que la cantidad de polifenoles encontrada en el filtrante fue de 43,01±0,17 Eq. ác. gálico.
3.3. Actividad antioxidante de las muestras
3.3.1. Método de DPPH
En la Tabla 2 se muestra el equivalente Trolox encontrado en la infusión de hojas frescas enteras y cortadas (trozos) fue 77,08±0,36 µg/mL y 234,24±4,02 µg/mL, respectivamente. También se observa que en las infusiones de hojas secas enteras fue 156,23±5,80 µg/mL y en la infusión del filtrante fue 55,32±0,71 µg/mL.
3.3.2. Método de ABTS
La Tabla 3 muestra los resultados de equivalente Trolox en la infusión de hojas frescas enteras y cortadas (trozos), los cuales fueron: 55,40 ± 2,09 µg/mL y 214,94 ± 2,83 µg/mL, respectivamente. Respecto a la infusión de hojas secas enteras fue 221,47 ± 3,27 µg/mL y en el filtrante fue 87,12 ± 0,32 µg/mL.
3.4. Contenido de polifenoles totales, DPPH y ABTS en el filtrante
La Figura 24 muestra que el contenido de polifenoles aumenta hasta los 10 minutos de extracción, pasado ese tiempo se observa una ligera disminución. Asimismo, el DPPH presenta su mejor nivel de inhibición ese mismo tiempo (10 min) después de ese tiempo su porcentaje de inhibición disminuye; sin embargo, para el ABTS aumenta de forma directamente proporcional al tiempo de reposo.
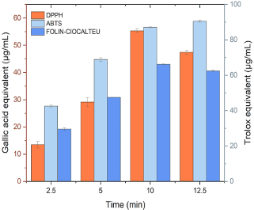
Figura 24. Gráfica de DPPH, ABTS y polifenoles totales en filtrante borraja en cuatro tiempos diferentes.
3.5. Comparación de los análisis realizados a las cuatro muestras
En la Figura 25 se observa la comparación de las cuatro muestras en los análisis realizados. Siendo la muestra de hojas frescas cortadas (trozos) y secas enteras las muestras que dieron los mejores resultados. Si comparamos los resulta-dos obtenidos en el filtrante con las hojas frescas enteras. El filtrante muestra una mejor actividad antioxidante.
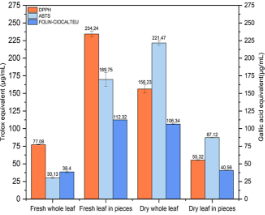
Figura 25. Gráfica de DPPH, ABTS y polifenoles totales en hojas frescas enteras y cortadas (trozos), secas enteras y en filtrante. Nota: Fresh whole leaf: hoja fresca entera, fresh leaf in pieces: hoja fresca cortada (trozos), Dry whole leaf: hoja seca entera y dry leaf in pieces: hoja seca molida o en trozos (filtrante).
3.6. Análisis microbiológico del filtrante
La Tabla 4 muestra los resultados del análisis microbiológico del filtrante donde se observa que los resultados se encuentran dentro de los límites establecidos por la NTS N° 071-MINSA/DIGESA V-01. XVII.2 (102 < mohos y levaduras < 103, 102 < Enterobacterias < 103).
Tabla 4
Resultados del análisis microbiológico del filtrante
Agente microbiano | Valor encontrado |
Mohos y levaduras | 740 |
Enterobacteriacea | 100 |
3.7. Análisis sensorial del filtrante
La Tabla 5 muestra los resultados del análisis sensorial de borraja, del total de panelistas el mayor porcentaje se encuentra en las categorías “Me agrada un poco” y “Me agrada mucho”, estos porcentajes representan aproximadamente el 70% de los panelistas.
Según Sardoei & Shahdadi (2023), la capacidad de las plantas para eliminar radicales libres se debe principalmente a los compuestos fenólicos y ésta es dependiente del número de grupos hidroxilo. En el presente estudio se efectuó el análisis de la actividad antioxidante y de los compuestos fenólicos totales contenidos en el filtrante de borraja.
En hojas frescas enteras se hallaron 9,6 mg EAG y en hojas frescas cortadas 28,08 mg EAG, de polifenoles totales, este valor comparado con los 19,66 mg EAG/g hoja reportado por García et al. (2010) representa aproximadamente la mitad y una y media veces, aproximadamente. Esto nos lleva a deducir que el proceso de cortado permite la liberación de compuestos polifenólicos. De igual forma, comparando los valores encontrados en este estudio de 26,585 mg (hoja seca entera) y 10,75 mg de GA (filtrante), con los resultados obtenidos por Abu et al. (2018) en extractos metanólicos de hojas silvestres (5,21 mg GA/g) y cultivadas (2,37 mg GA/g) sus valores son aproximadamente la quinta parte, lo cual nos permite deducir que es mejor utilizar el agua hirviente en lugar de metanol por su mejor capacidad de extracción. Por último, si los valores hallados en este estudio para hojas secas enteras y el filtrante los comparamos con lo encontrado por Zemmouri et al. (2019) para los extractos: etanólico (94,09 ± 1,72 mg GAE/g extracto seco) y acuoso (35,48 ± 2,70 mg GAE/g extracto seco) de borraja. Estos son inferiores lo que nos permite deducir que el etanol es más efectivo al momento de realizar una extracción de polifenoles.
Respecto a los valores de DPPH para hojas frescas enteras, cortadas; hojas secas enteras y en el filtrante en este trabajo se hallaron los siguientes valores: 19,270; 58,560; 39,0575 y 13,8300 mg Trolox respectivamente. Si compa-ramos con los encontrados por García et al. (2010): 10,30592 mg Trolox, los valores deter-minados en nuestra investigación son superiores, lo que indica que el filtrante posee mayor capacidad inhibitoria de radicales libres; sin embargo, al comparar estos resultados con los valores obtenidos por los autores Bandonien & Murkovic (2002), quienes realizaron su determi-nación de capacidad antioxidante mediante el método HPLC-DPPH en línea, identificando varios compuestos antioxidantes dentro de los cuales señalaron que el compuesto antioxidante más importante es el ácido rosmarínico y reportaron su actividad antioxidante, encontrada en las hojas de borraja, como 15,8 mg/g peso seco (15000 µg Trolox) valor que al comparar con los resultados de esta investigación sería inferior a los reportados para hojas frescas enteras y cortadas y para hojas secas enteras, reafirmando que las hojas de borraja producto de esta investigación posee mayor capacidad antioxidante. Respecto al radical ABTS, en este presente trabajo se hallaron valores para las hojas frescas enteras y cortadas, hojas secas enteras y en filtrante, 13,850, 53,735, 55,3675 y 21,780 mg Trolox/g hoja seca, respectivamente. Comprando estos valores con el valor obtenido por García et al. (2010) para el extracto de hojas frescas de borraja: 1,12838 mg Trolox/g planta fresca, el cual sería 9,40317 mg Trolox en gramos de hojas secas, se concluye que el filtrante desarrollado en nuestra investigación posee mayor poder inhibitorio o antioxidante.
La variación en los resultados obtenidos en este presente estudio, posiblemente se debe a la oxidación de los antioxidantes naturales en los procesos de secado y molienda (la reducción del tamaño de la partícula aumenta el área de contacto con el oxígeno del aire y por ende se oxidan los antioxidantes), otro factor es humedad relativa del aire que causa hidrólisis durante el almacenamiento.
Por otro lado, si comparamos nuestro filtrante con frutas como la naranja, fresa, mandarina y aguaymanto (Cai et al., 2024; Hayat et al., 2010; Alothman et al., 2009; Xu & Chang, 2007). Los valores encontrados para el filtrante de borraja en este trabajo son superiores tanto para polifenoles como para actividad antioxidante.
4. Conclusiones
Se concluye que el filtrante elaborado a partir de hojas de borraja, secado a 45 °C y durante cinco horas, libera en la infusión correspondiente un contenido de antioxidantes totales de 13,8300 mg y 21,780 mg Trolox/g hoja seca, determinados por los métodos de DPPH y ABTS, respectivamente, valor que es suficientemente elevado, comparado con otros productos cuyo acceso y manipulación no es tan fácil y cómodo como en un filtrante para infusión. Además, la cantidad de compuestos polifenoles, 10,75 mg/g hoja seca, expresado como EAG, determinado por el método de Folin Ciocalteau, en este valor influye la sensibilidad y delicadeza de la hoja fresca.
Este estudio demuestra que la hoja de borraja tiene buena capacidad antioxidante en sus dife-rentes formas (hoja fresca o seca), y que el troceado ayuda a extraer los compuestos antio-xidantes. Las hojas frescas cortadas poseen el más alto porcentaje de inhibición de radicales libres que las hojas frescas enteras. Además, el filtrante elaborado cumple con la NTS N° 071-MINSA/DIGESA V-01. XVII.2 y tuvo buena aceptación sensorial.
Por lo tanto, como el filtrante contiene altas con-centraciones de antioxidantes, se recomienda realizar mayores estudios a la planta completa de borraja para determinar sus compuestos bio-activos.
Agradecimientos
Los autores expresamos nuestro agradecimiento a la Q.F. Carol Lizeth Ramos Vera y al Dr. César Máximo Fuertes Ruitón coordinador del grupo de investigación Natural Resources Research por su apoyo en este trabajo de investigación.
Referencias bibliográficas
Abu-Qaoud, H., Shawarb, N., Hussen, F., Jaradat, N., & Shtaya, M. (2018). Report: Comparison of qualitative, quantitative analysis and antioxidant potential between wild and cultivated Borago officinalis leaves from Palestine. Pakistan Journal of Pharmaceutical Sciences, 31(3), 953–959.
Aumasa, T., Ogawa, Y., Singh, J., Panpipat, W., & Donlao, N. (2023). The role of herbal teas in reducing the starch digestibility of cooked rice (Oryza sativa L.): An in vitro co-digestion study. NFS Journal, 33, 100154.
Alothman, M., Bhat, R., & Karim, A. A. (2009). Antioxidant capacity and phenolic content of selected tropical fruits from Malaysia, extracted with different solvents. Food Chemistry, 115(3), 785-788.
Alvarez, S. (2020). Capacidad antioxidante del 3,4-dihidroxibenzal-dehído frente al radical hidroperoxilo en disolución: Un enfoque teórico. ACI Avances en Ciencias e Ingenierías, 11(3), 6–33. https://doi.org/10.18272/aci.v11i3.1411
Bandonien, D., & Murkovic, M. (2002). The detection of radical scavenging compounds in crude extract of borage (Borago officinalis L.) by using an on-line HPLC-DPPH method. Journal of Biochemical and Biophysical Methods, 53(1–3), 45–49.
Blois, M. S. (1958). Antioxidant determinations by the use of a stable free radical. Nature, 181(4617), 1199–200.
Cai, Y., Luo, Q., Sun, M., & Corke, H. (2004). Antioxidant activity and phenolic compounds of 112 traditional Chinese medicinal plants associated with anticancer. Life Sciences, 74(17), 2157-2184.
Ciriano, M. G.-I. de, García-Herreros, C., Larequi, E., Valencia, I., Ansorena, D., & Astiasarán, I. (2009). Use of natural antioxidants from lyophilized water extracts of Borago officinalis in dry fermented sausages enriched in ω-3 PUFA. Meat Science, 83(2), 271–277.
Csicsor, A., Tombácz, E., & Kulcsár, P. (2023). Antioxidant potential of humic substances measured by Folin-Ciocalteu, CUPRAC, QUENCHER-CUPRAC and ESR methods. Journal of Molecular Liquids, 391(123294), 123294. https://doi.org/10.1016/j.molliq.2023.123294
Francenia, S., Salas-Coronado, R., Villanueva-Cañongo, C., & Hernández-Carlos, B. (2019). Antioxidant compounds and their antioxidant mechanism. En E. Shalaby (Ed.), Antioxidants. IntechOpen.
García-Herreros, C., García-Iñiguez, M., Astiasarán I., & Ansorena, D. (2010). Antioxidant activity and phenolic content of water extracts of Borago officinalis L.: Influence of plant parts and cooking procedures. Italian Journal of Food Science, 22(2), 156.
Hayat, K., Zhang, X., Farooq, U., Abbas, S., Xia, S., Jia, C., & Zhang, J. (2010). Effect of microwave treatment on phenolic content and antioxidant activity of citrus mandarin pomace. Food Chemistry, 123(2), 423-429.
Losada-Barreiro, S., Sezgin-Bayindir, Z., Paiva-Martins, F., & Bravo-Díaz, C. (2022). Biochemistry of antioxidants: Mechanisms and pharmaceutical applications. Biomedicines, 10(12), 3051. https://doi.org/10.3390/biomedicines10123051
Mohajer, S., Taha, R. M., Ramli, R. B., & Mohajer, M. (2016). Phytochemical constituents and radical scavenging properties of Borago officinalis y Malva sylvestris. Industrial Crops and Products 94(30), 673-681.
Norma Técnica de Salud (2007). Norma Sanitaria que establece los criterios microbiológicos de calidad sanitaria e inocuidad para los alimentos y bebidas de consumo humano (NTS N° 071-MINSA/DIGESA V-01). Ministerio del Perú. Lima, Perú.
Pérez, M., Dominguez-López, I., & Lamuela-Raventós, R. M. (2023). The Chemistry Behind the Folin–Ciocalteu Method for the Estimation of (Poly)phenol Content in Food: Total Phenolic Intake in a Mediterranean Dietary Pattern. J Agric Food Chem, 71(46), 17543–53.
Shahdadi, F., & Sardoei, A. S. (2023). Antioxidant activity of methanolic extracts of Borago officinalis, Teucrium polium, Mentha aquatica and Allium taradox. Archives of Medical Laboratory Sciences, 9, 1-7 (e4).
Vara, D., & Pula, G. (2014). Reactive oxygen species: physiological roles in the regulation of vascular cells. Current molecular medicine, 14(9), 1103–1125.
Xu, B. J., & Chang, S. K. C. (2007). A comparative study on phenolic profiles and antioxidant activities of legumes as affected by extraction solvents. Journal of Food Science, 72(2), S159-S166.
Zemmouri, H., Ammar, S., Boumendjel, A., Messarah, M., El Feki, A., & Bouaziz, M. (2019). Chemical composition and antioxidant activity of Borago officinalis L. leaf extract growing in Algeria. Arabian Journal of Chemistry, 12(8), 1954–1963.