Incremento de la prolina por la aplicación del bioestimulante CBX-103 mejora el crecimiento de Arabidopsis thaliana Col 0 bajo condiciones de estrés salino
Increase in proline by the application of the biostimuant CBX-103 improves the growth of Arabidopsis thaliana Col 0 under salt stress conditions
Fresia Mejía1, 2*; Gustavo Sandoval2; Juan Lucar1
1 Biogen Agro SAC. Departamento de Investigación y Desarrollo. Calle René Descartes 311, Lima, Perú.
2 Universidad Nacional Mayor de San Marcos. Facultad de Ciencias Biológicas. Grupo de Investigación en Bioinformática y Biología Estructural. Av. República de Venezuela s/n, Ciudad Universitaria, Lima, Perú.
ORCID de los autores
F. Mejía: https://orcid.org/0000-0003-0090-7609 G. Sandoval: https://orcid.org/0000-0002-8392-9880
J. Lucar: https://orcid.org/0009-0009-1064-5359
RESUMEN
La agricultura se enfrenta a nuevos retos cada vez más complicados ante un medio ambiente en constante cambio que ocasiona diferentes tipos de estrés en los cultivos, siendo uno de ellos la salinidad. Se han realizado numerosas investigaciones para conocer el efecto del estrés salino en la fisiología de las plantas, así como también diferentes maneras de afrontarlo y crear tolerancia y/o resistencia para que la productividad de los cultivos no se vea afectada, entre estas alternativas encontramos a los bioestimulantes. El bioestimulante CBX-103 que está compuesto por ácidos carboxílicos, succínicos, oligogalacturónidos, entre otros, los cuales se obtienen mediante una fermentación enzimática controlada del extracto vegetal de Saccharum officinarum L. En el presente estudio se demuestra que las aplicaciones foliares del bioestimulante CBX-103 en plantas de Arabidopsis thaliana Col 0 cultivadas bajo estrés salino incrementan el contenido foliar de prolina, disminuyendo significativamente los efectos nocivos del estrés, lo cual se demuestra a nivel biométrico y regulando los estados de crecimiento. Se propone como modo de acción una vía en la regulación energética de las plantas debido al incremento en la acumulación de prolina obtenida y al efecto de sus componentes.
Palabras clave: Arabidopsis thaliana Col 0; bioestimulante CBX-103; estrés salino; ácidos carboxílicos; prolina.
ABSTRACT
Agriculture faces new, increasingly complicated challenges in the face of a constantly changing environment that causes different types of stress in crops, one of them being salinity. Numerous investigations have been carried out to understand the effect of salt stress on the physiology of plants, as well as different ways of dealing with it and creating tolerance and/or resistance so that the productivity of crops is not affected. Among these alternatives we find biostimulants. The biostimulant CBX-103 is composed of carboxylic acids, succinic acids, oligogalacturonides, among others, which are obtained through a controlled enzymatic fermentation of the plant extract of Saccharum officinarum L. In the present study it is demonstrated that foliar applications of the biostimulant CBX- 103 in Arabidopsis thaliana Col 0 plants grown under salt stress increase leaf proline content, significantly reducing the harmful effects of stress, which is demonstrated at a biometric level and regulating growth states. A pathway in the energy regulation of plants is proposed as a mode of action due to the increase in the accumulation of proline obtained and the effect of its components.
Keywords: Arabidopsis thaliana Col 0; bioestimulant CBX-103; carboxylic acids; proline; salt stress.
1. Introducción
La salinidad del suelo constituye un desafío global que restringe la viabilidad de la tierra y la producción de cultivos (Morton et al., 2019), el estrés por salinidad es una de las principales formas que afecta la producción de cultivos a nivel global en la agricultura (Rolly et al., 2020). La salinidad del suelo ocurre por la acumulación de sales entre las cuales se encuentran el cloruro de sodio (siendo el más abundante y representativo), los bicarbonatos, los sulfatos de magnesio y calcio cuya composición depende del tipo de suelo (Dagar et al., 2019) y puede medirse con la conductividad eléctrica (CE) (Bedoya-Perales et al., 2023), considerándose estrés salino cuando el suelo presenta una CE ≥ 4 dS/M (Figueroa & Neaman, 2023).
El estrés salino detiene el desarrollo, la productividad y la calidad de los cultivos (Yang & Guo, 2018); se presenta una desaceleración del crecimiento de las plantas, tanto en su desarrollo vegetativo como en reproductivo, al perturbar el equilibrio de las funciones fisiológicas, su influencia nociva se extiende a varias partes de las plantas, incluyendo los brotes, las raíces, los frutos y los granos. Analizar lo que ocasiona el estrés salino en las plantas implica un proceso complejo dado que se tienen que estudiar diversos aspectos, como el comportamiento de las partes vegetativas y reproductivas, las propiedades fisicoquímicas, los procesos bioquímicos, las rutas metabólicas y la expresión genética (Gupta et al., 2021).
En condiciones de salinidad se produce una entra-da considerable de iones de sodio (Na+) en las células vegetales, lo que incrementa las concentra-ciones de Na+ en el citoplasma y la vacuola, resultando en efectos tóxicos para los procesos metabólicos y aumentando el riesgo de muerte celular (Dwiningsih et al., 2021). La salinidad desencadena la producción de especies reactivas de oxígeno, especialmente en los cloroplastos y las mitocondrias (Hameed et al., 2021).
El exceso de sal en la planta tiene como consecuencia una reducción significativa en la estabilidad de la membrana celular, daño en la pared celular, degradación del citoplasma, plasmólisis, daño del retículo endoplásmico y acumulación de sustancias osmoprotectoras como la prolina, malato, citrato e inositol en la hoja. Numerosos datos científicos respaldan la existencia de una asociación positiva entre la acumulación de prolina y la capacidad de las plantas para resistir diversos tipos de estrés abiótico. Debido a su capacidad para secuestrar metales, la prolina actúa como una especie de "guardiana molecular" que protege a la planta contra las especies reactivas de oxígeno (ROS), además de desempeñar un papel señalizador que activa funciones genéticas específicas esenciales para la recuperación de las plantas después de situaciones de estrés (Ghosh et al., 2022). Al parecer en situaciones de estrés salino moderado, los contenidos endógenos de prolina o aplicado exógenamente, ayudan al incremento del rendimiento de los cultivos, por ejemplo, Wani et al. (2016) probaron que, en situaciones de estrés leve, aplicar una concentración de prolina de 20 mM, mejora la productividad de Brassica juncea L. mientras que, no se observó un efecto positivo cuando las plantas estaban sometidas a niveles elevados de estrés salino, disminuyendo el rendimiento del cultivo a pesar de incrementarse el contenido de prolina (Sahi et al., 2006); así mismo, la aplicación de 5 µM de prolina en condiciones de salinidad de 15 mM (baja salinidad) mejoró de manera significativa el crecimiento de las plantas y el rendimiento de Lactuca sativa L. (Orsini et al., 2018).
Para evaluar el efecto de la acumulación de la prolina y su consecuente mejora en el crecimiento de las plantas, se puede usar la escala BBCH dado que es un referente a nivel mundial para determinar las fases de crecimiento de las plantas (Hess et al., 1997); así mismo, se han realizado numerosas adaptaciones de la escala BBCH para cada especie, como el realizado por Boyes et al. (2001) para A. thaliana Col 0. Otra manera de evaluar el crecimiento de una planta es a través de índices conocidos como la Tasa de Crecimiento Relativo (TRC) y Tasa de Asimilación Neta (TAN), entre otros (Gardner et al., 2017). La TRC indica la velocidad de cambio en el tamaño en relación con la medida inicial, mientras que, la TAN evalúa la habilidad fotosintética y mejora la comprensión de la conexión entre la acumulación de biomasa y la producción (Mayén et al., 2023).
Desde las últimas 2 décadas se ha incrementado el interés a nivel mundial el uso de moléculas alternativas a los tradicionales fertilizantes foliares (Dorais & Alsanius, 2015), por lo que son muchos los productos naturales que han potenciado el uso de bioplaguicidas, biofertilizantes, bioestimulantes, etc., principalmente en condiciones de estrés salino (Hadavi & Ghazijahani, 2022). Las plantas han mejorado su eficiencia y resistencia ante diferentes tipos de estrés mediante la aplicación exógena de bioestimulantes ecológicos y productos antioxi-dantes (Alharby et al., 2021).
Numerosos ácidos orgánicos desempeñan un papel en la capacidad de las plantas para adaptarse a distintos tipos de estrés, tanto bióticos como abióticos, y algunos tienen efectos regulatorios que podrían compararse con los conocidos reguladores del crecimiento de las plantas. Ya sea que el interés sea mejorar la vida útil después de la cosecha, aumentar el contenido de compuestos bioactivos, facilitar la absorción de minerales a través de las raíces, fortalecer la resistencia a situaciones de estrés biótico o abiótico, o incluso incrementar los rendimientos del metabolismo secundario, podemos encontrar valiosas herramientas dentro de la gama de ácidos orgánicos presentes en la naturaleza (Hadavi & Ghazijahani, 2022).
Los ácidos carboxílicos combinados con otros compuestos han demostrado tener un efecto promotor del crecimiento de las plantas, regulando la absorción de nutrientes y tolerancia al estrés abiótico (Scaglia et al., 2017). Se ha reportado que el ácido succínico mejora el crecimiento vegetal bajo condiciones de estrés por contaminación de plomo, logrando revertir su efecto dañino (Song, 2018).
Los oligopectatos u oligogalacturónidos son cadenas de 2 a 20 unidades de ácido galacturónico, conectadas a través de enlaces α (1.4). Estos se generan a partir de la degradación de la pectina que se encuentra en la pared celular de las plantas (Singh et al., 2020). Los oligo-galacturónidos pueden controlar la producción y función de ciertas hormonas, así como diversos procedimientos relacionados con la formación de órganos y el crecimiento en las plantas (Acosta et al., 2018), por ejemplo, Reyes et al. (2021) mencionan sus potencialidades como enraizante de esquejes de bajo costo debido a su regulación hormonal, principalmente auxínica.
El bioestimulante CBX-103 que está compuesto por ácidos carboxílicos, succínicos, oligogalac-turónidos, entre otros, los cuales se obtienen mediante una fermentación enzimática contralada del extracto vegetal de S. officinarum L. El bioestimulante CBX-103 ha mostrado su impacto en condiciones de campo al mejorar el crecimiento vegetativo e incrementar la productividad de los cultivos principales, sin embargo, se desconocen los efectos de CBX-103 en el desarrollo vegetativo y reproductivo de A. thaliana Col 0 bajo condiciones de estrés salino. Por tal motivo, en el presente estudio se examinó el efecto de CBX-103 sobre el desarrollo vegetativo evaluando el contenido foliar de prolina, aminoácido que representa una fuente de reserva de Carbono y Nitrógeno, y parámetros biométricos, usando también la escala BBCH para visualizar la existencia de algún cambio en su tiempo regular de crecimiento, determinándose dos índices de crecimiento, así mismo se evaluó el peso seco de los frutos de A. thaliana Col 0 como un indicador de su productividad. Nuestra hipótesis es que la aplicación foliar exógena de CBX-103 antes y después del riego salino y a una concentración de 5 ml/L, tiene un efecto mitigador del estrés salino, así como también mejora la acumulación prolina, regulando el desarrollo tanto vegetativo como reproductivo de A. thaliana Col 0.
2. Metodología
Materia prima e insumos
Las semillas de A. thaliana Col 0 se cultivaron in vitro hasta 14 días después de la germinación (DDG) (Jiménez et al., 2020), posteriormente, fueron sembradas en macetas de 190 mL de volumen con sustrato Sunshine® compuesto del musgo Sphagnum canadiense (75% aprox.), vermiculita (7% aprox.), perlita (18% aprox.), dolomita, yeso, agentes humectantes y fertili-zantes, con un fotoperíodo de 16h/8h (luz/ oscuridad), una intensidad lumínica de 132 µmolm-2s-1, temperatura de 25 °C y humedad relativa de 60% aproximadamente. Para la fertili-zación usamos una solución nutritiva, cuya composición es la siguiente: nitrógeno 200 partes por millón (ppm), potasio 250 ppm, fósforo 40 ppm, magnesio 35 ppm, azufre 46 ppm, calcio 116 ppm, hierro 1,5 ppm, manganeso 0,5 ppm, zinc 0,2 ppm, cobre 0,1 ppm, boro 0,4 ppm y molibdeno 0,01 ppm, (30 mililitros por cada unidad experimental, una vez por semana), luego de 2 semanas del trasplante.
Estrés salino
Luego de aproximadamente 21 DDG o cuando la roseta tuvo 9 hojas (Boyes et al., 2001), se realizaron 3 riegos salinos para las plantas que lo requieran, con 50 mL de agua con NaCl a una concentración de 200 Mm cada 3 días. Al día 39 DDG se tomaron aleatoriamente 10 muestras de suelo de cada tratamiento para medir la conductividad eléctrica del sustrato empleando un conductímetro Hanna UNE 77308, siguiendo las instrucciones del fabricante.
Diseño experimental y análisis estadísticos
Se utilizó un diseño factorial, siendo los factores: estrés salino con 2 niveles (sin estrés salino y con estrés salino: 200 mM de NaCl) y bioestimulante CBX-103 (sin aplicación y con aplicación foliar del bioestimulante CBX-103), obteniéndose 4 trata-mientos (T): T0: 0 mM NaCl, T1: 0 mM NaCl + CBX-103, T2: 200 mM NaCl y T3: 200 mM NaCl + CBX-103.
La aplicación de CBX-103 a una concentración de 5 ml/L se realizó 2 veces: 5 días antes (16 DDG) y 1 día después de la culminación del riego salino (31 DDG). Para los análisis estadísticos se empleó el programa Infostat versión 2020e, se realizó la normalización de datos con el log10 para las variables no paramétricas y un nivel de significancia de α = 0,05.
Prolina (µmol/g)
Se cuantificó el peso fresco de las plantas (mg) y se determinó según literatura (Bates et al., 1973). Para este fin se empleó 0.5 gramos de tejido foliar pulverizado con nitrógeno líquido y el contenido de prolina se determinó mediante la curva estándar y se calcula de acuerdo con el peso fresco de la siguiente manera (ecuación 1):
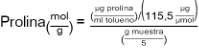 (1)
(1)
Biometría
Se evaluó el número de hojas, diámetro de la roseta en centímetros (considerando el promedio del diámetro más ancho y angosto) y el área foliar (cm2), para lo cual se tomaron fotografías con escala para luego determinarse mediante el programa ImageJ. La biometría fue evaluada el día 19 y 39 DDG, con un n = 20 por Tratamiento.
Estado de crecimiento (EC)
Se consideraron los estados de crecimiento según Boyes et al. (2001). Fue evaluada el día 19 y 39 DDG, con un n = 20 por Tratamiento.
Índices de crecimiento
Se usaron 20 repeticiones para la primera evaluación o evaluación inicial al día 19 DDG (antes de someterlas a riego salino), mientras que la segunda evaluación se realizó con un n = 20 por cada tratamiento al día 39 DDG según Almanza-Merchán (2016).
Tasa de crecimiento relativo (TRC): Es la medida principal del análisis de crecimiento y se define como la ganancia de peso (P) por unidad de biomasa y tiempo (T), según la ecuación 2:
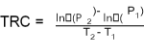 (2)
(2)
Tasa de crecimiento absoluto (TAN): Es la tasa de incremento en el peso (P) de la planta por unidad de área foliar (A) a través del tiempo (T). Se expresa en kg (planta) m–2 (hoja) día–1, según la ecuación 3.
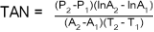 (3)
(3)
Producción
Se usó una menor concentración de riego salino: 50 mM de NaCl, siguiendo la misma metodología de riego anteriormente mencionada, llegando a un acumulado de 150 mM de NaCl que por literatura es el límite máximo para evitar mortandad (Rolly et al., 2020). Se realizaron cosechas interdiarias de los frutos maduros hasta el día 60 DDG. Las estructuras reproductivas, es decir, los frutos (tanto silicua y semilla) fueron recolectadas en tubos de centrífuga de 5 ml y secadas a estufa por 24 horas a 80 °C para determinar su peso seco, con un n = 30 por tratamiento.
3. Resultados y discusión
Factor estrés salino
La CE tomada del sustrato de los tratamientos con estrés salino al día 39 DDG fue de 3,39 dS/m y de 0,66 dS/m para los que no presentaban estrés, lo que demuestra un incremento de sales. A pesar de que la CE fue menor a la considerada como estrés salino, CE = 4 dS/m (Figueroa & Neaman, 2023), se visualiza que nuestro estrés (CE = 3,39) ocasiona daños en A. thaliana Col 0, inclusive muerte, 10% para el T2, incrementando el contenido de Prolina cuando se aplica el estrés (Figura 1), como consecuencia, todas las variables biométricas analizadas se diferenciaron significativamente (Tabla 1).
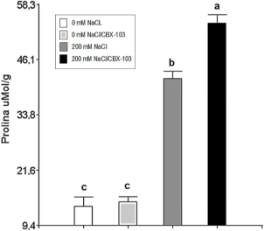
Figura 1. Contenido foliar de prolina analizado un día después de la segunda aplicación de CBX-103. Letras iguales no muestran diferencias estadísticas según el factor HSD de Tukey (α = 0,05), n = 5.
Esto es corroborado por Gupta et al. (2022) y Dwiningsih et al. (2021), quienes mencionan que el estrés salino ocasiona que las plantas disminuyan su crecimiento, así mismo, también ocasionan cambios a nivel bioquímico, como el incremento en el contenido de osmoprotectores como el aminoácido prolina (Orsini et al., 2018) tal y como demuestran nuestros resultados. Cabe resaltar que las plantas usadas para la producción fueron sometidas a una menor concentración de NaCl, obteniéndose una CE = 1,8 dS/m.
Tabla 1
Efecto del Factor Estrés. Comparación de promedios ± error estándar
Variables | Factor Estrés (NaCl) |
0 mM | 200 mM |
Log (N° hojas) | 1,1 ± 0,01 A | 1 ± 0,01 B |
Log (Diámetro roseta) | 0,72 ± 0,02 A | 0,46 ± 0,01 B |
Log (Área roseta) | 1,12 ± 0,02 A | 0,66 ± 0,02 B |
Log (Peso fresco roseta) | -0,59 ± 0,02 A | -1,00 ± 0,02 B |
Prolina (µMol/g) | 14,17 ± 1,05 B | 48,02 ± 2,97 A |
Log (TRC) | -0,60 ± 0,01 A | -0,69 ± 0,01 B |
Log (TAN) | -1,55 ± 1,90 A | -1,64 ± 0,01 B |
Peso de frutos* | 152,15 ± 1,90 A | 139,44 ± 1,90 B |
Letras iguales no muestran diferencias estadísticas según el test de t-Student (α = 0,05). *Estrés salino 50 mM NaCl según metodología.
Factor Tratamiento
El factor bioestimulante CBX-103 tuvo efecto positivo al incrementar el contenido foliar de prolina (Tabla 2), resultando en un mejor desarrollo vegetal y productivo dado que se obtuvieron diferencias significativas entre todas las variables evaluadas con respecto al control. De esta manera, se demuestran resultados mitigadores del estrés salino al aplicar exógenamente el bioestimulante CBX-103.
Se han realizado estudios previos que demuestran el efecto de la aplicación foliar de mezclas de oligogalacturónidos en el incremento de variables de crecimiento como número de hojas y área foliar en plantas de tomate (Yildirim et al., 2008), así como también de los ácidos carboxílicos (Scaglia et al., 2017) y ácido succínico (Yakunina & Sinitsyna, 2023), por lo que los ingredientes activos de CBX-103 influencian positivamente en dichas variables.
Tabla 2
Efecto del Factor Tratamiento. Comparación de promedios ± error estándar
Variables | Factor Tratamiento |
Testigo | CBX-103 |
Log (N° hojas) | 1,02 ± 0,01 B | 1,08 ± 0,01 A |
Log (Diámetro roseta) | 0,54 ± 0,02 B | 0,65 ± 0,02 A |
Log (Área roseta) | 0,79 ± 0,04 B | 1,00 ± 0,04 A |
Log (Peso fresco roseta) | -0,89 ± 0,03 B | -0,69 ± 0,04 A |
Prolina (µMol/g) | 27,77 ± 6,41 B | 34,42 ± 8,89 A |
Log (TRC) | -0,66 ± 0,01 B | -0,62 ± 0,01 A |
Log (TAN) | -1,62 ± 0,01 B | -1,56 ± 0,01 A |
Peso de frutos* | 134,33 ± 1,90 B | 157,26 ± 1,90 A |
Letras iguales no muestran diferencias estadísticas según el test de t-Student (α = 0,05). *Estrés salino 50 mM NaCl según metodología.
Interacción entre factores
Comparando los 4 tratamientos, también se encuentran diferencias significativas entre los tratamientos para todas las variables biométricas evaluadas en donde el T1: 0 mM NaCl + CBX-103 presenta el mayor promedio, seguido por el T0: 0 mM NaCl - Testigo, T3: 200 mM NaCl + CBX-103 y T2: 200 mM NaCl. Se demuestra que la aplicación exógena de CBX-103 incrementa el número de hojas, diámetro de la roseta (cm), área de la roseta (cm2), peso fresco de la roseta (g), TRC, TAN y peso seco del fruto (mg) (Figura 2).

Figura 2. Efecto de los Tratamientos a los 39 días después de la germinación de las semillas (DDG).
Se ha reportado que los componentes de CBX-103, como los ácidos carboxílicos, oligogalacturónidos y succínicos tienen efectos bioestimulantes y mitigadores de estrés (Scaglia et al., 2017; Yakunina & Sinitsyna, 2023; Singh et al., 2020), lo cual se comprueba en el presente estudio. En cuanto al contenido de prolina, el T3 es el que acumula mayor cantidad seguido por el T2 y los tratamientos sin estrés salino (T0 y T1) la menor cantidad (Tabla 3).
Prolina
Está reportado que osmoprotectores como la prolina se acumulan en situaciones de estrés, el estrés salino aplicado fue leve y según literatura, en dichas condiciones, la acumulación endógena o aplicación exógena de prolina logra mitigar los efectos del estrés salino (Wani et al., 2016; Orsini et al., 2018). El incremento de prolina se debe a la regulación positiva de la pirrolina-5-carboxilato sintetasa (P5CS) y la regulación negativa de la prolina deshidrogenasa (PDH), enzimas presen-tes en los cloroplastos y mitocondrias, por lo que su metabolismo podría ser el resultado entre el uso de reductores en cloroplastos y su reconstrucción en las mitocondrias (Aswani et al., 2019). La prolina desempeña un papel esencial en la síntesis de proteínas, siendo un aminoácido crucial para el metabolismo del nitrógeno y, por ende, para la producción de proteínas fundamentales para el crecimiento de las plantas (Souza et al., 2018). Pereira et al. (2021), evidenció que la acumulación de nitrógeno lograda mediante el empleo de prolina como agente osmoprotector resultó de gran relevancia para el desarrollo de plántulas de arroz. Estos impactos pueden atribuirse, al menos parcial-mente, a una función nutricional de la prolina, como el suministro de nitrógeno y carbono durante el crecimiento de las plántulas.
Una de las propuestas del modo de acción del bioestimulante CBX-103 dados sus ingredientes activos es que, mediante la metabolización de sus ácidos carboxílicos, incremente la fosforilación oxidativa, brindando mayor cantidad de energía a la planta principalmente en situaciones de estrés. Dado que la prolina desempeña el papel de reserva de carbono, nitrógeno y energía durante la recuperación del estrés (Sekhar et al., 2007), la cual incrementa marcadamente su concentración foliar con la aplicación de CBX-103 tanto en situaciones normales como de estrés salino, podríamos indicar que el modo de acción de CBX-103 está dentro de la vía de la regulación energética.
Biometría
Costales et al. (2007) mencionan que los oligoga-lacturónidos incrementan la biomasa de las plantas de tomate, tal y como encontramos en el presente estudio. Se han realizado numerosas investigaciones que demuestran que el estrés salino disminuye tanto el peso seco radicular y foliar (Yildirim et al., 2008; Bertrand et al., 2001; Tuteja, 2009; Lynch, 1995; Monshausen, 2009), otros estudios también indican que una manera para que la planta pueda tolerar el estrés salino es que la raíz se vea lo menos afectada, acumulando carbohidratos específicos que regularizarían su peso (Passioura, 2002).
Se sabe, además, que A. thaliana Col 0, incre-menta hasta en 4 mg/día su peso seco (Boyes et al., 2001).
Tabla 3
Efecto de la Interacción de Factores. Comparación de promedios ± error estándar
| Tratamientos | p_value | CV (%) |
Variables | 0 mM NaCl | 200 mM NaCl |
Testigo | CBX - 103 | Testigo | CBX - 103 |
Log (N° Hojas) | 1,07 ± 0,01 B | 1,14 ± 0,01 A | 0,96 ± 0,01 D | 1,02 ± 0,01 C | <0,0001 | 4,41 |
Log (Diámetro roseta) | 0,65 ± 0,02 B | 0,79 ± 0,01 A | 0,41 ± 0,02 D | 0,50 ± 0,01 C | <0,0001 | 11,32 |
Log (Área roseta) | 0,98 ± 0,01 B | 1,27 ± 0,01 A | 0,56 ± 0,02 D | 0,74 ± 0,01 C | <0,0001 | 5,12 |
Log (Peso fresco roseta) | -0,73 ± 0,01 B | -0,46 ± 0,01 A | -1,09 ± 0,02 D | -0,92 ± 0,02 C | <0,0001 | 8,21 |
Prolina (µMol/g) | 13,67 ± 2,03 C | 14,67 ± 1,07 C | 41,87 ± 1,67 B | 54,17 ± 1,88 A | <0,0001 | 9,46 |
Log (TRC) | -0,63 ± 0,01 B | -0,57 ± 0,01 A | -0,71 ± 0,01 D | -0,67 ± 0,01 C | <0,0001 | 2,32 |
Log (TAN) | -1,59 ± 0,01 B | -1,51 ± 0,01 A | -1,67 ± 0,02 BC | -1,62 ± 0,02 C | <0,0001 | 4 |
Peso de frutos* | 140,26 ± 2,65 C | 164,04 ± 2,11 A | 128,40 ± 2,89 D | 150,48 ± 3,02 B | <0,0001 | 9,22 |
Letras iguales no muestran diferencias estadísticas según el factor HSD de Tukey (α = 0,05), con un n = 20. Promedio ± error estándar. CV: Coeficiente de variación. *Estrés salino 50 mM NaCl según metodología.
Se encontró que dicho valor es diferente, dado que el peso seco radicular y foliar se incrementa en 0,15 mg/día y 1,5 mg/día, mientras que el peso fresco lo hace en 2,7 mg/día y 18 mg/día, respectivamente. Estos resultados pueden deberse a que se evaluaron bajo un fotoperiodo diferente al referenciado.
Índices de crecimiento
Tanto la TRC como la TAN obtenida a los 39 DDG nos demuestra una diferencia significativa cuando se aplica al bioestimulante CBX-103 con y sin estrés salino (ver Tablas 1 al 3).
Los índices de crecimiento son técnicas de análisis que nos brindan información sobre cómo va incrementando el área o peso seco (o ambos) a través del tiempo. Actualmente, estos análisis son bastante útiles para la agronomía y ecofisiología porque se necesitan variables de fácil cuantificación con resultados con suficiente precisión que permitan determinar como ejemplo, la productividad, fijación del carbono, entre otros (Poorter, 1989; Poorter & Garnier, 1996; Ordoñez et al., 2009; Poorter & Sack, 2012). El TRC es una manera de representar la eficiencia que tiene la planta de generar nuevo material (peso) a través del tiempo (Sivakumar & Shaw, 1978), por lo que también se considera como una medida que nos permite determinar el balance total de la fotosíntesis y respiración vegetal, consignándose como una representación del comportamiento fisiológico de las plantas (Radford, 1967), por lo que la aplicación del bioestimulante CBX-103 incrementa la materia seca a lo largo del tiempo.
TAN es otra medida que nos permite interpretar fisiológicamente a la planta, debido a que indica la ganancia neta de asimilados considerando el área foliar y durante un tiempo determinado, por lo cual depende de la edad de las hojas, del ciclo de crecimiento de la demanda de asimilados, etc. (Hunt, 1982).
Estados de crecimiento (EC)
Los EC también se vieron fuertemente afectados por el estrés salino, esto debido a que todas las plantas que no tenían estrés salino se encontraron en estado reproductivo, mientras las que tenían estrés salino presentan cierto porcentaje de plantas aún en estado vegetativo, siendo 30% para el tratamiento 200 mM NaCl y 5% para el tratamiento 200 mM NaCl + CBX-103 (Figura 3).
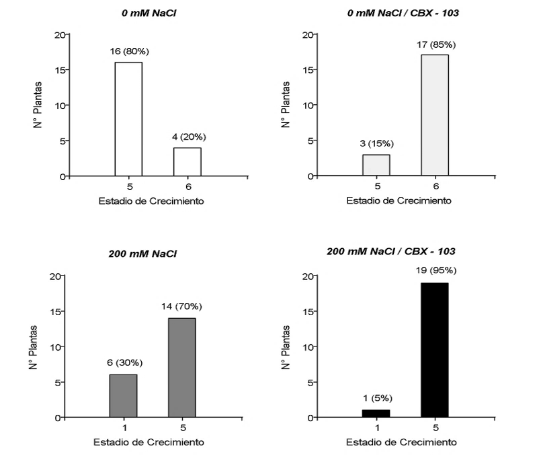
Figura 3. Estadios de crecimiento según la escala de BBCH (Boyes et al., 2001) de cada tratamiento, evaluados al día 39 DDG, n = 20. EC 1: producción de hojas. EC 5: emergencia de la inflorescencia. EC 6: floración.
La combinación de ácidos carboxílicos con otras sustancias ha mostrado tener la capacidad de estimular el crecimiento de las plantas mejorando su tolerancia a condiciones de estrés abiótico, como se evidenció en la investigación de Scaglia et al. (2017), pudiendo evitar cualquier posible retardo en su crecimiento. Nuestros resultados demuestran claramente que las plantas con aplicación de CBX-103 que no tienen estrés salino, presentan un 85% de las plantas que se encuentran en plena floración (EC6), comparado con las plantas sin aplicación de CBX-103 que solo presenta 20% en este estadio, según la escala de Boyes et al. (2001), mientras que en condiciones de estrés salino solo el 5% de plantas se encuentran en estado vegetativo (EC1) cuando se aplica CBX-103 en contraste con el 30% en EC1 que no fueron aplicadas con el biostimulante CBX-103 (Figura 3), sumado al incremento significativo en el peso seco de las semillas (expresado como productividad), estos resultados muestran a CBX-103 como potencial estrategia comercial en los principales cultivos comerciales que se encuentran en constante exposición a diferentes tipos de estrés, regulando su crecimiento.
Producción
Finalmente, los pesos de semillas muestran diferencias significativas en todos los trata-mientos, evidenciándose mayor promedio en las plantas aplicadas con el bioestimulante CBX-103 (Figura 4).
En la agricultura, uno de los principales fines es lograr mayor producción de los cultivos, ya sean vegetales, tubérculos, frutos, etc. En el presente estudio evidenciamos que la aplicación de CBX-103 induce una mayor producción a través de la obtención de semillas, tanto en condiciones normales como con estrés salino, probablemente por la acción de los oligogalacturónidos en la correcta organogénesis (Acosta et al., 2018) y también a la mayor fuente de energía que tenían en reserva bajo la forma de prolina (Sekhar et al., 2007).
4. Conclusiones
Las conclusiones deben ser concisas y representar los aspectos más importantes encontrados en el desarrollo del trabajo reportado. Debe intentar destacar los avances científicos y/o tecnológicos y/o teóricos efectivamente realizados. Finalmente, puede incluir de forma concisa, una posible investigación de trabajo futuro siguiendo la misma línea de investigación tratada en el estudio.
En el presente estudio se ha demostrado que las aplicaciones exógenas del bioestimulante CBX-103 incrementa el contenido foliar de prolina, ya sea en condiciones normales o con estrés salino, lo cual se traduce en la mejora del crecimiento vegetativo y productivo de A. thaliana Col 0.
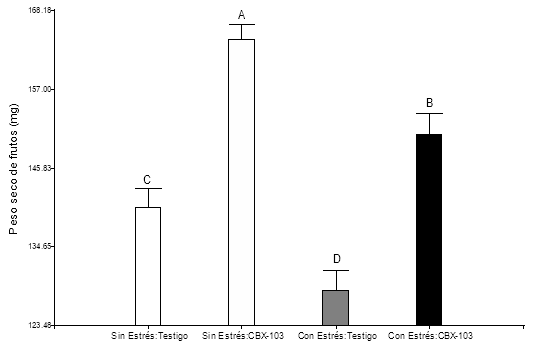
Figura 4. Peso de frutos (semillas y silicuas) en mg de cada Tratamiento, evaluados hasta el día 60 DDG, n = 30. Letras iguales no muestran diferencias estadísticas según el factor HSD de Tukey (α = 0,05).
La eficiencia de los componentes del bioesti-mulante CBX-103 en la recuperación del estrés salino, así como una posible ruta de su modo de acción mediante la regulación energética, lo convierten en una alternativa orgánica a ser utilizada para mitigar no solo el estrés salino, sino posiblemente otro tipo de estrés tanto abiótico como biótico, siendo relevante realizar mayores estudios que demuestren el potencial que tiene para enfrentar los problemas fisiológicos de los cultivos en la agricultura.
Agradecimientos
Este trabajo fue parcialmente financiado por el Vicerrectorado de Investigación y Posgrado - Universidad Nacional Mayor de San Marcos [Código N° B21100571] y por la empresa Biogen Agro SAC en donde se realizó la parte experimental. El presente artículo es parte de la tesis de Maestría en Biología Molecular de FEMP para la Universidad Nacional Mayor de San Marcos.
Referencias bibliográficas
Acosta, D. L., Menéndez, D. C., & Rodríguez, A. F. (2018). Los oligogalacturónidos en el crecimiento y desarrollo de las plantas. Cultivos Tropicales, 39(2), 127-134.
Almanza-Merchán, P. J., Tovar-León, Y. P., & Velandia-Díaz, J. D. (2016). Comportamiento de la biomasa y de las tasas de crecimiento de dos variedades de lulo (Solanum quitoense Lam.) en Pachavita, Boyacá. Ciencia y Agricultura, 13(1), 67-76.
Alharby, H .F., Al-Zahrani, H. S., Hakeem, K. R., Alsamadany, H., Desoky, E.-S. M.; Rady, M.M. (2021). Silymarin-Enriched Biostimulant Foliar Application Minimizes the Toxicity of Cadmium in Maize by Suppressing Oxidative Stress and Elevating Antioxidant Gene Expression. Biomolecules, 11, 465. https://doi.org/10.3390/biom11030465
Aswani, V., Rajsheel, P., Bapatla, R. B., Sunil, B., & Raghavendra, A. S. (2019). Oxidative stress induced in chloroplasts or mitochondria promotes proline accumulation in leaves of pea (Pisum sativum): another example of chloroplast-mitochondria interactions. Protoplasma, 256, 449-457. https://doi.org/10.1007/s00709-018-1306-1
Bates, L. S., Walden, R. P., & Tear, G. D. (1973). Rapid determination of free proline for water stress studies. Plant Soil, 39, 205–210. https://doi.org/10.1007/BF00018060
Bedoya-Perales N., Maus D., Neimaier A., Escobedo-Pacheco E., Pumi G. (2023). Assessment of the variation of heavy metals and pesticide residues in native and modern potato (Solanum tuberosum L.) cultivars grown at different altitudes in a typical mining region in Peru. Toxicology Reports, 11, 23-34. https://doi.org/10.1016/j.toxrep.2023.06.005
Bertrand, H., Nalin, R., Bally, R., & Cleyet-Marel, J. C. (2001). Isolation and identification of the most efficient plant growth-promoting bacteria associated with canola (Brassica napus). Biology and fertility of soils, 33, 152-156. https://doi.org/10.1007/s003740000305
Boyes, D. C., Zayed, A. M., Ascenzi, R., McCaskill, A. J., Hoffman, N. E., Davis, K. R., & Görlach, J. (2001). Growth stage-based phenotypic analysis of Arabidopsis: A model for high throughput functional genomics in plants. Plant Cell, 13(7), 1499–1510. https://doi.org/10.1105/tpc.13.7.1499
Costales, D., Martínez, L., & Núñez, M. (2007). Efecto del tratamiento de semillas con una mezcla de oligogalacturónidos sobre el crecimiento de plántulas de tomate (Lycopersicon esculentum Mill.). Cultivos Tropicales, 28(1), 85-91.
Dagar, J. C., Yadav, R. K., & Sharma, P. C. (2019). Research Developments in Saline Agriculture. Salinity Tolerance Indicators. 10.1007/978-981-13-5832-6 (Chapter 5), 155–201. https://doi.org/10.1007/978-981-13-5832-6_5
Desoky, E. -S. M., Elrys, A. S., Mansour, E., Eid, R. S. M., Selem, E., Rady, M. M., Ali, E. F., Mersal, G. A. M., & Semida, W. M. (2021). Application of biostimulants promotes growth and productivity by fortifying the antioxidant machinery and suppressing oxidative stress in faba bean under various abiotic stresses. Scientia Horticulturae, 288, 110340. https://doi.org/10.1016/j.scienta.2021.110340
Dwiningsih, Y., Kumar, A., Thomas, J., Ruiz, C., Alkahtani, J., Baisakh, N., & Pereira, A. (2021). Quantitative trait loci and candidate gene identification for chlorophyll content in RIL rice population under drought conditions. Indonesian Journal of Natural Pigments, 3(2), 54-64. http://doi.org/10.33479/ijnp.2021.03.2.54
Figueroa, L., & Neaman, A. (2023). Salinos, pero ácidos: una extraña combinación en suelos del valle de Lluta en el norte de Chile. Idesia (Arica), 41(1), 133-137. https://dx.doi.org/10.4067/S0718-34292023000100133
Gardner, F. P., Pearce, R. B., & Mitchell, R. L. (2017). Physiology of crop plants. Scientific publishers.
Ghosh, U. K., Islam, M. N., Siddiqui, M. N., Cao, X., & Khan, M. A. R. (2022). Proline, a multifaceted signalling molecule in plant responses to abiotic stress: understanding the physiological mechanisms. Plant Biology, 24(2), 227-239. https://doi.org/10.1111/plb.13363
Gupta, A., Rai, S., Bano, A., Khanam, A., Sharma, S., Pathak, N. (2021). Comparative evaluation of different salt tolerant plant growth promoting bacterial isolates in mitigating the induced adverse effect of salinity in Pisum sativum. Biointerface Research in Applied Chemistry, 11(5), 13141–13154. https://doi.org/10.33263/BRIAC115.1314113154
Hadavi, E., & Ghazijahani, N. (2022). Simple Organic Acids as Plant Biostimulants. In Biostimulants: Exploring Sources and Applications. Singapore: Springer Nature Singapore, 71–105. https://doi.org/10.1007/978-981-16-7080-0_4
Hameed, A., Ahmed, M. Z., Hussain, T., Aziz, I., Ahmad, N., Gul, B., & Nielsen, B. L. (2021). Effects of salinity stress on chloroplast structure and function. Cells, 10(8), 2023. https://doi.org/10.3390/cells10082023
Hess, M., Barralis, G., Bleiholder, H., Buhr, L., Eggers, T. H., Hack, H., & Stauss, R. (1997). Use of the extended BBCH scale—general for the descriptions of the growth stages of mono, and dicotyledonous weed species. Weed research, 37(6), 433-441. https://doi.org/10.1046/j.1365-3180.1997.d01-70.x
Hunt, R. (1982). Plant growth curves. The functional approach to plant growth analysis. Edward Arnold Ltd.
Jiménez-Vázquez, K. R., García-Cárdenas, E., Barrera-Ortiz, S., Ortiz-Castro, R., Ruiz-Herrera, L. F., Ramos-Acosta, B. P., Coria-Arellano, J. L., Sáenz-Mata, J., & López-Bucio, J. (2020). The plant beneficial Rhizobacterium achromobacter sp. 5B1 influences root development through auxin signaling and redistribution. Plant Journal, 103(5). https://doi.org/10.1111/tpj.14853
Lynch J. (1995). Root architecture and plant productivity. Plant Physiol.,109(1), 7-13. https://doi.org/10.1104/pp.109.1.7
Mayén-Villa, R. I., Morales-Rosales, E. J., Morales-Morales, E. J., & López-Sandoval, J. A. (2023). Rendimiento de tomate (Solanum lycopersicum) en función de fosfito de potasio como fertilizante foliar. Ecosistemas y recursos agropecuarios, 10(2). https://doi.org/10.19136/era.a10n2.3543
Monshausen, G. B., & Gilroy, S. (2009). The exploring root–root growth responses to local environmental conditions. Curr Opin Plant Biol., 12, 766-772. https://doi.org/10.1016/j.pbi.2009.08.002
Morton, M. J. L., Awlia, M., Al-Tamimi, N., Saade, S., Pailles, Y., Negrão, S., & Tester, M. (2019). Salt stress under the scalpel – Dissecting the genetics of salt tolerance. Plant J., 97, 148–163. https://doi.org/10.1111/tpj.14189
Ordoñez, J. C., Van Bodegom, P. M., Witte, J. P. M., Wright, I. J., Reich, P. B., & Aerts, R. (2009). A global study of relationships between leaf traits, climate and soil measures of nutrient fertility. Global Ecology and Biogeography, 18(2), 137-149. https://doi.org/10.1111/j.1466-8238.2008.00441.x
Orsini, F., Pennisi, G., Mancarella, S., Al Nayef, M., Sanoubar, R., Nicola, S., & Gianquinto, G. (2018). Hydroponic lettuce yields are improved under salt stress by utilizing white plastic film and exogenous applications of proline. Sci. Hortic., 233, 283–293. https://doi.org/10.1111/j.1466-8238.2008.00441.x
Passioura, J. B. (2002). Environmental biology and crop improvement. Functional Plant Biology, 29(5), 537-546. https://doi.org/10.1071/FP02020
Pereira, E. G., Amaral, M. B., Bucher, C. A., Santos, L. A., Fernandes, M. S., & Rossetto, C. A. V. (2021). Proline osmopriming improves the root architecture, nitrogen content and growth of rice seedlings. Biocatalysis and Agricultural Biotechnology, 33,101998. https://doi.org/10.1016/j.bcab.2021.101998
Poorter, H. (1989). Plant growth analysis: towards a synthesis of the classical and the functional approach. Physiologia Plantarum, 75(3), 237-244. https://doi.org/10.1111/j.1399-3054.1989.tb06175.x
Poorter, H., & Garnier, E. (1996). Plant growth analysis: an evaluation of experimental design and computational methods. Journal of Experimental Botany, 47(9), 1343-1351. https://doi.org/10.1093/jxb/47.9.1343
Poorter, H., & Sack, L. (2012). Pitfalls and possibilities in the analysis of biomass allocation patterns in plants. Frontiers in Plant Science, 3(259), 1-10. https://doi.org/10.3389/fpls.2012.00259
Porra, R. J., Thompson, W. A., & Kriedemann, P. E. (1989). Determi-nation of accurate extinction coefficients and simultaneous equations for assaying chlorophylls a and b extracted with four different solvents: verification of the concentration of chlorophyll II standards by atomic absorption spectroscopy. Biochim Biophys Acta, 975(3), 384–394. https://doi.org/10.1016/S0005-2728(89)80347-0
Radford, P. (1967). Growth analysis formulae. Their use and abuse. Crop Sci, 7(3), 171 - 175. https://doi.org/10.2135/cropsci1967.0011183X000700030001x
Reyes-Pérez, J. J., Ramos-Remache, R. A., Llerena-Ramos, L. T., Ramírez-Arrebato, M. Á., & Falcón-Rodríguez, A. B. (2021). Potentialities of oligogalacturonides and chitosaccharides on plant rooting. Terra Latinoamericana, 39.
Rolly, N. K., Imran, Q. M., Lee, I. J., & Yun, B. W. (2020). Salinity stress‐mediated suppression of expression of salt overly sensitive signaling pathway genes suggests negative regulation by AtbZIP62 transcription factor in Arabidopsis thaliana. International Journal of Molecular Sciences, 21(5), 1–17. https://doi.org/10.3390/ijms21051726
Sahi, C., Singh, A., & Kumar, K. (2006). Salt stress response in rice: genetics, molecular biology and comparative genomics. Funct. Integr. Genomics, 6, 263–284. https://doi.org/10.1007/s10142-006-0032-5
Scaglia, B., Pognani, M., & Adani, F. (2017). The anaerobic digestion process capability to produce biostimulant: the case study of the dissolved organic matter (DOM) vs. auxin-like property. Science of The Total Environment, 589, 36-45, https://doi.org/10.1016/j.scitotenv.2017.02.223
Shahid, S. A., Zaman, M., & Heng, L. (2018). Soil Salinity: Historical Perspectives and a World Overview of the Problem. In: Guideline for Salinity Assessment, Mitigation and Adaptation Using Nuclear and Related Techniques, Springer, Cham., 43–53. https://doi.org/10.1007/978-3-319-96190-3_2
Sekhar, P. N., Amrutha, R. N., Sangam, S., Verma, D. P. S., & Kishor, P. K. (2007). Biochemical characterization, homology modeling and docking studies of ornithine δ-aminotransferase—an important enzyme in proline biosynthesis of plants. Journal of Molecular Graphics and Modelling, 26(4), 709-719. https://doi.org/10.1016/j.jmgm.2007.04.006
Singh, R. P., Prakash, S., Bhatia, R., Negi, M., Singh, J., Bishnoi, M., & Kondepudi, K. K. (2020). Generation of structurally diverse pectin oligosaccharides having prebiotic attributes. Food Hydrocolloids, 108, 105988. https://doi.org/10.1016/j.foodhyd.2020.105988
Sivakumar, M. V. K., & Shaw, R. H. (1978). Methods of growth analysis in field-grown soya beans (Glicine max L.). Merril. Ann. Bot., 42(1), 213 - 222. https://doi.org/10.1093/oxfordjournals.aob.a085442
Souza, C. R., de Mello, A., Antunes, P., de Araújo Bitencourt, J., Sampaio, I., Carneiro, P. L. (2017). Species validation and cryptic diversity in the Geophagus brasiliensis Quoy & Gaimard, 1824 complex (Teleostei, Cichlidae) from Brazilian coastal basins as revealed by DNA analyses. Hydrobiologia, 809, 309-321. https://doi.org/10.1007/s10750-017-3482-y
Tuteja, N. (2007). Mechanisms of high salinity tolerance in plants. Methods Enzymol., 428, 419-438. https://doi.org/10.1016/S0076-6879(07)28024-3
Uddin, Md., & Juraimi, A. (2013). Salinity Tolerance Turfgrass: History and Prospects. The Scientific World Journal. 409413. https://doi.org/10.1155/2013/409413
Wani, A., Ahmad, A., Hayat, S., Tahir, I. (2016). Is foliar spray of proline sufficient for mitigation of salt stress in Brassica juncea cultivars?. Environ. Sci. Pollut. Res., 23, 13413–13423. https://doi.org/10.1007/s11356-016-6533-4
Yang, Y., & Guo, Y. (2018). Elucidating the molecular mechanisms mediating plant salt stress responses. New Phytol., 217, 523–539. https://doi.org/10.1111/nph.14920
Yildirim, E., Turan, M., & Donmez, M. F. (2008) Mitigation of salt stress in radish (Raphanus sativus L.) by plant growth: Promoting rhizobacteria. Romanian Biotechnological Letters, 86(3), 52-62.
(1)
(2)
(3)