1. Introducción
La guanábana (Annona muricata L.), conocida como graviola, pertenece a la familia Annonaceae, es nativa de las regiones más cálidas de América del Sur y del Norte y ha crecido de forma diversa en las regiones tropicales y subtropicales de América Central y del Sur (Moghadamtousi et al., 2015; Coria-Téllez et al., 2018). Es un árbol frutal, que está tomando gran auge por sus propiedades nutraceúticos (Alania-Lucero et al., 2021).
La guanábana es una fruta muy apreciada por sus propiedades organolépticas, medicinales y por su diversidad en la industrialización. Es un árbol o arbusto perennifolio/caducifolio, que varía de tamaño desde los 3 a 11 metros de altura, ramificado en la base y la copa tiene un desarrollo en forma cónica, el tronco puede medir hasta 20 cm de diámetro. Las ramas son de color castaño o gris, ásperas, redondeadas y arrugadas con numerosas lenticelas (Veloz, 2019). Las hojas se caracterizan por contener compuestos bioactivos que se degradan al separarse de la matriz nativa (Jordán, Glorio, & Vidal, 2021). Brinda beneficios a la salud debido a la presencia de componentes antioxidantes naturales, los cuales contribuyen a la prevención de enfermedades cardiovasculares, y otras enfermedades crónicas como cáncer, diabetes, alzheimer y enfermedades del corazón (Dar, Mahajan, Lay, & Sharma, 2018). Presenta en su composición nutricional proteínas, flavonoides y antioxidantes de alto beneficio para la alimentación, las cuales son extraídas de la pulpa, semilla y hojas (Mendoza et al., 2022).
Las frutas tropicales con mayor aceptación en el mercado mundial son aquellas que presentan propiedades alimenticias y curativas, de fácil digestión, con una relación entre azúcares y acidez aceptable (Echenique et al., 2020).
La guanábana se reproduce por semillas dando lugar a plantas francas; debido a ello, existe diversidad en la forma y tamaño de los frutos, que conduce a la existencia de gran variación genética que puede ser utilizada en la selección, pero antes es fundamental realizar investigaciones sobre la selección de genotipos superiores a través de la caracterización morfológica, el uso y la conservación (Terán-Erazo et al., 2019). Existe gran variación entre plantas de guanábana dentro de una misma especie tanto en el follaje y la productividad, en el tamaño, forma, color, número de semillas y calidad del fruto en la selección de plantas (Tincheu et al., 2021).
Existe baja diversidad en poblaciones de diferentes huertos comerciales propagadas por semillas en Nayarit, México (Talamantes-Sandoval, Cortés-Cruz, Balois-Morales, López-Guzmán, y Palomino-Hermosillo, 2019). Para los programas de mejoramiento, conocer la diversidad genética y su distribución de un cultivo es importante para la utilización del germoplasma. Aún no se cuenta con la descripción botánica referente a variedades de guanábana, los agricultores realizan selecciones de los mejores árboles de acuerdo con la calidad de la fruta por tamaño y grosor de cáscara.
Los estudios de variación fenotípica y genotípica identifican plantas élites para su uso como plantas madre en programas de mejoramiento de árboles frutales perennes, en base a características de rendimiento, componentes de calidad y cantidad de fruta (Moreira et al., 2018; Álvarez et al., 2019). La caracterización morfológica mediante descriptores facilita la agrupación de caracteres según la estructura de la planta, permite la identificación de caracteres distintivos, a partir de los cuales se puede realizar un mejoramiento genético dirigido a una estructura específica de las plantas, donde se identifican y seleccionan plantas como potenciales progenitoras para obtener variedades mejoradas para la industria y fruta fresca (Montaña et al., 2020). Asimismo, la caracterización de la diversidad morfológica de los cruzamientos proporciona información sobre las características, asegurando la máxima utilización de la colección de células germinales para las características del tallo, la hoja y el fruto (Montana et al., 2020).
Los frutos de la guanábana en muchos clones son de tamaño grande (15-20 cm). La pulpa contiene de 55 -170 semillas negras cubiertas con cáscara verde. Las cáscaras y semillas son partes no comestibles de la guanábana, hay una gran cantidad de subproductos de esta fruta que no han sido estudiados como fuente de compuestos bioactivos (Aguilar-Hernández et al., 2019).
La pulpa de guanábana es rica en nutrientes como proteínas, lípidos, fibra, cenizas y carbohidratos. El contenido de proteína de la pulpa de guanábana es similar al reportado para cereales importantes que contienen, en general, de 7,8 a 22,8% (Bernardino Tincheu et al., 2021).
Las características fisicoquímicas de los frutos de la colecta de guanábana revelan diferencias significativas en el color de la cáscara al madurar para el consumo, la firmeza de la piel y la relación acidez/dulzor; dadas las diferencias encontradas entre accesiones, permite la selección de materiales vegetales de acuerdo con las necesidades del mercado (Nolasco-González et al., 2020). La caracterización fisicoquímica y cuantitativa de los compuestos bioactivos de la semilla es importante para su aplicación en el desarrollo de productos farmacéuticos.
La producción de guanábana es afectada por insectos plaga como el picudo de las anonáceas (Optatus palmaris Pascoe) (Coleoptera: Curculionidae) barrenadores de la semilla (Bephratelloides maculicollis Cameron) (Hymenoptera: Eurytomidae) y Euphoria leucographa (Gory & Percheron) (Coleoptera: Melolonthidae) (Cambero et al., 2017). Asimismo, se ha reportado la asociación de los hongos C. gloeosporioides y Lasiodiplodia theobromae (Patouillard) Griffon y Maublanc con pudriciones secas y blandas respectivamente (Hernández et al., 2017). El estudio de la diagnosis de los agentes causales de las pudriciones de fruto de guanábana resulta de gran impacto económico debido a las pérdidas que estas ocasionan en volumen y calidad de producción.
EL objetivo del presente estudio fue caracterizar e identificar injertos clonales multipatrón con características morfológicas, fisicoquímicas y de sanidad para obtener buenos rendimientos y calidad de pulpa del fruto en poblaciones de guanábana.
2. Material y métodos
El material genético está formado por plantas clónales compatibles producto del proceso de injertación en multipatrones con yemas de plantas madre en producción de la empresa Selva Industria S.A, en etapa de fructificación entre 2,5 a 3 años de edad, instaladas en el terreno del anexo 14 de la E.E.A. San Ramón, Chanchamayo de la Universidad Nacional del Centro de Perú.
A la cosecha de los frutos se realizó la caracterización de fruta y pulpa de 40 plantas clonales injertadas (Tabla 1).
Disposición Experimental
El experimento en campo estuvo formado por 40 plantas, lote 1, extensión total de 1280 m2.
Caracterización morfológica de fruta
Se utilizó la “Lista de descriptores para guanábana” recomendado por CORPOICA, considerando caracteres principales del fruto, cada uno con sus estados correspondientes (Figura 1).
Análisis de la pulpa de los frutos
El pH se determinó por triplicado en la pulpa de guanábana por el método potenciométrico (AOAC 981.12. 2019). Para solidos solubles, fue mediante refractómetro (AOAC 932.12. 2019), expresado en °Brick. Se evaluó las pulpas libres de semillas de los frutos de las plantas clonales.
Tabla 1
Plantas clónales injertados
N° | CLON | INJERTACION |
1 | BA0007 | Blanca/Acorazonada |
2 | AL0008 | Annona/Lagarto |
3 | AB0011 | Annona/Blanca |
4 | AB0012 | Annona/Blanca |
5 | AL0013 | Annona/Lagarto |
6 | AB0014 | Annona/Blanca |
7 | AC0014 | Annona/Colombiana |
8 | AI01016 | Annona/INDALSA 063 |
9 | AI01017 | Annona/INDALSA 063 |
10 | AI01018 | Annona/INDALSA 063 |
11 | AI01019 | Annona/INDALSA 063 |
12 | AI01020 | Annona/INDALSA 063 |
13 | AL00023 | Annona/Lagarto |
14 | AL00025 | Annona/Lagarto |
15 | AL00026 | Annona/Lagarto |
16 | AC00027 | Annona/Colombiana |
17 | AC00028 | Annona/Colombiana |
18 | AB00029 | Annona/Blanca |
19 | AB00030 | Annona/Blanca |
20 | AAC0731 | Annona/Acorazonado |
21 | AL00132 | A |
22 | BI01033 | Blanca/INDALSA 063 |
23 | NI01034 | Negra/INDALSA 063 |
24 | NI02035 | Negra/INDALSA 130 |
25 | NI02036 | Negra/INDALSA 130 |
26 | AI02037 | Amarilla/INDALSA 130 |
27 | AI02037a | Amarilla/INDALSA 130 |
28 | BL00138 | Blanco/Lagarto |
29 | BL00139 | Blanco/Lagarto |
30 | NL00140 | Negra/Lagarto |
31 | NL00141 | Negra/Lagarto |
32 | NL00142 | Negra/Lagarto |
33 | NI02043 | Negra/INDALSA 130 |
34 | AI02044 | Amarrilla/INDALSA 063 |
35 | AAC0045 | Annona/Acorazonado |
36 | A1N0146 | Amarrilla/INDALSA 074 |
37 | AC00147 | Amarilla/Lagarto |
38 | A1N0150 | Amarilla/INDALSA 074 |
39 | NI02051 | Negra/INDALSA 130 |
40 | NI02052 | Negra/INDALSA 130 |
Análisis estadístico
El procesamiento de los datos de la caracterización morfológica de fruto y pulpa se realizó mediante el software estadístico InfoStat. Para determinas las características más sobresalientes de la pulpa se realizó tablas, gráficos de frecuencia y estadísticos descriptivos. Para ello, se utilizó el programa SPSS Ver. 24.
Podas de formación
Los árboles de guanábana responden bien a la poda de formación y se recomienda realizarla a partir del momento en que se establece el arbolito y hacerla durante los meses de floración escasa.
Se realizaron dos podas de formación a las plantas clonales el primero el 15 agosto del 2020 y el segundo el 30 de octubre del 2021, eliminando ramas laterales y centrales completas desde su inserción con el tronco o ramas principales, a fin de favorecer el crecimiento de las ramas restantes y tomen mayor fuerza. Además, con esta poda se logra una planta más abierta y con mayor iluminación al interior de la copa.
Los clones A101020, AI01017, AI01019, AI01018 y AI01016 tienen patrón Annona e injerto Indalsa-063, se agrupan por presentar 100% de similitud en las características cualitativas, el clon AC00147 de patrón Amarrilla e injerto Lagarto tienen 77,77% de similitud en las características forma de la base del fruto, forma de espina, tamaño de espina, diámetro de espina, forma de la base de la espina, forma del carpelo y color de la cáscara. El segundo grupo, formado por los clones NI02036 y NI02035 tienen patrón negro e injerto Indalsa-130 agrupadas al 100% de similitud en sus características cualitativas. Los clones AB0011, AB0012, AB0014, AB00030 y AB00029 presentan patrón Annona e injerto Blanco, agrupadas al 100% de similitud en sus características cualitativas. El clon AAC0045 tiene patrón Annona e injerto de fruto acorazonado presentando el 33,33% de similitud en las características de forma de la base del fruto, tamaño de la espina y diámetro de la espina. El tercer grupo, formado por los clones AC0014 y AC00027 presentan patrón Annona e injerto Colombina observándose 100% de similitud en sus características cualitativas. Los clones AI02037(a) y AI02037, con patrón Amarilla e injerto Indalsa-130, presentan 100% de similitud entre sus características cualitativas evaluadas en el presente estudio. Los clones BI01033 (Annona/Lagarto), AC00028 (Annona/colom-biana), BL00139 y BL00138 (Blanca/Lagarto), AACO73 (Annona/fruto acorazonado), se agrupan por presentar 11,11% de similitud en la característica forma de la base del fruto. El cuarto grupo, formado por los clones NI01034, AI02044 (Negra/Indalsa-063) y A1N0150, A1N0146 (Amarilla/Indalsa-074), se agrupan por presentar el 55,55% de similitud en las características forma de la base del fruto, forma del ápice del fruto, forma de la espina, tamaño de la espina y forma del carpelo. Leiva et al. (2018) indican que, las variables morfológicas del tallo, hojas y frutos en general son de gran importancia en el reconocimiento de las especies caracterizadas; además, permite discriminar de manera efectiva mediante diferencia o similitud existente entre los clones en estudio.
Caracterización morfológica cuantitativa de los clones injertadas de los frutos y pulpa
En la figura 4 se observa el dendograma formada por tres grupos principales, a un coeficiente de similitud de 12,33 para siete características cuantitativa de frutos por planta. El primer grupo, formado por dos sub grupos. Sub grupo 1 los clones BI01033, AI01020, AI01018, AI01019 y AI01017. Sub grupo 2, conformado por los clones AC0028, AL0008, AC0014 se agrupa por tener promedios cercanos a longitud de fruto (19,5 cm) y diámetro de fruto (26 cm) con los clones de patrón Annona e injerto Indalsa-063, NL00142, AL0013, AL00025, AL00026, AL00023 y AC00027 que mostraron un promedio de 1,342 kg/fruto, peso de pulpa 776 g/fruto, 156 semillas/fruto, con peso de semilla 102 g, longitud de fruto 14 cm y diámetro de fruto con 29 cm, coincidiendo con lo señalado por Hernández et al. (2017) que reportan un peso promedio de fruto de entre 0,72 a 1,93 kg en cinco selecciones y el peso de pulpa en promedio 551 g.
Incidencia y severidad de enfermedades en injertos de guanábano
La principal enfermedad que se presentó en los injertos multipatrón instalados en campos definitivo de San Ramón, Junín fue la antracnosis ocasionada por Colletotrichum spp. También se registró en algunos clones la presencia de un hongo Ascomyceto Albonectria sp. que ocasionaba una mancha foliar cuya incidencia y severidad fue no significativa, indicando que tiene baja virulencia.
La incidencia de la antracnosis causada por Colletotrichum evaluada como presencia o ausencia de la enfermedad en toda la población de plantas fue de 100% (Figura 7); es decir, todas las plantas mostraron síntomas de la enfermedad, pero con diferentes de escalas de infección.
Respecto a la severidad de la antracnosis referido al porcentaje de tejido foliar enfermo por cada planta de guanábana, los resultados del porcentaje de tejido enfermo en cada uno de los clones multipatrón presentaron reacción desde resistencia a susceptibilidad diferenciada en condiciones de inóculo natural. Los resultados que se presentan en la Figura 7 muestran la reacción del material genético expuesto en campo definitivo mostrando respuestas desde suscep-tibles correspondiente a los clones AB0011, BA0007, AC0015 y AC0002 con altos grados de severidad (55% a 60% de severidad); asimismo, otro grupo de clones de Annona squamosa tuvieron reacción de tolerancia, en la cual se observaron solamente trazas de la enfermedad que expresa la resistencia del material genético, estos clones multipatrones fueron AI01019, AL00132, AB00030 y AI02037 con solamente 1 a 3% de severidad, considerándose clones promisorios con resistencia decampo a la antracnosis ocasionada por Colletotrichum spp. en condiciones de selva central del Perú.
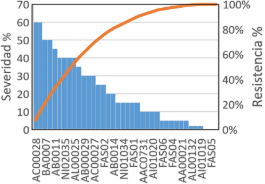
Figura 7. Reacción de resistencia de clones multipatrón de guanábana a la incidencia y severidad de antracnosis ocasionado por Colletotrichum lindemutianum. en condiciones de San Ramón.
Características de las pulpas
La variación de los cambios en sabor, color, textura y aroma en el proceso de maduración, están asociados con el climaterio. Arrazola et al. (2013), señalan a las guanábanas Annona Glabra L, y Annona muricata L. poseer pulpa blanca, jugosa, aromática y de sabor agridulce. Estas características coinciden en 26,3 % respecto a la característica jugosa de las pulpas obtenidas, las pulpas jugosas y semi jugosas son utilizadas en el procesamiento de néctares y mermeladas. En el caso del color, 43,1% de las pulpas mostraron color blanco y blanco nieve coincidiendo con lo señalado por Arrazola et al. (2013). Leiva et al. (2018), en los descriptores respecto al sabor señalan a la pulpa de guanábana que tiene sabor bastante ácido, esta característica coincide con los resultados obtenidos en el presente trabajo donde 42,1% de las pulpas tuvo sabor ácido. Villarreal et al. (2022) igualmente señala al fruto como acido, este sabor acido es una característica de néctares y mermeladas por lo que es importante contar con pulpas que tengan pH 5,5 a 3,7 (Babaji y Abu 2018). El pH máximo encontrado en las pulpas fue 4,70 y el mínimo 2,92 y como promedio fue 3,62; este valor muestra ligera diferencia al promedio 3,97 reportado en el estudio de León et al. (2016). Así mismo se encontró escasa diferencia a lo hallado 3,86 por Ramírez et al. (2012). Esta diferencia se puede deber a los patrones/injertos realizados, así como a la procedencia de los mismos, suelo y factores climáticos. Sin embargo, el pH promedio se encuentran dentro de 5,04- 3,42 (Tincheu et al. 2021) y de 3,00-4,00 (Mendoza et al., 2022). Los sólidos solubles totales expresados en ºBrix fue en promedio 17,10, este valor se encuentra dentro de los valores 13-24 °Brix, reportados por Ávila et al. (2012). El valor mínimo de Brix obtenido en la guanábana blanco /lagarto está dentro de 7,8- 15,1% en la pulpa cimarrona reportados por Arrazola et al. (2013). Según Nolasco et al. (2019) la textura de las pulpas de guanábana puede ser blanda, media y firme, en esta característica 57,9% de las pulpas obtenidas tuvo textura media, esto facilita la obtención de la pulpa y refinado de las mismas.
Nolasco et al. (2019) en sus descriptores, ellos reportan que, el aroma se clasifica como débil, medio y alto, al respecto 44,7 % de las pulpas de guanábana muestra aroma medio, 36,8% alto y 18,4% el aroma fue débil. Esta característica del aroma alto es importante porque da buenas características organolépticas a la pulpa y productos derivados de esta.
4. Conclusiones
Las plantas clonales injertados de guanábana de 2,5 a 3 años de vida presentan variabilidad genética en características cualitativas y cuantitativas de fruta y pulpa; por lo tanto, la variabilidad existente en los clones en el futuro contribuiría con el mejoramiento genético de la guanábana. En la caracterización de fruto, para peso presentaron valores entre 3,120 y 0,589 kg/fruto. En el análisis químico de pulpa para sólidos solubles totales en ºBrix fue de 17,10 y pH de 3,62. En sanidad mostraron resistencia los clones multipatrones AI01019, AL00132, AB00030 y AI02037 con solamente 1% a 3% de severidad, considerándose clones promisorios con resistencia de campo a la antracnosis ocasionada por Colletotrichum spp. en condicio-nes de selva central del Perú. Los resultados obtenidos permiten la selección por rendimiento y calidad del fruto en etapa de producción al cuarto y quinto año de plantas élites con un buen potencial productivo. Se recomienda hacer uso de la pulpa de estos clones seleccionados en el proceso de néctares y mermeladas pues es promisorio para estos productos.
Agradecimientos
El presente estudio fue realizado conjuntamente con los profesionales de la Universidad Nacional Alcides Carrión y la Universidad Nacional del Centro del Perú, en el marco del proyecto: Colección núcleo del germoplasma de guanábana de selva central del Perú.
Referencias bibliográficas
Aguilar-Hernández, G., Garcia-Magana, M. L., Vivar-Vera, M. A., Sayago-Ayerdi, S. G., Sánchez-Burgos, J. A., et al. (2019). Optimization of Ultrasound-Assisted Extraction of Phenolic Compounds from Annona muricata By-Products and Pulp. Molecules, 24(5), 904.
Alania-lucero, J., Atao-Surichaqui, E., & Erazo-Toscano, E. (2021). Prendimiento y crecimiento de injertos en plantones de guanábana (Annona muricata L.), en Satipo-Perú. Revista Agrotecnológica Amazónica, 2(1), e252.
Arrazola, G. S., Barrera, J., & Villalba, M. (2013). Determinación física y bromatológica de la guanábana Cimarrona (Annona glabra L.) del departamento de Córdoba. Orinoquía, 17, 159-166.
Bernardi, D., Ribeiro, L., Andreazza, F., Neitzke, C., Oliveira, E. E., Botton, M., & Vendramim, J. D. (2017). Potential use of Annona by products to control Drosophila suzukii and toxicity to its parasitoid Trichopria anastrephae. Industrial Crops and Products, 110, 30-35.
Cambero-Ayón, C., Rodríguez-Palomera, M., Cambero, J., Campos, K., & Cambero-Nava, G.( 2017). Euphoria leucographa (Gory & Percheron, 1833) (Coleoptera: Melolonthidae) on soursop fruits (Annona muricata L.) in Nayarit, México. Revista gaditana de Entomología, 8(2), 223-227.
Coria-Téllez, A. V., Montalvo-Gonzales, E., Yahia, E., & Obledo-Vázquez, E. (2018). Annona muricata: A comprehensive review on its traditional medicinal uses, phytochemicals, pharmacological activities, mechanisms of action and toxicity. Arabian Journal of Chemistry, 11(5), 662-691.
Dar, A. A., Mahajan, R., Lay, P., & Sharma, S. (2018). Biodiversity of temperate fruits. In: Mir, S. A., Shah, M. A., & Mir, M. M. (Eds.), Postharvest biology and technology of temperate fruits (pp. 1-20). Cham, Switzerland: Springer.
Echenique, Q., & Mollo, G. (2020). Establecimiento in vitro de segmentos nodales de guanábana (Annona muricata L.) en la Estación Experimentar-Bolivia. Revista de Investigación e Innovación Agropecuaria y de Recursos Naturales, 7(1), 62-68.
Hernández, F. L. M., Nolasco, G. Y., & Cruz, G. E. J. (2017). Selección y caracterización de guanábana y recomendaciones para su manejo agronómico. Instituto nacional de Investigaciones Forestales, Agrícolas y Pecuarias (INIFAP)-Campo Experimental Santiago Ixcuintla, Nayarit. México. Folleto técnico núm. 34. 57 p.
Jiménez, Z. J; Baloiz, M. R; Alia, T. I; Juárez, L. P; Sumaya, M. M, y Bello, L. B. (2016). Caracterización de frutos de guanabana (Annona muricata L.) en Tepic, Nayarit, México. Revista mexicana de ciencias agrícolas, 7(6), 1261-1270.
Jordan, O., Glorio, P., & Vidal, L. (2021). Optimization of processing parameters for the microencapsulation of soursop (Annona muricata L.) leaves extract: Morphology, physicochemical and antioxidant properties.Scientia Agropecuaria, 12(2), 161-168.
Mendoza, O., Palacios, A., Salinas, H., Sarmiento, K., & Paucar, L. M. (2022). Guanábana (Annona muricata L): Origen, características, cosecha, Postcosecha, actividad antioxidante, actividad antinflamatoria y beneficios parala salud. Agroind. sci., 12(1), 123 -129.
Moghadamtousi, S. Z., Fadaeinasab, M., Nikzad, S., Mohan, G., Ali, H. M., & Kadir, H. A. (2015). Annona muricata (Annonaceae): A Review of Its Traditional Uses, Isolated Acetogenins and Biological Activities. Int. J. Mol. Sci., 16(7), 15625-15658.
Montaña, G., Rodríguez, R., Jaramillo, B., Villamil, C., & Valencia, M. (2020). Caracterización morfológica de 160 accesiones de ajonjolí (Sesamum indicum L.) del banco de germoplasma de Colombia. Ciencia y Agricultura, 17(3), 63-67.
Moreira, R., Moreno, J., Buitrón, J., Orbe, K., Héctor-Ardisana, E., Uguña, F., & Viera, W. (2018). Characterización of a soursop population (Annona muricata) from the central región of Ecuatorian littoral using ISSR markers. Vegetos, 31(3), 13-18.
Ramírez, M. R., Arenas, D. M., Acosta, K., Yamarte, M., & Sandoval, L. (2012). Efecto del escaldado sobre la calidad nutricional de pulpa de guanábana (Annona muricata L.). Revista Iberoamericana de Tecnología Postcosecha, 13(1), 48-57.
Talamantes-Sandoval, C. A., Cortés-Cruz, M., Balois-Morales, R., López-Guzmán, G. G., & Palomino-Hermosillo, Y. A. (2019). Análisis molecular de la diversidad genética en guanábana (Annona muricata L.) mediante marcadores srap. Revista Fitotecnia Mexicana, 42(3), 209-2014.
Terán-Erazo, B., Alia-Tejacal, I., Balois-Morales, R., Juárez-López, P., López-Guzmán, G. G., Pérez-Arias, G. A., & Núñez-Colín, C. A. (2019). Caracterización física, química y morfológica de frutos de guanábana (Annona muricata L.). Agrociencia, 53(7), 1013-1027.
Tincheu, B., Egbél, E. C., Achidi, A. U., Tenyang, N., Tiepma, E. F., Djikeng, F. T., & Fssi, B. T. (2021). Nutritional, Organoleptic and Phytochemical Properties of Soursop (Annona muricata) Pulp and Juice after Postharvest Ripening. European Journal of Nutrition & Food Safety, 13(1), 15-28.
Veloz, D. (2019). Evaluación del efecto de dos tipos de cera en la conservación de guanábana Annona muricata L. a dos temperaturas de almacenamiento. [Tesis de título de Ingeniero Agrónomo]. Facultad de Ciencias Agrícolas, carrera de Ingeniería Agronómica. Universidad Central del Ecuador. Quito. Ecuador. 98 pp.
Villarreal-Fuentes, J. M., Alia-Tejacal, L., Hernández-Salvador, M. A., Hernández-Ortiz, E., Marroquín-Agreda, F. J.; Núñez-Colin, C. A., & Campos-Rojas, E. (2020). In situ characterization of soursop (Annona muricata L.) in the Soconusco region, Chiapas, Mexico. Revista Chapingo Serie Horticultura, 26(3), 189-205.