1. Introducción
El alto crecimiento poblacional, las necesidades energéticas y el avance industrial, están agotando cada vez más los recursos energéticos fósiles, además de surgir problemas de emisión de contaminantes que ponen en crisis el bienestar de la población mundial. Por estas razones, es necesario encontrar alternativas para la obtención de energía, además de tecnologías que puedan minimizar o eliminar los efectos adversos sobre el ambiente (Chu & Majumdar, 2012).
La crianza intensiva de cerdos es un ejemplo de industria con potencial de contaminación, esta actividad agropecuaria implica varios aspectos ambientales, como la generación de aguas residuales, que causan impactos negativos sobre el ambiente (Rodríguez-León et al., 2019). La Unidad Experimental de Cerdos (UEC) de la Universidad Nacional agraria La Molina (UNALM) corresponde a este tipo de industrias con las características previamente mencionadas. Durante el periodo 2008 al 2018, en la UEC se ha criado un máximo de 463 cerdos y un mínimo de 199, las distintas etapas del proceso productivo y la variabilidad en la cantidad de cerdos, puede afectar la cantidad y calidad de los efluentes (Iman, 2021), los cuales se caracterizan por sus altas concentraciones en materia orgánica, sólidos, aceites y grasas, nutrientes y agentes patógenos (Suero, 2016).
Es así que en este estudio se emplearon las celdas de combustible microbianas (CCM), o también denominadas bioceldas, una tecnología prometedora para el tratamiento de aguas residuales y producción de energía renovable de manera simultánea (Naseer et al., 2021; Singh & Kalia, 2017). En ellas, los microorganismos tienen la función de biocatalizadores para convertir la energía química a energía eléctrica a partir de la transformación directa de los compuestos orgánicos y/o inorgánicos en electricidad (Kim et al., 2004; Santoro et al., 2017). Una configuración típica de las CCM consiste en dos cámaras separadas por una membrana de intercambio de protones y electrodos en cada cámara conectados a través de un circuito externo (Hamed et al., 2020; Khamis et al., 2020). Las bacterias obtienen la energía necesaria para su subsistencia a partir de un donador de electrones como la materia orgánica presente en algunos efluentes. La oxidación de dicho sustrato se lleva a cabo en la cámara anódica y los electrones circularán por el circuito externo hasta un aceptor final de electrones en la cámara catódica, el oxígeno (Buitrón & Pérez, 2011; Kannan & Donnellan, 2021). En consecuencia, se genera una corriente eléctrica continua y se mejora la calidad del agua reflejados en la disminución, por ejemplo, de la demanda bioquímica de oxígeno (DBO5) y demanda química de oxígeno (DQO).
El objetivo de esta investigación fue comparar la reducción de la carga orgánica de los efluentes de la Unidad Experimental de Cerdos de la Universidad Nacional Agraria La Molina y la generación de bioelectricidad mediante el uso de celdas de combustible microbianas (bioceldas); teniendo en cuenta su desempeño con y sin el uso de inóculo. Se espera que el tratamiento con inóculo de estiércol vacuno tenga una mayor reducción de DQO y DBO5, además de un mejor desempeño en la generación de bioelectricidad.
2. Material y métodos
Los efluentes de la UEC son almacenados en una poza de 12 m3 de capacidad, de ella se tomaron 02 muestras de 20 litros cada uno y se caracterizó. Se empleó el multitester UNI – T UT61C para medir el voltaje como referente de la producción de energía eléctrica. Además, se efectuó el seguimiento de la calidad de agua teniendo en consideración al pH, conductividad eléctrica (CE) y temperatura utilizando el multiparámetro PCSTestr 35; demanda química de oxígeno (DQO) y demanda bioquímica de oxígeno (DBO5), estos fueron determinados por el laboratorio de SGS Perú (SMEWW-APHA-AWWA-WEF; 23rd Ed: 2017).
Diseño de las bioceldas
Se construyeron 3 bioceldas de doble cámara, el cátodo contiene agua del grifo aireado constantemente a una tasa de 3 L/min (bomba de aire SOBO SB – 108) y en el ánodo, el efluente con el tratamiento correspondiente. Las cámaras fueron elaboradas a partir de recipientes cilíndricos de plástico con capacidad neta de 3L. La conexión entre ambas cámaras se dio mediante una membrana de intercambio de protones (puente salino) y un circuito eléctrico externo. El primero fue fabricado con tubos PVC de 1 1⁄4’’ de diámetro y 4” de largo; rellenado con agar-agar al 5% y NaCl al 10% (Kumar et al., 2012). Para asegurar que no existe mezcla de fluidos entre cámaras o la pérdida de muestra por fugas, se realizó la prueba de hermeticidad (Figura 1). El test consiste en la inspección de las uniones entre niples y cámaras, y la observación de una posible transferencia del tinte azul de una cámara a otra, en este último caso se produciría la mezcla del agua aireada hacia la cámara anódica generando resultados no confiables (Condori & Torres, 2019). El circuito eléctrico externo estuvo conformado por una resistencia eléctrica de 1000 Ohm y cables de cobre que conectan los electrodos de grafito (Ø = 1,02 cm; L = 20 cm).

Figura 1. Prueba de hermeticidad e independencia entre las cámaras de las bioceldas.
Preparación del inóculo
Se adaptó el procedimiento descrito por Marks et al. (2020), quienes lo elaboraron a partir de la mezcla y homogeneización de agua destilada y estiércol de vaca en una proporción de 1:4, en esta investigación se empleó una proporción de 1:2. Las muestras de excretas fueron tomadas en la granja de vacunos de la UNALM. Para las bioceldas que empleaban inóculo, el tratamiento se efectuó en una proporción de 1:10 del inóculo y efluente, respectivamente.
Tratamiento del efluente
El experimento fue realizado en La Molina, Lima, Perú. Se trabajó en 02 lotes, cada uno con una duración de 13 días. El primer lote correspondió al tratamiento sin la adición de inóculo, se trabajó con los microorganismos autóctonos de los efluentes de la Unidad Experimental de Cerdos y el segundo lote, al tratamiento con inóculo.
La clasificación del efluente según su biodegradabilidad se determinó en función de la siguiente fórmula:
Biodegradabilidad = (DBO5)/DQO (1)
El monitoreo eléctrico se llevó a cabo mediante mediciones horarias de voltaje (Voltios). A partir de la ley de Ohm, se calculó la corriente eléctrica producida (Amperios). Posteriormente, se calculó la eficiencia coulómbica según Logan et al. (2006):

Análisis de datos
Los datos de las 4:00 y 5:00 horas fueron imputados mediante interpolación lineal teniendo en consideración los puntos vecinos de las 3:00 y 6:00 horas. Se empleó el software Minitab 19 para realizar el análisis de varianza (ANOVA) y una comparación de medias entre los tratamientos. El diseño experimental fue del tipo completamente al azar (DCA).
3. Resultados y discusión
Caracterización del efluente
La poza de almacenamiento es descargada semanalmente, este reúne los efluentes genera-dos en la limpieza de las granjas que incluye principalmente orina, además de residuos de sangre y restos de excretas. Durante los 2 muestreos, los efluentes de la UEC fueron de apariencia negruzca y con olor desagradable. Los valores promedio de la DBO5 y DQO fueron 6635 mg/L y 29360 mg/L respectivamente, el resto de los parámetros se muestran en la Tabla 1.
El cociente entre DBO5 y DQO es un indicador que hace referencia a cuán tratable es un efluente mediante sistemas biológicos; valores por debajo a 0,4, el efluente es difícilmente biodegradable y valores mayores a 0,6, indican que puede ser tratado con mayor facilidad (Ahn et al., 1999). La relación DBO5/DQO en esta investigación fue de 0,22, evidenciando que el efluente crudo es poco biodegradable, la diferencia en los resultados con otras investigaciones en la UEC radica principalmente en la DQO. Por ejemplo, Suero (2016) caracterizó los efluentes de la UEC, el valor de la DBO5 y DQO fue de 6470 mg/L y 9362 mg/L, respectivamente (DBO5/DQO = 0,69); valores similares de DQO fue encontrado por Pacco et al. (2018) (hasta 7047 mg/L).
Tratamiento del efluente
El pH, la conductividad eléctrica y la temperatura del efluente presentaron un comportamiento estable durante los tratamientos.
Tabla 1
Características fisicoquímicas del efluente
Parámetro | Efluente crudo | T1 | T2 |
pH | 7,0 | 7,3 | 7,1 |
CE (mS/cm) | 11,0 | 12,1 | 12,4 |
Temperatura (°C) | 24,0 | 25,3 | 26,1 |
Nota: CE representa la conductividad eléctrica. “T” denota la condición del agua residual postratamiento. T1 se refiere al tratamiento usando microorganismos autóctonos y T2, al tratamiento con estiércol vacuno como inóculo.
En la Figura 2 se observan reducciones en la DQO cercanas al 80% y de la DBO5, cercanas al 70%. El análisis de varianza demostró que los tratamientos tuvieron un efecto significativo en la reducción de la DQO y DBO5, sin embargo, no se evidenció diferencias significativas entre ellos respecto a las remociones medias de DQO y DBO5 (p = 0,181 y p = 0,275, respectivamente) a un nivel de significancia del 0,05.
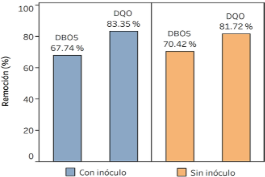
Figura 2. Porcentajes de remoción de DQO y DBO5 para los tratamientos con y sin inóculo.
Las altas remociones de DQO y DBO5 registradas durante los experimentos son causadas principal-mente por la sedimentación de sólidos, manifes-tándose en una fase con predominancia de sólidos (fase sólida) como se detalla en la Figura 3. Además, la diferencia no significativa entre los tratamientos podría ser explicado porque en los tratamientos con inóculo, la materia orgánica de las excretas pudo haberse incorporado en la fase acuosa causando que no se alcance remociones mayores durante el periodo de estudio.

Figura 3. Sedimentación de la fracción sólida del efluente al décimo tercer día.
Análisis de los parámetros eléctricos
Cada lote de tratamiento inició a las 15:00 horas. En la Figura 4 se observa que los voltajes iniciales son diferentes de cero y tienen una tendencia a disminuir en las primeras 100 horas. A nivel horario, el voltaje se comporta aumentando paulatinamente desde las 9:00 horas hasta las 16:00 horas; mientras que, por las noches, disminuye. Estadísticamente, los voltajes promedios en los tratamientos no tuvieron diferencias significativas (p = 0,634)
Min et al. (2005) explican que el potencial inicial diferente de cero en el cátodo y ánodo se debe a las reacciones oxidación-reducción espontáneas ocurridas en las cámaras anódicas (oxidación de sustancias) y catódicas (reducción del oxígeno) consideradas como factores químicos y biológicos en las bioceldas, esta condición explica el voltaje medido en el tiempo cero (t = 0 horas) de los tratamientos.
Asimismo, en diferentes investigaciones se halló una relación directa entre la temperatura y la densidad de potencia operando a temperaturas cercanas a la ambiental (Larrosa-Guerrero et al., 2010; Li et al., 2013; Ren et al., 2017), explicado por la variación de la resistencia interna de las bioceldas que depende de factores como la temperatura ambiental, configuración de la biocelda, material de los electrodos, distancia entre electrodos, superficie de los electrodos y la membrana de intercambio de protones (Larrosa-Guerrero et al., 2010; Liu et al., 2005). Adicionalmente, Gil et al. (2003) menciona que una alta resistencia eléctrica puede actuar como un limitante para la producción de corriente eléctrica, esto podría influir en la generación de bioelectricidad traducido como un bajo voltaje medido durante los tratamientos.
Respecto a la eficiencia coulómbica, se empleó el método del trapecio para la estimación de la integral, los trapecios formados tienen una altura de 24 horas y la integral se efectuó desde la hora 0 a la 311 (13 días), los resultados de estos cálculos están representados en la Figura 5. Es importante mencionar que la eficiencia coulómbica relaciona la carga generada con la carga teórica a partir de la degradación de un sustrato determinado, de ese modo, se compara el desempeño entre las bioceldas (Sharma & Li, 2010).
Los tratamientos tuvieron un efecto significativo en la eficiencia coulómbica, más la comparación de medias resultó no significativa (p = 0,978 y α = 0,05), es decir que, en ambos casos, el desempeño de la biocelda fue equivalente.
Los resultados que se presentan en la Figura 5 demuestran que la eficiencia coulómbica fue muy baja respecto a otras investigaciones (Condori & Torres, 2019; Estrada-Arriaga et al., 2018; Ma et al., 2016; Vogl et al., 2016), esto es explicado por factores físicos, de diseño y microbiológicos.
Para el factor físico, la EC tiene como divisor a la variación de la DQO, por lo tanto, a mayores valores de ΔDQO, la EC se reduce. La alta presencia de sólidos y su sedimentación, causó una brusca variación de la DQO haciendo que el cociente sea mucho menor. En relación al diseño, el desempeño de la biocelda presumiblemente fue afectado por sus dimensiones, por la sección transversal la membrana de intercambio de protones (Rossi & Logan, 2020) y la distancia entre electrodos de aproximadamente 20 cm (Ma et al., 2016; Sharma & Li, 2010). Finalmente, el factor microbiológico involucra la concentración y la aclimatación de los microorganismos capaces de generar energía eléctrica (Franks & Nevin, 2010; Park et al., 2017).
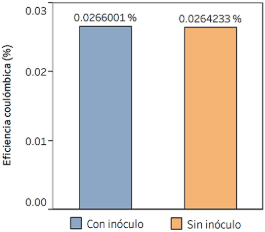
Figura 5. Eficiencia coulómbica promedio por tratamiento.
4. Conclusiones
La sedimentación fue el actor principal en la remoción de DQO y DBO5, lográndose reducir en 69,1% y 82,5% respectivamente. Los tratamientos no tuvieron diferencias estadísticamente significativas en los parámetros químicos del agua ni en los parámetros eléctricos, por lo que la adición de inóculo no implicó una mejora en la generación de bioelectricidad.
Se alcanzaron valores de voltajes promedio de 197,24 mV y 179,97 mV para el tratamiento con inóculo y sin inóculo, respectivamente. Se observó que el voltaje tiene un comportamiento característico a nivel horario que se asemeja a la variación horaria de la temperatura ambiental. Las eficiencias coulómbicas fueron muy bajas (EC menor a 0,1%), esto fue explicado por la poca biodegradabilidad del efluente, factores de diseño, insuficiente número de microorganismos electrogénicos, inóculo sin aclimatación y la gran diferencia entre la DQO inicial y final.
Es de gran importancia que en futuras investiga-ciones se busque maximizar la eficiencia coulómbica que significaría una buena recupera-ción de la energía química a través de la bioelectricidad. Esto podría alcanzarse reducien-do la resistencia interna de la biocelda o empleando inóculos aclimatados a este tipo de efluentes, por ejemplo, obtenidos de algunos biodigestores. La generación de bioelectricidad por este medio puede ser una alternativa importante en el futuro, por lo que el conocimiento sobre este tema debe seguir desarrollándose.
Agradecimientos
Al Círculo de Investigación en Pirólisis y Biomasa, y a sus integrantes por ser voluntarios en apoyar el desarrollo del proyecto. Además, al Laboratorio de Energías Renovables (LER) de la UNALM, por brindar sus instalaciones y equipos que facilitó la parte experimental de esta investigación. Este proyecto fue financiado en marco del “9no Concurso de Investigación: Proyecto de Investigación Junior UNALM – 2019 IV convocatoria - Círculos de Investigación”.
Referencias bibliográficas
Ahn, D. H., Chang, W. S., & Yoon, T. Il. (1999). Dyestuff wastewater treatment using chemical oxidation, physical adsorption and fixed bed biofilm process. Process Biochemistry, 34(5), 429–439.
Buitrón, G., & Pérez, J. (2011). Producción de electricidad en celdas de combustible microbianas utilizando agua residual: efecto de la distancia entre electrodos. TIP Revista Especializada En Ciencias Químico-Biológicas, 14(1), 5–11.
Chu, S., & Majumdar, A. (2012). Opportunities and challenges for a sustainable energy future. Nature, 488(7411), 294–303.
Condori, A., & Torres, G. (2019). Biodegradación de la materia orgánica y producción de Bioelectricidad en Celdas de Combustible Microbiano (CCM) a partir del agua residual doméstica – Lima (Tesis de Grado). Universidad Peruana Unión]. Repositorio Institucional – Universidad Peruana Unión
Estrada-Arriaga, E. B., Hernández-Romano, J., García-Sánchez, L., Guillén Garcés, R. A., Bahena-Bahena, E. O., Guadarrama-Pérez, O., & Moeller Chavez, G. E. (2018). Domestic wastewater treatment and power generation in continuous flow air-cathode stacked microbial fuel cell: Effect of series and parallel configuration. Journal of Environmental Management, 214, 232–241.
Franks, A. E., & Nevin, K. P. (2010). Microbial fuel cells, a current review. Energies, 3(5), 899–919.
Gil, G. C., Chang, I. S., Kim, B. H., Kim, M., Jang, J. K., Park, H. S., & Kim, H. J. (2003). Operational parameters affecting the performance of a mediator-less microbial fuel cell. Biosensors and Bioelectronics, 18(4), 327–334.
Hamed, M. S., Majdi, H. S., & Hasan, B. O. (2020). Effect of Electrode Material and Hydrodynamics on the Produced Current in Double Chamber Microbial Fuel Cells. ACS Omega, 5, 10339–10348.
Iman, I. A. M. (2021). Potencial energético de la biomasa residual pecuaria en el campus de la UNALM [Tesis de Grado, Universidad Nacional Agraria La Molina]. http://repositorio.lamolina.edu.pe/handle/UNALM/4692
Kannan, N., & Donnellan, P. (2021). Algae-assisted microbial fuel cells: A practical overview. Bioresource Technology Reports, 15, 1–13.
Khamis, A., Nordin, N., & Mokhtar, M. H. (2020). Performance of double chamber microbial fuel cell: Effect of waste water, electrode thickness and distance. Indonesian Journal of Electrical Engineering and Computer Science, 20(2), 619–626.
Kim, B. H., Park, H. S., Kim, H. J., Kim, G. T., Chang, I. S., Lee, J., & Phung, N. T. (2004). Enrichment of microbial community generating electricity using a fuel-cell-type electrochemical cell. Applied Microbiology and Biotechnology, 63(6), 672–681.
Kumar, S., Kumar, H. D., & K, G. B. (2012). A study on the electricity generation from cow dung using microbial fuel cell. Journal of Biochemical Technology, 3(4), 442–447.
Larrosa-Guerrero, A., Scott, K., Head, I. M., Mateo, F., Ginesta, A., & Godinez, C. (2010). Effect of temperature on the performance of microbial fuel cells. Fuel, 89(12), 3985–3994.
Li, L. H., Sun, Y. M., Yuan, Z. H., Kong, X. Y., & Li, Y. (2013). Effect of temperature change on power generation of microbial fuel cell. Environmental Technology, 34(13–14), 1929–1934.
Liu, H., Cheng, S., & Logan, B. E. (2005). Power generation in fed-batch microbial fuel cells as a function of ionic strength, temperature, and reactor configuration. Environmental Science and Technology, 39(14), 5488–5493.
Logan, B. E., Hamelers, B., Rozendal, R., Schröder, U., Keller, J., Freguia, S., Aelterman, P., Verstraete, W., & Rabaey, K. (2006). Microbial fuel cells: Methodology and technology. Environmental Science and Technology, 40(17), 5181–5192.
Ma, D., Jiang, Z. H., Lay, C. H., & Zhou, D. (2016). Electricity generation from swine wastewater in microbial fuel cell: Hydraulic reaction time effect. International Journal of Hydrogen Energy, 41(46), 21820–21826.
Marks, J., Kirkel, J., Sekoai, P., Enweremadu, C., & Daramola, M. (2020). Effect of combining different substrates and inoculum sources on bioelectricity generation and COD removal in a two-chambered microbial fuel cell: A preliminary investigation. Environmental and Climate Technologies, 24(2), 67–78.
Min, B., Cheng, S., & Logan, B. E. (2005). Electricity generation using membrane and salt bridge microbial fuel cells. Water Research, 39(9), 1675–1686.
Naseer, M. N., Zaidi, A. A., Khan, H., Kumar, S., Taha Bin Owais, M., et al. (2021). Mapping the field of microbial fuel cell: A quantitative literature review (1970-2020). Energy Reports, 7, 4126–4138.
Pacco, A., Vela, R., Miglio, R., Quipuzco, L., Juscamaita, J., Álvarez, C., Fernández -Polanco, F., & Molina, L. (2018). Propuesta de parámetros de diseño de un reactor UASB para el tratamiento de aguas residuales porcinas Proposal design parameters of a UASB reactor treating swine wastewater Scientia Agropecuaria 9(3): 381-391 (2018).
Park, Y., Cho, H., Yu, J., Min, B., Kim, H. S., Kim, B. G., & Lee, T. (2017). Response of microbial community structure to pre-acclimation strategies in microbial fuel cells for domestic wastewater treatment. Bioresource Technology, 233, 176–183.
Ren, H., Jiang, C., & Chae, J. (2017). Effect of temperature on a miniaturized microbial fuel cell (MFC). Micro and Nano Systems Letters, 5(1), 3–9.
Rodríguez-León, L. D., Ordoñez-Vásquez, K. M., & Quizhpe-Cordero, P. F. (2019). Estrategias para mitigar el impacto ambiental generado por la porcicultura hacia la contribución del desarrollo sostenible: Sitio Banasur, cantón Pasaje. Polo Del Conocimiento, 4(8), 51–70.
Rossi, R., & Logan, B. E. (2020). Unraveling the contributions of internal resistance components in two-chamber microbial fuel cells using the electrode potential slope analysis. Electrochimica Acta, 348, 136291.
Santoro, C., Arbizzani, C., Erable, B., & Ieropoulos, I. (2017). Microbial fuel cells: From fundamentals to applications. A review. Journal of Power Sources, 356, 225–244.
Sharma, Y., & Li, B. (2010). Optimizing energy harvest in wastewater treatment by combining anaerobic hydrogen producing biofermentor (HPB) and microbial fuel cell (MFC). International Journal of Hydrogen Energy, 35(8), 3789–3797.
Singh, L., & Kalia, V. C. (2017). Microbial Fuel Cells: Types and Applications. In Waste Biomass Management - A Holistic Approach (pp. 367–384).
Suero, D. E. (2016). Evaluación de opciones tecnológicas para el tratamiento de efluentes de la unidad experimental de cerdos de la UNALM [Tesis de Grado, Universidad Nacional Agraria La Molina]. http://repositorio.lamolina.edu.pe/handle/UNALM/2860
Vogl, A., Bischof, F., & Wichern, M. (2016). Single chamber microbial fuel cells for high strength wastewater and blackwater treatment—A comparison of idealized wastewater, synthetic human blackwater, and diluted pig manure. Biochemical Engineering Journal, 115, 64–71.