Efecto hepatoprotector de una mezcla de plantas medicinales y vitaminas en Rattus norvegicus con intoxicación hepática
Hepatoprotective effect of a mixture of medicinal plants and vitamins in Rattus norvegicus with liver poisoning
Ruben Eduardo Cueva-Mestanza1, 2 *
1 Escuela de Farmacia y Bioquímica, Universidad María Auxiliadora Lima 36 Lima, Perú.
2 Escuela de Farmacia y Bioquímica, Universidad Nacional Mayor de San Marcos. Lima, Perú.
ORCID de los autores
R. Cueva-Mestanza: https://orcid.org/0000-0002-0271-5427
RESUMEN
En la presente investigación se estudió el efecto hepatoprotector de una mezcla de polvo de hojas de Gentianella alborosea (Gilg) Fabris, Cynara scolymus, Berberis vulgaris, Peumus boldus, raíces de Taraxacum officinale, y vitaminas B6 y B12 (PROTHEPA®) en Rattus norvegicus Sprague Dawley con intoxicación hepática inducida por paracetamol. En el experimento, 25 ratas hembra fueron distribuidas aleatoriamente en cinco grupos, G1: suero fisiológico (SF) 4 mL/kg; G2 (control negativo): SF 4 mL/kg + paracetamol 400 mg/kg; G3 (control positivo): Silimarina 100 mg/kg + paracetamol 400 mg/kg; G4: Mezcla PROTHEPA® 100 mg/kg + paracetamol 400 mg/kg; y G5: Mezcla PROTHEPA® 500 mg/kg + paracetamol 400 mg/kg. Se realizaron análisis bioquímicos para determinar el perfil hepático (transaminasas glutámico oxalacético (TGO), transaminasa glutámico pirúvico (TGP), bilirrubinas totales (BT), y proteínas totales (PT)), así como, evaluaciones anatomo-patológicas. Los resultados demostraron que G2 presenta un incremento significativo de TGP (80,20 ± 1,3), BT (0,39 ± 0,23), y una reducción importante de PT (4,82 ± 0,46). En cuanto a G3, G4 y G5; todas las pruebas permanecieron dentro de los valores normales, similares a G1. Estos resultados demuestran que las mezclas PROTHEPA® de 100 mg/kg y 500 mg/kg presentan efecto hepatoprotector, lo cual se corrobora con las evaluaciones anatomo-patológicas.
Palabras clave: Hepatoprotector; Prothepa Silimarina; paracetamol; hígado; analgésicos.
ABSTRACT
In the present investigation, the hepatoprotective effect of a powder mixture of leaves of Gentianella alborosea (Gilg) Fabris, Cynara scolymus, Berberis vulgaris, Peumus boldus, Taraxacum officinale roots, and vitamins B6 and B12 (PROTHEPA®) was studied in Rattus norvegicus. Sprague Dawley with paracetamol-induced liver intoxication. In the experiment, 25 female rats were randomly distributed into five groups, G1: physiological serum (SF) 4 mL/kg; G2 (negative control): SF 4 mL/kg + paracetamol 400 mg/kg; G3 (positive control): Silymarin 100 mg/kg + paracetamol 400 mg/kg; G4: PROTHEPA® mixture 100 mg/kg + paracetamol 400 mg/kg; and G5: PROTHEPA® mixture 500 mg/Kg + paracetamol 400 mg/kg. Biochemical analyzes were performed to determine the liver profile (glutamic oxalacetic transaminase (GOT), glutamic pyruvic transaminase (GTP), total bilirubin (BT), and total protein (PT)), as well as pathological evaluations. The results showed that G2 presents a significant increase in TGP (80.20 ±1.3), BT (0.39 ± 0.23), and a significant reduction in PT (4.82 ± 0.46). As for G3, G4 and G5; all tests remained within normal values, similar to G1. These results demonstrate that the PROTHEPA® mixtures of 100 mg/kg and 500 mg/kg have a hepatoprotective effect, which is corroborated by the anatomo-pathological evaluations.
Keywords: Hepatoprotective; Prothepa Silymarin; paracetamol; liver; analgesics.
1. Introducción
El hígado es el principal órgano afectado por múltiples procesos inflamatorios inducidos por virus, medicamentos o sus metabolitos (Teja et al., 2005). Las afecciones hepáticas representan uno de los principales problemas de salud a nivel mundial a nivel mundial, en el Perú se encuentran ubicadas en el quinto puesto debido al uso de medicamentos hepatotoxicos entre ellos cabe resaltar a los antidepresivos, AINES, benzodiacepinas, etc. (Bustios, Dávalos, Román, y Zumaeta, 2007). La toxicidad hepática se puede definir como un deterioro del hígado afectando sus funciones a causa de un exposición a agenten lesivos como fármacos u agentes infecciosos (Fernández, 2015). El acetaminofén o paracetamol se ha posicionado como uno de los analgésico y antifebriles más utilizados a nivel mundial, en gran parte debido a su libre comercialización, amplia acción terapéutica y al ser considerado relativamente seguro. No obstante, se ha demostrado que una sobredosis con este fármaco puede conducir a una necrosis hepática ocasionando el deceso de la persona. Por otro lado la Silimarina que es básicamente una mezcla de flavonoides aislados del cardo mariano ( Silibina, Silidianina y Silicristina) este el activo presente en la mayoría de los fármacos hepatoprotectores, el cual ha demostrado eficacia y seguridad frente a las enfermedades hepáticas por tal razón se seleccionó como control positivo (Vargas, 2016).
Existen en el mercado varios productos comerciales a base de plantas medicinales que indican brindar beneficiosa la salud de las personas; sin embargo, no cuentan con el debido sustento científico. Por tal motivo se decidió elegir un producto que contenga en su composición plantas que tengas estudios que presenten efecto hepatoprotector de manera individual, Peumus boldus “Boldo” (Yovera, 2015), Gentianella alborosea “Hercampuri” (Ugaz, Zafra y Tapia, 2012, Quiroz, 2019) Cynara scolymus “Alcachofa” (Osorio, 2012), Berberis vulgaris “agracejo (Tahmasebi et al., 2018) Taraxacum officinale “diente de león” (Favari, Arce, Ortiz, Perez, Soto y Melendez, 2013), seleccionandose evaluar el efecto hepatoprotector de un producto a base de una mezcla de polvo de hojas de Gentianella alborosea (Gilg) Fabris “hercampuri”, hojas de Cynara scolymus “alcachofa”, hojas de Berberis vulgaris “agracejo”, hojas de Peumus boldus “boldo”, raíces de Taraxacum officinale “diente de león”, vitamina B6 y vitamina B12 (PROTHEPA®) en Rattus norvegicus Sprague Dawley con intoxicación hepática inducida por paracetamol.
2. Materiales y métodos
Se empleó la técnica de inducción a hepato-toxicidad por paracetamol propuesta por Gibson et al. (1996). El producto PROTHEPA® es una mezcla de polvo de hojas de Gentianella alborosea (Gilg) Fabris, hojas de Cynara scolymus, hojas de Berberis vulgaris, hojas de Peumus boldus, raíces de Taraxacum officinale, vitamina B6 y vitamina B12 caja por 100 capsulas en blíster, lote: 2010080, fecha de expira 01-2023, fue brindado por Laboratorios Biosana SAC.
Descripción de la muestra: Cápsulas con polvo no homogéneo, de color verde amarillento, con olor y sabor característico, con peso promedio de 383,8 mg, polvo parcialmente soluble en agua y con 8,5% de humedad. Limite microbiológico (unidades formadoras de colonia UFC): Mohos: recuento <10 ufc/g, Coliformes: recuento <10 ufc/g, Staphylococcus aureus: recuento <10 ufc/g, Salmonella sp: Ausente/ 25 g.
Tratamiento Experimental: Se emplearon 25 ratas hembra de la especie Rattus norvegicus, cepa Sprague Dawley con un peso de entre 160 a 190 gramos, las cuales fueron acondicionadas por una semana con periodos intermitentes de 12 horas de exposición a la luz y 12 horas en la oscuridad en un ambiente estándar a una temperatura de entre 20 a 25 °C. La distribución de las ratas se llevó a cabo en 5 grupos al azar de 5 ratas cada uno (Tabla 1), recibieron comida y agua (normoproteica y normocalórica). En el octavo día se llevó a cabo el peso y rotulado de cada rata empleada en el estudio, para dar inicio al desarrollo experimental del proyecto, durante los siguientes diez días. Tiempo en el cual se procedió a evaluar la acción hepatoprotectora de la mezcla PROTHEPA® ratas de la especie Rattus norvegicus, cepa Sprague Dawley con intoxicación hepática inducida por paracetamol(5). Al finalizar el experimento se obtuvo 5 mL de sangre arterial por punción cardiaca para el control de análisis de enzimas hepáticas; transaminasas glutámico oxalacético (TGO), transaminasa glutámico pirúvico (TGP), bilirrubinas totales (BT), y proteínas totales (PT).
Posteriormente, los animales fueron sacrificados mediante el método de degollación y se extrajeron sus hígados para el análisis anatomohistopa-tológico.
Tablas 1
Grupos de experimentación
G1 (Blanco) | G2 (Control negativo) | G3 (Control positivo) | G4 | G5 |
Suero fisiológico 0,9% | Suero fisiológico 0,9% | Silimarina 100 mg/kg | Mezcla PROTHEPA® 100 mg/kg | Mezcla PROTHEPA® 500 mg/kg |
| Paracetamol 400 mg/kg | Paracetamol 400 mg/kg | Paracetamol 400 mg/kg | Paracetamol 400 mg/kg |
Componente ético de la Investigación
El manejo de los animales empleados en el desarrollo de esta investigación se realizó según lo estipulado en el Art 19 de la ley de protección y bienestar animal (Perú ley Nº 30407) (Yovera, 2015). Las técnicas empleadas están diseñadas para reducir al mínimo el dolor y sufrimiento que se infringe a los animales empleados en esta investigación (ratas), tanto al suministrar los medicamentos como en el momento de su sacrificio. Por ello se tuvo en cuenta el principio de las tres R (Pardo, 2005).
Procedimiento y análisis de datos
Los datos fueron organizados para ser analizados por grupos, comparándose el blanco (G1) sin daño ni tratamiento, control negativo (G2) con daño, frente al grupo control positivo (G3) con daño y tratamiento, y a los grupos experimentales (G4 y G5). El análisis de datos se llevó a cabo a través del software estadístico SPSS versión 21.0 para Windows y Minitab.
3. Resultados y discusión
Resultados de los parámetros bioquímicos
En la Tabla 2 se exponen los valores de concentración del perfil hepático de todos los grupos. Grupo blanco (G1) demostró valores normales de transaminasas glutámico oxalacético (TGO), transaminasa glutámico pirúvico (TGP), bilirrubinas totales (BT) y proteínas totales (PT). Grupo control negativo (G2) a diferencia de (G1) señala un aumento importante de TGP. Con relación al grupo control positivo (G3), los valores de TGO, TGP y BT se encontraron dentro de los valores estándar. En el grupo tratado con PROTHEPA® 100 mg/kg (G4), los valores hallados fueron similares a G1. En el grupo tratado con PROTHEPA® 500 mg/kg (G5), los hallasgos demostraron valores normales con similitud a G1 y G3.
Se compararon todos los resultados bioquímicos obtenidos a través de la prueba de análisis de varianza (ANOVA). Para la comparar los prome-dios entre los grupos tratamiento y experimental, se obtuvo que sólo existe diferencia significativa para TGP. En la Tabla 3 se observa el valor de significancia 2 subconjuntos de comparación para TGP; el único grupo que obtuvo diferencia es el control negativo (G2) para un alfa = 0,05 en HSD.
Tabla 3
Determinación de la efectividad de los tratamientos empleado, análisis de HSD Turkeya para TGP
Grupos | N | Subconjunto para alfa = 0,05 |
1 | 2 |
Blanco | 5 | 43,0000 | |
Mezcla PROTHEPA® 100 mg /kg | 5 | 52,2000 | |
Mezcla PROTHEPA® 500 mg /kg | 5 | 58,0000 | 58,0000 |
Control positivo | 5 | 67,2000 | 67,2000 |
Control negativo | 5 | | 80,2000 |
Sig. | | 0,055 | 0,089 |
Se visualizan las medias para los grupos en los subconjuntos homogéneos. |
- Utiliza el tamaño de la muestra de la media armónica = 5,000.
|
Tabla 2
Perfil hepático de las ratas Rattus norvegicus hembras Sprague Dawley
Valores normales | TGO (UI/L) 79,5 – 248,1 | TGP (UI/L) 20,2 – 69,8 | BT (mg/dL) 0,005 – 0,19 | PT(g/dL) 6,11 – 17,49 |
G1 | 191,40 | ± 65,68 | 43,00 | ± 8,24 | 0,21 | ± 0,07 | 5,22 | ± 0,21 |
G2 | 193,00 | ± 63,73 | 80,20 | ± 1,34 | 0,39 | ± 0,23 | 4,82 | ± 0,46 |
G3 | 225,40 | ± 100,40 | 67,20 | ± 10,94 | 0,21 | ± 0,05 | 4,44 | ± 0,44 |
G4 | 187,80 | ± 36,72 | 52,20 | ± 16,04 | 0,21 | ± 0,10 | 4,72 | ± 0,16 |
G5 | 231,20 | ± 113,76 | 58,00 | ± 16,43 | 0,23 | ± 0,07 | 4,50 | ± 0,00 |
En este estudio se administró paracetamol 400 mg/kg para inducir el daño hepático en ratas hembra Sprague Dawley durante 10 días. Los resultados se pueden observar en la tabla 2, donde se resalta que el grupo control negativo (G2) muestra niveles altos de transaminasa glutamico pirúvica (TGP). Esto demuestra que el fármaco causó un efecto tóxico sobre el parénquima hepático, provocando el daño en la membrana plasmática hepatocelular, y así ocasionando la liberación de la enzima TGP del citosol al torrente sanguíneo. Esta información se corrobora con el mecanismo de la hepatotoxicidad inducida por acetaminofén, estudio realizado por Gibson et al. (1996). Por otro lado, el grupo de mezcla PROTHEPA® 100 mg/kg (G4), nos muestra una media donde los valores bioquímicos se encuentran dentro de los valores normales, se asemeja a los resultados del grupo blanco (G1). De esta manera, se entiende que las plantas medicinales y vitaminas presentes en la mezcla PROTHEPA® a concentración de 100 mg/kg protegen al hígado frente a un daño inducido por paracetamol de 400 mg/kg. Resultados similares se observan en estudios realizados para las plantas de manera individual, así como el efecto protector en el hígado que presentan las vitaminas B6 y B12, Yovera (2015) comprobó el efecto hepatoprotector de 200 mg/kg de extracto acuoso de las hojas de Peumus boldus “Boldo” en la intoxicación hepática inducida por isoniazida, Novoa et al. (2008) encontró que Gentianella alborosea “Hercampuri” a dosis de 35 mg/kg disminuye la necroinflamación hepática, pero no regenera el tejido hepático en un modelo de esteatosis hepática no alcohólica inducida con tetracloruro de carbono, Osorio (2012) observo que el extracto de las hojas de Cynara scolymus “Alcachofa” en una concentración de 200 mg/kg tiene efecto hepatoprotector en ratas (Rattus novergicus) con hepatoxicidad inducidad por tetracloruro de carbono, Tahmasebi et al. (2018) reportaron que el extracto de hojas de Berberis vulgaris a 40, 80, and 120 mg/kg tiene efecto hepatoprotector en ratas con intoxicación hepática aguda con tetracloruro de carbono (CCl4), Favari Liliana et al. (2013) efectos hepatoprotector y antioxidante del extracto acuoso de Taraxacum officinale (100, 200 y 400 mg/kg) en ratas con intoxicación hepática aguda con tetracloruro de carbono (CCl4), por otro lado Saravanan et al. (2017) detecto efecto hepatoprotector de la vitamina B12 en ratas con hepatotoxicidad inducida por acetaminofen y Cheng-Chin et al. (2015) evaluaron el rol de la vitamina B6 con defensa antioxidante en ratones. Al evaluar diferentes marcadores bioquímicos en la Tabla 2, de acuerdo con los valores de significancia de TGO y TGP, el grupo G3 (control positivo) se encuentra dentro de los valores normales, por lo tanto, se asume que tiene protección frente al daño hepático inducido por paracetamol. Sin embargo, el resultado obtenido del Grupo G3 (control positivo) en comparación con los grupos mezcla PROTHEPA® 100 mg/kg y 500 mg/kg se encuentra elevado ubicándose al límite del rango de valores normales del grupo blanco (G1). Es decir, el Grupo G3 (control positivo) presenta una menor protección a la protección frente al daño hepático inducido por paracetamol a los obtenidos por De la Cruz et al. (2018) Con un grupo patrón (Silimarina 100 mg + paracetamol de 200 mg). Este resultado se podría estar relacionado a que la concentración de paracetamol en nuestro estudio fue del doble.
Observación macroscópica de los hígados de ratas hembra Sprague Dawley
En la Tabla 4 se detalla el análisis macroscópico de los hígados extraídos de las ratas, se señalan características como el color y aspecto según los grupos.
Tabla 4
Análisis macroscópico de los hígados
GRUPOS | COLOR/ASPECTO |
GRUPO I (blanco) | rojo vino, aspecto liso y sin lesiones aparentes |
GRUPO II (control negativo) | color rojo pálido con áreas moreteadas y azul violeta |
GRUPO III (control positivo) | color rojo pálido |
GRUPO IV (Mezcla PROTHEPA® 100 mg/kg) | color rojo vino, aspecto liso y sin lesiones aparentes |
GRUPO V (Mezcla PROTHEPA® 500 mg/kg) | Color rojo vino, aspecto liso y sin lesiones aparentes |
Resultados del estudio anatomo-patológico
Con respecto a los controles en la Figura 1A se observa un tejido hepático normal, las trabéculas (TB) de las células hepáticas están formadas por una o dos células, las sinusoides (SN) se mantiene conservados entre las trabéculas, las células de Kupffer no muestran contenido, las venas centrolobulillares (CVL) se encuentran permeables y en los espacios porta (EP) se observa vena porta (VP) y un conducto biliar (VP), normales. En la Figura 1B se indican los hepatocitos, las trabéculas a nivel de la zona 3 acino portal presentan una leve micro vacuolización (MV) (desarrollo de pequeñas vacuolas dentro de las células hepáticas, que las hacen ver de color más claro) en el citoplasma, también se observa una disminución de la luz de las sinusoides (SN) (Dando lugar a percibir que las trabéculas se encuentran más cercanas entre sí y las sinusoides, como cerrados). Las venas centrolobulillares (CVL) se observan congestio-nadas; y en la Figura 1C la imagen histológica se aprecia aparentemente normal, a excepción del nivel periportal (EP), donde se observa una leve infiltración linfocitaria (LF) y elevación de la cantidad de conductos biliares (CB). Además, un aumento leve de células de Kupffer (CK) y ligera dilatación sinusoidal (SN).
Se aprecia una infiltración linfocitaria periportal leve (LF) (Figura 2A), se encontró sinusoides (SN) dilatados entre las trabéculas (TB), las células de Browicz-Kupffer no presentan contenido, las venas centrolobulillares (CVL) se observan congestionadas. En la Figura 2B se aprecia infiltrado linfocitario (LF) periportal, además daño celular alrededor, hepatocitos de citoplasmas vacuolados, se aprecia que las sinusoides (SN) no presentan dilatación entre las trabéculas (TB), las células de Browicz-Kupffer no presentan señal de contenido, las venas centrolobulillares (CVL) presentan una congestión leve).
La mezcla PROTHEPA® 100 mg/kg (G4) y 500 mg/kg (G5) se aproxima al resultado del grupo blanco (G1) (Tabla 3), lo cual indica que a partir de 100 mg/kg de mezcla de PROTHEPA® presenta protección frente al daño hepático inducido por paracetamol. En el estudio anatomo patológico (Figura 1B) del grupo tratado con paracetamol 400 mg/kg (G2), se muestra a los hepatocitos y a las trabéculas a nivel de la zona 3 acino portal con una leve micro vacuolización (MV) en el citoplasma causados por un estado de hipoxia o toxicidad, esto se relaciona con una sobre dosis de paracetamol.
También se observa una disminución de la luz de los sinusoides hepáticos (4), de tal manera que existe relación con los resultados obtenidos del perfil bioquímico, resaltando el incremento de la enzima TGP.
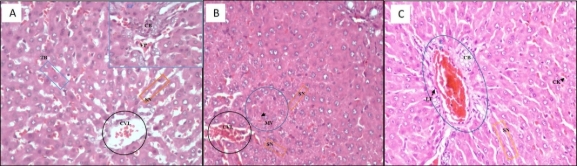
Figura 1. Microfotografía a 400X del corte histológico del hígado de ratas hembra Sprague Dawley que recibieron Suero Fisiológico 0,9% 4mL/kg. (A) grupo blanco, (B) grupo control negativo (G2), (C) grupo control positivo (G3).
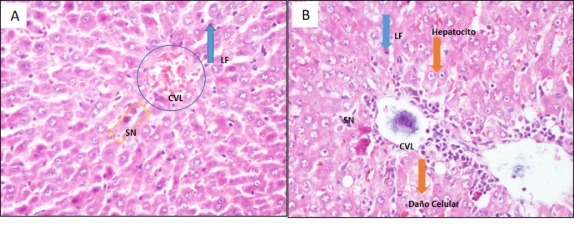
Figura 2. Microfotografías a 400X, corte histológico del hígado de las ratas hembra Sprague Dawley. (A)Grupo (G5) tratado con Mezcla de 500 mg/kg, (B) Grupo (G4) tratado con Mezcla de 100 mg/kg.
Bukhsh et al. (2014) menciona en su estudio hepatocurativo que el grupo control muestra relación entre el resultado bioquímico y los resultados del estudio anatomo-patológico donde se detalla presencia de necrosis de hepatocitos, presencia de vacuolas y fibrosis hepática.
En la Figura 1C, el Grupo G3 (control positivo) se observa un infiltrado linfocitario en los espacios porta, vacuolas en inicio de pérdida del orden de las trabéculas (TB). La cual representa una baja protección frente al daño hepático inducido por paracetamol en comparación con el grupo blanco (G1) Figura 1A, por otro lado el grupo tratado con extracto de 100 mg/kg (G4) Figura 2A, los sinusoides permanecen conservados entre las trabéculas, las células de Kupffer no muestran un contenido, las venas centrolobulillares (CV) se encuentran permeables, de manera que si se observa reducción del daño hepático al igual que el Grupo extracto 500 mg/kg (G5) Figura 2B; presentan ligera dilatación, con algunas vacuolas, leve presencia de células de Kupffer, sin embargo se desconoce el mecanismo especifico por el cual la mezcla de plantas y vitaminas presenta protección contra el daño hepático; este efecto estaría directamente relacionado a los metabolitos secundarios que lo componen y los efectos protectores y regeneradores que tienen las vitaminas B6 y B12. Esto muestra una relación de los resultados anatomo-patológicos con los resultados de los estudios bioquímicos. Por lo tanto, se concluye que a concentración de 100 mg/kg y 500 mg/kg la mezcla de polvo de hojas de Gentianella alborosea (Gilg) Fabris “hercampuri”, hojas de Cynara scolymus “alcachofa”, hojas de Berberis vulgaris “agracejo”, hojas de Peumus boldus “boldo”, raíces de Taraxacum officinale “dientes de león”, vitamina B6 y vitamina B12 (PROTHEPA®) en Rattus norvegicus Sprague Dawley con intoxicación hepática inducido por paracetamol 400 mg/kg, demostró efecto hepatoprotector en comparación con Silimarina (G3). Cabe resaltar que G3, control positivo, presenta una baja protección frente al daño hepático inducido por paracetamol 400 mg/kg, se recomienda seguir con los estudios con el fin de evaluar el efecto en humanos.
5. Conclusiones
A concentración de 100 mg/kg y 500 mg/kg, la mezcla de polvo de hojas de Gentianella alborosea (Gilg) Fabris “hercampuri”, hojas de Cynara scolymus “alcachofa”, hojas de Berberis vulgaris “agracejo”, hojas de Peumus boldus “boldo”, raíces de Taraxacum officinale “dientes de león”, vitamina B6 y vitamina B12 (PROTHEPA®) en Rattus norvegicus Sprague Dawley con intoxicación hepática inducido por paracetamol 400 mg/kg, comprobó un efecto hepatoprotector comparándose con Silimarina (G3). Además, se resalta que G3, control positivo, presentó una protección hepática baja frente a la injuria inducida por paracetamol 400 mg/kg.
Se recomienda seguir con los estudios con el fin de evaluar el efecto en humanos.
Agradecimientos
El autor agradece a la Universidad María Auxiliadora por las facilidades proporcionadas para el desarrollo de esta investigación y al Docente Mg. Chero Pacheco Víctor Humberto por el acompañamiento y asesoría brindada.
Referencias bibliográficas
Bustios, C., Dávalos, M., Román, R., & Zumaeta, E. (2007). Clinical and epidemiological profile of cirrhosis in the liver unit at Edgardo Rebagliati Martins National Hospital. Revista Gastroenterol, 27(3), 238–45.
Bukhsh, E., Akber, S., Saeed, S., & Erum, S. (2014). Hepatoprotective and hepatocurative properties of alcoholic extract of Carthamus oxyacantha seeds. African Journal of Plant Science, 8(1), 34–41.
Cheng-Chin, H., Chien-Hsiang C., Chin-Lin, H., Wan-Ju, L., Shih-Chien, H., & Yi-Chia, H. (2015). Papel del estado de la vitamina B6 en las defensas antioxidantes, el glutatión y las actividades enzimáticas relacionadas en ratones con estrés oxidativo inducido por homocisteína. Food Nutr Res, 59, 1-7.
De la Cruz, G., & Jaico, M. (2018). Efecto de decocto de Bacharis genistelloides “carqueja” sobre hepatotoxidad en Rattus novergicus var. albinus. (Tesis de pregrado). Universidad Nacional de Trujillo, Trujillo, Perú.
Fernández, C. (2015) Hepatotoxicidad por medicamentos. Revista Clínica Escuela de Medicina, 6(2), 1-7.
Favari, L., Arce, C., Ortíz, J., Perez, S., Soto, C., & Melendez, M. (2013). Efectos hepatoprotector y antioxidante de Taraxacum officinale en el daño hepático agudo inducido por el tetracloruro de carbono en la rata. Revista Mex. Cienc. Farm, 44(4), 53-61.
Gibson, J., Pumford N., Samokyszyn M., & Hinson J. (1996). Mechanism of acetaminophen-induced hepatotoxicity: Covalent binding versus oxidative stress. Chemical Research in Toxicology, 9(3), 580–585.
Osorio, D. (2012). Efecto hepatoprotector del extracto de las hojas de alcachofa (Cynara scolymus) en ratas (Rattus novergicus) con hepatoxicidad inducida por tetracloruro de carbono. (Tesis de grado). Escuela Superior Politécnica de Chimborazos, Ecuador.
Novoa, R., Oviedo, R., Tapia, K., Bohórquez, I. (2008). Efecto de Gentianella alborosea en hígado graso inducido por tetracloruro de carbono en ratas machos. An Fac Med., 69(1), 40 - 1.
Pardo, A. (2005). Ética de la experimentación Animal. Directrices legales y éticas contemporáneas. Asociación Española de Bioética y Ética Médica, 3, 393-417.
Quiroz, A. A. (2019). Efecto del extracto acuoso DE Gentianella Alborosea (hercampuri) sobre los niveles de colesterol sérico en Rattus rattus var. Albinus (Tesis de maestría), Universidad Católica los Ángeles de Chimbote.
Saravanan, T., Shanmugapriya, S., Sumitra, G., Dhayananth, R, Saravanan, A., & Vasuki, A. (2017). Hepato-Protective Effect of Folic Acid and Vitamin B12 in Comparison to N-Acetylcysteine in Experimentally Induced Acetaminophen Toxicity in Rats. Biomedical and Pharmacology Journal, 10(2), 549-555.
Tahmasebi, M., Sadeghi, H., Nazem, H., Kokhdan, E., & Omidifar, N. (2018). Efectos hepatoprotectores del extracto de hoja de Berberis vulgaris sobre la hepatotoxicidad inducida por tetracloruro de carbono en ratas. Revista de educación y promoción de la salud, 27(7), 147.
Teja, Á., Ceballos, H., Durán, A., Posadas, G. (2012). Tratamiento estomatológico de los trastornos vesiculoampollosos. Síndrome de Lyell. Informe de un caso Acta Pediátrica de México, 26(4), 184-189.
Ugaz, L., Zafra, J., & Tapia, M. (2012). Efecto de Gentianella alborosea en hígado graso inducido por tetracloruro de carbono en ratasmachos. Revista ciencia e investigación médica estudiantil latinoamericana, 17(1), 18-23.
Vargas, M. (2016). Intoxicación por acetaminofén en adultos. Revista medicina legal de Costa Rica, 33(1), 103–109.
Yovera, E. (2015) Efecto protector del extracto acuoso de las hojas de Peumus boldus “Boldo” en la intoxicación hepática inducida por isoniazida en ratas Holtzman hembra (Tesis de grado). Universidad Nacional Mayor de San Marcos, Lima, Perú.