Evaluación antifúngica in vitro de quitosano con aceites esenciales de Citrus x aurantifolia (Christm.) Swingle “limón sutil” y Origanum vulgare L. “orégano” contra Botrytis cinerea Pers. “moho gris”
In vitro antifungal evaluation of chitosan with essential oils from Citrus x aurantifolia (Christm.) Swingle “sutil lemon” and Origanum vulgare L. “oregano” against Botrytis cinerea Pers. “gray mold”
Mario Ruiz1; Juan Ramos1, 2 *
1 Escuela Profesional de Biología. Facultad de Ciencias Biológicas. Universidad Ricardo Palma. Av. Benavides 5440 Urb. Las Gardenias, Santiago de Surco 15039, Lima, Perú.
2 Instituto de Control y Certificación de la Calidad e Inocuidad Alimentaria de la Universidad Ricardo Palma ICCCIA.URP. Av. Benavides 5440 Urb. Las Gardenias, Santiago de Surco 15039, Lima, Perú
ORCID de los autores
M. Ruiz: https://orcid.org/0000-0002-7794-657X
J. Ramos: https://orcid.org/0000-0002-9713-2653
RESUMEN
El objetivo de este estudio fue determinar la eficacia de la aplicación de quitosano (QUI) y aceites esenciales de Citrus x aurantifolia (AECA) y Origanum vulgare (AEOV) para prevenir infecciones por Botrytis cinerea, causante del moho gris en tomates. Todas las concentraciones probadas in vitro de AEOV (10 µL/mL, 5 µL/ml, 2,5 µL/mL y 1,25 µL/mL) y QUI (4 mg/mL y 8 mg/mL) resultaron en un 100% ICM para B. cinerea. Por otro lado, AECA 20 µL/mL originó valores entre 40-47% ICM. Estos resultados sugieren que los tratamientos compuestos por QUI, AECA y AEOV pueden llegar a ser un tratamiento alternativo prometedor contra B. cinerea debido a su carácter natural, la actividad antimicrobiana mejorada y al no desarrollar resistencia en los patógenos.
Palabras clave: limón; orégano; aceite esencial; quitosano; Botrytis; tratamiento.
ABSTRACT
The aim of this investigation was to determine the effectiveness of the application of chitosan (CHI) and essential oils from Citrus x aurantifolia (CAEO) and Origanum vulgare (OVEO) against infections caused by the grey mold Botrytis cinerea in tomatoes. Every concentration tested in vitro of OVEO (10 µL/mL, 5 µL/ml, 2.5 µL/mL y 1.25 µL/mL) and CHII (4 mg/mL y 8 mg/mL) showed 100% of Mycelial Growth Inhibition (MGI%) against B. cinerea. Conversely, AECA 20 µL/mL showed values between 40-47% MGI. These results suggest that these treatments comprising CHI, CAEO and OVEO might be a promising alternative treatment against B. cinerea due to its natural characteristics, the enhanced antimicrobial activity and not developing antibiotic resistance.
Keywords: lemon; oregano; essential oil; chitosan; Botrytis; treatment.
1. Introducción
El tomate es susceptible al hongo B. cinerea “moho gris” (Liu et al., 2007; Shao et al., 2015), lo que da lugar a importantes pérdidas económicas (Guerra et al., 2015). Por esta razón, es muy importante que se controle esta enfermedad, sobre todo durante el transporte en frio, almacenamiento y en los anaqueles de mercados, porque las esporas se desarrollan a temperaturas bajas y tienden a propagarse rápidamente, generando contaminación cruzada entre otras frutas y verduras (Mohammadi et al., 2015).
Usualmente, este problema se enfrenta rociando fungicidas sintéticos (por ejemplo, benzamida-zoles, hidrocarburos aromáticos e inhibidores de la biosíntesis de esteroles). Sin embargo, esto genera que el organismo desarrolle resistencia al antifúngico, lo que resulta que se aumente la dosis del agroquímico, induciendo el uso indiscriminado de una mayor dosis de antifúngicos en la agricultura y por ello la aparición de mayores cantidades de residuos tóxicos en los alimentos (Munhuweyi et al., 2017; Sangsuwan et al., 2016).
Al emplear el quitosano, se crea un vehículo para los aceites esenciales, permitiendo reducirla permeabilidad al agua, mejorando la eficacia antimicrobiana, porque los principios activos de los aceites esenciales son liberados en la superficie de la fruta con el transcurrir del tiempo, además de las propiedades antimicrobianas inherentes del biopolímero (Athayde et al., 2016; Barreto et al., 2016).
De la misma manera, los tratamientos con quitosano proporcionaron un control efectivo de las enfermedades del tomate causadas por B. cinerea y P. expansum (Sangsuwan et al., 2016) y aún mejor, se verificó que los tratamientos combinados mostraron alta actividad antimicrobiana al reducir la pudrición negra causada por A. alternata, y en general, muchos trabajos reportan que la sinergia entre quitosano y aceites esenciales inhiben mejor el crecimiento fúngico (Athayde et al., 2016).
Por otro lado, este tratamiento combinado para tratar diversos tipos de hongos, incluido B. cinerea, no es exclusivo para tomate, sino también es aplicado a las manzanas, uvas, fresas, granadas, frutos cítricos, entre otras. Se logró inhibir B. cinerea en fresas con un tratamiento compuesto por perlas de quitosano, más aceites esenciales de lavanda y tomillo rojo. Se encontró que el tratamiento de quitosano con aceite esencial de romero logró inhibir a B. cinerea, tanto en altas como en bajas concentraciones. La eficacia del tratamiento se ensayó también con fresas envasadas, las cuales se almacenaron a 7 ºC durante 10 días. En el día 10, se observó que los tratamientos combinados retrasaron mejor la descomposición de la fresa, a comparación con los tratamientos de sólo quitosano. Asimismo, el aceite de romero resultó ser más eficiente que el de lavanda (Sangsuwan et al., 2016). Este comportamiento fue igual en otro ensayo con aceite esencial de limón, el cual potenció la actividad antifúngica del quitosano tanto en ensayos in vitro como durante el almacenamiento en frío en fresas inoculadas con una suspensión de esporas de B. cinerea (Sangsuwan et al., 2016).
Hoy en día, las preferencias de los consumidores se centran en alimentos con los niveles más bajos de conservantes sintéticos y con características más naturales. En este caso, utilizar una película comestible o una capa de quitosano con aceites esenciales es otra forma natural de mantener la calidad de las frutas y verduras. Por su biodegradabilidad y baja fitotoxicidad, se considera una tecnología ecológica para el control de infecciones poscosecha. Reducir las pérdidas causadas por la pudrición fúngica es un objetivo básico de la tecnología de poscosecha, que busca utilizar métodos efectivos para controlar la contaminación y el crecimiento de hongos patógenos de plantas (Guerra et al., 2016). Por otra parte, en el contexto peruano, luego de una extensa revisión, no se ha investigado el potencial antimicrobiano del limón sutil frente al hongo B. cinerea.
El objetivo de este estudio fue determinar preliminarmente in vitro la eficacia de la aplicación de quitosano (QUI) y aceites esenciales de Citrus x aurantifolia (AECA) y Origanum vulgare (AEOV) para prevenir infecciones por Botrytis cinerea.
2. Material y métodos
2.1 Material Biológico
La cepa de B. cinerea se obtuvo del laboratorio de micología de la Universidad Agraria La Molina.
2.2 Reactivos
El quitosano de caparazón de camarones (75% deacetilado) fue adquirido de Sigma-Aldrich – USA, fabricado en Islandia a partir de caparazones de Pandalus borealis); El aceite esencial de Citrus x aurantifolia, fue comprado de la empresa Essential oils Perú (http://www.eopperu.com) y el aceite de Origanum vulgare se adquirió de Zane Hellas, Grecia (https://www.zanehellas.com, 86% de carvacrol). Se empleó ácido acético 1 M, Tween 80 (Insuquimica) y Glicerol (Farmacia Universal) para elaborar los recubrimientos. El hongo fue cultivado en agar Extracto de Malta (EM, Difco®).
2.3 Preparación del material biológico
Las cepas de B. cinerea se reactivaron de la muestra adquirida en agar EM y se incubaron a 25 °C por 7 días (Figura 1a, 1b).
2.4 Efecto inhibitorio in vitro de QUI y AECA o AEOV en el crecimiento micelial
Se determinó el %ICM de QUI, AECA y AEOV mediante la técnica del sustrato envenenado (Figura 1d). Para este fin, se sembró por picadura un inóculo (< 1 mm, de un cultivo de 7 días) con micelios de B. cinerea en el centro de placas Petri con agar EM suplementado con diferentes concentraciones de QUI (8 mg/mL y 4 mg/mL), AECA (20 µL/mL) o AEOV (10 µL/mL, 5 µL/ml, 2,5 µL/mL y 1,25 µL/mL). En el caso los aceites esenciales, se agregó al agar aún líquido (~45 °C) Tween 80 1% (agente emulsificante), y seguida-mente la cantidad deseada de AECA (20 µL/mL) o AEOV (10, 5, 2,5 y 1,25 µL/mL). Para la preparación con QUI (4 mg/mL y 8 mg/mL), el agar EM fue preparado con una solución de ácido acético al 1% (pH 4,7 - 5,6), ya que el QUI se disuelve en medio ácido (Athayde et al., 2016; De Oliveira et al., 2017; Dos Santos et al., 2017; Guerra et al., 2016)). Las preparaciones se agitaron manualmente con vigorosidad por 15 minutos y luego en un vortex mixer (XH-D) a máxima potencia por 20 minutos, hasta homogenizar y como control, se empleó agar EM sin suplementar. Luego, se incubaron a 25 °C durante 15 días. El crecimiento radial del micelio fue medido (Figura 1e) cada 3 días con un vernier (De Oliveira et al., 2017). Los resultados se expresaron como porcentaje de inhibición de crecimiento micelial (ICM%) (Barreto et al., 2016). El %ICM se calculó con la siguiente fórmula:
%ICM=(C-T)/C×100
Donde “C” es el diámetro de la colonia control y “T”, el diámetro de los tratamientos con QUI, AECA o AEOV (De Oliveira et al., 2017; Munhuweyi et al., 2017).
2.5 Análisis estadístico
Todos los análisis se realizaron por triplicado en tres experimentos independientes, y los resul-tados se expresaron como el promedio de los datos obtenidos en cada repetición. Previamente, los datos se evaluaron a través del análisis descriptivo (promedio, desviación estándar y pruebas de normalidad y varianza). Posterior-mente, se realizaron análisis inferenciales (No paramétricas: U de Mann – Whitney; paramé-tricas: T de student y ANOVA seguido de la prueba post hoc de Tukey) para determinar las diferencias significativas (p < 0,05) entre los resultados obtenidos (Athayde et al., 2016; De Oliveira et al., 2017; Dos Santos et al., 2017). El análisis estadístico y ploteo de gráficos se realizó con los programas SPSS versión 21 y GraphPad Prism 5 respectivamente.
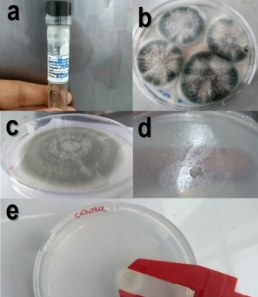
Figura 1. Inhibición del crecimiento de B. cinerea in vitro. a. Cepa reactivada; b. Cepa de B. cinerea; c. Explante de B. cinerea; d. Crecimiento normal de B. cinerea; e. Medición del diámetro de crecimiento.
3. Resultados y discusión
Los valores del diámetro de crecimiento están descritos en la Tabla 1 y en la Figura 2, y los valores del %ICM en la Tabla 2. Todas las concentraciones probadas de AEOV (10, 5, 2,5 y 1,25 µL/mL) y ambas concentraciones de QUI (8 y 4 mg/mL) resultaron en un 100% ICM para B. cinerea después de 15 días de exposición al tratamiento (Figura 3a, 2b). Por otra parte, AECA 20 µL/mL originó valores entre 40%-47% de ICM. Se observó un diámetro de crecimiento (Figura 3c, Figura 2) y un porcentaje de inhibición menor en medios de cultivo suplementados con AECA 20 µL/mL a diferencia de los medios sin suplementar (p < 0,05).
Tabla 2
%ICM de Botrytis cinerea después de quince días de exposición de QUI, AECA o AEOV en medio sólido (Agar extracto de malta)
Tratamiento | ICM% |
AECA 20 µL/mL | 68,83% |
AEOV 10µL/mL | 100,00% |
AEOV 5 µL/mL | 100,00% |
AEOV 2.5 µL/mL | 100,00% |
AEOV 1.25 µL/mL | 100,00% |
AECA 20 µL/mL + AEOV 5 µL/mL | 100,00% |
QUI 4 mg/mL | 100,00% |
QUI 8 mg/mL | 100,00% |
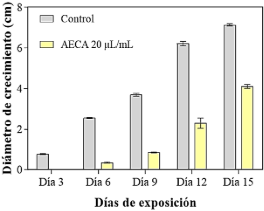
Figura 2. Efecto del aceite esencial de limón (AECA 20 µL/mL) en la inhibición del diámetro de crecimiento de B. cinerea en Agar EM.
La capacidad antifúngica del quitosano ha sido siempre asociada a la interacción entre los grupos amino cargados positivamente del compuesto con los fosfolípidos en la pared celular de los hongos, generándose daño por el cambio de la permeabilidad de la membrana, permitiendo el transporte activo de quitosano (gasto energético) (Miranda-Castro, 2016). De esta forma, el quitosano al entrar al citoplasma interfiere con el ARN y, por consiguiente, con la síntesis de proteínas, además de generar estrés oxidativo (ROS) (Xing et al., 2016).
Existe evidencia por parte de los investigadores, los cuales, si reportaron la eficacia de AECA, mejorando la eficacia en conjunto con el quitosano (Ammad et al., 2018; Perdones et al., 2012; Vitoratos et al., 2013) y de AEOV (Camiletti et al., 2016). Las propiedades antifúngicas son atribuidas a los componentes mayoritarios, en este caso, al limoneno y al carvacrol. Estos son compuestos cíclicos, que son grupos funcionales responsables de conferir la actividad biológica de los aceites (Marinelli et al., 2012; Simas et al., 2017). Diversos estudios previos han demostrado que los monoterpenos juegan un rol importante en la desintegración de las membranas celulares, causando despolarización y alteraciones físicas y químicas, desequilibrando el metabolismo fúngico (Fouad & da Camara, 2017; Lombardo et al., 2016) y que el quitosano es efectivo en el control del moho gris (Guerra et al., 2015; Sangsuwan et al., 2016).
4. Conclusiones
Las diferentes concentraciones de quitosano (4 mg/mL y 8 mg/mL) y AEOV (10 µL/mL, 5 µL/ml, 2,5 µL/mL y 1,25 µL/mL) si inhibieron en 100% el crecimiento micelial in vitro. Por otro lado, la inhibición provocada por AECA 20 µL/mL sobre B. cinerea fue menor (p < 0,05), llegando hasta un 47% de disminución del diámetro micelial.
Se recomienda aislar de manera particular diversas cepas de hongos y/o bacterias de importancia económica que afecten a cultivos dentro del contexto peruano, como, por ejemplo, Colletotrichum gloeosporioides, Rizhophus stolonifer, Asperigillus sp, Alternaria sp, etc. Asimismo, se debería aprovechar los desechos de industrias o negocios que producen cangrejos, camarones, langostinos entre otros para extraer el quitosano., y de la misma forma, extraer los aceites esenciales de residuos agroindustriales como cáscaras de limón, naranja, mandarina, entre otros, para así darles un segundo uso. Asimismo, evaluar y producir recubrimientos comestibles para su aplicación directa en tomates.
Referencias bibliográficas
Ammad, F., Moumen, O., Gasem, A., Othmane, S., Hisashi, K., Zebib, B., & Merah, O. (2018). Les huiles essentielles de citron (Citrus limon L.) pour lutter contre certaines maladies fongiques du bois de la vigne. Comptes Rendus - Biologies, 341, 97–101.
Athayde, A., de Oliveira, P., Guerra, I., da Conceição, M., de Lima, M., Arcanjo, N., Madruga, M., Berger, L., & de Souza, E. (2016). A coating composed of chitosan and Cymbopogon citratus (Dc. Ex Nees) essential oil to control Rhizopus soft rot and quality in tomato fruit stored at room temperature. Journal of Horticultural Science and Biotechnology, 91(6), 582–591.
Barreto, T., Andrade, S., Maciel, J., Arcanjo, N., Madruga, M., Meireles, B., Cordeiro, Â., Souza, E., & Magnani, M. (2016). A chitosan coating containing essential oil from Origanum vulgare L. to control postharvest mold infections and keep the quality of cherry tomato fruit. Frontiers in Microbiology, 7, 1724.
Camiletti, B., Asensio, C., Gadban, L., Pecci, M., Conles, M., & Lucini, E. (2016). Essential oils and their combinations with iprodione fungicide as potential antifungal agents against withe rot (Sclerotium cepivorum Berk) in garlic (Allium sativum L.) crops. Industrial Crops and Products, 85, 117–124.
De Oliveira, K., Ramos, L., Amorim de Araújo, S., Saraiva, M., & Souza, E. (2017). Synergistic mixtures of chitosan and Mentha piperita L. essential oil to inhibit Colletotrichum species and anthracnose development in mango cultivar Tommy Atkins. Food Microbiology, 66, 96–103.
Dos Santos, J., de Carvalho, R., de Souza, N., de Sousa Oliveira, K., Franco, O., Schaffner, D., de Souza, E., & Magnani, M. (2017). Effects of oregano essential oil and carvacrol on biofilms of Staphylococcus aureus from food-contact surfaces. Food Control, 73, 1237–1246.
Fouad, H., & da Camara, C. (2017). Chemical composition and bioactivity of peel oils from Citrus aurantifolia and Citrus reticulata and enantiomers of their major constituent against Sitophilus zeamais (Coleoptera: Curculionidae). Journal of Stored Products Research, 73, 30–36.
Guerra, I., de Oliveira, P., de Souza, A., Carneiro, A., Tavares, J., Barbosa-Filho, J., Madruga, M., & de Souza, E. (2015). Coatings comprising chitosan and Mentha piperita L. or Mentha×villosa Huds essential oils to prevent common postharvest mold infections and maintain the quality of cherry tomato fruit. International Journal of Food Microbiology, 214, 168–178.
Guerra, I., de Oliveira, P., Fernandes, M., Carneiro, A. S., Tavares, J., Barbosa-Filho, J., Madruga, M., & de Souza, E. (2016). The effects of composite coatings containing chitosan and mentha (piperita L. or x villosa Huds) essential oil on postharvest mold occurrence and quality of table grape cv. Isabella. Innovative Food Science & Emerging Technologies, 34, 112–121.
Lombardo, P., Guimaraens, A., Franco, J., Dellacassa, E., & Pérez Faggiani, E. (2016). Effectiveness of essential oils for postharvest control of Phyllosticta citricarpa (citrus black spot) on citrus fruit. Postharvest Biology and Technology, 121, 1–8.
Marinelli, E., Orzali, L., Lotti, E., & Riccioni, L. (2012). Activity of Some Essential Oils against Pathogenic Seed Borne Fungi on Legumes. Asian Journal of Plant Pathology, 6(3), 66–74.
Miranda-Castro, S. P. (2016). Application of Chitosan in Fresh and Minimally Processed Fruits and Vegetables. In Chitosan in the Preservation of