Hidrolizado de músculo de calamar gigante (Dosidicus gigas) apto para el consumo humano: características fisicoquímicas, microbiológicas y sensoriales
Hydrolyzed giant squid muscle (Dosidicus gigas) suitable for human consumption: physicochemical, microbiological and sensory characteristics
Leonel A. Gutiérrez-Flores1; Julio F. Calle-Grados1; Ramiro Guevara-Pérez1;
Andrés Reátegui-Quispe2, *; Armando Solari-Godiño3
1 Facultad de Ingeniería Pesquera y Alimentos. Universidad Nacional del Callao. Av. Juan Pablo II 306, Bellavista 07011, Callao, Perú.
2 Centro de Innovación Productiva y Transferencia Tecnológica Pesquero – CITEpesquero Callao. Instituto Tecnológico de la Producción - ITP. Carretera a Ventanilla Km. 5.2, Callao, Perú.
3 Pesquera Diamante S.A. Av. Prolongación Centenario 1956 - Los Ferroles, Callao, Perú.
ORCID de los autores
L. A. Gutiérrez-Flores: https://orcid.org/0000-0001-8786-8248
J. F. Calle-Grados: https://orcid.org/0000-0002-1189-3903
R. Guevara-Pérez: https://orcid.org/0000-0002-2926-8380
A. Reátegui-Quispe: https://orcid.org/0000-0002-8508-3380
Armando Solari-Godiño: https://orcid.org/0000-0002-8572-0853
RESUMEN
Con el objetivo de obtener un producto de buenas características fisicoquímicas, microbiológicas y sensoriales, apto para el consumo humano, se realizó el estudio experimental de un proceso de hidrólisis enzimática, utilizando músculo cocido de calamar gigante Dosidicus gigas (Orbigny 1835). Para este fin, se evaluó la interacción idónea entre la proporción de enzima alcalina (Delvolase)/proteína del sustrato (1,6%; 2,4% y 3,2%) y la relación agua/sustrato (1/1 y 1/2), sometiendo cada tratamiento al método de secado por aspersión y, bajo esta condición, se determinó sensorialmente su aceptabilidad. La prueba con mejor calificación sensorial mostró una proporción de enzima/proteína del sustrato de 3,2% y una relación agua/sustrato de 1/2. El análisis proximal del producto presentó valores en proteínas de 79,22 ± 0,1 %; humedad entre 4,47 ± 0,2 %; grasa en 4,30 ± 0,2 %; cenizas entre en 4,10 ± 0,2 % y 7,91 ± 0,5 % de carbohidratos. El producto hidrolizado tuvo un grado de hidrólisis de 12,8 % con pesos moleculares entre 36 y 116 kDa, según lo indicado por el gel de poliacrilamida PAGE-SDS al 15%. Finalmente, el análisis microbiológico mostró ausencia de microorganismos patógenos, lo que garantizó la inocuidad del producto en aras de su consumo.
Palabras clave: Dosidicus gigas; hidrólisis enzimática; grado de hidrólisis; peso molecular; parámetros tecnológicos.
ABSTRACT
In order to obtain a product suitable for human consumption of good physicochemical, microbiological and sensory characteristics, an experimental study of an enzymatic hydrolysis process was carried out using cooked muscle of giant squid Dosidicus gigas (Orbigny 1835). For this purpose, was determined the ideal interaction between the ratio of alkaline enzyme (Delvolase)/substrate protein (1.6%; 2.4% and 3.2%) and the water/substrate ratio (1/1 and 1/2), where each treatment was subjected to the spray drying method and, under this condition, its acceptability was assessed sensually. The test with the best sensory rating showed a substrate enzyme/protein ratio of 3.2% and a water/substrate ratio of 1/2. The proximal analysis of the product showed protein values of 79.22 ± 0.1%; humidity between 4.47 ± 0.2%; fat in 4.30 ± 0.2%; ashes between 4.10 ± 0.2% and 7.91 ± 0.5% carbohydrates. The hydrolyzed product had a degree of hydrolysis of 12.8% with molecular weights between 36 to 116 kDa, as indicated by the 15% PAGE-SDS polyacrylamide gel. Finally, the microbiological analysis showed the absence of pathogenic microorganisms, which guaranteed the safety of the product for the sake of its consumption.
Keywords: Dosidicus gigas; enzymatic hydrolysis; degree of hydrolysis; molecular weight; technological parameters.
1. Introducción
La utilización de productos hidrolizados de origen marino ha despertado gran interés en diferentes ámbitos de estudio. En la industria alimentaria, se señala que los procesos de hidrólisis preservan el alto contenido de aminoácidos esenciales del pescado y, además, producen muchas funciones mejoradas en diferentes aplicaciones alimen-ticias. De este modo, su adición como ingrediente influye a favor de propiedades fisicoquímicas funcionales tales como la solubilidad, la capacidad de agitación, la viscosidad, la capacidad emulsionante y la capacidad de unión al aceite; las cuales confieren una adecuada apariencia, gusto y textura a productos alimenticios a base de cereales, sopas deshidratadas y lácteos (Kristinsson & Rasco, 2000; Córdova, 2016; Atef & Ojagh, 2017).
Dentro del dominio de la medicina, prometedores resultados han demostrado que los péptidos derivados de productos y subproductos del procesamiento pesquero poseen una gama de propiedades bioactivas, cuyo consumo expondrían beneficios para la prevención y control de enfermedades crónicas no transmisibles (ENT). El descubrimiento de estos roles biorreguladores, en conjunto con los mecanismos de acción de los péptidos marinos, recomendarían su aprovechamiento como fármacos factibles para el tratamiento del cáncer, la diabetes o la hipertensión, enfermedades de gran incidencia relacionadas con el estilo de vida y el envejecimiento de la sociedad occidental (Cheung et al., 2015; Gevaert et al., 2016; Le Gouic et al., 2019).
Asimismo, reportes sobre la evaluación de hidrolizados a base de krill (Euphasia sp.), atún (Thunnus sp.), arenque (Clupea harengus.) y subproductos de calamar (Loligo pealei), como suplementos dietéticos dentro de los alimentos acuícolas, exponen la posibilidad de su utilización como un aditivo de alto valor en proteínas y lípidos, con efectos positivos en el rendimiento del crecimiento, la eficiencia alimenticia y la respuesta inmune de especies de cultivo como el salmón del atlántico, el langostino y peces en estadios larvales (Córdova et al., 2002; Hevrøy et al., 2005; Lian et al., 2005; Delcroix et al., 2014; Khosravi et al., 2015).
Por otro lado, los productos hidrolizados de origen marino e ingredientes activos son el “gran sueño” de la industria biotecnológica moderna, la cual ha tenido presencia relevante en la generación de suplementos proteicos de bajo peso molecular, con gran poder de digestibilidad intestinal, valor biológico, prebióticos e inmuno moduladores, también llamados alimentos nutracéuticos (Guerard et al., 2011).
En la elaboración de estos productos, generalmente se emplean materias primas constituidas por subproductos que devienen del procesamiento de recursos hidrobiológicos, los cuales han mostrado un gran potencial al proporcionar péptidos liberados por hidrólisis enzimática, a partir de proteínas involucradas en la nutrición y salud (Atef & Ojagh, 2017). En nuestro país, dentro de los principales recursos pesqueros de importancia comercial, la pota o calamar gigante Dosidicus gigas es una especie de cefalópodo que posee un importante contenido proteico y bajo nivel graso en su músculo, bondades nutricionales que han sido convenientemente utilizadas en diversos estudios, a través de procedimientos que favorecieron su aprovechamiento (Moreno et al., 2016; Reátegui & Jiménez, 2016; Albrecht et al., 2017; Solari-Godiño et al., 2017; Porturas et al., 2019; Flores et al., 2020; Maza & Pariona, 2020).
Como parte del conjunto de procesos que permiten la utilización industrial e integral de este recurso, se considera como alternativa la tecnología de hidrólisis enzimática de D. gigas destinada al consumo humano; procesamiento donde resulta esencial que se esclarezcan los parámetros como la relación agua/sustrato, proteína/enzima específica y los parámetros de operación de este proceso, a fin de optimizar el manejo de materias primas con potencial en la industria (Wu et al., 2012; Le Gouic et al., 2019). En tal sentido, el objetivo del presente trabajo fue determinar los parámetros tecnológicos en el proceso de elaboración de un producto hidrolizado en polvo a partir de músculo cocido de D. gigas, que cumpla con los estándares de calidad e inocuidad, a fin de promover posteriores estudios para su evaluación como alimento dirigido al consumo humano directo.
2. Material y métodos
Acondicionamiento de la materia prima y proceso de hidrólisis enzimática
Para los tratamientos, se adquirió 196 kg de manto fresco eviscerado de pota (peso y longitud promedio 2,2 kg y 47,8 cm, respectivamente) en el terminal pesquero de Ventanilla, Callao, Perú. Estos fueron trasladados en cajas isotérmicas con hielo en proporción 1:1 hasta la planta de procesos del CITEpesquero Callao del Instituto Tecnológico de la Producción (ITP), dónde fueron desollados y lavados para la eliminación de los restos de tejidos no musculares. Posteriormente, se realizó al músculo cortes laminares de 10-15mm de espesor, los cuales se sometieron a cocción en agua potable a temperatura de 85 °C durante 10 minutos y a una proporción agua/lámina de 3/1. Las láminas cocidas se enfriaron por inmersión en una mezcla de agua potable y hielo durante 30 minutos y a una temperatura aproximada de 0 °C, para luego ser molidas en un moledor de carne de criba de 10 mm de diámetro (marca HENKEL©). Para la etapa de hidrólisis, se utilizó agua potable y la enzima de marca comercial DELVOLASE®, una proteasa alcalina derivada de una cepa seleccionada de Bacillus licheniformis, desarrollada específica-mente para hidrólisis de todo tipo de proteínas (actividad ≥ 560,000 DU/g). Se desarrollaron 6 pruebas de hidrólisis alcalina (P1 al P6), como resultado de la interacción de 3 proporciones de la enzima (1,6%; 2,4% y 3,2%) con 2 ratios de agua/sustrato de hidrólisis (1/1 y 1/2), siendo los parámetros de temperatura, pH y tiempo para todos los casos de 55 °C, 7 y 1 hora. Durante los experimentos de hidrólisis se adicionó hidróxido de sodio al 40% (NaOH marca Merck®), a fin de mantener el rango de pH óptimo de actividad de la enzima, controlándolo cada 10 minutos con un potenciómetro marca Mettler Toledo Seven Easy®. Al término del proceso de hidrólisis, los tratamientos fueron sometidos a inactivación de la enzima a 90 °C, durante 5 minutos y luego filtrados, mediante el uso de sacos de polipropileno, reteniendo la fracción no hidrolizada. Los tratamientos filtrados fueron vertidos en baldes plásticos de capacidad 20 L y secados mediante aspersión (spry drying) durante 3 horas, a 40 ºC y a una presión de vacío 4-5 mm Hg, obteniendo un hidrolizado en presentación en polvo, el cual fue envasado y sellado al vacío en bolsas de polietileno de alta densidad, con un peso neto de 200 g (Figura 1), para ser finalmente almacenados a temperaturas por debajo de -18 °C. La consecución de etapas del proceso se muestran esquematizadas en la Figura 2.
Sólidos disueltos totales (SDT)
Se tomaron 2 mL de muestras hidrolizadas cada 10 minutos durante 1 hora, cuantificando los SDT con un refractómetro de mano (ATAGO, N-1EBX, Japón), a escala de 0 a 32 °Brix, a 20 °C (AOAC, 1996).

Figura 1. Hidrolizado en polvo de músculo cocido de calamar gigante.
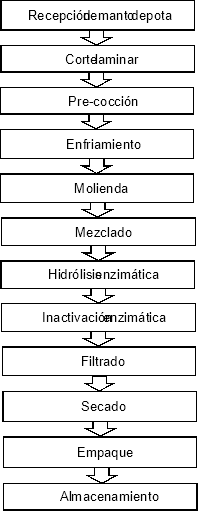
Figura 2. Diagrama de flujo del proceso de hidrólisis del músculo de calamar gigante.
Evaluación sensorial
Se realizó según el manual de métodos no acreditados LABS-ITP del laboratorio sensorial del Instituto Tecnológico de la Producción (ITP), sometiendo a panelistas no entrenados a la calificación del grado de aceptabilidad del producto hidrolizado en polvo, utilizando un cuestionario con una escala hedónica de 5 puntos (5 = Me gusta mucho, 4 = Me gusta, 3 = Ni me gusta ni me disgusta, 2 = Me disgusta y 1 = Me disgusta mucho). De este modo, 25 g de hidrolizado fueron dispuestos en vasos transparentes, cada uno identificado con un código numérico al azar de 3 cifras.
Análisis Proximal
Se utilizaron 500 gramos de músculo de pota fresco (crudo), pre-cocido e hidrolizado, para la cuantificación de la humedad, grasas, proteína, cenizas y carbohidratos, empleando métodos normalizados por la Asociación Oficial de Químicos Analíticos (AOAC, 2006).
Grado de hidrólisis (GH)
Se adoptó la metodología propuesta por Al-Janabi (2014) para hidrolizados en polvo, la cual está basada en la reactividad de los grupos amino en formaldehído y posterior titulación ácido base.
Determinación de pesos moleculares (PM)
Según el método propuesto por Laemmli (1970) y sus modificaciones, las fracciones de proteína de la muestra hidrolizada se separaron de acuerdo a sus pesos moleculares (PM), empleando la técnica de electroforesis en gel de poliacrilamida-SDS al 15% (SDS-PAGE).
Análisis microbiológico
Para el conteo de mohos, levaduras, enterobac-terias y Salmonella nos servimos de métodos normalizados por la AOAC y la Comisión Internacional de Especificaciones Microbiológicas para Alimentos (ICMSF). Asimismo, se tomó como referencia sanitaria el manual de indicadores sanitarios y de inocuidad para los Productos Pesqueros y Acuícolas del Organismo Nacional de Sanidad Pesquera del Perú (SANIPES, 2016).
Análisis de datos
Los resultados se desarrollaron por duplicado, reportándose como la media ± error estándar. Las comparaciones y diferencias entre los valores de SDT y los puntajes obtenidos de la evaluación sensorial se analizaron respectivamente a través del test paramétrico ANOVA de una sola vía y el test no paramétrico de Kruskal-Wallis, ambas con posterior test HSD (Honestly Significant Difference) de Tukey, para determinar las medias significativamente diferentes de otras, por comparación múltiple. Todos los análisis fueron estimados con un nivel de significancia de p < 0,05, utilizando el Software estadístico STATGRAPHICS Centurion XVI, versión 16.1.03.
3. Resultados y discusión
En todas las pruebas, el producto hidrolizado en polvo mostró una ligera higroscopicidad, no presentó el característico olor del recurso pota en estado fresco y exhibió una tonalidad blanco cremosa (lechosa), coloración atribuida a un proceso de deshidratación adecuada y controlada, evitando el pardeamiento conocido como reacción de Maillard, causado por la interacción de aminoácidos libres o grupos aminos terminales de proteínas (Miranda et al., 2005; Espinoza, 2017). Estos resultados guardan relación con los trabajos realizados por Rojas (2009), Omote et al. (2014) y Ponte (2014), quienes obtuvieron características físicas análogas en la elaboración de un concentrado proteico e hidrolizados a base de pota, empleando para los hidrolizados enzimas alcalinas o alcalasas y bacterias ácido lácticas (técnica de ensilado).
Sólidos disueltos totales y pH
Para procesos de hidrólisis eficientes es necesario una adecuada proporción de agua/sustrato, ya que favorece a la solubilización de las proteínas (Pandia et al., 2013). En la Figura 3, se muestra las concentraciones de los SDT generados en todas las pruebas de hidrólisis, dónde se pudo distinguir una tendencia al incremento que se mantuvo hasta el término del proceso, siendo las pruebas 1, 3 y 5 las que expusieron una mayor cantidad de SDT. Este resultado respondió en proporción directa con el aumento de la concentración de la enzima, en combinación con la menor tasa de agua/sustrato empleada en estas 3 pruebas. No obstante, todas las pruebas no mostraron diferencias significativas (p < 0,05).
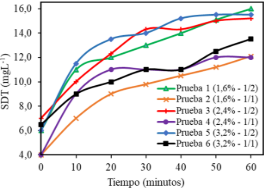
Figura 3. Incremento de los SDT en el proceso de hidrólisis.
A nivel industrial, se reporta que elevados contenidos de agua en la reacción hidrolítica, requieren mayores capacidades para la evaporación de la misma; una inversión de tiempo y costos que encarecen la producción, en búsqueda de deshidratar el producto (Šližytė et al., 2014).
Dentro de los parámetros fisicoquímicos del proceso de hidrólisis enzimática, es fundamental el control del pH óptimo de actividad de la enzima. En la Figura 4, se muestra el comportamiento del pH durante todas las pruebas de hidrólisis del músculo pre-cocido de pota.
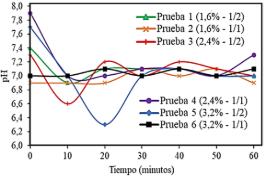
Figura 4. Variación del pH en el proceso de hidrólisis enzimática.
Se puede apreciar que las pruebas 1, 3, 4 y 5 presentaron un descenso inicial del pH, siendo la prueba 5 la que mostró el valor más bajo (pH = 6,3) durante los primeros 20 minutos. Posteriormente, se observó una uniformidad hacia la neutralidad en el pH, con mínimas fluctuaciones hasta el término del proceso de hidrólisis. La causa de esta estabilidad se debió al efecto de la adición del buffer NaOH al 40%, como solución reguladora para neutralizar los protones que se formaron durante la disociación del grupo carboxilo terminal de las proteínas, los cuales, mientras se repartían de acuerdo al equilibrio de protonización de los grupos amino liberados (Figueroa et al., 2016), hubiesen podido acidificar el medio, dificultando la acción de la enzima alcalina en el proceso.
Se señala que para realizar la actividad enzimática al máximo nivel, factores como la temperatura y el pH deben ajustarse a sus condiciones óptimas. De este modo, se reporta que altas temperaturas en el proceso hacen que muchas enzimas se desnaturalicen, mientras que el pH tiene influencia en la velocidad de reacción de la enzima (Baltodano, 2016).
Evaluación sensorial
En la Tabla 1 se puede observar que la mayor calificación del test de aceptabilidad fue asignada a la prueba de hidrólisis 5 - P5 (3,2% proporción de enzima vs 1/2 proporción de agua/sustrato), la cual, de acuerdo a los comentarios de los panelistas, presentó una menor intensidad del sabor amargo, en comparación con los demás tratamientos. Este atributo estaría en relación al tamaño molecular de los péptidos producidos (Pandia et al., 2013) y al tiempo de acción de la enzima utilizada durante el proceso de hidrólisis, siendo este último, un factor que pudo contribuir a la exposición de péptidos hidrofóbicos vinculados con la percepción sensorial de amargor.
Tabla 1
Grado de aceptabilidad de las pruebas en la escala hedónica del 1 al 5
Prueba de hidrolizado | Puntajes (1 - 5) |
P1 P2 P3 P4 | 1,27 ± 0,45 1,63 ± 0,49 1,53 ± 0,51 1,57 ± 0,50 |
P5 | 2,20 ± 0,48 |
P6 | 1,83 ± 0,46 |
En la Tabla 2 se observa que las pruebas experimentales no tuvieron el mismo efecto sobre el grado de aceptabilidad, con una diferencia significativa entre ellas (p < 0,05), destacando la prueba 5 con la más alta puntuación de los rangos promedios de la prueba de Kruskal-Wallis. Asimismo, este tratamiento presentó diferencia significativa respecto a los otros restantes (p < 0,05). En consecuencia, la prueba 5 fue elegida para ser sometida a los demás análisis contemplados en este estudio.
Tabla 2
Test de Kruskal-Wallis y HSD de Tukey para las puntuaciones sensoriales obtenidas por pruebas
Pruebas | N° de muestra | Rango prom. | Valor H | Valor p | Grupos homog.* |
P1 P2 P3 P4 | 30 | 56,93 88,47 79,87 82,73 | 45,54 | 0,001 | X |
30 | | | XX |
30 | | | XX |
30 | | | X |
P5 | 30 | 130,31 | | | X |
P6 | 30 | 104,68 | | | X |
* No existen diferencias estadísticamente significativas entre aquellos grupos que compartan una misma columna de X's.
Análisis Proximal
La composición química del músculo crudo y pre-cocido de D. gigas se muestra en la Tabla 3. Los valores expuestos para el músculo crudo son similares a los expuestos por diversos autores (Cortés-Ruiz et al., 2008; Sotelo, 2011; Salcedo, 2015). La reducción de la humedad, a expensas del ligero incremento de los otros componentes del producto pre-cocido, se debería a la solubilización y gelatinización del tejido conectivo, cuando este es sumergido en agua a alta temperatura (Lanier, 2000). Este proceso permitió la liberación del agua libre del músculo, en conjunto con proteínas sarcoplasmáticas y compuestos hidrosolubles responsables del sabor y olor característico de la pota, como lo son el cloruro de amonio (NH4Cl) y las N-BVT (Porturas et al., 2019). No obstante, se debe considerar que la composición química del músculo del calamar gigante puede variar debido a la edad y la temporada (De la Fuente-Betancourt et al., 2008).
Tabla 3
Composición proximal del músculo crudo y pre-cocido de pota
Componentes | Crudo (%) | Pre-cocido (%) |
Humedad | 84,70 ± 0,01 | 76,10 ± 0,10 |
Grasa | 0,40 ± 0,01 | 1,10 ± 0,20 |
Ceniza | 1,02 ± 0,01 | 0,90 ± 0,01 |
Proteína | 13,19 ± 0,07 | 20,44 ± 0,09 |
Carbohidratos* | 0,69 ± 0,10 | 1,46 ± 0,40 |
*Calculado por diferencia.
Múltiples estudios han reportado diversos valores en la composición fisicoquímica de productos proteínicos a base de pota, dirigidas al consumo humano (Tabla 4). Las notables diferencias frente a nuestros resultados se explicarían por el acondicionamiento inicial de la materia prima y las etapas implicadas en el desarrollo del producto hidrolizado. De este modo, operaciones como la pre-cocción y el método de secado aplicado, favorecieron a la reducción significativa del contenido de humedad y, por ende, el incremento de los demás componentes.
Respecto al método de secado por aspersión aplicado, se sabe que este convierte una solución o suspensión en polvo seco en un solo paso, lo cual es ventajoso para maximizar los beneficios y simplificar el proceso de deshidratación (Afoakwah et al., 2012).
Una concentración proteica similar al presente estudio se muestra en el trabajo de Canahualpa (2008), quien obtuvo un contenido de proteína de 80,95% y 81,31% en un aislado proteico a base de manto de pota, elaborado a través del método de hidrólisis química a diferentes valores de pH. Sin embargo, en contraste a este método hidrolítico, Sánchez (2014) distingue al proceso de hidrólisis enzimática, como aquel que permite obtener un producto soluble de elevada calidad, ya que el músculo es sometido a condiciones de pH y temperatura más favorables. Al respecto, Llerena et al. (2017) realizaron un hidrolizado enzimático de colágeno a partir de residuos de pescado, cuyo contenido proteico de 12,55% estuvo por debajo de nuestros resultados, probablemente debido a la naturaleza de su materia prima, la cual se considera como un sustrato de menor valor biológico.
En el ámbito normativo nacional, se establecen disposiciones de procesamiento pesquero para concentrados proteicos dirigida al consumo humano directo, de donde se desprende una clasificación de 3 categorías (A, B y C) en función al contenido de grasa y atributos sensoriales del producto. De esta manera, podemos clasificar a nuestro producto dentro de la tipología C, que engloba a toda harina de pescado producida en condiciones higiénicas satisfactorias (PRODUCE, 2016).
Grado de hidrólisis y pesos moleculares
El GH de la prueba 5 fue de 12,8%. A su vez, se observaron bandas de pesos moleculares en un rango entre 36 y 116 kDa en el gel de electroforesis, resultado que sugiere la presencia de fracciones proteicas con tamaños relacionados al bajo grado de fraccionamiento proteico. Se señala que las proteínas musculares del manto de D. gigas incluyen fracciones miofibrilares (entre 75 a 85% de la proteína total), compuestas principalmente por miosina (220 kDa), actina (45 kDa) y paramiosina (111 kDa) (De la Fuente-Betancourt et al., 2008; Rocha-Estrada et al., 2010; Dihort-Garcia et al., 2011).
La presencia de una banda próxima a los 116 kDa (cercano a la paramiosina) indicaría que esta tuvo su origen a partir de la cadena pesada de miosina (MHC), mientras que la banda de 36 kDa podría tratarse de la proteína fibrosa conocida como tropomiosina (TM), la cual ha sido reportada en D. gigas (PM aprox. de 38 kDa) y en otras especies de moluscos como la vieira (Z. patagónica), mejillón (Aulacomya ater ater) y calamar (I. argentinus), organismos asociados a un peso molecular aproximado de 35 kDa para TM (Murrieta-Martínez et al., 2015). A su vez, estudios indican la existencia de enzimas proteolíticas o metaloproteasas propias del músculo del manto de D. gigas, las cuales pueden contribuir al tratamiento de hidrólisis de la miosina, en su degradación a fragmentos más cortos como la meromiosina pesada (MMP) y la meromiosina ligera (MML) (Cortés-Ruiz et al., 2008; Dihort-Garcia et al., 2011; Fimbres-Romero et al., 2020).
Como indicador de rendimiento de la reacción hidrolítica, se señala que el GH depende de condiciones como la concentración de sustrato o proteína, la concentración de enzima utilizada o relación enzima/sustrato, el tiempo de reacción del proceso de hidrólisis, además de las condiciones físico químicas como el pH y la temperatura (Benítez et al., 2008). Un incremento del GH aseguraría la producción de cadenas peptídicas con menores PM, los cuales influyen sobre el comportamiento y efecto de las propiedades funcionales de los hidrolizados, siendo las más afectadas las capacidades espumantes, emulsificantes y antioxidantes (Benjakul et al., 2014). Tomando en cuenta este propósito, Vera (2016) señaló que el incremento del grado de hidrólisis, al trabajar con una mayor concentración de sólidos, debe contemplar el aumento del tiempo de reacción o la adición de una mayor cantidad de enzima. Sin embargo, el costo asociado al añadir más enzima es mucho mayor en comparación con los costos de funcionamiento del reactor, de agitación, de calentamiento, de inactivación, de agua o cualquier otra operación con costo asociado.
Finalmente, es importante señalar que estudios recientes en proteómica predictiva “in silico”, han identificado la presencia de péptidos bioactivos en la piel de D. gigas, con propiedades antitumorales, antimicrobianos y antihipertensivos (Carrera et al., 2020).
Análisis microbiológico
La prueba 5 presentó valores inferiores al intervalo límite de microorganismos no patógenos, asociados a las condiciones de higiene del proceso y a la vida útil/alteración del producto. Asimismo, los microorganismos patógenos vinculados a enfermedades transmitidas por alimentos (ETA) fueron ausentes. Estos resultados, en su conjunto, aseguraron la calidad sanitaria e inocuidad del producto (Tabla 5).
Tabla 5
Recuento de microrganismos de la prueba 5 en comparación con límites establecidos
Microorganismos | Límites1 | P5 |
m | M |
Mohos | 102 UFC/g | 103 UFC/g | < 10 UFC/g |
Levaduras | 102 UFC/g | 103 UFC/g | < 10 UFC/g |
Enterobacterias | 10 UFC/g | 102 UFC/g | < 10 UFC/g |
Salmonella spp | AUS/25 g | - | AUS |
1 SANIPES – Organismo Nacional de Sanidad Pesquera (2016).
Límites para la categoría de productos hidrobiológicos deshidratados (concentrados proteicos y otros de consumo humano).
AUS: ausencia.
4. Conclusiones
El empleo de cefalópodos en el procesamiento de productos hidrolizados es una ventana tecnológica que debe ser estudiada y difundida para evaluar su viabilidad en la industria alimentaria. Este estudio determinó que los parámetros tecnológicos de concentración de enzima, ratio agua/sustrato, pH, temperatura y tiempo con valores de 3,2%, 1/2, 7, 55 °C y 1 hora, respectivamente; permitieron que la prueba 5 de hidrolizado en polvo de calamar gigante, mostrara un contenido de nitrógeno proteico elevado (79,22%), un GH de 12,8%, con fracciones proteicas entre 36 a 116 kDa de PM, y un recuento de microorganismos por debajo de los límites establecidos para esta categoría de alimentos, condiciones sanitarias adecuadas para su consumo. Dados estos resultados, se recomienda el estudio del producto respecto a su vida útil y propiedades funcionales, información esencial para su consideración como ingrediente marino dentro de la formulación de otros alimentos, los cuales podrían conformar una dieta suplementaria infantil y del adulto mayor, quienes requieren de alimentos que contribuyan a una mayor digestibilidad y fácil nutrición enteral.
Referencias bibliográficas
Afoakwah, N., Adomako, C., Owusu. J., Engman, N. F., & Hannah, A. A. (2012). Spray Drying as an Appropriate Technology for the Food and Pharmaceutical Industries - A Review. Journal of Environmental Science, Computer Science and Engineering & Technology, 1(3), 467-476.
Albrecht, M., Yupanqui, G., Solari, A., & Pariona, D. (2017). Seasonal effects on proximal composition of male and female giant squid (Dosidicus gigas) and its rheological properties of surimi. Cogent Food & Agriculture, 3: 1-6.
Al-Janabi, Y. (2016). The Utilization of Mackerel (Scomber scombrus) Rest Raw Material Towards the Production of Oil and Protein - Effect of Storage Conditions on Yield, Quality, and Composition (Tesis de maestría). Norwegian University of Science and Technology, Trondheim, Noruega.
AOAC-Association of Official Analytical Chemists. (1996). Official Methods of analysis. Rockville, USA.
AOAC-Association of Official Analytical Chemists. (2006). Official Methods of Analysis of AOAC International, 18th ed. AOAC International, Maryland, USA.
Atef, M., & Ojagh, S. (2017). Health benefits and food applications of bioactive compounds from fish byproducts: A review. Journal of Functional Foods, 35, 673-681.
Baltodano, S. (2016). Efecto de la concentración de alcalasa y tiempo de digestión sobre el grado de hidrolisis y acción inhibitoria frente a Staphylococcus aureus en el hidrolizado proteico de frijol ñuña (Phaseolus vulgaris l.) variedad pava (Tesis de pregrado). Universidad Privada Antenor Orrego, Trujillo, Perú.
Benjakul, S., Yarnpakdee, S., Senphan, T., Halldorsdottir, S. M., & Kristinsson, H. G. (2014). Fish protein hydrolysates: Production, bioactivities, and applications. En H. G. Kristinsson (Ed.), Antioxidants and Functional Components in Aquatic Foods (pp. 237-281). John Wiley & Sons.
Benítez, R., Ibarz, A., & Pagan, J. (2008). Hidrolizados de proteína: procesos y aplicaciones. Acta Bioquímica Clínica Latinoamericana, 42(2), 227-237.
Bustamante, D. (2014). Caracterización de barras de cereales altoandinos bañadas en chocolate y enriquecidas con concentrado proteico de pota (Dosidicus gigas) (Tesis de pregrado). Universidad Nacional San Agustín, Arequipa, Perú.
Canahualpa, L. (2008). Obtención de un aislado proteico a partir del manto de pota o calamar gigante (Dosidicus gigas) (Tesis de pregrado). Universidad Nacional del Centro del Perú, Huancayo, Perú.
Carrera, M., Ezquerra-Brauer, J. M., & Aubourg, S. P. (2020). Characterization of the Jumbo Squid (Dosidicus gigas) Skin By-Product by Shotgun Proteomics and Protein-Based Bioinformatics. Marine Drugs, 18(1), 1-27.
Cheung, R., Ng, T., & Wong, J. (2015). Marine Peptides: Bioactivities and Applications. A review. Marine Drugs, 13(7), 4006-4043.
Cortés-Ruiz, J. A., Pacheco-Aguilar, R., Lugo-Sánchez, M. E., Carvallo-Ruiz, M. G., & García-Sánchez, G. (2008). Production and functional evaluation of a protein concentrate from giant squid (Dosidicus gigas) by acid dissolution and isoelectric precipitation. Food Chemistry, 110, 486-492.
Córdova J., & García, F. (2002). Nutritive value of squid and hydrolyzed protein supplement in shrimp feed. Aquaculture, 210, 371-384.
Córdova, J. (2016). Efecto del polvo proteico de pota (Dosidicus gigas) como insumo en la elaboración de yogurt (Tesis de maestría). Universidad Nacional Mayor de San Marcos, Lima, Perú.
De la Fuente-Betancourt, G., García-Carreño, F., De los Ángeles, M., Pacheco-Aguilar, R., & Córdova-Murueta, J.H. (2008). Effect of storage at 0 °C on mantle proteins and functional properties of jumbo squid. International Journal of Food Science and Technology, 43, 1263-1270.
Delcroix, J., Gatesoupe, J., Desbruyères, E., Huelvan, C., Le Delliou, H., Le Gall, M.-M., Quazuguel, P., Mazurais, D., & Zambonino, J. L. (2015). The effects of dietary marine protein hydrolysates on the development of sea bass larvae, Dicentrarchus labrax, and associated microbiota. Aquaculture Nutrition, 21, 98-104.
Dihort-Garcia, G., Ocano-Higuera, V. M., Ezquerra-Brauer, J. M., Lugo-Sanchez, M. E., Pacheco-Aguilar, R., Barrales-Heredia, S. M., & Marquez-Rios, E. (2011). Producción y evaluación funcional de un concentrado proteico de calamar gigante (Dosidicus gigas) obtenido mediante disolución alcalina. CyTA - Journal of Food, 93, 171-179.
Espinoza, K. (2017). Desarrollo de un snack extruido a base de maíz enriquecido con harina de pota (Dosidicus gigas) precocida y determinación de su vida útil (Tesis de pregrado). Universidad Nacional Agraria La Molina, Lima, Perú.
Figueroa, O. A., Zapata, J. E., & Sánchez, C. P. (2016). Optimización de la Hidrólisis Enzimática de Proteínas de Plasma Bovino. Información Tecnológica, 27(2), 39-52.
Fimbres-Romero, M. J., Cabrera-Chávez, F., Ezquerra-Brauer, J. M., Márquez-Ríos, E., Suárez-Jiménez, G.M., Del Toro-Sanchez, C.L., Ramírez-Torres, G.I., & Torres-Arreola, W. (2020). Utilisation of collagenolytic enzymes from sierra fish (Scomberomorus sierra) and jumbo squid (Dosidicus gigas) viscera to generate bioactive collagen hydrolysates from jumbo squid muscle. Journal of Food Science and Technology, 1-9.
Flores, S. M., Guevara, A., Córdova-Ramos, J. S., & Solari-Godiño, A. (2020). Efecto del tiempo de hidrólisis enzimática sobre las propiedades tecno-funcionales y capacidad antioxidante de la pota Dosidicus gigas. Ciencia e Investigación, 23(2), 15-21.
Gevaert, B., Veryser, L., Verbeke, F., Wynendaele, E., & De Spiegeleer, B. (2016). Fish Hydrolysates: A Regulatory Perspective of Bioactive Peptides. Protein & Peptide Letters, 23(12), 1-9.
Guerard, F., Decourcelle, N., Sabourin, C., Floch-Laizet, C., Le Grel, L., Le Floch, P., Gourlay, F., Le Delezir, R., Jaouen, P., & Bourseauet, P. (2010). Recent developments of marine ingredients for food and nutraceutical applications: A review. Journal des Sciences Halieutique et Aquatique, 2, 21-27.
Hevrøy, E., Espe, M., Waagbø, R., Sandnes, K., Ruud, M., & Hemre, G.-I. (2005). Nutrient utilization in Atlantic salmon (Salmo salar L.) fed increased levels of fish protein hydrolysate during a period of fast growth. Aquaculture Nutrition, 11, 301-313.
Kristinsson, H., & Rasco B. (2000). Fish Protein Hydrolysates: Production, Biochemical, and Functional Properties. Critical Reviews in Food Science and Nutrition, 40(1), 43-81.
Khosravi, S., Bui, H., Rahimnejad, S., Herault, M., Fournier, V., Kim, S.-S., Jeong, J.-B., & Lee K.-J. (2015). Dietary supplementation of marine protein hydrolysates in fish-meal based diets for red sea bream (Pagrus major) and olive flounder (Paralichthys olivaceus). Aquaculture, 435, 371-376.
Laemmli, U. K. (1970). Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature, 227, 680-685.
Lanier, T. C. (2000). Gelation chemistry. En J. W. Park (Ed.), Surimi and surimi seafood (pp. 237-265). New York, USA: Marcel Dekker.
Le Gouic, A., Harnedy, P., & Fitzgerald, R. (2019). Bioactive Peptides from Fish Protein By-Products. En J.-M. Mérillon, y K. G. Ramawat (Eds.), Bioactive Molecules in Food, Reference Series in Phytochemistry (pp. 355-388). Springer Cham.
Lian, P., Lee, C., & Park, E. (2005). Characterization of squid-processing byproduct hydrolysate and its potential as aquaculture feed ingredient. Journal Agricultural and Food Chemistry, 53(14), 5587-5592.
Llerena, T., & Rodríguez, W. (2017). Obtención y caracterización de un hidrolizado de colágeno purificado producido mediante el uso de la enzima delvolase. Anales Científicos, 78(2), 251-259.
Maza, S., & Pariona, D. (2020). Mejoramiento del gel de surimi de anchoveta (Engraulis ringens) mediante adición de surimi de brazo de calamar gigante (Dosidicus gigas). Revista de Investigaciones Veterinarias del Perú, 31(1), e17569.
Miranda, G., Ventura, J., & Fuertes, C. (2007). Actividad citotóxica y antioxidante de los productos de la reacción de Maillard de los sistemas modelo D-glucosa-glicina y D-glucosa-L-lisina. Revista de la Sociedad Química del Perú, 73(4), 215-225.
Moreno, H. M., Herranz, B., Pérez, M., Sánchez, I., & Borderías, J. A. (2016). New Alternatives in Seafood Restructured Products. Critical Reviews in Food Science and Nutrition, 56(2), 237-248.
Murrieta-Martínez, C. L.; Ezquerra-Brauer, J. M.; Ocaño-Higuera, V. M., Cinco-Moroyoqui, F. J., Torres-Arreola, W., & Márquez-Ríos, E. (2015). Aislamiento y caracterización parcial de miosina del manto de calamar gigante (Dosidicus gigas). CyTA - Journal of Food, 13(3), 392-399.
Omote, J., Roldán, D., & Juscamaita, J. (2014). Elaboración de un hidrolizado de músculo desmenuzado de pota (Dosidicus gigas), con proteasa alcalina. Anales Científicos, 75, 227-233.
Pandia, S., Solari, A., & Albrecht, M. (2013). Hidrólisis enzimática de residuos de anchoveta y anchoveta entera a nivel piloto y caracterización de sus productos. En A. Salas, M. Barriga, y M. Pazos (Eds.), Boletín de Investigación Instituto Tecnológico de la Producción 11 (pp. 21-28). Callao, Perú.
Ponte, C. (2014). Informe final proyecto de investigación "Elaboración de hidrolizado de pota (Dosidicus gigas), para consumo humano". Informe Final de investigación. Universidad Nacional del Callao. 133 p.
Porturas, R., Hurtado, M., & Crispín, F. (2019). Preparation of single pasta from pota (Dosidicus gigas) cuttings in pack ¼ club. Agroindustrial Science, 9(2), 145-153.
Reátegui, A., & Jiménez, G. (2016). Elaboración de porciones precocidas y empanizadas a base de "pota", Dosidicus gigas (Tesis de pregrado). Universidad Nacional del Callao, Callao, Perú.
PRODUCE. (2016). Decreto Supremo Nº 015-2016-PRODUCE, que establece disposiciones sobre la actividad de procesamiento pesquero para la producción de concentrados proteicos. Normas Legales. El Peruano.
Rocha-Estrada, J. G., Córdova-Murueta, J. H., & García-Carreño, F.L. (2010). Functional properties of protein from frozen mantle and fin of jumbo squid Dosidicus gigas in function of pH and ionic strength. Food Science and Technology International, 16(5), 451-458.
Rojas, D. (2009). Evaluación de la toxicidad a dosis repetidas (90 días) por vía oral del concentrado de proteína de pota (Dosidicus gigas), en ratas sprague dawley (Tesis de maestría). Universidad Nacional Agraria La Molina, Lima, Perú.
Salcedo, F. (2015). Elaboración de hojuela dulce a partir del manto molido de pota (Dosidicus gigas) con quinua (Chenopodium quinoa) (Tesis de pregrado). Universidad Nacional Agraria La Molina, Lima, Perú.
Sánchez, A., Arias, J. L., Torres, W., Marquez, E., Cárdenas, J. L., García, G., & Ezquerra, J. M. (2013). Caracterización de hidrolizados de desechos de calamar gigante (Dosidicus gigas) obtenidos por autohidrólisis y un proceso químico-enzimático. CyTA - Journal of Food, 12(1), 85-96.
SANIPES-Organismo Nacional de Sanidad Pesquera. (2016). Manual de Indicadores Sanitarios y de Inocuidad para los Productos Pesqueros y Acuícolas. Recuperado de: http://www.sanipes.gob.pe/normativas/15_R_DE_N_057_2016_A1.pdf
Šližytė, R., Carvajal, A., Mozuraityte, R., Aursand, M., & Storrø, I. (2014). Nutritionally rich marine proteins from fresh herring by-products for human consumption. Process Biochemistry, 49(7), 1205-1215.
Solari-Godiño, A., Córdova-Ramos, J. S., Pilco-Quesada, S., Cerrón Mallqui, L. M., Albrecht-Ruiz, M., & Sánchez, J. (2017). Composición proximal y propiedades funcionales del surimi liofilizado de Dosidicus gigas "calamar gigante". Scientia Agropecuaria, 8(1), 57-62.
Sotelo, C. (2011). Efecto de la congelación sobre la capacidad gelificante del músculo de calamar gigante (Dosidicus gigas) y su relación con los cambios estructurales de las proteínas (Tesis de maestría). Centro de Investigación en Alimentación y Desarrollo, A.C., Sonora, México.
Vera, O. (2016). Evaluación económica de la operación de reactor enzimático para la hidrólisis de proteínas de subproductos de la industria pesquera (Memoria de pregrado). Universidad Técnica Federico Santa María, Valparaíso, Chile.
Wu, S., Sun, J., Tong, Z., Lan, X., Zhao, Z., & Liao, D. (2012). Optimization of Hydrolysis Conditions for the Production of Angiotensin-I Converting Enzyme-Inhibitory Peptides and Isolation of a Novel Peptide from Lizard Fish (Saurida elongata) Muscle Protein Hydrolysate. Marine Drugs, 10(12), 1066-1080.