
Estrés prenatal por
SARS-CoV-2 como factor de riesgo de la esquizofrenia.
Prenatal SARS-CoV-2 stress as a risk factor for schizophrenia.
Mariana Lucía Falla-Castillo 1,a,
Ángel Carlos Fabian-Alfaro
1,a,
Ángel Carlos Fabian-Alfaro 1,2,a,
Sandra Nayelly Estrella-Saavedra
1,2,a,
Sandra Nayelly Estrella-Saavedra 1,a, Julio Cesar
Eslava-Díaz
1,a, Julio Cesar
Eslava-Díaz 1,a,
María Nimia Cruz-Briceño
1,a,
María Nimia Cruz-Briceño 1,b
1,b
1 Universidad Nacional de Trujillo. La
Libertad, Perú.
2 Sociedad Científica de Estudiantes de
Medicina de la Universidad Nacional de Trujillo (SOCEMUNT).
a Estudiante de Medicina Humana.
b Biólogo, Doctor en Ciencias
Biomédicas.
Correspondencia: Angel Carlos Fabian Alfaro. 🖂 t1021801321@unitru.edu.pe / angelcarlosfabianalfaro@gmail.com Recibido: 12/04/2022 Aceptado: 05/06/2022
Citar como: Falla-Castillo M, Fabian-Alfaro A,
Estrella-Saavedra S,Eslava-Díaz J, Cruz-Briceño M. Estrés prenatal por
SARS-CoV-2 como factor de riesgo de la esquizofrenia. Rev méd
Trujillo.2022;17(2):062-067. doi: https://doi.org/10.17268/rmt.2022.v17i2.4567
RESUMEN
La esquizofrenia es un trastorno mental grave que se caracteriza
por delirios y alucinaciones (síntomas positivos), además de abulia, depresión
y deterioro cognitivo (síntomas negativos), lo que supone una gran carga
socioeconómica requiriendo de un diagnóstico temprano y tratamiento oportuno.
Esta enfermedad es de origen multifactorial, siendo uno de sus posibles
factores el estrés prenatal causado por infecciones víricas, que podrían
perjudicar el desarrollo neuronal. La investigación tiene como objetivo revisar
la información sobre la infección prenatal por SARS-CoV-2 como factor de riesgo
en el desarrollo de la esquizofrenia. El adecuado desarrollo del sistema
nervioso requiere de un estado anti-inflamatorio del sistema inmunológico
materno durante el segundo trimestre de embarazo. En este periodo, los procesos
de infección viral, como la Covid-19, actúan como estímulos proinflamatorios
que alteran el ambiente molecular e inducen la “Activación inmune materna”
(AIM), evento asociado con la alteración funcional de las neuronas
dopaminérgicas que genera desequilibrios en la concentración de dopamina.
Asimismo, la AIM afecta la actividad fagocítica de las microglías,
desencadenando una poda sináptica excesiva; además, induce cambios epigenéticos
en las mismas, que sumado a su supervivencia de hasta 20 años, conllevarían al
desarrollo a largo plazo de la esquizofrenia.
Palabras
Clave: Esquizofrenia, activación
inmune materna, Covid-19, estrés prenatal (Fuente:
DeCS BIREME).
SUMMARY
Schizophrenia is a serious mental disorder characterized by
delirium and hallucinations (positive symptoms), as well as abulia, depression
and cognitive impairment (negative symptoms), which entails a large
socioeconomic burden requiring early diagnosis and timely treatment. This
disease has a multifactorial origin, being the prenatal stress caused by viral
infections one of its possible factors; this due to, it could harm neuronal
development. This research aims to review the knowledge on prenatal SARS-CoV-2
infection as a risk factor in the development of schizophrenia. The proper
development of the nervous system requires an anti-inflammatory state of the
maternal immune system during the second trimester of pregnancy. In this
period, viral infection processes, such as Covid-19, act as proinflammatory
stimuli that alter the molecular environment and induce "maternal immune
activation" (MAI), an event associated with the functional alteration of
dopaminergic neurons that generates imbalances in dopamine concentration.
Likewise, MAI affects the phagocytic activity of microglia, triggering excessive
synaptic pruning; in addition, it induces epigenetic changes in them, which
added to their survival of up to 20 years, would lead to the long-term
development of schizophrenia.
Key
words: Schizophrenia, maternal immune
activity, Covid-19, prenatal stress (Source:
MeSH).
INTRODUCCIÓN
Según la OMS, la esquizofrenia es un
trastorno mental grave de tipo psicótico y de origen multifactorial,
caracterizado por un alejamiento de la realidad con presencia de delirios,
desequilibrios emocionales, alucinaciones y comportamiento regresivo. Actualmente,
alrededor de 24 millones de personas en el mundo son afectadas con esta
enfermedad [1].
En el 2010, según el director del Hospital Víctor Larco Herrera había
aproximadamente 280 mil casos de esquizofrenia en el Perú y de éstos, sólo el
62 % tienen diagnóstico definido y reciben tratamiento [2]; en la actualidad
no se ha reportado una cifra oficial de pacientes que padecen de esquizofrenia
en el país.
Su etiología se ha asociado con el estrés
prenatal generado por infecciones víricas, que al inducir una respuesta
inflamatoria perjudican el desarrollo neuronal, provocando una alteración de la
actividad dopaminérgica. Esto originará un desequilibrio en la concentración de
dopamina, evento característico de la fisiopatología de la esquizofrenia [3]. En la actualidad,
se evidencia que la infección por SARS-CoV-2 provoca una reacción exacerbada
del sistema inmune innato, lo que desencadena la liberación de citoquinas
proinflamatorias que activan a más células leucocitarias, y de esta manera
retroalimentan positivamente la síntesis de más citoquinas como interferones
(IFN); factor de necrosis tumoral (TNF); las interleucinas (IL) 1β, 6, 7, 8; entre
otras moléculas [4] que incrementarían el estrés prenatal.
En 1991, O’Callaghan et al. asociaron el
problema de esquizofrenia con la epidemia de influenza A2 de 1957, observando
que, de los nacidos durante esta epidemia, la frecuencia con la que se presentó
la enfermedad fue 88% mayor que el grupo control [5]. En el año 2003,
Zuckerman propuso por primera vez la relación entre la esquizofrenia y la
exposición prenatal a infecciones por agentes patógenos, explicándolo a través
del mecanismo de la activación inmune materna (AIM), que consiste en la
liberación de citoquinas proinflamatorias durante el embarazo; que podría
conllevar a la alteración del desarrollo del cerebro fetal normal [6]. Los resultados de
O'Callaghan sugirieron una correlación entre ambos factores, sin embargo, no se
tuvo un entendimiento certero hasta el trabajo de Zuckerman [6]. Estos antecedentes
permiten preguntarnos si, al igual que en epidemias pasadas, la infección por
SARS-Cov2 de las gestantes, constituye un factor de riesgo para el futuro desarrollo
de la esquizofrenia en sus hijos. Además, varias investigaciones [3,7,8] ya están planteando
posibles hipótesis de lo que el futuro le depara a este problema.
La esquizofrenia supone una gran carga
socioeconómica, que no solo afecta a las personas que la padecen, sino también
a sus cuidadores, el sistema de salud y la sociedad. Pueden transcurrir varios
años entre la aparición de los primeros síntomas y el primer contacto
terapéutico, por lo que lograr dar un diagnóstico temprano y tratamiento
oportuno conlleva a evitar el agravamiento del cuadro clínico y la reducción
del sufrimiento derivado de la enfermedad. En otras palabras, la intervención
temprana es importante para un mejor pronóstico; además, supone una reducción
del gasto sanitario [9,10].
Comprender la influencia del SARS-CoV-2 en la
etapa prenatal y posible desarrollo de la esquizofrenia a largo plazo en el
individuo permitirá al sistema de salud: a) mejorar la atención, a través del
asesoramiento en la mujer grávida durante el control gestacional; b) prevenir
el incremento del número de personas que desarrollarán la enfermedad mental; y
c) ofrecer una atención precoz en el diagnóstico, tratamiento y seguimiento de
los hijos de las gestantes afectadas por el virus. Ante lo expuesto, en la
presente investigación se revisa la infección por SARS-Cov-2 como probable
factor de riesgo, a largo plazo, de la esquizofrenia.
METODOLOGÍA
Para la presente revisión narrativa se
realizó una búsqueda bibliográfica en 5 bases de datos: Pubmed, Science Direct,
Scopus, Proquest y Redalyc; y fuentes externas, como la página del Estado
peruano, desde diciembre de 2021 hasta febrero de 2022. Se empleó los
siguientes términos de búsqueda: “Activación Inmune Materna”, “Embarazo”,
“Sistema inmune del embarazo”, “Infección prenatal”, “SARS-CoV-2”, “Covid-19”,
“Poda sináptica”, “Esquizofrenia”, “Neuronas dopaminérgicas”, “Desarrollo del
sistema nervioso”. Se emplearon artículos tanto en inglés como en español; se
priorizó el uso de artículos realizados en los últimos 5 años. Sin embargo,
desde hace décadas, la esquizofrenia y la activación inmune materna han sido
motivo de diferentes investigaciones, por lo que fue necesario hacer uso de 9
artículos de publicaciones no recientes.
Se recopiló un total de 41 artículos de las
bases de datos ya mencionadas, a partir de los cuales se realizó un exhaustivo
análisis con el objetivo de obtener información de importancia para la
elaboración de la presente revisión narrativa.
DESARROLLO DE LAS NEURONAS DOPAMINÉRGICAS
La génesis de las neuronas dopaminérgicas
inicia en la sexta semana y media del desarrollo embrionario, a partir de la
zona proliferativa de la placa de suelo del mesencéfalo (mFP). En su
diferenciación temprana expresan marcadores neuronales como la β-tubulina III, luego
migran a la zona intermedia y finalmente se ubican en la zona del manto donde
se realiza su maduración. En su diferenciación tardía se expresa la enzima
catecolaminérgica tirosina hidroxilasa (TH) y la descarboxilasa de
L-aminoácidos aromáticos (AADC), necesarios para sintetizar dopamina [11]. Este proceso está
regulado por la señalización SHH-FOXA2 y por citoquinas liberadas por el
sistema inmune adaptativo de la madre, como el factor de crecimiento
transformante β (TGF-β) y la IL-10, producidos
por los linfocitos T reguladores (Treg), que son necesarios para la
diferenciación de células progenitoras mesencefálicas (CPM) a neuronas
dopaminérgicas [12,13]; específicamente participando en la expresión de la enzima TH,
que limita la velocidad de la síntesis de dopamina (14). Asimismo, las
citoquinas proinflamatorias IL-1β e IL-6, en concentraciones moderadas, promueven la
diferenciación de las CPM y la modulación de la actividad dopaminérgica en
diversas estructuras mesolímbicas, respectivamente [3].
La posición final de las neuronas
dopaminérgicas es en tres núcleos distintos: la sustancia negra pars compacta,
el área tegmental ventral y el campo retrorubral [15].
Las neuronas dopaminérgicas maduras
sintetizan dopamina y participan en la regulación del movimiento voluntario,
por ello cualquier tipo de lesión de las células dopaminérgicas, o procesos
inflamatorios anormales, conllevarán al desarrollo de la esquizofrenia [3,16].
SISTEMA INMUNOLÓGICO EN EMBARAZADAS
Durante el embarazo, el embrión al expresar
genes paternos, forman moléculas antigénicas que son reconocidas como no
propias, por las células maternas. Estas deberán ser atacadas por anticuerpos
maternos; sin embargo, se dan cambios en el sistema inmunológico materno para
que se establezca un estado de tolerancia materno-fetal, necesaria para el
desarrollo embrio-fetal. Estos cambios suceden en tres etapas:
Etapa
pro-inflamatoria, primer trimestre.
En esta etapa se da la implantación y
formación de la placenta, procesos que requieren de la reciprocidad entre el
trofoblasto infiltrante y las células endometriales receptoras, evento mediado
por proteínas de adhesión en la membrana endometrial [17]. Esto es posible ya
que las células T helper (Th1) generan un estado proinflamatorio al producir citoquinas
como IL-1β, IL-6, IL-8, IL-15,
TNFα y el factor
estimulante de colonias de granulocitos y macrófagos (GM-CSF). Además, aumentan las células dendríticas C11+, que
intervienen en la tolerancia materna [17,18]; las células T natural
killer (NK), que participan en la implantación del blastocisto [19,20]; y los monocitos
intermedios, que estimulan un aumento en la producción de IL-12 y TNFα [20] (Figura 1).
Etapa anti-inflamatoria,
segundo trimestre.
Participan principalmente las células T
helper 2 (Th2), que están relacionadas con citoquinas anti-inflamatorias como
IL-4, IL-5 e IL-13, por lo que cualquier estímulo proinflamatorio que reciba,
provocará graves consecuencias en el desarrollo fetal [18]. Las células Treg
al detener la maduración de células dendríticas, la citotoxicidad de las
células NK, la proliferación de células CD4 y CD8 (20), impiden la respuesta
inmunitaria materna contra los antígenos paternos, conservando así el estado
anti-inflamatorio [17]. Asimismo, aumenta la concentración de células dendríticas
monocitoides (mDC) y plasmacitoides (pDC), granulocitos y monocitos. Estas
últimas células, a partir de la semana 13, presentan un mayor número de
proteínas adhesión e incrementan la producción de la IL-1β; mientras que la producción
del TNFα (21) y quimiocinas
disminuye, así como también la migración de leucocitos [20] (Figura 1).
Etapa
pro-inflamatoria, tercer trimestre.
Disminuye la concentración de las células T,
macrófagos y células B [21], y aumenta la producción de IL-6 [22]. En los últimos dos
trimestres, la presencia de CD56dim y producción del interferón gamma (IFN-γ) es menor [21]. (Figura 1).
Durante la gestación existe una menor
concentración de células CD3, CD4 y CD8, en comparación al periodo postparto [21]. Además, el aumento
de la concentración de estrógenos suprime la acción de Th1 y estimula a Th2 [23]; y el incremento de
la progesterona estimula la producción de la IL-10 [24].
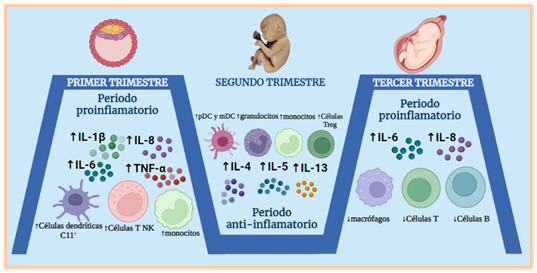
Figura 1: Cambios
inmunológicos normales durante la gestación. Elaborado por los autores
SISTEMA INMUNOLÓGICO DE LAS EMBARAZADAS INFECTADAS POR SARS-COV-2:
ACTIVACIÓN INMUNE MATERNA
La infección por SARS-CoV-2 en el embarazo
es, en cierto punto, igual al de una persona sin dicha condición; sin embargo,
las consecuencias de este proceso, como la liberación de ciertas citoquinas,
son perjudiciales para la madre, pero especialmente para el producto de la
gestación. En este proceso se presentan las siguientes etapas (Figura 2):
1.
Cuando
el SARS-CoV-2 ingresa a la mucosa respiratoria, las células del sistema inmune
innato (neutrófilos, macrófagos y células NK) migran a la zona afectada para
neutralizar al antígeno [25]:
§ Los neutrófilos:
Fagocitan al SARS-CoV-2 y producen quimiocinas, como IL-23 y G-CSF, que
reclutan otras células inmunológicas para actuar en la zona de la lesión [26].
§ Los macrófagos:
Fagocitan al SARS-CoV-2 pero estos, a diferencia de los neutrófilos, sobreviven
al proceso y presentan el antígeno a los linfocitos T. Al formar el endosoma,
sus receptores tipo Toll 3 o 7 (TLR3 o TLR7) actúan como receptores de patrones
moleculares asociados a patógenos (PRR) y reconocen patrones moleculares
asociado al SARS-CoV-2, como parte de su ARN o proteínas virales. Luego, estas
se exponen en la superficie celular de los macrófagos a través de los antígenos
leucocitarios humanos (HLA) para que sean reconocidos por los linfocitos T CD4+
(TH1 y TH17) y T CD8+ [25,26]. Además, liberan óxido
nítrico sintasa (NOS) y citoquinas como TNF, INF-α, IL-1, IL-1β, IL-6, IL-12, que
participarán en la inflamación y estimulación de células del sistema inmune
innato y adaptativo [26].
§ Las células NK:
Causan la lisis de células infectadas, reconocen las células que no lo están y
el ambiente proinflamatorio, ya que su membrana presenta receptores de
interleucinas. También liberan citoquinas como INF-γ y TNF que contribuyen a que
los macrófagos digieran patógenos fagocitados [27].
2.
Las
células presentadoras de antígenos contactan a linfocitos Th y citotóxicos (T
CD8+) para estimular a los linfocitos B en la producción de
anticuerpos y eliminación de células infectadas, respectivamente. Además, estos
linfocitos secretan más citoquinas proinflamatorias como IFN-α, IFN-γ, IL-1β, IL-2, IL-6, IL-12,
IL-18, IL-33, proteína
quimioatrayente de monocitos 1 (MCP1), proteína inflamatoria de macrófagos 1 alfa (MIP-1α) y TNF-α [25].
3.
Los
linfocitos T citotóxicos, las células NK y los macrófagos ahora actúan
específicamente gracias a que los anticuerpos marcan a células infectadas o
virus. Pero como consecuencia de la liberación de citoquinas proinflamatorias,
se inhibe la acción de los linfocitos Treg por lo que no hay un control en la
acción de las células inmunitarias, lo que desencadena la respuesta inmune
exacerbada y la “tormenta de citoquinas” [28].
Como se mencionó, la gestante tiene una
especie de “reloj inmunológico” ya que la dinámica respuesta inmunológica en el
interfaz materno-fetal cambia dependiendo del trimestre del embarazo [29], debido a los
aportes hormonales maternos (gonadotropina coriónica y progesterona) y a la
inducción robusta y progresiva en la señalización STAT5ab endógena en diversos
subconjuntos de linfocitos T [25,29]. Este evento inmunológico
indistinto a la COVID-19 altera la historia natural de la enfermedad en la
mujer embarazada.
Durante el segundo trimestre de gestación, se
alcanza un estado anti-inflamatorio que favorece al rápido crecimiento celular
del feto [17]. En este periodo hay secreción de citoquinas
anti-inflamatorias, pero principalmente de TGF-β que induce la
diferenciación de linfocitos navïe a linfocitos Treg y no a linfocitos TH17 que
participan en procesos de naturaleza proinflamatorios; entonces, una proporción
alterada entre células TH17 y células Treg en el útero o en la circulación
materna, está asociada a complicaciones del embarazo, como aborto espontáneo,
preeclampsia y parto prematuro [17]; y eso es lo que sucede si
hay una infección y reactivación del sistema inmune en la madre durante el
segundo trimestre. Este proceso de reactivación del sistema inmune de un estado
anti-inflamatorio a proinflamatorio se denomina “Activación inmune materna”
(AIM), caracterizado por la presencia de citoquinas proinflamatorias como TNFα, IL-1β, IL-6, IL- 17a,
IL-10 en el suero materno que, al ser permeables a la placenta, también son recepcionadas
por el feto [8,30,31].
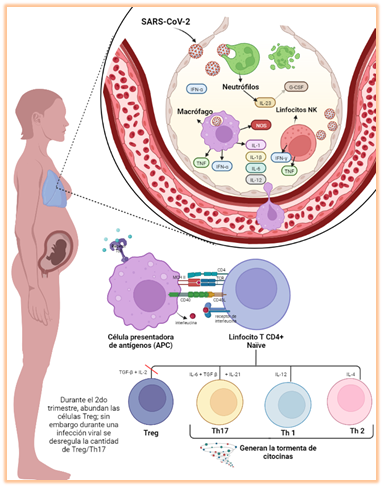
Figura 02. Descripción del proceso de
infección por SARS-CoV-2 en una mujer embarazada. Elaborado por los autores
SARS-COV-2, ACTIVACIÓN INMUNE MATERNA Y DESARROLLO DE LA ESQUIZOFRENIA
Estudios pasados de brotes infecciosos
históricos demostraron la asociación de la AIM, producto de infecciones, y el
posterior desarrollo de la esquizofrenia; estas afirmaciones podrían
extrapolarse a la actual pandemia por SARS-CoV-2.
En 1957 la exposición intrauterina al virus
de la influenza, durante el segundo trimestre de la gestación, tuvo como
consecuencia el incremento del riesgo de hospitalizaciones por esquizofrenia de
los adultos que habían sido expuestos prenatalmente [7]; asimismo, la
pandemia de rubéola de 1964, provocó el aumento de la prevalencia de esta
patología de menos del 1% al 20% (32). En ambos casos, la AIM es el factor que
predispuso el desarrollo de la esquizofrenia.
Para demostrar la asociación entre una
infección viral y el desarrollo de la esquizofrenia, se realizan pruebas en
animales preñados con ácido poliinosínico-policitidílico (Poly [I:C]), o en
presencia de interleucinas proinflamatorias (IL-1, IL-6, IL-17) [7]. Pekala et al. [33] recopilaron
estudios hecho en ratones con Poly [I:C] que evidenciaron que ante estos
estímulos la descendencia de los ratones presentaba aumento de ansiedad,
disminución de la interacción social, comportamiento anhedónico aumentado o
mayor número de movimientos repetitivos. Se reportó que después de la
exposición a Poly [I:C] las citoquinas proinflamatorias como IL-6, IL-1β y el TNF-α, se elevan en la
sangre materna, la placenta y el líquido amniótico [33].
La AIM altera la actividad de las microglías
tanto antes como después del nacimiento, ya que estas pueden permanecer
funcionalmente activas hasta 20 años en el cerebro. La exposición inicial a un
estímulo inflamatorio, como el generado por la AIM debido al SARS-CoV-2, puede
generar que las microglías actúen con una mayor reactividad hacia los factores
estresantes en el futuro. Esto se explica a través de la hipótesis de que los
desafíos inmunológicos dejan marcas epigenéticas de larga duración en las
células del cerebro de la descendencia, a través del entrenamiento inmunológico
y la memoria celular [34]. Los estudios con Poly [I:C] en ratas y
ratones corroboran el aumento de citoquinas en el cerebro fetal, después de la
AIM, y la posterior alteración de la actividad fagocítica de las microglías [35].
La AIM interrumpe el desarrollo de las
microglías y altera las acciones fagocíticas de estas, en consecuencia, se
desencadena un proceso de poda sináptica excesiva durante periodos críticos del
desarrollo que se caracterizan por picos de poda, como la adolescencia [34,36]. Diversos estudios
apoyan esta hipótesis al demostrar menor densidad y anomalías morfológicas de
tejido nervioso ante estímulos que simulan una infección como Poly [I:C] [33,34]. Entonces, sería el
mecanismo de la poda sináptica el que afecte el desarrollo y función de las
neuronas dopaminérgicas y contribuya al desarrollo de la esquizofrenia.
También la AIM conduce a la activación de
células inmunitarias que secretan IL-6 y, posteriormente, IL- 17a. La IL-6
afecta el neurodesarrollo a través de la hipoferremia, una reducción del hierro
no hemo circulante materno, elemento importante para el desarrollo cerebral
saludable de las neuronas dopaminérgicas. La IL-17a se asocia con
malformaciones corticales y aparición de comportamientos anormales en la descendencia
adulta que estuvieron expuestos a la AIM [37].
Las neuronas dopaminérgicas sufren
alteraciones como: la hiperfunción dopaminérgica subcortical en las
proyecciones mesolímbicas, generando una sobreestimulación de los receptores
D2, lo cual genera los síntomas positivos de la esquizofrenia y la hipofunción
en la proyecciones dopaminérgicas mesocorticales al córtex frontal, que produce
la hipoestimulación de receptores D1 dando lugar a los síntomas negativos [38]; cualquiera de los
dos mecanismos causa desequilibrio en la neurotransmisión dopaminérgica [39]. Todo esto se
explica en la hipótesis dopaminérgica que presenta cuatro vías:
1.
Vía Mesolímbica: Se extiende desde el área tegmental ventral
del mesencéfalo a la región límbica, como el núcleo accumbens. Esta vía regula
emociones, la motivación, el placer, y la recompensa. Al tener la
hiperactividad de dopamina explica la aparición de síntomas positivos
psicóticos, como delirios y alucinaciones.
2.
Vía Mesocortical: Se extiende desde el área
tegmental ventral al córtex prefrontal ventromedial y dorsolateral. La conexión
ventromedial está relacionada con funciones de regulación de emociones y
afectividad; y la conexión dorsolateral, con la regulación de funciones
cognitivas. En esta vía hay una disminución de dopamina dando como consecuencia
síntomas negativos como abulia, anhedonia, depresión, deterioro cognitivo entre
otros
3.
Vía Nigroestriada: Se extiende desde la
sustancia negra del troncoencéfalo a los ganglios basales y el cuerpo estriado.
Esta vía está relacionada con el sistema extrapiramidal y se encarga de regular
los movimientos motores. Los niveles de dopamina son normales cuando se padece
esquizofrenia, la alteración ocurre al suministrar antipsicóticos que generan
una deficiencia de dopamina por el bloqueo de los receptores de dopamina D2
produciendo trastornos de movimientos como: la enfermedad de Parkinson,
acatisia y distonía.
4.
Vía Tuberoinfundibular: Se extiende desde el
hipotálamo a la hipófisis anterior y regula las funciones neuroendocrinas
encargadas de la secreción de prolactina a la circulación sanguínea, al igual
que la vía anterior solo se altera cuando se suministra antipsicóticos, estos
generan una deficiencia de dopamina, conllevando así a un incremento de la
prolactina y la aparición de galactorrea [38].
Se propone que a partir de la AIM se generan
cambios epigenéticos. Un ejemplo sería la hipometilación del promotor del gen
Mecp2, que participa en la oportuna activación y represión de la expresión
génica normal, y por activación de señales inmunológicas. Mecp2 también ha sido
involucrado como mediador en la diferenciación de precursores dopaminérgicos en
el mesencéfalo ventral, especialmente en el hipotálamo en desarrollo; a través
de la regulación de la expresión de enzimas limitantes de la velocidad en la
síntesis y degradación de neurotransmisores aminérgicos [40].
Con lo expuesto, las evidencias de brotes
infecciosos en el pasado; los experimentos realizados que simulan una infección
vírica; los cambios epigenéticos; y la hipótesis dopaminérgica en el desarrollo
de la esquizofrenia sugieren que, a través de la AIM generada, puede aumentar
el riesgo de padecer esquizofrenia en el futuro en personas expuestas
prenatalmente. De acuerdo a la teoría de los dos hits para el desarrollo del
fenotipo clínico de la esquizofrenia en el presente análisis se explica el
primer hit. Es necesario la presencia de un segundo hit, un daño ambiental
posterior a la infección vírica materna (trauma infantil, derrota social,
desnutrición, fumar, etc.), para desencadenar el cuadro clínico [41].
Actualmente, se plantea que las citoquinas
maternas pueden atravesar la placenta y afectar al feto, pero también es
posible la secreción de citoquinas placentarias y fetales en respuesta a la AIM
[33], estos hechos requieren de investigaciones en el futuro que
demuestren cuál de estos dos o si ambos mecanismos son los implicados en el
desarrollo de la esquizofrenia por infección de SARS-CoV-2.
CONCLUSIÓN
La condición inmunológica excepcional del
embarazo incrementa la susceptibilidad a infecciones virales principalmente
durante el segundo trimestre; así la invasión de SARS-CoV-2, induce la
liberación de citoquinas proinflamatorias maternas, permeables a la placenta,
que desregulan la proporción entre linfocitos Treg/TH17, activando así el
sistema inmune materno. Como consecuencia se altera la actividad fagocítica de
las microglías desencadenando una poda sináptica excesiva, que sumado al
aumento de la concentración de IL-6, afectan el desarrollo y función de las
neuronas dopaminérgicas. Estos eventos junto a los cambios epigenéticos
generados, constituyen a la activación inmune materna como un factor de riesgo
para el desarrollo de la esquizofrenia a largo plazo.
REFERENCIAS BIBLIOGRÁFICAS
[1]
Organización
Mundial de la Salud [Internet]. Ginebra: OMS; 2022 [citado el 10 de abril de
2022]. Esquizofrenia; [aprox. 4 p.]. Disponible en: https://www.who.int/es/news-room/fact-sheets/detail/schizophrenia
[2]
Más
de 280 mil peruanos sufren de esquizofrenia [Internet]. gob.pe. 2010 [citado el
23 de enero de 2022]. Disponible en:
https://www.gob.pe/institucion/minsa/noticias/37326-mas-de-280-
mil-peruanos-sufren-de-esquizofrenia
[3]
Purves-Tyson
TD, Weber-Stadlbauer U, Richetto J, Rothmond DA, Labouesse MA, Polesel M, et
al. Increased levels of midbrain immune-related transcripts in schizophrenia
and in murine offspring after maternal immune activation. Mol Psychiatry. marzo
de 2021;26(3):849–63. Disponible en: https://doi.org/10.1038/s41380-019-0434-0
[4]
Fara
A, Mitrev Z, Rosalia RA, Assas BM. Cytokine storm and COVID-19: a chronicle of
pro- inflammatory cytokines. Open Biol [Internet]. septiembre de 2020 [citado
el 23 de enero de 2022];10(9). doi:10.1098/rsob.200160
[5]
O’Callaghan
E, Sham P, Takei N, Glover G, Murray RM. Schizophrenia after prenatal exposure
to 1957 A2 influenza epidemic. Lancet Lond Engl. el 25 de mayo de 1991;337(8752):1248–50.
doi: 10.1016/0140-6736(91)92919-s
[6]
Zuckerman
L, Weiner I. Post-pubertal emergence of disrupted latent inhibition following
prenatal immune activation. Psychopharmacology (Berl). el 1 de septiembre de
2003;169(3):308–13. doi: 10.1007/s00213-003-1461-7
[7]
Daaboul
J, Tamouza R, Leboyer M. Immuno-psychiatrie et pandémie de SARS-CoV-2 : liens et
possibles conséquences. L’Encephale. abril de 2021;47(2):151. doi:
10.1016/j.encep.2020.07.002
[8]
Figueiredo
CP, Fontes-Dantas FL, da Poian AT, Clarke JR. SARS-CoV-2-associated cytokine
storm during pregnancy as a possible risk factor for neuropsychiatric disorder
development in post-pandemic infants. Neuropharmacology. el 15 de diciembre de
2021;201:108841. doi: 10.1016/j.neuropharm.2021.108841
[9]
Científica
(SIIC) SI de I. La importancia del tratamiento precoz en la esquizofrenia
[Internet]. [citado el 23 de enero de 2022].
Disponible en: https://www.siicsalud.com/des/insiiccompleto.php/69329
[10] Press E. La
importancia de la detección precoz en la esquizofrenia [Internet]. Europa
Press; 2018 [citado el 30 de diciembre de 2021].
Disponible en: https://www.infosalus.com/asistencia/noticia-importancia-deteccion-precoz-esquizofrenia-
20180524084435.html
[11] Arenas E, Denham
M, Villaescusa JC. How to make a midbrain dopaminergic neuron. Development. el
1 de junio de 2015;142(11):1918–36. doi: 10.1242/dev.097394.
[12] Deverman BE,
Patterson PH. Cytokines and CNS Development. Neuron. el 15 de octubre de 2009;64(1):61–78.
doi: 10.1016/j.neuron.2009.09.002.
[13] Huang Y, Liu Z,
Cao B-B, Qiu Y-H, Peng Y-P. Treg Cells Attenuate Neuroinflammation and Protect
Neurons in a Mouse Model of Parkinson’s Disease. J Neuroimmune Pharmacol. el 1
de junio de 2020;15(2):224–37. doi:10.1007/s11481-019-09888-5.
[14] Dunaevsky A,
Bergdolt L. Brain changes in a maternal Immune activation model of
neurodevelopmental brain disorders. Prog Neurobiol. abril de 2019;175:1. doi:
10.1016/j.pneurobio.2018.12.002.
[15] Wang M, Ling K-H,
Tan JJ, Lu C-B. Development and Differentiation of Midbrain Dopaminergic
Neuron: From Bench to Bedside. Cells. junio de 2020;9(6):1489.
doi:10.3390/cells9061489.
[16] Hegarty SV,
Sullivan AM, O’Keeffe GW. Midbrain dopaminergic neurons: A review of the
molecular circuitry that regulates their development. Dev Biol. el 15 de julio
de 2013;379(2):123–38. doi: 10.1016/j.ydbio.2013.04.014.
[17] Mor G, Aldo P,
Alvero AB. The unique immunological and microbial aspects of pregnancy. Nat Rev
Immunol. agosto de 2017;17(8):469–82. doi: 10.1038/nri.2017.64.
[18] Denney JM, Nelson
EL, Wadhwa PD, Waters TP, Mathew L, Chung EK, et al. Longitudinal modulation of
immune system cytokine profile during pregnancy. Cytokine. el 1 de febrero de
2011;53(2):170–7. doi: 10.1016/j.cyto.2010.11.005.
[19] Balasundaram P,
Farhana A. Immunology At The Maternal-Fetal Interface. En: StatPearls
[Internet]. Treasure Island (FL): StatPearls Publishing; 2022 [citado el 24 de
enero de 2022].
Disponible en: http://www.ncbi.nlm.nih.gov/books/NBK574542/
[20] Abu-Raya B,
Michalski C, Sadarangani M, Lavoie PM. Maternal Immunological Adaptation During
Normal Pregnancy. Front Immunol [Internet]. 2020 [citado el 24 de enero de
2022];11:575197. doi: 10.3389/fimmu.2020.575197.
[21] Alberca RW,
Pereira NZ, Oliveira LMDS, Gozzi-Silva SC, Sato MN. Pregnancy, Viral Infection,
and COVID-19. Front Immunol [Internet]. 2020 [citado el 24 de enero de
2022];11:1672. doi: 10.3389/fimmu.2020.01672.
[22] Fuhler GM. The
immune system and microbiome in pregnancy. Best Pract Res Clin Gastroenterol.
el 1 de febrero de 2020;44–45:101671. doi: 10.1016/j.bpg.2020.101671.
[23] Marañón Cardonne
T, Mastrapa Cantillo K, Zaldívar Rosales Y, Marañón Cardonne T, Mastrapa
Cantillo K, Zaldívar Rosales Y. Inmunología del embarazo e infección por COVID-
19: una revisión en el contexto actual. Rev Cuba Hematol Inmunol Hemoter
[Internet]. 2021 [citado el 24 de enero de 2022];37.
Disponible en:
http://scielo.sld.cu/scielo.php?script=sci_abstract&pid=S0864-
02892021000500005&lng=es&nrm=iso&tlng=es
[24] Shah NM,
Herasimtschuk AA, Boasso A, Benlahrech A, Fuchs D, Imami N, et al. Changes in T
Cell and Dendritic Cell Phenotype from Mid to Late Pregnancy Are Indicative of
a Shift from Immune Tolerance to Immune Activation. Front Immunol [Internet].
2017 [citado el 24 de enero de 2022];8: 1138. doi: 10.3389/fimmu.2017.01138.
[25] Ferrer-Oliveras
R, Mendoza M, Capote S, Pratcorona L, Esteve-Valverde E, Cabero-Roura L, et al.
Immunological and physiopathological approach of COVID-19 in pregnancy. Arch
Gynecol Obstet. 2021; 304 (1): 39-57. doi: 10.1007/s00404-021-06061-3.
[26] Rojas M. W, Cano
R. LE. Inmunidad innata. En: Inmunología Compendio de la 15a edición de la
inmunología de Rojas. 1a ed. Medellín: Corporación para investigaciones
Biológicas; 2010. p. 23–54.
[27] Abbas A, Lichtman
A, Pillai S. Inmunidad innata. En: Inmunología celular y molecular. 8a ed.
Barcelona: Elsevier; 2015. p. 55–88.
[28] González-Hernández
LA, Andrade-Villanueva JF, Jave-Suárez LF, Bravo-Cuellar A. Inmunología
celular: células Th-17. Rev Médica MD. 2011;2.3(4):223–7.
[29] Liu H, Wang L-L,
Zhao S-J, Kwak-Kim J, Mor G, Liao A-H. Why are pregnant women susceptible to
COVID-19? An immunological viewpoint. J Reprod Immunol. junio de
2020;139:103122. doi: 10.1016/j.jri.2020.103122.
[30] Couch ACM, Berger
T, Hanger B, Matuleviciute R, Srivastava DP, Thuret S, et al. Maternal immune
activation primes deficiencies in adult hippocampal neurogenesis. Brain Behav
Immun. el 1 de octubre de 2021;97:410–22. doi: 10.1016/j.bbi.2021.07.021.
[31] Canetta SE, Brown
AS. Prenatal infection, maternal inmune activation, and risk for schizophrenia.
Transl Neurosci. el 1 de diciembre de 2012;3(4):320. doi:
10.2478/s13380-012-0045-6.
[32] Estes ML,
McAllister AK. Maternal immune activation: implications for neuropsychiatric
disorders. Science. el 19 de agosto de 2016;353(6301):772-7. doi:
10.1126/ciencia.aag3194.
[33] Pekala M, Doliwa
M, Kalita K. Impact of maternal immune activation on dendritic spine
development. Dev Neurobiol. 2021;81(5):524–45. doi: 10.1002/dneu.22804.
[34] Han VX, Patel S,
Jones HF, Dale RC. Maternal immune activation and neuroinflammation in human
neurodevelopmental disorders. Nat Rev Neurol. septiembre de 2021;17(9):564–79.
doi:10.1038/s41582-021-00530-8
[35] Solek CM, Farooqi
N, Verly M, Lim TK, Ruthazer ES. Maternal immune activation in
neurodevelopmental disorders. Dev Dyn. 2018;247(4):588–619. doi:
10.1002/dvdy.24612.
[36] Germann M,
Brederoo SG, Sommer IEC. Abnormal synaptic pruning during adolescence
underlying the development of psychotic disorders. Curr Opin Psychiatry. mayo
de 2021;34(3):222. doi: 10.1097/YCO.0000000000000696.
[37] Aguilar-Valles A,
Rodrigue B, Matta-Camacho E. Maternal Immune Activation and the Development of
Dopaminergic Neurotransmission of the Offspring: Relevance for Schizophrenia
and Other Psychoses. Front Psychiatry [Internet]. 2020 [citado el 23 de enero de
2022];11:852. doi: 10.3389/fpsyt.2020.00852
[38] Saiz Ruiz J, Vega
Sánchez DC de la, Sánchez Páez P. Bases Neurobiológicas de la Esquizofrenia.
Clínica Salud. 2010;21(3):235–54.
[39] Perez de la Mora
M, Hernandez-Mondragon C, Crespo-Ramirez M, Rejon-Orantes J, Borroto- Escuela
DO, Fuxe K. Conventional and Novel Pharmacological Approaches to Treat
Dopamine-Related Disorders: Focus on Parkinson’s Disease and Schizophrenia.
Neuroscience. el 15 de julio de 2020;439:301–18.
doi:10.1016/j.neuroscience.2019.07.026.
[40] Basil P, Li Q,
Dempster EL, Mill J, Sham P-C, Wong CCY, et al. Prenatal maternal immune
activation causes epigenetic differences in adolescent mouse brain. Transl
Psychiatry. septiembre de 2014;4(9):e434. doi: 10.1016/j.neubiorev.2016.03.017.
[41] Davis J, Eyre H,
Jacka FN, Dodd S, Dean O, McEwen S, et al. A review of vulnerability and risks
for schizophrenia: Beyond the two hit hypothesis. Neurosci Biobehav Rev. junio
de 2016;65:185. doi: 10.1016/j.neubiorev.2016.03.0
1,a,
Ángel Carlos Fabian-Alfaro
1,2,a,
Sandra Nayelly Estrella-Saavedra
1,a, Julio Cesar
Eslava-Díaz
1,a,
María Nimia Cruz-Briceño
1,b